全脂牛乳粉中糖基化酪蛋白分析
孙静丽
李林强
朱莉莉
唐 露
武 媛
(陕西师范大学食品工程与营养科学学院,陕西 西安 710119)
全脂牛乳粉中糖基化酪蛋白分析
孙静丽
李林强
朱莉莉
唐 露
武 媛
(陕西师范大学食品工程与营养科学学院,陕西 西安 710119)
研究全脂牛乳粉中糖基化酪蛋白,探讨其酶解特性。重点考察了不同pH、酸及提取方法对酪蛋白提取质量百分数的影响,并通过SDS-PAGE电泳分析酪蛋白,高碘酸—希夫碱染色法及莫氏试验鉴定糖基化酪蛋白,木瓜蛋白酶水解酪蛋白,测定其氨基酸含量。结果表明,pH 4.6时提取酪蛋白的质量百分数显著高于其他组(P<0.05);质量百分数为2%的乙酸(pH 3.58)提取酪蛋白的质量百分数为(40.45±0.66)%,显著高于其他组(P<0.05);鞣酸提取酪蛋白的质量百分数为(46.13±0.46)%,显著高于其他方法(P<0.05);酪蛋白SDS-PAGE电泳结果表明,不同酸、不同方法提取的酪蛋白均有3条带,其分子量均分别为34,24,60 ku;高碘酸—希夫碱染色结果表明,分子量为34,24 ku的酪蛋白是糖基化酪蛋白;莫氏试验结果表明,乳粉酪蛋白中存在糖基化酪蛋白;酶解结果表明,乳粉酪蛋白经木瓜蛋白酶水解后游离氨基酸含量显著高于鲜乳酪蛋白(P<0.05)。说明全脂牛乳粉中有糖基化酪蛋白,其分子量分别为34,24 ku,易于水解。
全脂牛乳粉;复原乳;酪蛋白;糖基化
糖蛋白是一类由糖和多肽或蛋白质以共价键连接而成的结合蛋白[1],是生物体内重要的生物大分子之一,广泛存在于细胞膜、细胞间质、血浆及黏液中,细胞内超过50%的蛋白质都以糖基化形式存在,包括许多酶、激素、血浆蛋白、抗体、转铁蛋白和受体等[2-3]。糖蛋白具有增强免疫调节、抑制肿瘤、降血糖、降血脂、抗氧化、防衰老等作用[4]。这些固有糖蛋白的生理作用大多是有益的,比如牛乳中的转铁蛋白、乳铁蛋白[5]、高度糖基化的α-1-酸性糖蛋白(AGP)[6]、免疫活性因子[7-8]等具有增强免疫力的作用。关于外源糖蛋白的致敏作用甚至有害的生理作用的报道[9-11]较多,结果表明饮用牛乳产生的过敏反应是由糖蛋白引起的。引起过敏的糖蛋白是牛乳中固有的,还是在加热过程中产生的尚未见报道。
鲜乳经过热处理后会发生不同程度羰氨反应,已经被众多的研究所证实。生产乳粉时鲜乳经过巴氏杀菌、长时间较高温度的真空浓缩及170 ℃左右的高温喷雾干燥等热处理过程,相比较液态乳的生产,乳粉加工的温度更高、热处理时间更长,这是否会导致羰氨反应程度更大、是否会影响酪蛋白的水解,相关的研究尚未见报道。因此,本研究主要分析全脂牛乳粉中糖基化酪蛋白是否存在及其水解特性,以期分析乳粉中糖蛋白的来源,丰富乳粉营养功能评价理论体系,并为乳粉生产过程中营养品质控制提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
全脂牛乳粉:新西兰恒天公司;
蛋白Mark:18~94 ku,美国Thermo公司;
木瓜蛋白酶:≥800 U/mg,美国Bioreagent公司;
干酪素:北京奥博星生物技术有限责任公司;
双歧杆菌:北京川秀科技有限公司;
三羟甲基氨基甲烷(Tris)、丙烯酰胺、N,N,N,N-四甲基乙二胺(TEMED)、十二烷基硫酸钠(SDS)、过硫酸铵、甘氨酸、甘油、溴酚蓝、考马斯亮蓝G-250、冰乙酸、乙酸钠、乳酸、盐酸、磷酸、鞣酸、氯化钠、乙酸锌、氢氧化钠、石油醚、高碘酸、三氯乙酸、碱性品红、偏重亚硫酸钠、活性炭、α-萘酚、浓硫酸、葡萄糖、茚三酮、无水乙醇:均为分析纯。
1.1.2 主要仪器
台式离心机:800B型,上海安亭科学仪器厂;
电泳系统:PowerPacTM Universal型,美国Bio-rad公司;
数控超声波清洗器:KQ-250DB型,昆山市超声仪器有限公司;
往复振荡器:HY-2型,金坛市富华仪器有限公司;
可见分光光度计:722型,上海光谱仪器有限公司。
1.2 酪蛋白的提取
1.2.1 乙酸—乙酸钠缓冲体系提取酪蛋白 奶粉与水以1∶7 (g/mL)的比例配制复原乳,依次取复原乳5 mL,分别加入不同pH(4.6,4.8,5.0,5.4,5.6,5.8)的乙酸—乙酸钠缓冲溶液5 mL。200×g离心10 min,弃去脂肪层,倾出上层液体,按式(1)计算酪蛋白的质量百分数。
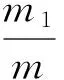
(1)
式中:
W——酪蛋白质量百分数,%;
m1——沉淀的酪蛋白质量,g;
m——样液质量,g。
1.2.2 酪蛋白酸法提取 奶粉与水以1∶7 (g/mL)的比例配制复原乳,依次取5 mL乳样,分别加入不同质量百分数(0.5%,1%,2%,3%,4%,5%)的乙酸、乳酸、盐酸、磷酸,混匀后测定pH值,200×g离心10 min,弃去脂肪层,倾出上层液体,按1.2.1中式(1)计算酪蛋白的质量百分数。
1.2.3 不同方法提取酪蛋白 乳粉经索氏抽提法脱脂后配制复原乳。依次取复原乳5 mL,分别加入10 mL pH 4.6的乙酸—乙酸钠缓冲溶液(盐析法)、pH 4.6的盐酸溶液(酸沉淀法)、0.1%鞣酸溶液(生物碱沉淀法)、无水乙醇(有机溶剂法)、5%乙酸锌溶液(重金属离子法),将上述溶液用滤纸过滤,将过滤所得沉淀置于40 ℃烘箱中干燥至恒重,称重,按1.2.1式(1)计算酪蛋白的质量百分数。
1.3 酪蛋白的SDS-PAGE分析
SDS-PAGE凝胶电泳参考文献[12~14],稍作修改。取以上方法制备的酪蛋白沉淀物于40 ℃干燥至恒重,研磨成粉末,索氏抽提法脱脂,用蒸馏水洗涤3次,200×g离心5 min。取酪蛋白约2 mg溶于1 mL样品缓冲液中,沸水浴处理10 min,冷却至室温,即为电泳样品。向凝胶板间灌注10 mL 15%的分离胶,立即覆一层蒸馏水,凝固40 min后将上层蒸馏水倾去用滤纸吸干,灌注4 mL 3%浓缩胶,插入样品梳子,凝固1 h后,将电极缓冲液倒入电泳槽,直至没过短板,拔梳子,加样10 μL,开始电泳。80 V恒压 40 min,120 V恒压2.5 h,停止电泳。考马氏亮蓝G-250染液振荡染色约2 h,蒸馏水冲洗,然后加入脱色液至背景透亮、条带清晰为止。
1.4 糖基化酪蛋白鉴定
1.4.1 高碘酸—希夫碱染色 取制备的酪蛋白样液(乙酸、乙酸锌、乳酸提取的酪蛋白)左右对称加样进行SDS-PAGE电泳,将胶从中间均匀地切成两部分,左边考马氏蓝染色,右边对称样液进行高碘酸—希夫碱染色[15-17](简称糖染)。
高碘酸—希夫碱染色步骤:将凝胶置于10%三氯乙酸中固定1 h,蒸馏水漂洗2次(共0.5 h),然后置于1%高碘酸水溶液氧化1 h,用水漂洗2次(共0.5 h),再用Schiff试剂染色1 h(Schiff试剂配制:碱性品红1 g溶于蒸馏水400 mL,加12 mol/L HCl 4.2 mL、偏重亚硫酸钠3.2 g,4 ℃搅匀过夜,加活性炭2 g,振荡1 min过滤),最后用脱色液(0.5%偏重亚硫酸钠及7%乙酸水溶液按体积1∶1混合)脱色,4 ℃过夜,若是糖蛋白则呈红色谱带。
1.4.2 莫氏试验 参考文献[18],修改如下:取2支编号试管,分别加入1 mL的1%葡萄糖溶液、1%的乳粉酪蛋白溶液(溶于0.1%的NaCl溶液中),然后加入莫氏试剂(5%的α-萘酚溶液,溶于95%的乙醇,现配现用)2滴,摇匀。将试管倾斜,沿管壁慢慢加入浓硫酸1.5 mL。硫酸层沉淀于试管底部与糖溶液分成2层,观察液面交界处有无紫红色环出现。
1.5 糖基化酪蛋白水解及氨基酸含量测定
1.5.1 糖基化酪蛋白水解 取pH 4.6乙酸—乙酸钠缓冲液提取的乳粉酪蛋白和鲜乳酪蛋白,均配制为0.1%的样品液(溶于0.1% NaCl溶液中),各取样品溶液10 mL,均加入1 mL的0.1%木瓜蛋白酶液(溶于0.1%的NaCl溶液,现配现用),置于37 ℃水浴中酶解6 h。
1.5.2 氨基酸含量测定 采用茚三酮比色法[19-20]。取系列标准溶液(0.0,1.0,2.0,5.0,10,15,20 μg/mL)各1.0 mL于7支25 mL试管中,均加入2 mL pH 5.5乙酸—乙酸钠缓冲液,摇匀,再加2%茚三酮溶液(2 g溶于100 mL无水乙醇中,现配现用)2 mL。置沸水浴15 min,冷却至室温,于570 nm波长处测定吸光值,得回归方程(y=0.031 9x+0.002 5,R2=0.999 5)。将酶解后的样品用上述同种方法测定蛋白溶液的吸光值,计算其氨基酸含量。
1.6 数据处理
所有试验均平行重复3次,试验数据均运用SPSS 19.0软件进行单因素方差分析,结果以“平均值±标准偏差”表示,采用LSD法5%水平检验组间差异显著性。
2 结果与分析
2.1 乙酸—乙酸钠缓冲体系提取酪蛋白
乙酸—乙酸钠溶液在pH为4.6时,酪蛋白提取质量百分数为(28.38±2.49)%,显著高于其他组(P<0.05),与文献[21-22]中酪蛋白等电点pH 4.6一致。乙酸—乙酸钠缓冲体系为盐溶液,是否会导致部分酪蛋白溶解,影响酪蛋白提取质量百分数,还需进一步分析。
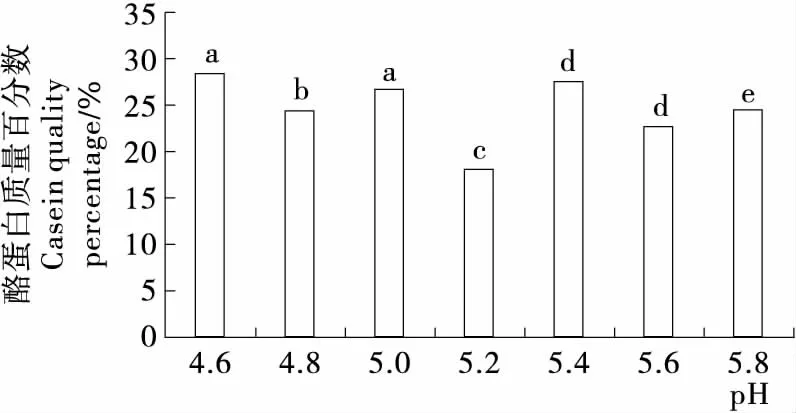
不同小写字母表示差异显著(P<0.05)
2.2 酪蛋白酸法提取条件的筛选
由图2~5可知,乙酸添加量为2%时,酪蛋白质量百分数为(40.45±0.66)%,显著高于其他组(P<0.05);乳酸添加量2%时,酪蛋白质量百分数为(39.31±2.76)%,显著高于其他组(P<0.05);盐酸添加量3%时,酪蛋白质量百分数为(37.44±1.04)%,显著高于其他组(P<0.05);磷酸添加量4%时,酪蛋白质量百分数为(31.74±4.20)%,显著高于其他组(P<0.05)。综上结果表明,不同的酸提取酪蛋白时,酪蛋白质量百分数由大到小依次为乙酸>乳酸>盐酸>磷酸。
不同酸的添加量对pH值的改变程度的影响由大到小依次为盐酸>乳酸>磷酸>乙酸,乙酸添加量对pH的影响较为缓慢,易于接近等电点,酪蛋白沉淀较多,所以提取率最高。文献[23]等电点法提取蛋白质也有类似的结果,且乙酸作为食用酸,更利于在食品工业中的应用。
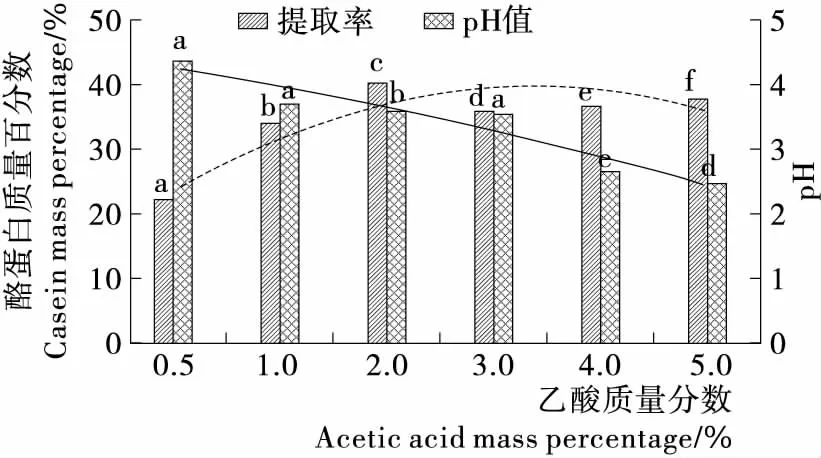
不同小写字母表示差异显著(P<0.05)
Figure 2 Influence of acetic acid different additions on extraction rate of protein and pH value of solution

不同小写字母表示差异显著(P<0.05)
Figure 3 Influence of lactic acid different additions on extraction rate of protein and pH value of solution

不同小写字母表示差异显著(P<0.05)
Figure 4 Influence of hdrochloric acid different additions on extraction rate of protein and pH value of solution
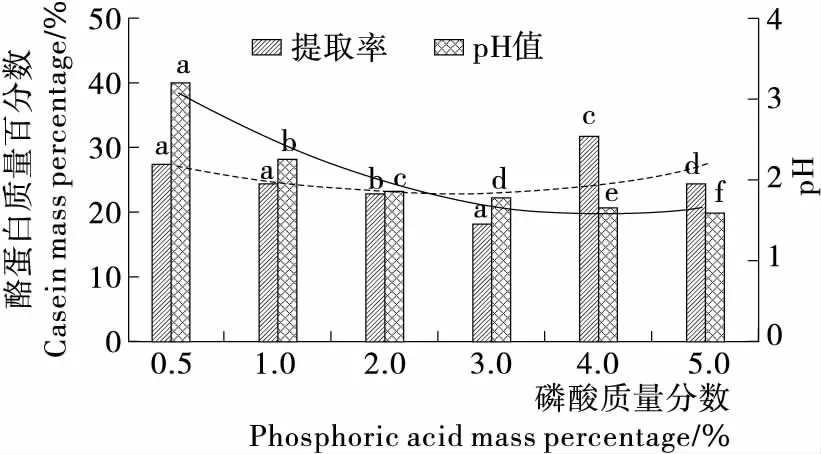
不同小写字母表示差异显著(P<0.05)
Figure 5 Influence of phosphate acid different additions on extraction rate of protein and pH value of solution
2.3 不同方法对酪蛋白提取率的影响
由图6可知,鞣酸提取的酪蛋白质量百分数为(46.13±0.36)%,显著高于其他组(P<0.05),乙酸锌提取的酪蛋白质量百分数显著高于无水乙醇、乙酸—乙酸钠和盐酸组(P<0.05)[这3组对酪蛋白的提取质量百分数无显著性差异(P>0.05)]。结果表明,鞣酸是提取酪蛋白的一种理想生物碱试剂。文献[24~25]研究结果也表明鞣酸生物碱沉淀法比等电点法、盐析法提取蛋白质的纯度高,提取率也高。鞣酸作为一种活性物质,具有抗氧化、抗衰老,预防心血管疾病等功效,而且具有凝乳的作用,但对其在乳中的应用尚需进一步研究确认。

不同小写字母表示差异显著(P<0.05)
2.4 酪蛋白的SDS-PAGE电泳结果
由图7可知,不同酸提取的酪蛋白均有3条带,与标准蛋白Mark条带比对,其分子质量分别为24,34,60 ku,与文献[26~28]对酪蛋白分子量的分析结果一致。不同酸提取的酪蛋白条带之间位置基本相同,表明不同酸处理对复原乳酪蛋白分子大小影响不大。由图8可知,不同方法提取的酪蛋白均有3条带,与标准蛋白Mark条带比对,其分子质量分别为24,34,60 ku,且不同方法提取的酪蛋白条带位置基本相同,表明不同方法处理对复原乳酪蛋白分子大小影响不大。
2.5 酪蛋白高碘酸—希夫碱染色结果
酪蛋白SDS-PAGE考马氏亮蓝染色和高碘酸—希夫碱染色结果见图9。考马氏亮蓝染色有3条带(图9 a),其分子量分别为24,34,60 ku。高碘酸—希夫碱染色有2条带(图9 b),其分子量分别为24,34 ku,结果表明,二者为糖基化的酪蛋白。结合图9 a条带分析结果,分子量60 ku的酪蛋白非糖基化酪蛋白,文献[29~32]也有相同的研究结果。
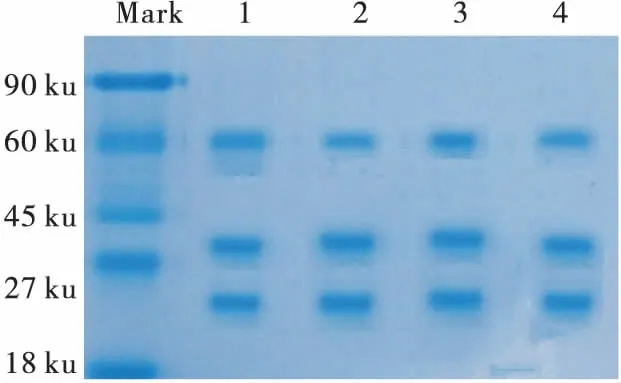
1~4. 依次为乙酸、乳酸、盐酸、磷酸提取的酪蛋白

1~5. 依次乙酸-乙酸钠、无水乙醇、鞣酸、盐酸、乙酸锌提取的酪蛋白
Figure 8 Analysis of SDS-PAGE on casein from reconstitu-ted milk treated by different extraction methods
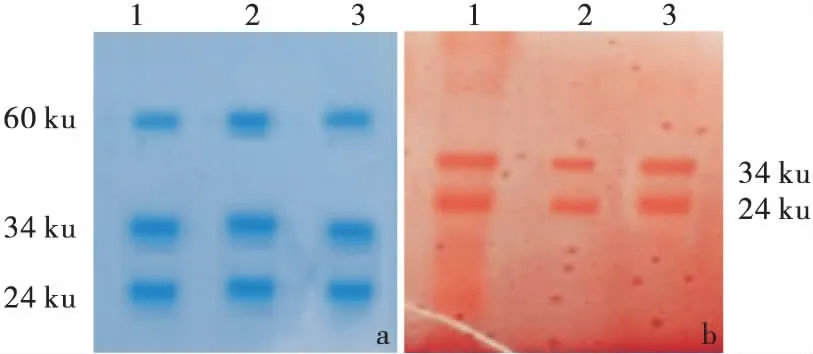
a. 考马氏亮蓝G-250染色 b. 高碘酸—希夫碱染色 1~3. 依次为乙酸、乙酸锌、乳酸提取的酪蛋白
Figure 9 Analysis of SDS-PAGE on casein from reconstitu-ted milk treated by different dyeing methods
2.6 莫氏试验糖基化酪蛋白鉴定结果
糖基化酪蛋白莫氏试验结果见图10。葡萄糖标准溶液莫氏试验有很明显的紫色环,乳粉提取的酪蛋白莫氏试验也呈现明显的紫色环。结果表明,乳粉提取的酪蛋白中有糖基化酪蛋白,与2.5电泳的糖染结果一致,进一步证明乳粉中存在一定量的糖基化酪蛋白。

图10 酪蛋白莫氏试验
2.7 酪蛋白酶解结果
酪蛋白酶解结果表明,乳粉提取的酪蛋白水解后氨基酸(茚三酮反应颜色呈深紫色)含量显著高于鲜乳水解后的(P<0.05)。结合酪蛋白SDS-PAGE高碘酸—希夫碱染色结果和莫氏试验鉴定结果表明,乳粉提取的酪蛋白中有糖基化酪蛋白,易于水解,表明这2种糖基化酪蛋白可能不是致敏因子。文献[33~36]报道牛乳中的乳铁蛋白或免疫活性因子可能是过敏因子,且为牛乳本身所固有,特别是在初乳中含量较高[37-38],相比较本文的研究结果,表明糖蛋白是否易于水解可能是其是否具有致敏性的重要原因之一,因此白乳粉的各类产品中加入对致敏性糖蛋白专一性的水解酶,可能是降低或消除其致敏性的一条有效途径。
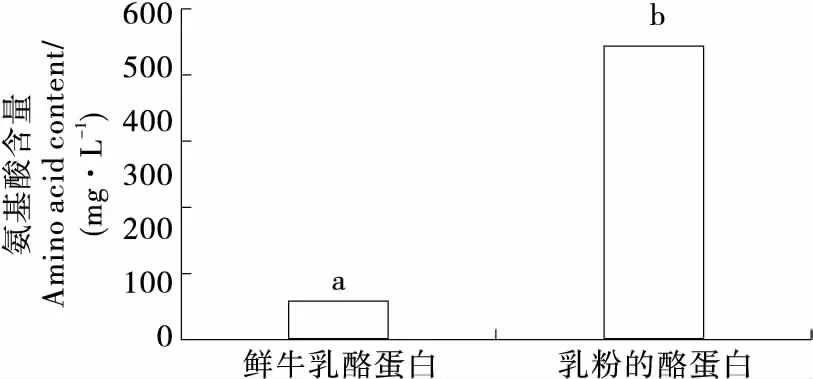
不同小写字母表示差异显著(P<0.05)
3 结论
糖蛋白具有致敏作用,牛乳经过热处理后,是否会使蛋白糖基化,难于水解,加重牛乳蛋白的致敏作用,值得探究。本试验分析了全脂牛乳粉中糖基化酪蛋白,结果表明全脂牛乳粉中有3种酪蛋白,经过鉴定其中2种为糖基化酪蛋白,其分子量较小,分别为34,24 ku。蛋白酶水解试验表明全脂牛乳粉中糖基化的酪蛋白相比鲜牛乳中酪蛋白更易于水解,至于为什么小分子酪蛋白糖基化后更易于水解,是否是由于蛋白结构的变化更易于酶的作用,尚需进一步研究。
[1] 吕克凡, 高世勇, 季宇彬, 等. 天然糖蛋白的提取和抗肿瘤研究[J]. 哈尔滨商业大学学报: 自然科学版, 2013, 29(1): 1-3.
[2] 朱科学, 周惠明, 郭晓娜. 植物来源糖蛋白的结构与功能[J]. 食品与发酵工业, 2002, 28(12): 57-61.
[3] 连高焱, 俞飚. 蛋白质的化学糖基化研究进展[J]. 中国科学: 化学, 2012(12): 1 746-1 759.
[4] 仇娟. 糖肽/糖蛋白富集新技术的研究[D]. 上海: 复旦大学, 2009: 1-4.
[5] 彭增起. 牛乳中糖蛋白的保健功能[J]. 中国乳品工业, 1996(1): 22-23.
[6] ORCZYK P, OWICZ M, BERGHAUSEN M, et al.O-Glycosylation ofα-1-Acid Gly-coprotein of human milk is lactation stage related[J]. Breastfeeding Medicine, 2015, 10(5): 270-276.
[7] PICARIELLO G, FERRANTI P, MAMONE G, et al. Identification of N-linked glycoproteins in human milk by hydrophilic interaction liquid chromatography and mass spectrometry[J]. Proteomics, 2008, 8(18): 3 833-3 847.
[8] JOLANTA L K, IWONA K P , MARTA B M, et al. Lectin-based analysis of fucosylated glycoproteins of human skim milk during 47 days of lactation[J]. Glycoconjugate Journal, 2015, 32(9): 665.
[9] 白振宇. 牛奶中主要过敏原的消除及检测技术的研究[D]. 天津: 天津商业大学, 2007: 1-5.
[10] 应有成. 牛乳主要过敏原α-乳白蛋白和β-乳球蛋白标准物质的制备[D]. 南昌: 南昌大学, 2013: 3-4.
[11] 贾敏, 张亦凡, 张银志, 等. 牛奶过敏原检测方法研究进展[J]. 食品工业科技, 2015, 36(12): 385-389.
[12] 李林强, 朱莉莉, 万威, 等. 牛羊乳热处理蛋白质变性程度比较及机理分析[J]. 西北农林科技大学学报: 自然科学版, 2016, 44(11): 149-154.
[13] 宋宏新, 刘立新, 柏红梅, 等. 牛乳中蛋白质的电泳分析技术研究[J]. 食品与机械, 2010, 26(6): 51-53.
[14] 管方方. 牛乳中掺假大豆蛋白的SDS-PAGE方法研究[D]. 上海: 上海应用技术学院, 2015: 28-46.
[15] 萧能赓. 生物化学实验原理和方法[M]. 北京: 北京大学出版社, 2005: 145-151.
[16] 刘翠芳, 蒋继志. 高碘酸—硝酸银染色法鉴定糖蛋白[J]. 生物技术通报, 2006(s1): 534-535.
[17] 陈小萍, 吴钦穗. PAS组织化学染色的几点体会[J]. 福建医药杂志, 2006, 28(6): 178-179.
[18] 陈钧辉. 生物化学实验[M]. 北京: 科学出版社, 2003: 1-2.
[19] 胡京枝, 董小海, 余大杰, 等. 牛奶及其制品中游离氨基酸含量的测定方法研究[J]. 河南畜牧兽医: 综合版, 2007, 28(10S): 29-31.
[20] 邵金良, 黎其万, 董宝生, 等. 茚三酮比色法测定茶叶中游离氨基酸总量[J]. 中国食品添加剂, 2008(2): 162-165.
[21] 李宏梁, 焦茜楠, 黄峻榕, 等. 酪蛋白沉淀检测方法及其在牛乳经济掺假鉴定中的应用[J]. 食品科技, 2008, 33(12): 262-267.
[22] 杨勇, 徐志霞, 黄循吟, 等. 等电点法提取酪蛋白的方法改进[J]. 海南师范大学学报: 自然科学版, 2016(1): 109-111.
[23] 孙雯. 乳蛋白与大豆蛋白组分分离及鉴别方法的研究[D]. 西安: 陕西科技大学, 2015: 23-36.
[24] 向天勇, 黄健, 沈卫红. 缫丝废水中丝胶蛋白的回收工艺[J]. 浙江农业科学, 2016, 57(8): 1 335-1 337.
[25] 胡鹏刚, 刘强. 高纯食品鞣酸在啤酒中的应用[J]. 酿酒科技, 2004(3): 61-62.
[26] 陈惠, 谢彩军, 叶广辉, 等. 几种儿童牛奶酪蛋白含量的测定与比较[J]. 食品研究与开发, 2014, 35(20): 101-103.
[27] PORTUGAL C A M. Milk Protein, UF Application[M]. Berlin: Springer Berlin Heidelberg, 2016: 1-20.
[28] LEJARS A, NOGRE M, TELLIER M, et al. Method for the extraction of one or several proteins present in milk: EP, WO/2007/138198[P]. 2007-02-25.
[29] BASCH J J, GREENBERG R, FARRELL H M Jr, et al. Identification of the milk fat globule membrane proteins(II): Isolation of major proteins from electrophoretic gels and comparison of their amino acid compositions[J]. Biochimica Et Biophysica Acta, 1985, 830(2): 127.
[30] RIORDAN O N. Targeting the glycome of major milk proteins[J]. Febs Journal, 2016, 278(19): 3 769-3 781.
[31] KARAV S. Selective prebiotic activity ofN-glycans released from milk glycoproteins by novel endo-beta-N-acetyglucosaminidase[J]. Dissertations & Theses-Gradworks, 2015, 15(10): 15-16.
[32] KARAV S, LE P A, KIRMIZ N, et al. Oligosaccharides released from milk glycoprote-ins are selective growth substrates for infant-associated bifidobacteria[J]. Applied & Environmental Mi-crobiology, 2016, 82(12): 3 622.
[33] 刘丽波, 孙迪, 李春, 等. 美拉德反应影响α-乳白蛋白和β-乳球蛋白过敏原性研究[C]//中国食品科学技术学会儿童食品分会学术年会. 哈尔滨: 东北农业大学, 2011: 26-32.
[34] 罗永康, 沈小琴, 李朝慧, 等. 牛乳蛋白过敏原改性的研究[J]. 中国乳品工业, 2005, 33(10): 4-8.
[35] 蔡为荣, 薛正莲. 生活物性肽—酷蛋白磷酸肽(CPP)的研制[J]. 食品与机械, 2000(6): 15-16.
[36] 程金波, 王加启, 刘光磊, 等. 牛奶中乳铁蛋白含量的影响因素及调控机制研究进展[J]. 东北农业大学学报, 2008, 39(5): 137-140.
[37] 凌雪萍. 牛初乳中乳铁蛋白的分离、纯化及其抗菌活性的研究[D]. 天津: 天津商业大学, 2003: 2-6.
[38] 孙国庆, 康晓红, 生庆海, 等. 牛乳中α-乳白蛋白和β-乳球蛋白含量的变化特性[J]. 食品与机械, 2010, 26(3): 94-96.
Analysis of glycosylated casein in whole milk powder
SUNJing-li
LILin-qiang
ZHULi-li
TANGLu
WUYuan
(CollegeofFoodEngineeringandNutritionalScience,ShaanxiNormalUniversity,Xi'an,Shaanxi710119,China)
This study investigated glycosylated casein in whole milk powder and explored its enzymatic property. The casein extraction weight percentage were determined by different pH, different acids, and different methods. The casein was analyzed by SDS-PAGE electrophoresis, and the glycosylated casein were identified via the method of periodate-schiff alkali dyeing and the experiment of morse. The casein was hydrolyzed by papain and the amino acid content was determined accordingly. Results: The percentage of casein extracted under pH 4.6 was significantly higher than that of other groups (P<0.05). The weight percentage of casein extracted from acetic acid (pH 3.58) was (40.45±0.66)%, which was significantly higher than that of other groups (P<0.05). The percentage (46.13±0.46)% of casein extracted by tannic acid was significantly higher than that of other methods (P<0.05). The results of casein SDS-PAGE electrophoresis both showed the same 3 bands either different acids or different methods on casein extraction, and their molecular weights were 34, 24, and 60 ku, respectively, and the 34 and 24 ku were glycosylated casein by the method of periodate-schiff alkali dyeing. The results of morse experiment showed that milk powder casein exist glycosylated casein. The content of free amino acid from whole milk powder was significantly higher than that from fresh milk after papain hydrolysis (P<0.05). Whole milk powder has glycosylated casein, their molecular weights are 34 and 24 ku respectively, which are easy to hydrolysis.
whole milk powder; reconstituted milk; casein; glycosylation
陕西省农业科技创新与攻关项目(编号:2016NY-212)
孙静丽,女,陕西师范大学在读硕士研究生。
李林强(1971—),男,陕西师范大学副教授,博士。 E-mail: lilinq@snnu.edu.cn
2017—03—15
10.13652/j.issn.1003-5788.2017.07.002

