VP3的细胞定位及其诱导乳腺癌细胞凋亡效应研究①
江杨帆 刘雪兰 叶 红
(安徽省医学科学研究院,合肥230061)
VP3的细胞定位及其诱导乳腺癌细胞凋亡效应研究①
江杨帆 刘雪兰②叶 红
(安徽省医学科学研究院,合肥230061)
目的:研究鸡传染性贫血病毒VP3基因在正常细胞和乳腺癌细胞中不同时间段的定位及其诱导细胞凋亡效应的变化。方法:用PCR方法扩增鸡贫血病毒的VP3基因,克隆至绿色荧光载体pEGFP-C1,构建含VP3的基因重组体,利用FuGENE®6 Reagent将pEGFP-C1-VP3分别转染乳腺癌MCF-7和成纤维细胞L929,观察VP3转染24、48、72 h后的细胞定位,并用流式细胞术检测MCF-7不同时间段的细胞凋亡率。结果:VP3融合蛋白定位于乳腺癌细胞MCF-7核内,并呈现细胞凋亡不同阶段的典型核改变,VP3融合蛋白在L929细胞中经历了由核内迁移到细胞质的变化过程,不引起L929细胞凋亡。结论:VP3在乳腺癌细胞MCF-7中定位于细胞核,并能以诱导凋亡的方式引起癌细胞的死亡,并且凋亡率高于对照组且具有时间依赖性;VP3在正常细胞中定位于细胞质,且不引起凋亡效应。
鸡贫血病毒;VP3基因;细胞定位;凋亡
鸡传染性贫血(Chicken infectious anemia,CIA),是由鸡传染性贫血病毒引起的一种传染病,病鸡造血器官和淋巴器官受损,出现再生障碍性贫血和免疫抑制,因此加重或导致其他疾病。凋亡素(Apoptin)是由禽贫血病毒(Chicken infectious anemia virus,CIAV)中VP3基因编码的一种功能蛋白,研究发现VP3有明显的致肿瘤细胞凋亡作用,而对人的正常二倍体细胞无毒副作用,且这种选择性凋亡作用既不依赖于p53蛋白介导,也不被Bcl-2的过表达所抑制,故考虑其可被广泛应用于抗癌的基因治疗[1-3]。本实验利用PCR技术构建了含VP3基因的pEGFP-C1-VP3,并分别转染人乳腺癌细胞MCF-7和小鼠成纤维细胞L929,观察VP3转染24、48、72 h后的细胞定位,并用流式细胞术检测MCF-7不同时间段的细胞凋亡率,揭示鸡传染性贫血病毒VP3基因在正常细胞和乳腺癌细胞中不同时间段的定位及其诱导细胞凋亡效应的变化,为进一步探讨VP3诱导肿瘤细胞特异凋亡的机制奠定基础。
1 材料与方法
1.1材料
1.1.1菌株、细胞株和质粒 病鸡骨髓由安农大惠赠,pMD-18T Vector克隆载体、增强型绿色荧光蛋白真核表达载体pEGFP-C1、DH5α、小鼠成纤维细胞L929由实验室保存,人乳腺癌细胞MCF-7购自上海细胞生物学研究所。
1.1.2主要试剂和仪器 DL2000 DNA Marker、限制性内切酶(EcoRⅠ、KpnⅠ)、ExTaq 酶、pMD-18T Vector克隆载体试剂盒、T4 DNA 连接酶(宝生物工程公司),1640培养液、Opti-mem培养基(Gibco,美国),质粒抽提试剂盒(Omega,美国),FuGENE®6质粒转染试剂(Promega,美国),Annexin V/7-AAD凋亡检测试剂盒(BD,美国),Centrifuge 5427R高速离心机(Eppendorf,德国),荧光显微镜IX71(Olympus,日本)。
1.2方法
1.2.1目的基因的获得及扩增 用动物组织基因组提取试剂盒从病鸡骨髓中提取组织DNA,参考GenBank上CIAV基因序列(登录号:M55918.1),针对该病毒凋亡素VP3基因通过Primer Premier 5.0软件设计pMD18T-vp3克隆质粒的引物:F:5′-TTACAGTCTTATACACCTTCTTGC-3′,R:5′-ATGAACGC-TCTCCAAGAAGAT-3′,引物上下游设计分别从CIAV病毒VP3的起始密码子开始到终止密码子结束,产物长度366 bp。PCR反应条件为:94℃预变性4 min;94℃热变性30 s,55℃退火30 s,72℃延伸30 s,循环次数30;72℃延长5 min。PCR产物与pMD18T载体在T4连接酶的作用下连接,转化DH5a大肠杆菌感受态,蓝白斑筛选重组载体,质粒提取纯化后进行测序。引物合成和测序由上海英潍捷基贸易有限公司完成。
1.2.2真核表达质粒的构建 真核表达质粒pEGFP-C1-VP3的引物设计:F1:5′-CGGAATTCTATGAACGCTCTCCAAGAAGATAC-3′(EcoRⅠ),R1:5′-GGGGTACCCAGTCTTATACA/GCCTTC/TTTGCG-3′(Kpn Ⅰ) ,在引物中加入了EcoR Ⅰ 和Kpn Ⅰ 两个限制性酶切位点。使用Axygen DNA凝胶回收试剂盒进行PCR产物的回收,用DNA纯化试剂盒纯化,使用构建好的pMD18T-vp3重组质粒为模板,用TaKaRa预混ExTaq酶扩增反应,目的基因vp3和真核表达载体pEGFP-C1分别经EcoR Ⅰ、Kpn Ⅰ 双酶切,目的基因片段在连接酶作用下亚克隆到线性化pEGFP-C1,质粒提取纯化并经电泳及双酶切鉴定后判断是否获得pEGFP-C1-VP3。质粒提取纯化后进行测序。
1.2.3细胞培养及转染 MCF-7和L929细胞均置于含10%的胎牛血清1640培养液中,37℃、5%CO2常规培养,待细胞长满用0.25% Trypsin-EDTA进行消化并按梯度分至6孔培养板,24 h后分别用2 μg的pEGFP-C1-VP3和pEGFP-C1进行转染,转染步骤按FuGENE®6试剂说明书进行。
1.2.4荧光观察和细胞内定位 在真核细胞内pEGFP-C1质粒编码一个GFP红移突变体,能够在488 nm的外源激发光的激发下发出明亮的荧光。转染MCF-7细胞和小鼠成纤维细胞L929,24、48、72 h 后取出培养板,使用荧光显微镜观察结果并进行拍照。
1.2.5流式细胞术检测细胞凋亡率 细胞处理步骤同1.2.3,用冷的PBS洗涤消化收集好的MCF-7细胞2次,吸取100 μl用1×Binding Buffer调制的细胞悬液至反应管中,加入5 μl的APC Annexin V和5 μl的7-AAD,轻轻混匀并避光孵育15 min,再加入400 μl 1×Binding Buffer,在1 h内上流式细胞仪进行检测。
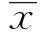
2 结果
2.1VP3基因PCR扩增 将病鸡的组织研磨并按照试剂盒所述方法提取组织DNA后,以自行设计的引物进行PCR扩增并在琼脂糖凝胶上电泳,在366 bp 处出现预期大小的PCR 条带(图1)。PCR产物回收纯化后,连接到pMD18T载体,提取质粒,经测序分析证实vp3基因片段含有完整的开放阅读框为366 bp。
2.2VP3重组表达质粒的鉴定 pMD18T-VP3亚克隆到pEGFP-C1,获得重组质粒pEGFP-C1-VP3。经双酶切鉴定,可见VP3为366 bp(图2),说明pEGFP-C1质粒中已插入了目的条带,并经测序后验证重组质粒构建成功。
2.3pEGFP-C1-VP3在细胞内的定位 转染24 h后,空质粒pEGFP-C1表达的绿色荧光在L929细胞中呈全细胞分布(图3A);与空质粒相比,pEGFP-C1-VP3表达的VP3融合蛋白发出强绿色荧光,且定位于细胞核,多数细胞核内荧光分布不均匀,呈点灶状,少数荧光在细胞质内弱表达(图3B)。
转染24 h后,空质粒pEGFP-C1表达的绿色荧光呈均匀弥散状分布在MCF-7细胞内,没有特异性定位,细胞核荧光比细胞质中强(图3C);pEGFP-C1-VP3表达的VP3融合蛋白定位在MCF-7细胞核内,发出明亮的绿色荧光,且均一分布,而细胞质无荧光分布(图3D)。
48 h后,空质粒pEGFP-C1表达的绿色荧光在L929和MCF-7两种细胞内都呈现均匀弥散状分布,且无特异性定位(图4A、C);在L929细胞中,pEGFP-C1-VP3表达的VP3融合蛋白从细胞核内出来,并在细胞质内聚集,不能引起正常细胞的凋亡(图4B);而在MCF-7细胞中,VP3融合蛋白在核内聚集,行使凋亡功能,部分绿色荧光出现团块状聚集,失去均一性(图4D)。
72 h后,空质粒pEGFP-C1表达的绿色荧光在L929细胞和MCF-7细胞中呈全细胞分布(图5A、C),荧光变弱,极少数细胞因正常生长周期而老化变圆;在L929中,pEGFP-C1-VP3表达的VP3融合蛋白与转染后24、48 h相比,绿色荧光由核内迁移到细胞质,且在细胞质中聚集,不能引起L929细胞凋亡(图5B);在MCF-7中,VP3融合蛋白的绿色荧光强度减弱,呈团块状,完全失去均一性,细胞可见明显的核固缩,核边聚,核破裂,呈现细胞凋亡不同阶段的典型核改变(图5D)。
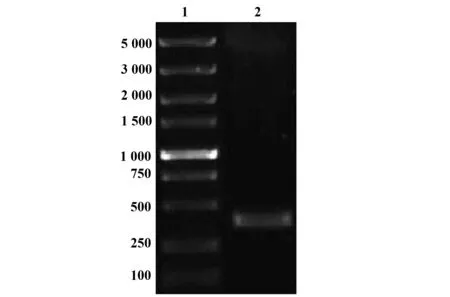
图1 VP3的PCR扩增Fig.1 Electrophoresis photo of PCR amplified coding region for VP3Note: Lane 1.DNA marker DL 2000;Lane 2.VP3 band (366 bp).

图2 真核表达质粒的双酶切鉴定Fig.2 Identification of recombinant plasmids of pEGFP-C1-VP3Note: Lane 1.DNA marker DL 2000;Lane 2.Recombinant plasmids of pEGFP-VP3 digested by EcoRⅠ+KpnⅠ.
2.4Annexin V/7-AAD 双染检测VP3对MCF-7细胞凋亡的影响 转染24、48和72 h后,分别检测各组MCF-7细胞的凋亡率(图6),结果显示VP3于转染后24 h即开始出现细胞凋亡,48 h及72 h后凋亡逐渐增多,且呈现出随转染时间而增加的明显趋势(图7),将转染pEGFP-C1-VP3后24、48和72 h的MCF-7试验组分别进行比较,差异均有统计学意义(P<0.01),且将转染pEGFP-C1-VP3的MCF-7与同时期转染空白质粒pEGFP-C1的MCF-7及正常无任何转染的MCF-7细胞两个对照组分别进行比较,差异均有统计学意义(P<0.01),以上表明VP3基因能以凋亡的方式有效诱导MCF-7细胞死亡,并且诱导凋亡具有时间依赖性。
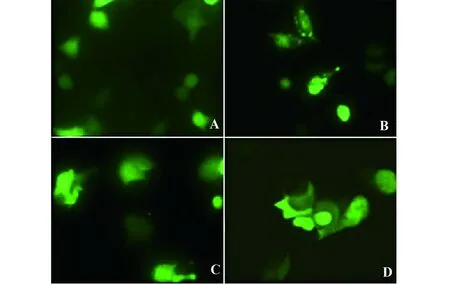
图3 转染24 h后的细胞定位及形态(×400)Fig.3 Fluorescent microscopy of transfected cells after 24 h(×400)Note: A.L929 cells transfected by pEGFP-C1;B.L929 cells transfected by pEGFP-C1-VP3;C.MCF-7 cells transfected by pEGFP-C1;D.MCF-7 cells transfected by pEGFP-C1-VP3.
图4 转染48 h后的细胞定位及形态(×400)Fig.4 Fluorescent microscopy of transfected cells after 48 h(×400)Note: A.L929 cells transfected by pEGFP-C1;B.L929 cells transfected by pEGFP-C1-VP3;C.MCF-7 cells transfected by pEGFP-C1;D.MCF-7 cells transfected by pEGFP-C1-VP3.

图5 转染72 h后的细胞定位及形态(×400)Fig.5 Fluorescent microscopy of transfected cells after 72 h(×400)Note: A.L929 cells transfected by pEGFP-C1;B.L929 cells transfected by pEGFP-C1-VP3;C.MCF-7 cells transfected by pEGFP-C1;D.MCF-7 cells transfected by pEGFP-C1-VP3.

图6 流式细胞术检测凋亡率Fig.6 Cell apoptosis by FCM analysis

图7 MCF-7细胞凋亡率变化Fig.7 Changes of MCF-7 cell apoptosisNote: **.P<0.01,VS pEGFP-C1 group and normal group,VS pEGFP-C1-VP3 groups of 24 h and 48 h.
3 讨论
VP3是CIAV编码产生的小分子蛋白, CIAV属圆环病毒科,环形病毒属,基因长度为2.3 kb,编码3个蛋白:VP1、VP2和VP3,分别为衣壳蛋白、辅助蛋白和功能蛋白,因VP3能够诱导人癌细胞凋亡,故又被称为凋亡素[4,5]。凋亡素C端氨基酸形成的折叠结构NLS是一个很重要的功能区域,它与凋亡素的核定位过程与识别蛋白结合相关,尤其在肿瘤细胞中的定位起主要作用。
本实验以绿色荧光蛋白EGFP为标签蛋白,构建VP3 融合蛋白,证实在转染后24、48、72 h,VP3融合蛋白在L929细胞中经历了由核内迁移到细胞质的变化过程,不能引起L929细胞凋亡。与L929细胞相比,VP3 融合蛋白在转染MCF-7乳腺癌细胞24 h后,定位在核内,且发出均一明亮的绿色荧光;转染48 h后,VP3融合蛋白在核内聚集,开始行使凋亡功能,部分绿色荧光出现团块状聚集,失去均一性;转染72 h后转染细胞内可见明显的核固缩,核边聚,核破裂,呈现细胞凋亡不同阶段的典型核改变。本研究通过VP3在细胞内定位的变化,证实了凋亡素能够特异性引起乳腺癌细胞MCF-7的凋亡,而不能够导致正常细胞L929的凋亡。凋亡素引起凋亡的机制虽尚未完全清楚,但多数研究已显示凋亡素只有在转化细胞中并向核内迁移才能发挥活性。流式细胞术结果同样显示出VP3基因能以诱导凋亡的方式使MCF-7细胞死亡且具有时间依赖性。
凋亡素被认为是一种核质穿梭蛋白,核质穿梭活动是引起凋亡的关键,凋亡素的核定位受细胞转化的调节,转化细胞出现转型的早期就已经引起凋亡素对核的指向作用,凋亡素迁移到细胞核中并进行表达后,会导致PML-NBs的形成[6],这种复合物在DNA损伤反应中发挥着关键性的调控作用,而且能进一步招募其他蛋白质并调节其活性与功能,通过调控细胞凋亡来维护基因组的稳定性。
而且凋亡素能与某些蛋白作用,形成复合体,在NLS的引导下迁移到核内,从而引起细胞凋亡。有资料表明,Akt的抑制剂有抗癌作用,但在凋亡素的作用下,Akt易位到核内,这时Akt促进凋亡的作用明显大于抑制细胞凋亡[7],说明凋亡素的选择性核定位功能对凋亡作用是极其重要的。
此外,细胞周期中有一个主要的管理者叫APC/C(anaphase-promoting complex),它执行与有丝分裂相关的一系列重要任务[8,9],能促进细胞进入有丝分裂的后期,在转化细胞中,凋亡素可能会募集APC/C并与其共同存在于细胞核中,且与APC1亚基发生作用引起APC/C的消耗,从而阻滞细胞在G2/M期并引起不依赖p53的凋亡作用发生[10]。凋亡素尚能通过PI3-K/Akt影响细胞凋亡,PI3-K亚单位p85可与凋亡素作用同时激活PI3-K,从而使凋亡素停留在细胞核内并引发凋亡作用[11],而Akt这个关键分子也能与凋亡素结合并与其共同迁移到细胞核内导致凋亡素磷酸化,启动一系列的信号通路发挥作用诱导细胞凋亡。
VP3能够特异引起肿瘤细胞的凋亡,而且这种凋亡是非P53依赖的,无毒副作用,然而目前的研究还停留在体外实验阶段,VP3诱导癌细胞凋亡的机制值得进一步深入探讨。
[1] Los M,Panigrahi S,Rashedi I,etal.Apoptin,a tumor-selective killer[J].Biochimica et Biophysica Acta-Molecular Cell Res,2009,1793(8):1335-1342.
[2] Russo A,Terrasi M,Agnese V,etal.Apoptosis:a relevant tool for anticancer therapy [J].Annals Oncol,2006,17(7):115-123.
[3] Singh PK,Tiwari AK,Rajmani RS,etal.Apoptin as a potential viral gene oncotherapeutic agent [J].Applied Biochemistry Biotechnol,2015,176(1):196-212.
[4] 殷 震,刘景华.动物病毒学[M].第2版.北京:科学出版社,1997:1175-1179.
[5] Lanz HL,Zimmerman RM,Brouwer J,etal.Cstastrophe triggered in human cancer cells by viral protein apoptin[J].Cell Death Dis,2013,7(4):487-490.
[6] Heilman DW,Teodoro JG,Green MR.Apoptin nucleocytoplasmic shuttling is required for cell type-specific localization,apoptosis,and recruitment of the anaphase-promoting complex/cyclosome to PML bodies[J].J Virol,2006,80(15):7535-7545.
[7] Workman P.Inhibiting the phosphoinositide 3-kinase pathway for cancer treatment[J].Biochem Soci Transa,2004,32(2):393-396.
[8] 沈林海,陈加平,徐丽红.SCF和APC/C的结构及功能[J].中国细胞生物学学报,2007,29(4),487-492.
[9] Chang LF,Zhang Z,Yang J,etal.Molecular architecture and mechanism of the anaphase-promoting complex[J].Nature,2014,513(7518):388-393.
[10] Teodoro JG,Heilman DW,Parker AE,etal.The viral protein Apoptin associates with the anaphase-promoting complex to induce G2/M arrest and apoptosis in the absence of p53[J].Genes Dev,2004,18(16):1952-1957.
[11] Maddika S,Bay GH,Kroczak TJ,etal.Akt is transferred to the nucleus of cells treated with apoptin,and it participates in apoptin-induced cell death[J].Cell Proliferation,2007,40(6):835-848.
[收稿2016-12-03 修回2017-02-06]
(编辑 张晓舟)
StudyoncellularlocalizationofVP3anditsapoptosis-inducingeffectonbreastcancercells
JIANGYang-Fan,LIUXue-Lan,YEHong.
AnhuiAcademyofMedicalSciences,Hefei230061,China
Objective:To observe the localization of chicken infectious anemia virus VP3 gene in normal cells and breast cancer cells in different times and its apoptosis-inducing effect.Methods: The fundamental cloning method,inserting the VP3 gene of chicken anemia virus into the eukaryotic expression vector pEGFP-C1 was used.Then,the positive recombinant containing VP3 gene pEGFP-C1-VP3 was transfected into human breast cancer cell line MCF-7 and mouse fibroblasts L929 by FuGENE®6 transfection reagent in vitro respectively.After 24 hours,48 hours and 72 hours,fluorescence microscope was used to observe the distribution of VP3 in cells and the rate of apoptosis was studied on the treated MCF-7 cells by FCM(Flow Cytometry).Results: The recombinant plasmid pEGFP-C1-VP3 could be localized in the nuclei of breast cancer cells,which showed the typical nuclear changes in different stages of apoptosis.In L929 cells,pEGFP-C1-VP3 underwent a process of migration from the nucleus to the cytoplasm,which didn′t induce apoptosis of L929 cells.Conclusion: VP3 located in the nucleus of MCF-7 breast cancer cells,which can led to cancer cell death by inducing apoptosis,and the apoptosis rate was higher than the control group with time dependence.VP3 located in the cytoplasm of normal cells,and didn′t induce apoptosis.
Chicken anemia virus;VP3 gene;Localization;Apoptosis
10.3969/j.issn.1000-484X.2017.09.002
①本文受国家自然科学基金(No.31372417)资助。
江杨帆(1981年-),女,助理研究员,主要从事病原微生物研究。
及指导教师:叶 红(1973年-),女,博士,副研究员,副教授,主要从事微生物与免疫学研究,E-mail: yehong2000312@126.com。
R373
A
1000-484X(2017)09-1286-05
②安徽农业大学动物科技学院,合肥 230036。
——一道江苏高考题的奥秘解读和拓展

