苦味类中药成份藉苦味受体途径对气道炎症过程的遏制效应①
刘美花 周向东 李 琪 刘 峰 王 杰 钟有清
(海南医学院第一附属医院呼吸内科,海口570102)
·中医中药与免疫·
苦味类中药成份藉苦味受体途径对气道炎症过程的遏制效应①
刘美花 周向东 李 琪 刘 峰 王 杰 钟有清
(海南医学院第一附属医院呼吸内科,海口570102)
目的:探讨苦味受体(Bitter taste receptor,TAS2Rs)在苦味类中药组份治疗慢性气道炎症中的抗炎效应。方法:实验分为三组(n=8),即空白对照组、PM2.5组(雾化吸入PM2.5悬液复制大鼠慢性气道炎症模型)和PM2.5+柠檬苦素组(陈皮提取物干预),分别以ELISA、RT-PCR和Westem blot检测各组大鼠支气管/肺组织炎症因子及TAS2Rs mRNA和蛋白表达水平。结果:PM2.5刺激组炎症因子TNF-α和IL-13的mRNA和蛋白表达水平较对照组明显增高,TAS2R14的mRNA和蛋白表达变化不明显;柠檬苦素干预组炎症因子TNF-α和IL-13的mRNA和蛋白表达水平较PM2.5组降低,TAS2R14的mRNA和蛋白表达水平则明显增高。结论:苦味类中药组份吸入治疗可遏制慢性炎性气道的炎症因子产生及释放,并刺激肺部TAS2Rs的表达增加,故认为苦味类中药组份激活气道TAS2Rs可能是其发挥抗炎效应的重要机制。
苦味受体;苦味中药;炎症因子;气道炎症
气道的慢性炎性过程是慢性阻塞性肺疾病(Chronic obstructive pulmonary desease,COPD)形成及发展的重要表征,多种炎症细胞和细胞因子参与该过程[1,2],目前的抗炎治疗药物虽能有效地减少炎症因子的分泌,但由于存在副作用多及缺乏器官特异性等问题而不够理想。苦味受体(Bitter taste receptors,TAS2Rs )是与人体感受苦味物质密切相关的一类G蛋白偶联受体,近几年研究发现人体呼吸系统也表达部分苦味受体[3]。目前国内外对肺部TAS2Rs的支气管舒张作用研究较多,而对其抗炎效应涉及甚少,鉴于临床上多数具抗炎作用的中药组份具有突出的苦味,故认为苦味受体的激活可能在气道慢性炎症的形成过程中起着拮抗作用,但其确切机制尚不得知。本研究采用临床上常用的苦味类中药陈皮的苦味成分柠檬苦素为刺激因素,研究TAS2Rs的激活对慢性气道炎症的作用,以期为TAS2Rs在慢性气道炎症的治疗作用提供新的理论依据。
1 材料与方法
1.1实验材料、试剂 TH-150C型大容量大气总颗粒物智能采样器(Andersen公司,美国);石英纤维膜(Whatman公司,美国);Wistar大鼠,SPF级,雌雄不限,4~6周龄,体质量(200±20)g[广东省医学实验动物中心,生产许可证号:SCXK(粤)2013-0002];中药单体化合物:柠檬苦素(质量分数99.5%),购自西安开来生物工程有限公司;TNF-α、IL-13 ELISA试剂盒(名劲生物科技有限公司,上海);兔抗鼠β肌球蛋白(β-Actin)多克隆抗体(碧云天生物技术有限公司,上海);HRP标记的羊抗兔多克隆IgG抗体(SantaCruz,美国);RNA抽提试剂盒,MMLV(重组鼠白血病病毒反转录酶)第一链cDNA合成试剂盒,实时荧光定量PCR试剂盒(货号:DRR820A,TaKaRa公司,日本);RIPA裂解液(由碧云天生物技术有限公司提供,上海);兔抗鼠TAS2R14多克隆抗体(Abcam公司,英国);兔抗鼠TNF-α、IL-13、GAPDH一抗(均Calbiochem公司);所有引物合成均由上海生物工程有限公司完成。
1.2方法
1.2.1PM2.5 的采集及悬浮液的制作 到建筑工地附近,用TH-150C型大容量大气总颗粒物智能采样器采集大气中的PM2.5颗粒物,将颗粒物采集在20 cm×20 cm的玻璃纤维滤膜上,连续采样24 h,采集连续1个月,剪短吸附PM2.5的纤维滤纸,对折后侵入超纯水,以超声低温震荡30 min,用纱布过滤洗脱液后,滤液于4℃、10 000 r/min下20 min离心3次,弃上清液,称其质量后保存于-20℃冰箱,用生理盐水配成40 μg/ml颗粒物悬液,超生震荡15 min后混合均匀,保存于4℃冰箱备用。
1.2.2实验动物分组、染毒 大鼠观察喂养3 d无异常情况后随机分为三组(n=8)分组实验条件如下:①空白对照组:以生理盐水(6 ml)雾化吸入。②PM2.5组:以PM2.5的颗粒物悬液(40 μg/ml)6 ml经超声雾化吸入进行毒染,约30 min/次,1次/d,染毒温度37℃,染毒时间持续4周,制成慢性气道炎症的动物模型。③PM2.5+柠檬苦素组:在给予PM2.5毒染1 h后给予雾化吸入20 μmol/L的柠檬苦素溶液(6 ml),约30 min/次,1次/d。第28天处死大鼠,均在最后一次染毒实验处理结束24 h后处死,剪开大鼠颈部皮肤,暴露气管,分别收集肺泡灌洗液,剥离气管和肺脏,将肺脏和气管收集于-80℃冻存备用。
1.2.3ELISA法检测支气管肺泡灌洗液(BALF)中TNF-α、IL-13的含量 各组大鼠经腹腔麻醉后,颈部切开插入气管导管,用4℃无钙镁Hanks液10 ml分2次灌洗,使回收的BALF不少于5 ml,经1 000 r/min离心10 min,取BALF上清液备用。标准品的稀释和加样:按试剂盒说明书进行。加样:各实验分组设 有3个复孔,另设置1个空白孔,分别吸取BALF上清液0.1 ml包被酶标板,4℃过夜,封闭采用含1%牛血清白蛋白的PBS(0.01%mol/L)-Tween 20(0.05%)于室温下封闭1 h,一抗以1∶500倍稀释,取抗大鼠气道TNF-α、IL-13单抗RTEll 100 ml,37℃孵育1 h,辣根过氧化物酶标记羊抗鼠IgG以1∶1 000稀释,取100 μl,37℃孵育1 h,底物溶液100 μl,于37℃显色15 min后停止反应。最后于492 nm处测光密度值作为TNF-α、IL-13含量的相对值(OD值)。
1.2.4RT-PCR法检测支气管肺组织中TAS2R14和TNF-α、IL-13 mRNA含量 采用Trizol法分别抽提各组动物肺组织总的RNA,经核酸检测仪测定RNA的浓度和在260 nm和280 nm的吸光度(A)值,样品A260/A280比值均介于1.8~2.0,样品的总RNA做初步定量后,保存于-20℃备用。随后采用两步法进行RT-PCR。参照试剂盒说明书合成cDNA第一链。引物序列见表1。灭菌PCR管中依次加入Mgcl2:(25 mmol/L) 4.0 μl、10×PCR反应缓冲液5.0 μl、上、下游引物各1.0 μl、dNTP 4.0 μl、cDNA 2.0 μl、Taq酶(5×106U/L) 0.5 μl,定容至50.0 μl,轻轻混匀离心后进行PCR扩增。先于94℃ 预变性3 min,后紧跟34个循环,循环参数:94℃ 45 s,54℃ 30 s,70℃ 60 s,后72℃延伸5 min补齐末端。PCR产物均经1.5%琼脂糖电泳鉴定,结果经光密度面积积分分析,均以与管家基因GAPDH mRNA的比值作为目的基因mRNA的相对值。
表1RT-PCR各目的基因引物序列
Tab.1PrimersequencoftargetgenesforRT-PCR

TargetgeneForwardReverseTAS2R145'-TGCTGCTTCTTGTGACTTCGGTCT-3'5'-GTGTGCTGCATCTTCTTGCGATGT-3'TNF-α5'-TTTGATCCCTGACATCTGGA3'5'-GGCCTAAGGTCCACTTGTGT-3'IL-135'-ACTTGCTTGCCTTGGTGGTC-3'5'-TAGGGGAGTCTGGTCTTGTG-3'GAPDH5'-CATGTTCGTCATGGGTGTGAACCA-3'5'-AGTGATGGCATGGACTGTGGTCAT-3'
1.2.5Western blot法检测TAS2R14和TNF-α、IL-13的蛋白含量 各组大鼠肺和气管组织分别称取0.1 g,加入1 ml含20 μl,100 μg/ml的PMSF和10 μl 磷酸酶抑制剂RIPA裂解液匀浆10 min,后置冰上裂解10 min,4℃ 12 000 r/min离心10 min,取上清液,采用Brad-ford法对上清液进行蛋白定量并分装后,于-20℃保存备用。分别取各组蛋白样品,经过含有12%丙烯酰胺的SDS-PAGE及含5%丙烯酰胺的SDS-PAGE分离-浓缩胶电泳分离,印迹转移至PVDF膜,用5%脱脂牛乳(PBS稀释)于摇床上封闭1 h后,加入兔抗鼠TAS2R14(1∶500)多克隆抗体,TNF-α、IL-13和β-actin单克隆抗体稀释比均为(1∶1 000),置于4℃冰箱孵育过夜,第二天取出于摇床上孵育1 h,洗膜3次后加入HRP标记的山羊抗兔IgG (1∶2 000),室温孵育1 h。经彻底洗涤后ECL显色,加反应液与入底物,暗室曝光5 min。结果经密度面积积分分析,均以与内参β-actin的产物条带的比值作为相对含量。
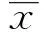
2 结果
2.1ELISA检测BALF中TNF-α、IL-13蛋白表达情况 PM2.5吸入刺激后, TNF-α、IL-13蛋白表达水平显著高于对照组;而与PM2.5刺激组比较,PM2.5+柠檬苦素组的TNF-α、IL-13蛋白表达水平下降。该结果表明,PM2.5可诱导气道炎症因子的产生增加,而柠檬苦素对PM2.5诱导的气道炎症因子的产生有抑制作用。见表2。



GroupsTNF-αIL-13Controlgroup0.39±0.020.23±0.03PM2.5group0.78±0.041)0.51±0.081)PM2.5+limoningroup0.63±0.062)0.38±0.032)
Note:1)P<0.01 compared with the control group;2)P<0.05 compared with PM2.5 group.
2.2Real-time PCR检测支气管/肺组织TAS2R14和TNF-α、IL-13 mRNA的转录情况 PM2.5刺激后,TNF-α、IL-13 mRNA表达水平较对照组明显升高;而与PM2.5组相比,PM2.5 +柠檬苦素组的TNF-α、IL-13 mRNA表达水平则显著下降,同时TAS2R14 mRNA表达水平明显升高。该结果提示,柠檬苦素可激活肺部TAS2R14的mRNA 表达,从而遏制PM2.5引起的炎症因子的转录。见表3,图1。
2.3Western blot检测支气管/肺组织中TAS2R14和TNF-α、IL-13蛋白表达情况 PM2.5吸入刺激后,气道的TNF-α、IL-13蛋白表达量较对照组明显升高;而与PM2.5组相比,柠檬苦素干预组的TNF-α、IL-13蛋白表达水平则显著下降,同时TAS2R14 mRNA表达水平明显升高。该结果表明,柠檬苦素可激活肺部TAS2R14的蛋白表达,其激活可进一步抑制PM2.5诱导的炎症因子的表达。见表4,图2。
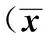


GroupsTNF-αIL-13TAS2R14Controlgroup0.27±0.060.27±0.090.25±0.09PM2.5group0.75±0.101)0.72±0.111)0.27±0.07PM2.5+limoningroup0.31±0.012)0.35±0.042)0.53±0.072)
Note:1)P<0.01 compared with the control group;2)P<0.05 compared with PM2.5 group.

图1 各组炎症细胞因子和苦味受体的mRNA表达水平Fig.1 mRNA expression levels of inflammatory cytokines and bitter taste receptorNote: 1.Control group;2.PM2.5 group;3.PM2.5+ limonin group.
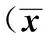
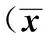

GroupsTNF-αIL-13TAS2R14Controlgroup0.29±0.070.29±0.120.27±0.01PM2.5group0.64±0.051)0.63±0.041)0.30±0.03PM2.5+limoningroup0.32±0.012)0.34±0.052)0.52±0.062)
Note:1)P<0.05 compared with the control group;2)P<0.05 compared with PM2.5 group.

图2 各组炎症细胞因子和苦味受体的蛋白水平Fig.2 Protein levels of inflammatory cytokines and bitter taste receptor in each groupNote: 1.Control group;2.PM2.5 group;3.PM2.5+ limonin group.
3 讨论
炎症细胞的浸润是慢性气道炎症性疾病的主要病理特征之一,各类炎症细胞侵润所释放的大量炎症因子和炎症介质是疾病发生发展的始发环节,亦是引起黏液高分泌并导致气道阻塞的重要事件[4]。COPD急性加重期的患者常伴有如TNF-α、IL-1β、IL-8、IL-13等炎症因子的大量释放,从而导致气道炎症加重,气道水肿加重,气道阻塞,甚者出现缺氧和二氧化碳潴留[5,6]。中医中药辅助抗炎治疗已获肯定,临床上常用的抗炎清热、止咳化痰类中药如陈皮、桔梗、远志、前胡、款冬花等多数带有苦味成分,“苦”物质可以抗炎,这是广泛认可的,但“苦”为何能抗炎却众说纷纭,无确切的解释。
TAS2Rs是一类表达于味觉感受细胞的G蛋白偶联受体,味觉细胞的TAS2Rs被苦味物质激活后,可与G蛋白发生偶联,通过G蛋白的经典信号通路转导,使味觉细胞发生去极化并释放神经递质,将信号传给大脑,从而感知苦味[7,8]。自国外研究证实TAS2Rs在气道表达之后,相继的研究结果显示气道上皮TAS2Rs的激活可产生舒张支气管及促进纤毛摆动作用[9,10],而其对气道炎症的作用涉及甚少。已有研究通过筛选发现,陈皮的药效成分柠檬苦素和白果药效物质芦丁、奎宁对TAS2Rs的亚型TAS2R14受体具有显著的激动作用[11]。据此认为“苦”物质可能借激活气道上的TAS2Rs发挥其抗炎效应。
本研究采用PM2.5为诱导因素,制成大鼠的慢性气道炎症模型,以具代表性的苦味中药陈皮的苦味单体“柠檬苦素”为干预刺激因素,并选取在呼吸道及肺组织高表达的TAS2R14为靶目标进行研究。结果显示:PM2.5刺激后,炎症因子TNF-α及IL-13的mRNA和蛋白表达水平升高,说明PM2.5可诱导炎症因子的产生进而形成慢性气道炎症。以柠檬苦素对PM2.5诱导的气道炎症进行干预后,炎症因子TNF-α及IL-13的mRNA和蛋白表达水平明显下降,表明苦味单体柠檬苦素对炎症因子的产生具有遏制作用。此外,对各组的TAS2R14检测结果表明,柠檬苦素干预组TAS2R14的基因转录及翻译表达较未干预组明显升高,提示中药苦味组份刺激可引起支气管/肺组织的TAS2R14的激活表达,说明TAS2R14参与了苦味质的抗炎效应过程。
本实验选择TNF-α和IL-13作为炎症反应强度的观察指标,是因为TNF-α是由单核巨噬细胞及内皮细胞产生的一种代表性炎性细胞因子,对炎症、感染及免疫源性反应产生首发性应答效应[12],具有多种前炎性介质的功能,是重要的细胞因子启动子,能启动其他炎性介质如IL-1β等释放及促进中性粒细胞脱颗粒,对炎症过程起瀑布性放大作用[13,14]。而另一指标IL-13作为白细胞介素家族的代表,其主要由活化的Th细胞分泌,可激活B细胞的增殖和IgE的产生,属多效能细胞因子。IL-13是至今为止所知的重要炎性因子之一,其可导致呼吸道炎症、黏液分泌增加和杯状细胞增生等多种呼吸道病理改变[15]。由于炎症因子与COPD患者的病情进展和预后密切相关,故本实验着重观察苦味素受体的激活与炎症反应强度的关系,结果提示肺部TAS2Rs的激活不仅可减少TNF-α介导相关炎性细胞因子的释放及阻遏白细胞的聚集,亦可削弱炎性因子诱导的杯状细胞增生及促黏液高分泌形成等作用,还能进一步抑制由中性粒细胞脱颗粒产生对细胞外蛋白的分解效应,从而阻遏炎症应答、血管生成和组织纤维化的发生。
目前研究已证实苦味质可激活气道上皮的TAS2Rs产生舒张支气管及促进纤毛摆动作用,而本实验则进一步证实了TAS2Rs的活化还具有抗炎效应,表明TAS2Rs对呼吸道具有多种有益效应。这不仅为临床上苦味类中药发挥抗炎效应提供了客观的解释依据,亦为其他“苦”味类药物的治疗提供了新的诠释机制及药物干预靶点。
[1] 江德鹏,尤列·皮尔曼,维克多·科罗索夫,等.白细胞介素-13通过FOXA2调控气道上皮细胞黏液分泌[J].中国免疫学杂志,2011,27(2):99-102.
[2] 童 瑾,尤列·皮尔曼,维克多·科罗索夫,等.甘草酸对白介素13诱导的大鼠黏液高分泌的作用[J].中华医学杂志, 2013,93(28):2225-2228.
[3] Deshpande DA,Wang WC,Mcllmoyle EL,etal.Bitter taste receptors on airway smooth muscle bronchodilate by localized calcium signaling and reverse obstruction [J].Nat Mel,2010,16(11):1299-1304.
[4] 崔利萍,田 明,吴丽娟,等.炎症因子TSLP、TNF-α和IL-8对不同气道炎症性疾病的影响及临床意义[J].中国临床研究,2014,27(7):776-777,781.
[5] Ji MF,Su XB,Su XH,etal.Identification of novel compounds for human bitter taste receptors [J].Chem Biol Drug Des,2014,84(1):63-74.
[6] Fehr J,Meyer D,Widmayer P,etal.Expression of the G-protein alpha-subunit gustducin in Mammalians permatozo [J].Com Physiol A Neuroethol Sens Neural Behav Physiol,2007,193(1):21-34.
[7] Doggrell SA.Bitter taste receptors as a target for bronchodilation [J].Expert Opin Ther Targets,2011,15(7):899-902.
[8] Shah AS,Ben-Shahar Y,Moninger TO,etal.Motile cilia of human airway epithelium are chemosensory[J].Science,2009,325(5944):1131-1134.
[9] Finger TE,Bottger B,Hansen A,etal.Solitary chemo receptor cells in the nasal cavity serve as sentinels of respiration [J].Proc Natl Acad Sci USA,2003,100(15):8981-8986.
[10] Shah AS,Ben-Shahar Y,Moninger TO,etal.Motile cilia of human airway epithelia are Chemosensory [J].Science,2009,325(5944):1131-1134.
[11] 胡毅翔,蔡 伟,张欢欢,等.基于肺部苦味受体抗哮喘天然活性成分筛选模型的建立与应用[J].中草药,2016,47(5):775-780.
[12] Braun C,Hamacher J,Morel DR,etal.Dichotomal role of TNF in experimental pulmonary edema reabsorption[J].Immunol,2005,175(5):3402-3408.
[13] Mukhopadhyay S,Hoidal JR,Mukherjee TK.Role of TNF-alpha in pulmonary pathophy-siology[J].Respir Res,2006,7:125.
[14] Li Q,Zhou XD,Kolosov VP,etal.Nicotine reduces TNF-α expression through a α7nAChR/MyD88/NF-κB Pathway in HBE16 airway epithelial cells[J].Cell Physiol Biochem,2011,27:605-612.
[15] Yu HM,Li Q,Zhou XD,etal.Interleukin-13 induces mucin5AC production involving STAT6/SPDEF in human airway epithelial cells[J].Cell Commun Adhesion,2011,17(4-6):83-92.
[收稿2017-04-11 修回2017-05-09]
(编辑 许四平 刘格格)
ContainmenteffectsofbittertastenativeingredientfromtraditionalChinesemedicineonairwayinflammationprocessviabittertastereceptorpathway
LIUMei-Hua,ZHOUXiang-Dong,LIQi,LIUFeng,WANGJie,ZHONGYou-Qing.
DepartmentofRespiratoryMedicine,theFirstAffiliatedHospitalofHainanMedicalCollege,Haikou570102,China
Objective:To investigate the anti-inflammatory effects of bitter taste receptor (TAS2Rs) in the treatment of chronic airway inflammation by bitter Chinese medicine.Methods: The experiment was divided into three groups (n=8),namely blank control group,PM2.5 group (the rat models of chronic airway inflammation were established by aerosolized PM2.5 suspension ) and PM2.5+limonin group (intervening with the extract from Tangerine peel).The expression of mRNA and protein of inflammatory cytokines and TAS2Rs in bronchial/pulmonary tissue were detected by ELISA,RT-PCR and Western blot respectively.Results: The mRNA and protein expression levels of TNF-α and IL-13 in PM2.5 stimulated group were significantly higher than those in control group,while the TAS2R14 were not significantly changed.The mRNA and protein expression levels of TNF-α and IL-13 in the limonin intervention group was lower than that in the PM2.5 group,and the TAS2R14 were significantly increased.Conclusion: The production and release of inflammatory cytokines in the chronic inflammatory airway can be curbed by inhaling the components of bitter Chinese herbal medicine.And then,the TAS2Rs in the lungs can be activated by the bitter components to increase its expression.Therefore,it is considered that bitter Chinese herbal medicine to play the airway anti-inflammatory effect is achieved through the activation of the airway TAS2Rs.
Bitter taste receptor;Bitter Chinese herbal;Inflammatory cytokines;Airway inflammation
10.3969/j.issn.1000-484X.2017.09.011
①本文为国家自然科学基金(81660010,81611530713)、海南省自然科学基金(2016-8305)、海南省教育厅科研课题(Hnky2016-35)和海南医学院大学生创新课题。
刘美花(1990年-),女,在读硕士,主要从事慢性气道炎症性疾病的发生及干预方面的研究。
及指导教师:周向东(1963年-),男,博士,教授,博士生导师,主要从事慢性气道炎症性疾病的发生及干预方面研究,E-mail:zxd999@263.net。
R56
A
1000-484X(2017)09-1331-05

