回盲部颗粒细胞瘤EMR切除1例并文献分析
杨倩倩 周建波
回盲部颗粒细胞瘤EMR切除1例并文献分析
杨倩倩 周建波
颗粒细胞瘤(GCT)是一种非常少见的神经源性肿瘤,1926年由Abrikossoff在舌部发现并首次报道。该肿瘤好发于舌部﹑皮肤及胸部和上肢的皮下组织,也可见于呼吸道﹑胃肠道﹑乳腺及胆道系统等。近年来免疫组织化学和电镜证实该肿瘤来源于神经鞘的雪旺细胞,因其细胞胞质充满嗜酸性颗粒而得名。免疫组织化学显示细胞质和细胞核神经元特异性烯醇化酶(NSE)和外周神经标记S-100蛋白均阳性。颗粒细胞瘤多来源于黏膜下层,生长较慢,多单发,形态不规则,GCT原发于消化道者罕见,仅占4%~6%。回盲部颗粒细胞瘤发病罕见。临床上均为散发﹑个案病例报道。本文报道1例患者,男性,44岁,因体检发现结肠息肉半月入院,内镜检查提示回盲部见0.8cm广基隆起,使用内镜下黏膜切除术切除肿物,并对国内回盲部颗粒细胞瘤病例报道情况进行检索和回顾。
1 病例报告
患者男性,44岁,因“体检发现结肠息肉半月”于2015年12月17日入院。患者无腹痛,无便血,体检无明显阳性体征。门诊结肠镜检查示:“结肠多发息肉”。结肠病理检测示:“(升结肠近回盲部)黏膜慢性炎,黏膜内见数个胞浆丰富的嗜酸性细胞巢”,患者要求内镜下治疗入院。于2015年12月18日行肠镜下治疗,全结肠见4处息肉,大约0.3cm,黏膜下注射后病变隆起,用热活检钳咬除,回盲部见一0.8cm广基隆起,黏膜下注射后病变隆起,用圈套器套住后摘除病灶,创面无出血(见图1)。术后病理检查示:(回盲部)黏膜下肿瘤细胞浸润,IHC确定类型;(横结肠)符合炎性息肉;(直肠)符合管状腺瘤。(回盲部)免疫组化提示:颗粒细胞瘤首先考虑;IHC:s-100+,NSE+,CD56+,CK-,Syn+,CgA-,Ki67<5%。(见图2)血常规﹑大便常规﹑尿常规﹑肝功能﹑肾功能﹑肿瘤标志物未见明显异常。术后该患者无明显并发症,治愈出院,嘱其定期复查电子肠镜及随访。
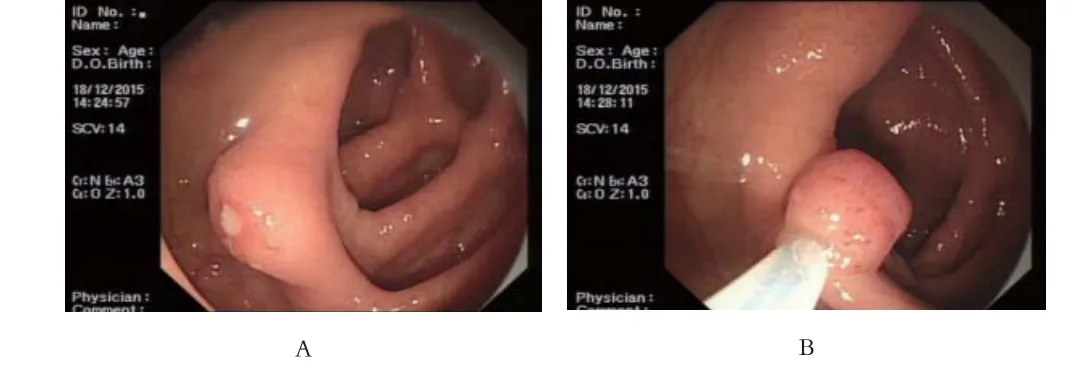

图1 患者内镜检查及病理标本:A、B、C为电子肠镜示回盲部见一0.8cm广基隆起,用圈套器套住后摘除病灶,创面无出血;D为回盲部颗粒细胞瘤病理标本。
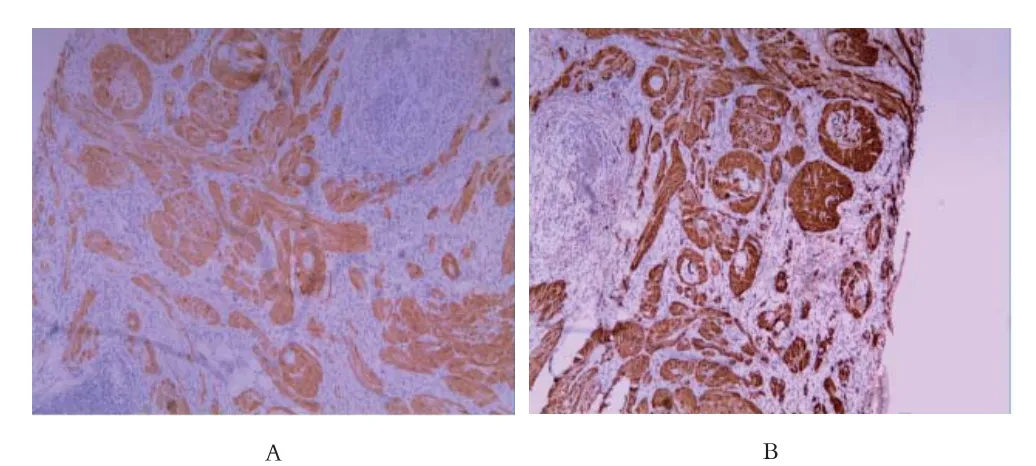
图2 患者免疫组织化学标本:A为组织NSE阳性表达;B为组织S-100阳性表达
3 讨论
GCT是一种神经源性肿瘤,最常发生于舌﹑皮肤及胸部和上肢的皮下组织。距报道颗粒细胞瘤发生于消化道者仅占4%~6%,主要位于食管,其次是结肠和肛周。由于结直肠GCT的发生率低,有关的临床病理资料相对缺乏,在国内的报道多为个案报道。作者检索和搜集了中国知网﹑万方数据库等多个数据库中比较详细的国内病例报告,总结及分析了结直肠GCT的临床及病理特点﹑鉴别诊断﹑治疗以及预后,通过文献复习提高临床医师对结直肠GCT的诊疗水平。
3.1 临床特点 自2006年至2015年国内报道结肠颗粒细胞瘤共13例,加上本组报道1例共14例,总结如下:患者年龄31~68岁,平均年龄47.36岁,无明显性别差异(男﹑女各7例),其中发生于结肠8例﹑直肠5例﹑阑尾1例,肿物大小0.5~11cm,病变小者多数患者无明显症状,常规结肠镜检查时发现病变,少数患者出现腹痛﹑便血﹑排便习惯改变﹑阑尾炎等。瘤体比较小时症状并不典型,病程可为数天至数年不等。对14例病例的组织学检查显示,其中11例位于黏膜层及黏膜下层,1例阑尾颗粒细胞瘤累及浆膜层,1例恶性结肠颗粒细胞瘤累及浆膜层及周围组织器官。14例均行免疫组化染色,结果全部呈 S-100核质阳性表达。14例患者随访结果显示,除1例降结肠颗粒细胞瘤由于肿物较大且累及周围组织器官无法手术切除外,其余13例均未发生复发及转移。尽管GCT大多都为良性,但如不能完整切除,仍有引起再生长的可能,因此应注意密切随访。处置措施包括:1例为恶性GCT,该病例确诊时已无手术指征,仅活检后随访观察,2例病例行外科手术切除,其余多为内镜下黏膜切除术等治疗,无术后复发病例报道;病理结果仅上述1例为恶性,其余报告均为良性。
3.2 诊断及鉴别诊断 结直肠GCT临床上多因出现下消化道系统疾病症状而去医院就诊行肠镜检查,病变主要位于黏膜下层,可表现为黏膜下结节样隆起或广基息肉样隆起,表面黏膜较光滑,直径为0.6~2.0cm,因此镜下较难与息肉﹑平滑肌瘤﹑间质瘤及脂肪瘤等鉴别。
结直肠GCT发病率低,临床罕见。作者收诊的该例患者,由于病变部位特殊,病理医师首先未考虑颗粒细胞瘤的诊断,因此报道了这例形态典型但部位特殊的GCT。该病临床确诊主要基于病理和免疫组织化学检查。GCT主要需与以下疾病进行鉴别:(1)上皮样平滑肌瘤:该肿瘤通常可见典型的呈杆状核的平滑肌细胞区域,且胞质内嗜酸性颗粒不如GCT明显。免疫组化表达肌源性标志物Demin﹑SMA阳性,而神经源性标志物S-100和NSE阴性可鉴别。(2)横纹肌瘤:该肿瘤细胞质内也可见到明显的嗜酸性颗粒,但因瘤体胞质内所含为糖原,通过淀粉酶消化的PAS染色(PAS-D)阴性,且镜下横纹常见,而GCT的PAS-D阳性,而且无横纹。免疫组化表达肌源性标志物Myoglobin﹑ Myogenin﹑Desmin阳性,而神经源性标记阴性可鉴别。(3)上皮样间质瘤:该瘤与GCT一样可出现梭形细胞区及上皮样区域,但前者瘤细胞边界较清晰,胞质染色比较淡。部分GCT可表达CD117弱阳性,部分伴有神经分化的间质瘤也可局部表达S-100蛋白,但是组合性免疫组化标记(如DOG1﹑CD34﹑CD117﹑CD68﹑S-100﹑Nestin等),及组织化学PAS-Dd的染色可以相鉴别。(4)嗜酸细胞型类癌:该肿瘤常形成器官样结构,间质中有丰富的血窦,细胞一致性较大,中等大小,胞质中等红染。神经内分泌标志物Syn﹑CD56﹑CgA﹑阳性,而CD68和S-100阴性可鉴别。(5)神经鞘瘤:该肿瘤主要由梭形细胞构成,胞质中等透明或嗜伊红染,细胞边界不清,相互融合成合体细胞样,免疫组化表达神经胶质纤维酸性蛋白(GFAP)和S-100蛋白阳性,而细胞质肌原调节蛋白(MyoD1)表达阴性可鉴别。
3.3 治疗及预后 在病理组织学上,良恶性颗粒细胞瘤存在一定重叠,恶性颗粒细胞瘤(MGCT)罕见,1945年由Racich等首次报道[1],约占1%~2%。Fanburg-Smith等[2]提出MGCT病理形态学诊断标准:肿瘤性坏死﹑梭形细胞形态﹑核仁明显增大及空泡状核﹑核分裂像>2个/10HPF(200倍)﹑高核质比和细胞多形性,满足上述>3个的形态学表现可诊断MGCT,满足1~2个上述形态学表现可诊断为不典型性颗粒细胞瘤。国内王坚等[3]学者建议将MGCT诊断标准修订为核分裂像>5个/50HPF。如果肿瘤表现为:生长速度快﹑直径>5cm﹑核分裂像>2个/10HPF﹑瘤体出现坏死特别是远处转移时,提示为MGCT。
大多数颗粒细胞瘤生物学行为表现良好。因此,对于直径<2cm且未累及肌层的肿瘤,Yasuda等[4]认为都可以采用内镜下黏膜切除术(EMR)进行治疗。对于肿瘤的直径>2cm者,Hülagü等[5]认为内镜下黏膜剥离术(ESD)能够更加的精准和安全。MGCT是一种高度恶性肿瘤,在软组织恶性肿瘤中极为少见,约占所有GCT的1%~2%。本文总结共14例颗粒细胞瘤,仅1例报道为恶性,其余均为良性。有文献显示[3,6]:已诊断的附有随访记录的恶性颗粒细胞瘤共90例,有31例局部复发(34%),56例转移(62%),其中34例死亡(38%),平均生存期约为2.5年。有文献报道[7-9],放疗和化疗并不能使MGCT的临床病程达到显著改善。目前,MGCT主要的治疗方法仍是手术局部广泛切除,必要时区域淋巴结清扫。
目前,电子结肠镜检查的广泛应用使得结直肠颗粒细胞瘤的发现越来越多。由于良恶性颗粒细胞瘤存在一定重叠,医疗条件和病变特点不同,治疗手段也存在一定的限制,但早期诊断及积极治疗,术后长时间的密切随访至关重要。且仍需要更多的病历报道﹑追踪随访及探索使该疾病的诊疗方法进一步达成共识。
[1] Ravich A, Stout AP, Ravich RA. Malignant Granular Cell Myoblastoma Involving the Urinary Bladder. Ann Surg ,1945, 121(3): 361-372.
[2] Fanburg-Smith JC, Meis-Kindblom JM, Fante R, et al.Malignant granular cell tumor of soft tissue:diagnostic criteria and clinicopathologic correlation.Am J Surg Pathol, 1998, 22(7):779-794.
[3] 王坚,朱雄增,张仁元.恶性颗粒细胞瘤10例临床病理学观察及文献复习.中华病理学杂志,2004,33(6):497-502.
[4] Yasuda I,Tomita E,Nagura K,et al.Endoscopic removal of granular cell tumors.Gastrointest Endosc,1995,41(2):163-167.
[5] Hülagü, Sentük O, Aygün C, et al.Granular cell tumor of esophagus removed with endoscopic submucosal dissection.Turk J Gastroenrol, 2007,18(3):188-191.
[6] Tan TJ,Alassiri AH,Ng TL,et al.Malignant granular cell tumor of the foot-multimodality imaging findings and literature review.Clin Imaging,2015,39(3):543-546.
[7] Nasser H,Ahmed Y,Szpunar SM,et al.Malignant granular cell tumor:a look into the diagnostic criteria.Pathol Res Pract,2011, 207(3): 164-168.
[8] 袁晓红,王风光,汪育苗,等.口腔颗粒细胞瘤13例临床病理观察.北京口腔医学,2013,21(6):341-344.
[9] Di Tommaso L,Magrini E,Consales A,et al.Malignant granular cell tumor of the lateral femoral cutaneous nerve:report of a case with cytogenetic analysis.Hum Pathol,2002,33(12):1237-1240.
315400 浙江省余姚市人民医院消化内科

