异甘草素对氧化偶氮甲烷和右旋葡聚糖苷钠诱导小鼠炎症相关结肠癌的预防作用及其机制
冯言晓
浙江省台州医院急诊科,浙江台州317000
异甘草素对氧化偶氮甲烷和右旋葡聚糖苷钠诱导小鼠炎症相关结肠癌的预防作用及其机制
冯言晓
浙江省台州医院急诊科,浙江台州317000
目的 探讨异甘草素(isoliquiritigenin,ISL)对结肠炎相关结肠癌的预防作用及其机制。方法 50只雄性BALB/c小鼠随机分为5组,每组10只:正常对照组;模型对照组;低、中、高剂量组。每天观察小鼠一般情况,每周测体质量1次,12周后处死小鼠,观察结肠癌发生率及结肠长度的变化,美蓝染色法观察异常隐窝灶(aberrant crypt foci,ACF)数量,病理形态学观察小鼠结肠组织形态学改变,免疫组化法检测组织中巨噬细胞甘露糖受体(CD206)、环氧合酶(COX)-2和一氧化氮合酶(iNOS)的表达水平。结果 模型对照组小鼠在实验过程中均出现消瘦、厌食、脱毛、血便等表现。三个剂量给药组一般情况均明显优于模型对照组。在实验第12周,模型对照组小鼠体质量显著低于正常对照组,而中、高剂量给药组小鼠体质量显著高于模型对照组;模型对照组小鼠结肠长度显著低于正常对照组,而中、高剂量给药组小鼠结肠长度较模型对照组显著增加。三个剂量给药组与模型对照组比,肿瘤发生率呈浓度依赖性减少;三个剂量给药组ACF数量与模型对照组比较显著降低;与模型对照组相比,三个剂量给药组随着ISL浓度的增加,肠黏膜愈来愈完整,隐窝形态逐渐恢复,炎性细胞浸润愈来愈少;三个剂量给药组CD206、COX-2和iNOS表达水平与模型对照组相比,呈剂量依赖性降低。结论 ISL对AOM/DSS诱导的小鼠结肠炎相关结肠癌发生具有明显预防作用,其作用机制可能与其能抑制巨噬细胞向M2型转化及下调COX-2和iNOS表达有关。
异甘草素;结肠炎相关结肠癌;肿瘤相关巨噬细胞;CD206
近几年,我国结肠癌的发病率越来越高,原因是人 们的生活水平不断升高,生活习惯发生变化,饮食结构也发生变化。目前,尽管已经在结肠癌的药物治疗方面已经有很大成就,但是依旧没有改变结肠癌发病率和死亡率高的现象[1-2]。根据流行病学的研究结果及临床观察结果,发生结肠癌之前会有很长一段癌前期,此时是治疗和干预的最佳时期。目前,从天然植物中寻找结肠癌的化学预防药物是研究的热点。从甘草中能够分离出一种黄酮类化合物,称为异甘草素(isoliquiritigenin,ISL),国内外研究[2-3]表明,它对肝癌、肺癌和乳腺癌等多种肿瘤有明显的抑制作用,且具有疗效好、不良反应小等特点。但迄今为止,ISL对结肠炎相关结肠癌的预防作用尚未见报道[3-4]。本文研究了ISL对结肠炎相关结肠癌的预防作用及其机制,为寻找结肠癌的新化学预防药提供理论和实验依据。
1 材料与方法
1.1 材料 药品与试剂:分离提取和制备ISL,纯度≥98%,批号:030401;氧化偶氮甲烷(azoxymethane,AOM)购自美国Sigma公司;右旋葡聚糖苷钠(dextran sodium sulfate,DSS)的相对分子质量为 36 000~50 000,购自美国 MP 公司;CD206、iNOS、COX-2 单克隆抗体购自Abcam公司;DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
动物:雄性6周龄BALB/c小鼠50只,购自湖南斯莱克实验动物有限公司,许可证号:SCXK(湘)2015-0004。5只一笼,自由饮水、进食。动物实验研究经过我院实验动物研究委员会(Animal Research Committee of Wuhan University)批准,与AAALAC要求保持一致。饲养环境:湿度(60±10)%,光照12 h照明,12 h黑暗交替,温度(22±1)℃。按照标准饲养1周之后观察小鼠的大小便状况、活动状况、饮水情况及饮食情况,确认小鼠健康之后再进行分组,采用随机分组方式。
1.2方法
1.2.1 模型的建立分组及处理:建立结肠炎相关结肠癌模型,50只BALB/c小鼠随机分为5组,每组10只:正常对照组;模型对照组;低、中、高剂量组。除正常对照组外,各组小鼠首先给予AOM(10 mg/kg,i.p×1),1周后饮用20 g/L DSS×7 d,14 d后再次饮用20 g/L DSS×7 d,共循环3疗程。低、中、高剂量组在诱癌的同时分别给予含 20、100、500 μg/ml ISL 饲料喂养,直至12周。正常对照组和模型对照组给予常规饲料饲养。
1.2.2 结肠黏膜异常隐窝灶(aberrant crypt foci,ACF)检测:肉眼观察后,每组取5个组织于40 g/L甲醛固定4~6 h。肠道两侧缘用大头针固定于橡胶板上,不要有弯曲褶皱,保证标本完全浸泡在液体中。在生理盐水中加入一定量的亚甲蓝,混合均匀,使亚甲蓝染色剂的浓度为2 g/L。固定之后,在亚甲蓝染色剂中放入结肠标本,30 s后立刻取出。取出的标本用生理盐水清洗,并用大头针进行固定。完成后,在立体显微镜下观察标本,进行ACF数量的计算。
1.2.3 HE染色:肉眼观察后,每组另外5个组织截取从肛门向上约3 cm处的结肠,长度约1 cm,用40 g/L的多聚甲醛固定,24 h后用石蜡包埋,最后进行切片,3~4 μm。脱蜡选择常规的二甲苯,使用不同浓度的乙醇清洗,最后使用清水洗,该清洗流程为:二甲苯、二甲苯各5 min,1000 g/L 的乙醇2 min,950 g/L、800 g/L、750 g/L的乙醇各1 min,最后使用蒸馏水清洗2 min。用苏木精进行染色,5 min后用流动水清洗。盐酸乙醇分化0.5 min(反复多次提插)。放入清水中浸泡,15 min即可,若使用温水浸泡时间可缩短。在伊红溶液内浸泡2 min,之后脱水,透明,最终封片,以下是封片步骤:950 g/L、950 g/L的乙醇各1 min,1000 g/L、1000 g/L的乙醇各1 min,按3∶1比例配置的二甲苯石蜡片处理1 min,二甲苯1 min,二甲苯1 min,最后使用中性树脂将切片封固。结果:细胞核被染成蓝色,胞浆被染成红色,背景粉红色。
1.2.4 免疫组化法检测结肠组织中CD206、iNOS和COX-2表达:一抗+生物素标记的二抗+SABC(链霉卵白素+辣根酶标记生物素)+辣根酶底物显色。阳性染色:CD206蛋白阳性染色在细胞膜上呈黄色或暗黄色颗粒,iNOS和COX-2在细胞浆呈黄色或暗黄色颗粒,界限清楚,无明显背景着色。所得切片用Image-Proplus(IPP)6.0软件来分析图像,能够得出灰度均值,再转换为平均光密度(mean optical density)。
1.3 统计学处理 采用SPSS 6.0软件进行分析,计量资料用均数±标准差表示,使用单因素方差分析(One-way ANOVA)法来比较多样本的均数。P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1 小鼠一般情况 正常对照组小鼠饮食正常、毛色亮丽、排便正常、便中没有血、活泼好动、好斗、未扎堆、未拱背。小鼠经过AOM处理后表现为:活动能力降低,毛发、饮食、排便等基本正常。经DSS处理后的小鼠在饮用第4天左右出现懒动,大便松软、便血,部分小鼠开始出现脱肛,并伴有拱背、不爱运动、扎堆、毛色失去光泽、饮食下降,有些出现毛发脱落现象(见图1)。从第9周开始,小鼠表现为:精神萎靡不振、饮食进一步降低、脱毛、毛发干枯无光泽、便中发现血。ISL低、中、高剂量给药组出现的症状较模型对照组有不同程度减轻,且具有剂量依赖性。全过程中,小鼠排便情况在换用普通灭菌蒸馏水后可较饮用DSS溶液时有所好转。

图1 小鼠一般情况Fig 1 General condition of mice
2.2 小鼠的体质量 实验过程中,小鼠的体质量随着交替饮用DSS溶液和普通蒸馏水有一定的波动。在饮用DSS溶液时,小鼠的体质量明显降低,换用普通蒸馏水后可有所改善。实验之前统计每组小鼠的体质量,差异无统计学意义(P>0.05)。第12周实验后,小鼠体质量发生变化,模型对照组小鼠体质量下降较对照组显著降低(P<0.01);与模型对照组相比,ISL 3个不同浓度给药组小鼠体质量剂量依赖性升高,差异均有统计学意义(P<0.05,见表1)。
表1 小鼠的体质量情况(±s,g)Tab 1 Body mass in mice(±s,g)
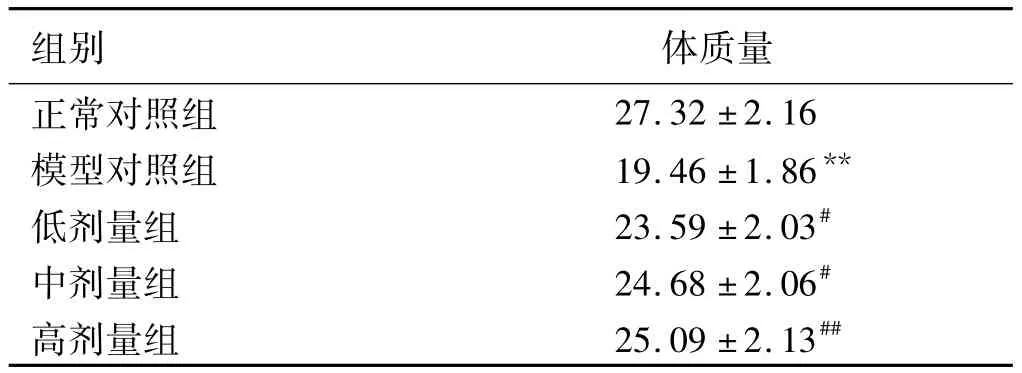
表1 小鼠的体质量情况(±s,g)Tab 1 Body mass in mice(±s,g)
注:与正常对照组相比,**P<0.01;与模型对照组相比,#P <0.05,##P <0.01。
组别 体质量正常对照组27.32±2.16模型对照组 19.46±1.86**低剂量组 23.59±2.03#中剂量组 24.68±2.06#高剂量组 25.09±2.13##
2.3 ISL对结肠长度和肿瘤发生情况的影响 正常对照组小鼠情况为:黏膜正常、光滑,肠黏膜未发现出血,肠黏膜没有溃疡症状,无隆起包块,结肠肠腔宽,肠系膜淋巴结正常,未发生肿大现象。模型对照组小鼠的情况为:结肠管腔变窄,肠黏膜均有不同程度的增厚,表面可见糜烂出血灶,肠系膜淋巴结肿大,多数有明显的肿块形成。诱发的肿瘤大多向肠腔内突出,少数呈片状隆起,主要分布在距肛门6 cm以内的肠段,以距肛门2~4 cm处最密集。肿瘤大小不一,多数直径2~3 mm,表面光滑、质韧,少数有溃疡及菜花样改变(见图2)。与正常对照组相比,模型对照组小鼠的结肠明显缩短;中、高剂量给药组小鼠结肠长度显著高于模型对照组。10只正常对照组小鼠均无肿瘤形成,模型对照组小鼠均有肿瘤发生,且肿瘤数量较多,瘤块较大,高剂量给药组有9只小鼠发生肿瘤,且瘤块较小。3个剂量给药组与模型对照组相比,肿瘤数量呈浓度依赖性减少(见表2)。小鼠其他脏器均未发现转移的肿瘤(见图6B)。

图2 ISL对结肠一般情况的影响Fig 2 Effect of ISL on the general condition of colon
表2 ISL对结肠长度和肿瘤发生情况的影响(±s)Tab 2 Effect of ISL on colon length and tumorigenesis(±s)

表2 ISL对结肠长度和肿瘤发生情况的影响(±s)Tab 2 Effect of ISL on colon length and tumorigenesis(±s)
注:与正常对照组相比,**P<0.01;与模型对照组相比,#P <0.05,##P <0.01。
组别 结肠长度(cm)肿瘤数量正常对照组11.08±0.92 0模型对照组 7.68±0.54** 17.86±1.53低剂量组 8.56±0.62# 13.98±1.24中剂量组 9.03±0.71# 9.79±0.88*高剂量组 9.83±0.76## 9.08±0.72**
2.4 ACF形成情况 亚甲基蓝染色后,除正常对照组外,其余各组小鼠结肠均有 ACF形成,结肠上皮异常隐窝较正常隐窝深染,上皮厚度增加,体积增大,肉眼可见其比黏膜平面高出很多,腺腔向管腔内生长,呈乳头样。模型对照组形成的ACF较大且数量多,ISL 3个剂量给药组ACF平均数量均显著低于模型对照组,且形成的ACF比模型对照组的ACF小(见表3)。
表3 ACF形成情况(±s)Tab 3 ACF formation(±s)

表3 ACF形成情况(±s)Tab 3 ACF formation(±s)
注:与模型对照组相比,*P <0.05,**P <0.01。
组别 平均数量 体质量(g)16±2 18.92±1.65低剂量组 7±3 14.31±1.28*中剂量组 5±2 13.28±1.16**高剂量组 3±2 12.35±1.09模型对照组**
2.5 组织HE切片病理学观察 HE切片观察结果显示,正常对照组肠黏膜完整,腺体排列整齐,固有层结缔组织结构致密。模型对照组的多数肠道黏膜细胞核分裂象明显,增生明显,部分肠黏膜被癌组织取代,腺体显著密集增生,排列紊乱,大小和形状不规则癌细胞体积大、染色深、细胞极性消失,多不规则排列成多层。细胞核形态与大小极不规则,核膜增厚,核仁大,核质比增大,细胞核形态多样。在腺腔中可以看到很多脱落坏死的肿瘤细胞及炎性浸润细胞,同时还有一些嗜酸性物质。与模型对照组比,随着ISL浓度的增加,肠黏膜越来越完整,隐窝形态逐渐恢复正常,浸润的炎性细胞越来越少。实验中诱发的结肠肿瘤多数为腺癌,在组织学上主要为中、高分化腺癌(见图3)。

图3 病理学观察(HE 100×) A:正常对照组;B:模型对照组;C:低剂量组;D:中剂量组;E:高剂量组Fig 3 Pathological observation(HE 100×) A:normal control group;B:model control group;C:low dose group;D:middle dose group;E:high dose group
2.6 结肠组织中CD206、iNOS及COX-2表达免疫组化检测结果 免疫组化结果显示,CD206、iNOS及COX-2的阳性染色呈黄色或深棕色,背景基本不着色,iNOS及COX-2定位于胞浆中,CD206定位于细胞膜上。正常对照组结肠组织CD206、iNOS及COX-2基本无阳性染色。模型对照组结肠癌组织CD206、iNOS及COX-2均有较多阳性染色细胞。随着ISL浓度的升高,低、中、高剂量给药组CD206、iNOS及COX-2阳性染色细胞逐渐减少(见图4)。用IPP 6.0图像分析软件分析免疫组化染色结果,正常对照组CD206、iNOS及COX-2光密度基本为零,模型对照组CD206、iNOS及COX-2光密度显著增加,与模型对照组相比,3个剂量给药组小鼠结肠肿瘤组织CD206、iNOS及COX-2平均光密度均明显降低,且有剂量依赖性(见表4)。
表4 结肠组织中CD206、iNOS及COX-2表达(±s)Tab 4 Expressions of CD206,iNOS and COX-2 in colon tissue(±s)
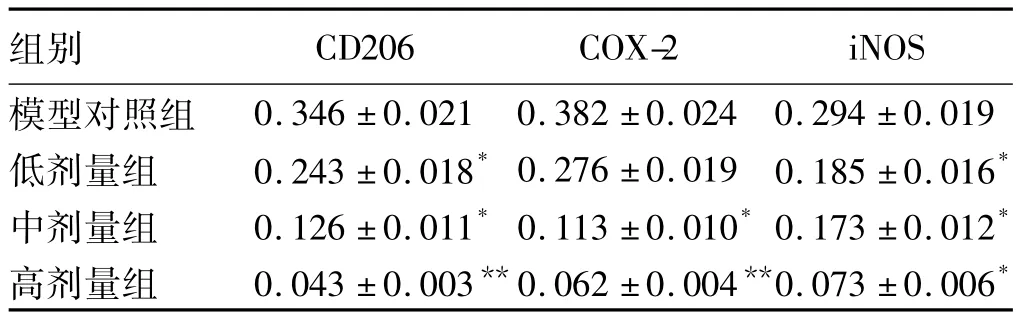
表4 结肠组织中CD206、iNOS及COX-2表达(±s)Tab 4 Expressions of CD206,iNOS and COX-2 in colon tissue(±s)
注:与模型对照组相比,*P <0.05,**P <0.01。
组别CD206 COX-2 iNOS模型对照组0.346±0.021 0.382±0.024 0.294±0.019低剂量组 0.243±0.018*0.276±0.019 0.185±0.016*中剂量组 0.126±0.011*0.113±0.010*0.173±0.012*高剂量组 0.043±0.003**0.062±0.004**0.073±0.006*
3 讨论
结肠癌属于消化系统中比较常见的恶性肿瘤,如果病情严重会对人们的生命造成很大的威胁。由于社会的不断进步和发展,我国人民的生活方式及饮食习惯都发生了很大的变化,而且结肠癌的发病率及死亡率呈逐年上升的趋势。对于肿瘤的发展过程,最主要的是慢性炎症的影响,而且炎症性肠病是导致直肠癌最关键的因素。针对癌变的预防,人们做了许多研究去寻求一种有效的、对人体无害的化学预防物质[5]。ISL属于一种天然的黄酮类化合物,主要来源于甘草,本身具有很多的生物活性,比如抗肿瘤作用、抗自由基作用及脂质抑制作用,目前为止,抗肿瘤作用已经成为热门研究之一。国外研究表明,它对多种肿瘤,如肝癌、肺癌、乳腺癌等具有明显的抑制作用,但其对结肠炎相关结肠癌的预防作用还未见报道。本实验研究不同剂量的ISL对AOM/DSS诱导的结肠炎相关结肠癌的预防作用及其作用机制。
结肠癌的发生是一个非常漫长的过程,一般从正常的黏膜到腺瘤的时间是5~20年,仅仅把最后肿瘤的发生作为最后的评价指标是非常不全面的。我们需要同时研究肿瘤发生过程中所出现的一些现象,来更好地研究肿瘤的发生、发展。目前,ACF属于化学诱导结肠癌模型的生物学指标之一。这个概念是Bird最早提出来的,是他在对AOM诱导小鼠结肠癌研究时发现的,在诱癌过程中大肠黏膜隐窝变大、上皮层增厚,多个变异隐窝聚集在一起,将其命名为 ACF[6]。研究[7-8]已证实,在人类结肠癌癌变过程中,ACF是一种癌前病变,但并不是所有的ACF都能形成腺瘤,一般只有一部分腺瘤发展成腺癌。本次实验显示,实验第12周,除正常对照组外,所有造模的小鼠都有ACF发生。模型对照组小鼠ACF数量明显高于药物干预组,ISL 3个不同剂量组对ACF的形成呈剂量依赖性抑制。
肿瘤的生长和发展有赖于机体促肿瘤和抗肿瘤效应的平衡,这除了与肿瘤细胞本身有关外,还涉及到肿瘤细胞所处的微环境。Paget早在1889年就将微环境与肿瘤的关系类比为“土壤”与“种子”的关系,他提出一定类型的肿瘤细胞只有在由特定的组织或是器官提供的适合的微环境中才能存活、生长和转移[9]。肿瘤的类型、发展阶段及肿瘤细胞受体的状态,决定了微环境中的各种因素产生促进或拮抗肿瘤作用[10-11]。肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)属于一种炎症细胞群,其数量在肿瘤间质中最多,占所有炎症细胞的30% ~50%。Mantovani等[13]曾经提出巨噬细胞能够存在于不同的癌症中,癌症发展的进展不同,肿瘤的位置也会不同,进而能够表现出不一样的类型及功能,所以在不一样的环境中,巨噬细胞受到的外界刺激也不同[12]。目前有很多研究得出了不同的结论,绝大多数研究认为,TAM和M2表型相似,由于TAM表面具有大量的CD分子,同时期分泌的一些细胞因子和M2具有相似之处[13]。本研究通过免疫组化法检测CD206的表达,观察结肠组织中肿瘤相关巨噬细胞的数量,结果显示,与模型对照组相比,随着给予ISL浓度的升高,CD206阳性表达逐渐降低(P<0.05)。以上实验结果证实,ISL可调节肿瘤微环境中巨噬细胞表型,这可能是其有效预防小鼠大肠癌发生的机制之一。
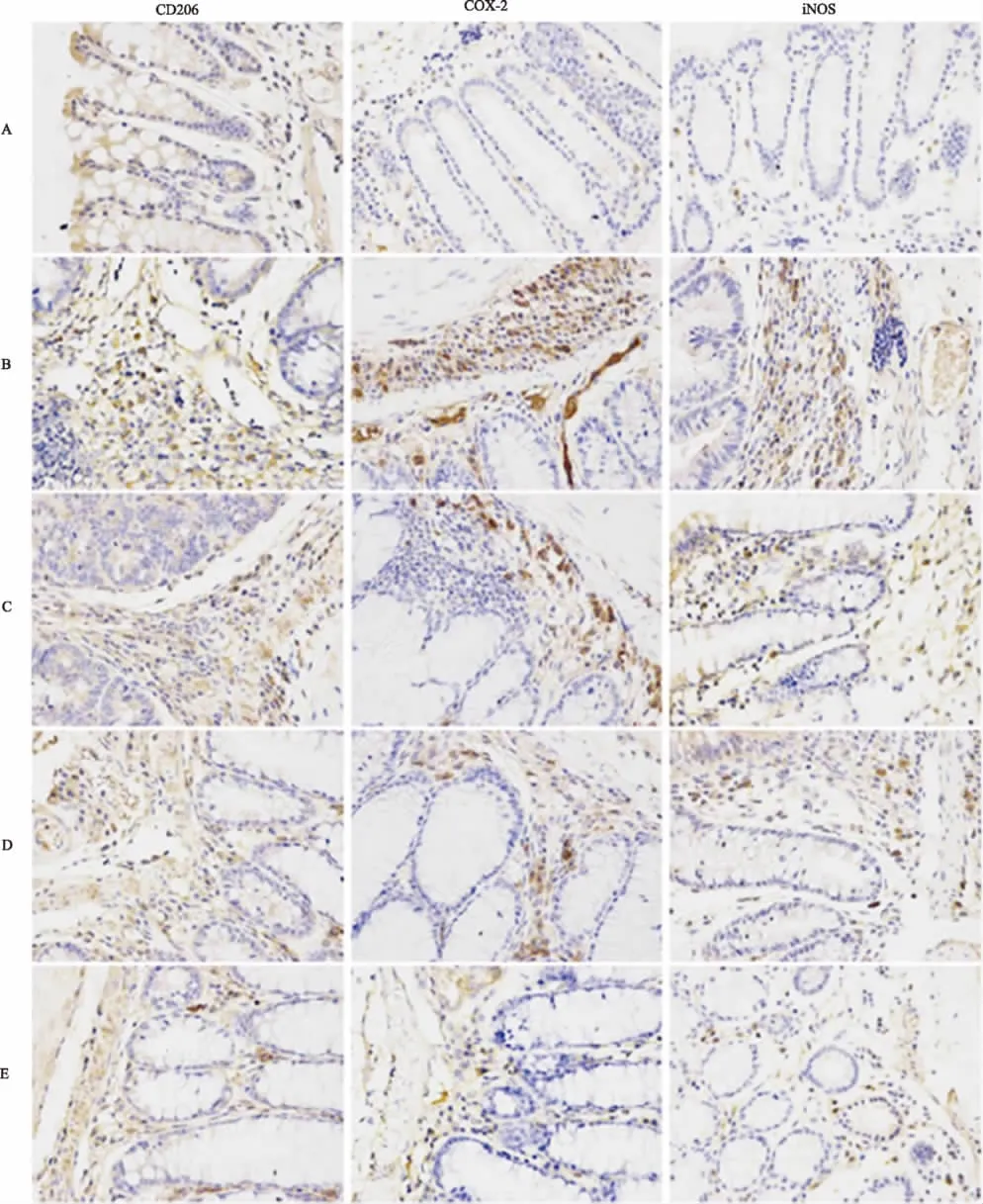
图4 结肠组织中CD206、iNOS及COX-2表达免疫组化检测结果(400×) A:正常对照组;B:模型对照组;C:低剂量组;D:中剂量组;E:高剂量组Fig 4 The expressions of CD206,iNOS and COX-2 in colon tissues detected by immunohistochemistry(400×) A:normal control group;B:model control group;C:low dose group;D:middle dose group;E:high dose group
肿瘤细胞在恶性转移及增殖分化的过程中,iNOS已经成为非常重要的因子之一。其中NOS属于一种同工酶,目前来源于内皮细胞、巨噬细胞、神经细胞及吞噬细胞。按照一氧化氮合酶的特点及基因定位将其分为两类,分别是原生型NOS(cNOS)和诱生型 NOS(iNOS)。cNOS持续表达于特定的细胞,iNOS主要在炎症、肿瘤等情况下产生,进而参与到机体的病理、生理过程中,同时在肿瘤的恶性增殖及转移过程中具有非常重要的作用。目前为止,已有大量的研究表明,肿瘤中具有很多的巨噬细胞及分泌的大量细胞因子,这些物质都能够对iNOS的表达进行诱导,所以,研究黄酮物质对于iNOS的影响对了解类黄酮抗炎症作用非常重要。已有研究[14]表明,黄酮类化合物木犀草素、芹菜素、山奈酚可以通过下调iNOS活性减少由LPS诱导的巨噬细胞NO释放。本实验中我们用免疫组化法检测各组小鼠肠道iNOS表达情况,结果发现正常对照组几乎无表达,与模型对照组相比,ISL可剂量依赖性下调iNOS表达。
按照流行病及临床试验可以得知,长时间使用非甾体类抗炎药(non-steroidal anti-inflammatory drugs,NSAIDs)能够对结肠癌产生一定的抑制作用。环氧化酶属于NSAIDs的靶目标,在花生四烯酸的作用下逐渐转变成为前列腺素(prostaglandins,PGs),前列腺素E2(prostaglandin E2,PGE2)还具有限制酶的作用,同时参与到相关的肿瘤活动中,比如免疫反应、细胞增殖分化及血管生成等过程。现在认为COX-2能够对前列腺素H2产生催化作用,随后逐渐转化为PGE2,从而具有促肿瘤作用。COX-2抑制剂可通过抑制结肠肿瘤 PGE2的合成,减少肿瘤数量[15]。本实验中我们用免疫组化法检测ISL对各组小鼠肠道COX-2表达的影响,结果发现ISL可剂量依赖性下调COX-2表达。
综上所述,ISL对AOM/DSS诱导小鼠结肠炎相关结肠癌有预防作用,作用机制可能与其对肿瘤微环境中巨噬细胞表型的调节作用,下调结肠组织中COX-2和iNOS表达有关。然而肿瘤微环境是非常复杂的,ISL对炎症相关结肠癌的预防作用是否还有其他作用机制,仍待进一步深入研究。本研究显示,ISL在体内可以调节巨噬细胞表型,抑制微环境中肿瘤相关蛋白的表达,为ISL用于肿瘤的预防提供了一定的实验依据。
[1]庞得全,王英曼,郑维国,等.抗黑色素瘤药物异甘草素对酪氨酸酶抑制机理的研究[J].中国生化药物杂志,2015,35(3):45-47.
Pang DQ,Wang YM,Zheng WG,et al.Study on inhibitory mechanism of anti-melanoma drug isoliquiritigenin on tyrosinase[J].Chinese Journal of Experimental Surgery,2015,35(3):45-47.
[2]李雅娟,甘露,王占洋,等.异甘草素对大鼠C6胶质瘤细胞增殖和分化的影响[J].中国药理学通报,2015,31(9):1298-1303.
Li YJ,Gan L,Wang ZY,et al.Effect of isoliquiritigenin on C6 glioma cell proliferation and differentiation[J].Chinese Pharmacological Bulletin,2015,31(9):1298-1303.
[3]付亚杰,李长栋,荔志云,等.异甘草素对低氧PC12细胞凋亡相关基因 Bcl-2、Bax的表达[J].创伤外科杂志,2014,16(5):440-444.
Fu YJ,Li CD,Li ZY,et al.Effect of isoliquiritigenin on the apoptosis-related genes Bcl-2,Bax of PC12 cells induced by hypoxia[J].J Trauma Surg,2014,16(5):440-444.
[4]雷平平,何伟平,石泉,等.代谢综合征与结肠癌关系的Meta分析[J].重庆医学,2015,44(24):3389-3392
Lei PP,He WP,Shi Q,et al.Metabolic syndrome and colon cancer:a Meta-analysis [J]. ChongqingMedicine,2015,44(24):3389-3392.
[5]郭毅,李慧颖,王磊,等.天然生物碱单体在结肠癌领域中的研究进展[J].中国老年学杂志,2015,35(3):832-835.
[6]Toyoda-Hokaiwado N,Yasui Y,Muramatsu M,et al.Chemopreventive effects of silymarin against 1,2-dimethylhydrazine plus dextran sodium sulfate-induced inflammation-associated carcinogenicity and genotoxicity in the colon of gpt delta rats[J].Carcinogenesis,2011,32(10):1512-1517.
[7]Xiao H,Hao X,Simi B,et al.Green tea polyphenols inhibit colorectal aberrant crypt foci(ACF)formation and prevent oncogenic changes in dysplastic ACF in azoxymethane-treated F344 rats[J].Carcinogenesis,2008,29(1):113-119.
[8]Sakai E,Morioka T,Yamada E,et al.Identification of preneoplastic lesions as mucin-depleted foci in patients with sporadic colorectal cancer[J].Cancer Sci,2012,103(1):144-149.
[9]Paget S.The distribution of secondary growths in Cancer of the breast.1889 [J].Cancer Metastasis Rev,1989,8(2):98-101.
[10]Mueller MM,Fusenig NE.Friends or foes-biPolar effects of the tumor stroma in caneer[J].Nat Rev Caneer,2004,4(11):839-849.
[11]Witz IP.The tumor mieroenvironment:the making of a paradigm[J].Cancer Microenviron,2009,2(Suppl l):9-17
[12]Mosser DM,Edwards JP.Exploring the full spectrum of macrophage activation [J].Nat Rev Immunol,2008,8(12):958-969.
[13]Mantovani A,Allavena P,Sica A,et al.Cancer-related inflammation[J].Nature,2008,454(7203):436-444.
[14]夏敏,朱惠莲,马静,等.膳食黑米皮对载脂蛋白E基因缺陷小鼠诱导型一氧化氮合酶表达的影响[J].中国病理生理杂志,2004,20(3):326-329.
Xia M,Zhu HL,Ma J,et al.Effect of dietary black rice outer layer fraction on inducible nitric oxide synthase expression in apoE-deficient mice [J].Chinese Journal of Pathophysiology,2004,20(3):326-329.
[15]Tsujii M,Kawano S,Tsuji S,et al.Cyclooxygenase regulates angiogenesis induced by colon cancer cells[J].Cell,1998,93(5):705-716.
(责任编辑:马 军)
Preventive effect and mechanism of different doses of isoliquiritigenin on the induction of inflammation related colon cancer in mice induced by azoxymethane and dextran sodium sulfate
FENG Yanxiao
Department of Emergency,Taizhou Hospital in Zhejiang Province,Taizhou 317000,China
ObjectiveTo investigate the effect of isoliquiritigenin(ISL)on the prevention of colitis associated colon cancer.MethodsFifty male BALB/c mice were randomly divided into 5 groups,each group was 10 mice:normal control group,model group,ISL low dose group,ISL middle dose group,ISL high dose group.Mice were observed for weight and other general condition,incidence of colon cancer and colon length changes;methylene blue staining was used to observe number of aberrant crypt foci(ACF);pathological morphology was used to observe morphological changes;immunohistochemistry method was used to detect macrophage mannose receptor(CD206),cyclooxygenase(COX)-2 and inducible nitric oxide synthase(iNOS)expressions in colon tissue.ResultsThe model group appeared emaciation,anorexia,hair removal,stool performance during the experiment.The three doses of ISL groups were significantly better than the model cont group.At the twelfth week,the weight of mice in model group was significantly lower than that in normal control group,while the mice in high dose group and middle dose group were significantly higher than that in model group,and the length of colon in model group was significantly lower than that in normal control group.Compared with model group,the incidence of tumor was significantly lower than that in 3 ISL dose groups,and the number of ACF in model group was significantly lower than that in 3 ISL dose groups,and the number of iNOS,COX-2 and CD206 expressions in three dose groups were decreased significantly.ConclusionISL has chemoprevention on AOM/DSS-induced mouse colon cancer.ISL can inhibit macrophages in the tumor microenvironment convert to M2 type and reduce COX-2 and iNOS expressions in colon tissue.
Isoliquiritigenin;Colitis-associated colon cancer;Tumor associated macrophage;CD206
R574.62;R735.3+5
A
1006-5709(2017)08-0873-06
2016-11-25
10.3969/j.issn.1006-5709.2017.08.009
冯言晓,住院医师,研究方向:医学急症。E-mail:zjfengyanxiao@163.com

