具核梭杆菌通过上调c-Jun表达促进结直肠癌细胞系caco-2的DNA复制
曾利红,林 欣,何 杰,黄惠康,杜艳蕾,赵 冲,魏 芳,王 红
广州医科大学附属市一人民医院消化内科,广东广州510180
具核梭杆菌通过上调c-Jun表达促进结直肠癌细胞系caco-2的DNA复制
曾利红,林 欣,何 杰,黄惠康,杜艳蕾,赵 冲,魏 芳,王 红
广州医科大学附属市一人民医院消化内科,广东广州510180
目的 研究具核梭杆菌(Fusobacterium nucleatum,Fn)促进结直肠癌(colorectal cancer,CRC)细胞系caco-2 DNA复制,并初步探讨其机制。方法 Fn感染caco-2细胞后,通过EdU检测caco-2细胞DNA复制情况,采用RT-PCR及Western blotting检测c-Jun基因转录和蛋白表达,Western blotting检测细胞增殖相关基因CCND1的表达,利用siRNA敲低c-Jun表达,Western blotting技术检测感染Fn后caco-2细胞CCND1蛋白表达及EdU检测caco-2 DNA复制情况。结果 Fn感染caco-2细胞6 h后,caco-2细胞DNA复制显著增加,c-Jun和Cyclin D1表达量增加,Fn感染并敲低c-Jun后,caco-2细胞DNA复制减少,Cyclin D1蛋白表达量也显著降低。结论 Fn可通过上调c-Jun的表达促进CRC细胞系caco-2的DNA复制。
具核梭杆菌;结直肠癌;c-Jun;caco-2
结直肠癌(colorectal cancer,CRC)是一种常见的消化道肿瘤,其发生是一个多阶段、多步骤的病理过程,与多个癌基因激活和抑癌基因失活有关。近年来研究[1]发现,肠道菌群也可能通过肠道黏膜屏障受损、慢性炎症反应、细菌酶、毒性代谢产物作用等多种机制促进肿瘤发生、发展。其中具核梭杆菌(Fusobacterium nucleatum,Fn)被认为与CRC的发生、发展高度相关。Fn属梭杆菌属,是革兰阴性无芽孢杆菌,专性厌氧,不具有运动能力。研究发现,Fn可通过代谢产物(丁酸、硫化氢)等破坏肠上皮DNA完整性,其中硫化氢可为CRC细胞的能量代谢来源,促进其增殖,Fn还可通过结构蛋白与宿主细胞相识别,启动炎症相关下游信号通路,促进IL-6、IL-8、IL-18的释放。c-Jun基因是禽肉瘤逆转录病毒基因ASV17的细胞内同源基因。研究[2]显示,c-Jun基因在蛋白水平或基因的改变与多种肿瘤的发生、发展有关。c-Jun与激活的ras基因一起可以转化细胞,c-Jun蛋白是细胞增殖的正向调节物[3]。目前尚无研究证实,Fn感染CRC细胞后促进c-Jun基因的表达,并通过上调c-Jun基因的表达促进CRC细胞DNA复制。本研究拟针对Fn感染CRC细胞株系caco-2细胞,探讨用共培养的方法让Fn感染CRC细胞系caco-2细胞后上调c-Jun基因的表达对caco-2细胞DNA复制是否有调节作用及该调节作用与哪些基因的激活与抑制相关,为Fn致癌机制提供实验依据。
1 材料与方法
1.1 主要实验材料与仪器 RIPA裂解液、Cooktail、蛋白浓度测定试剂盒、Lipo3000等均购自美国Thermo Fisher Scientific公司,鼠抗人β-actin单克隆抗体、兔抗人Cyclin D1单克隆抗体、辣根过氧化物酶标记山羊抗兔抗体、辣根过氧化物酶标记山羊抗鼠抗体等均购自美国ABCAM生物有限公司,兔抗人c-Jun多克隆抗体购自美国CST公司,PVDF膜、ECL发光液均购自美国Millipore公司,针对c-Jun特异性小干扰RNA及阴性对照小干扰RNA、EdU试剂盒均购自锐博生物有限公司,opti-MEM、DMEM高糖培养基、胰酶等均购自美国Life公司,胎牛血清、脑心浸液肉汤、哥伦比亚血平板培养基、caco-2细胞购自美国ATCC细胞库,CO2细胞培养箱(H90中国力康公司)、共聚焦显微镜(日本奥林巴斯公司)、NaNoDROP(美国Thermo Fisher Scientific公司)、BIO-RAD电泳仪(美国BIO-RAD公司)、化学发光分子成像系统(TANON公司)、荧光定量梯度PCR仪(qTower2.0德国耶拿公司)。
1.2 实验方法
1.2.1 细菌培养:Fn菌株ATCC10953(购自广东省微生物研究所微生物菌种保藏中心)接种于哥伦比亚血平板培养基,37℃厌氧培养48 h,生化鉴定、传代。液体培养20 h后4 000 r/min,Rt离心10 min,收集细菌,PBS洗涤3次,重悬于PBS溶液中,NaNoDROP测量600 nm的吸光度值,将菌悬液调制1×108CFU/ml备用。
1.2.2 细胞培养:人结肠癌细胞株caco-2购自美国ATCC公司,经复苏后,用含200 g/L胎牛血清的DMEM高糖培养液进行常规培养和传代。将caco-2细胞铺于细胞6孔培养板,细胞贴壁融合度达到70%时,更换新鲜无双抗培养基,加入Fn,分别共培养6 h、12 h,收集样品检测。实验设对照组与感染组,未加细菌组为对照组(Blank),加细菌处理组为感染组(Fn+),MOI=1∶200。
1.2.3 转染:siRNA转染实验参照LIPO 3000试剂说明书进行操作。转染前1 d将1.5×105个细胞/孔接种于6孔培养板,一共设置3组,分为空白对照组(Blank)、阴性对照组(NC control)、sic-Jun 组。
1.2.4 EdU:将24 mm×24 mm盖玻片放入6孔培养板中,每孔约1×105个细胞,待细胞融合至70%时,更换新鲜培养基,按 MOI=200∶1加入 Fn共培养6 h,PBS清洗3次后,按EdU试剂盒说明书按步骤加入试剂,染色、固定、封片,避光保存,由广州市第一人民医院中心实验室共聚焦显微镜室进行荧光拍摄。
1.2.5 RT-PCR检测 Fn:感染 Caco-2细胞6 h、12 h后,分别以 Trizol提取总 RNA。Prime Script RT Reagent Kit逆转录cDNA,实时PCR扩增。各引物序列见表1。每组实验重复3次。
1.2.6 Western blotting检测 Fn:感染 Caco-2细胞6 h、12 h后,提取总蛋白,测定蛋白质量浓度。取20 μl蛋白样品进行 SDS-PAGE,80 V恒压模式电泳20 min后转110 V恒压电泳,350 mA电流转膜70 min,5%脱脂奶粉封闭1 h,加入一抗后4℃孵育过夜。TBST清洗3遍,与相应的二抗室温孵育1 h,TBST清洗3遍,加入化学发光液室温作用1 min,化学发光分子成像仪曝光。每组实验重复3次。
1.3 统计学分析 采用SPSS 17.0进行统计学分析,计量资料用±s表示。两组间比较采用t检验,P<0.05为差异有统计学意义。
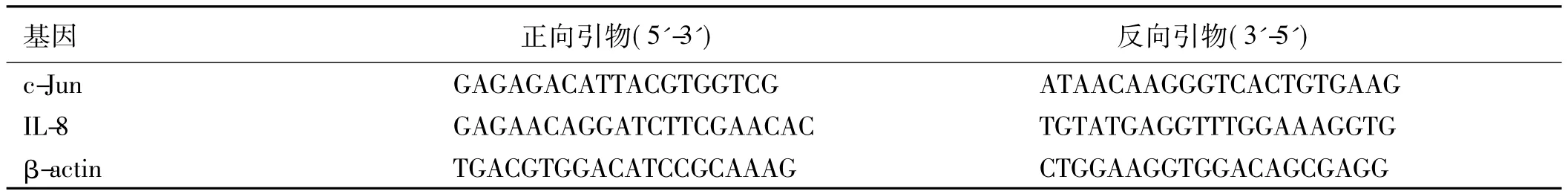
表1 实时定量PCR引物序列Tab 1 Primer sequences for real time PCR
2 结果
2.1 Fn感染促进caco-2细胞DNA复制 Fn与caco-2细胞共培养12 h(MOI=200),建立Fn与caco-2的感染模型,EdU检测DNA复制情况,与对照组相比,细胞复制显著活跃(见图1A、1B,P<0.01)。Western blotting检测G1/S期检验点关键蛋白Cyclin D1的表达情况,与对照组相比,感染6 h后,Cyclin D1表达量差异无统计学意义(见图1C、1E,P>0.05),感染12 h后,Cyclin D1表达量明显升高(见图1D、1E,P>0.05)。

图1 Fn感染caco-2促进DNA复制 A:聚焦内镜下Fn感染caco-2 DNA复制(400×);B:总细胞和EdU阳性细胞进行计数,统计阳性细胞所占比例(n=120);C:共培养6 h,Western blotting检测Cyclin D1蛋白后灰度扫描统计;D:共培养12 h,Western blotting检测CyclinD1蛋白后灰度扫描统计;E:Fn感染组与空白组Cyclin D1蛋白水平Fig 1 Fn stimulated the DNA-replikation of caco-2 cells A:DNA replication results in caco-2 cells after Fn infection by confocal microscopy(400 × );B:DNA replication results in caco-2 cells after Fn infection by EdU detection in bar chart,C:after co-culture 6 hours,CyclinD1 protein detected by Western blotting;D:after co-culture 12 hours,Cyclin D1 protein detected by Western blotting;E:expression of Cyclin D1 protein by Western blotting
2.2 Fn感染促进caco-2细胞c-Jun、炎症因子IL-8表达上调 Fn与caco-2细胞共培养6 h(MOI=200),进行RNA-sequencing检测c-Jun、IL-8 mRNA表达,与对照组相比,c-Jun、IL-8 mRNA表达显著增加(见图2A,P <0.01;见图2B,P<0.001)。RT-PCR 进一步验证c-Jun、炎症因子 IL-8 mRNA表达情况,c-Jun、IL-8转录水平表达显著上调(见图2C~2F,P<0.01)。Western blotting进一步验证c-Jun蛋白水平表达,与对照组相比,c-Jun蛋白表达量显著升高(见图2G~2I,P<0.05)。

图2 Fn感染组与空白对照组c-Jun、IL-8 mRNA水平、蛋白水平表达量比较 A:RNA-requencing检测c-Jun;B:RNA-requencing检测IL-8;C:共培养6 h,RT-PCR检测c-Jun mRNA水平;D:共培养12 h,RT-PCR检测c-Jun mRNA水平;E:共培养6 h,RT-PCR检测IL-8 mRNA水平;F:共培养12 h,RT-PCR检测IL-8 mRNA水平;G:共培养6 h,Western blotting检测c-Jun蛋白后灰度扫描统计;H:共培养12 h,Western blotting检测c-Jun蛋白后灰度扫描统计;I:Western blotting检测c-Jun蛋白表达Fig 2 Expressions of c-Jun and IL-8 in Fn group and blank group A:RNA-requencing of c-Jun;B:RNA-requencing of IL-8;C:the mRNA level of c-Jun after 6 hours co-culture by RT-PCR;D:the mRNA level of c-Jun after 12 hours co-culture by RT-PCR;E:the mRNA level of IL-8 after 6 hours co-culture by RT-PCR;F:the mRNA level of IL-8 after 12 hours co-culture by RT-PCR;G:the protein level of c-Jun after 6 hours co-culture by Gary-scan analysis;H:the protein level of c-Jun after 12 hours co-culture by Gary-scan analysis;I:the protein level of c-Jun by Western blotting
2.3 Fn通过上调c-Jun表达促进细胞DNA复制在caco-2细胞转染c-Jun siRNA 12 h后,加入Fn共培养12 h,EdU检测DNA复制情况,与对照组相比,细胞复制显著活跃(见图3A、3B,P<0.01)。Fn共培养12 h,Western blotting检测Cyclin D1蛋白水平表达情况,与对照组相比,Cyclin D1蛋白表达量显著下降(见图3C、3D,P <0.01)。

图3 c-Jun siRNA转染后caco-2 DNA复制相关指标结果 A:激光共聚焦显微镜观察EdU检测Fn感染sic-Jun转染后caco-2 DNA复制(400×);B:对视野中总细胞和EdU阳性细胞进行计数,统计阳性细胞所占比例(n=120);C:对sic-Jun转染caco-2细胞后Fn处理组与空白组Cyclin D1 Western blotting结果进行灰度扫面统计;D:Western blotting检测sic-Jun转染caco-2细胞后Fn处理组与空白对照组Cyclin D1Fig 3 Fn stimulated the DNA-replikation of caco-2 cells after transfection A:DNA replication results in caco-2 cells after c-Jun si-RNA infection by confocal microscopy(400×);B:DNA replication results in caco-2 cells after c-Jun siRNA infection by EdU detection in bar chart;C:Gray-scan analysis results of Cyclin D1 protein in caco-2 cells after c-Jun siRNA infection by Western blotting;D:expression of Cyclin D1 protein by Western bloting
3 讨论
在CRC的发生、发展中,肿瘤微环境的作用是一个重要因素,肿瘤细胞周围的间质细胞、免疫细胞及各种细胞所分泌的细胞因子、免疫因子等构成了肿瘤细胞相互作用的内环境,成为肿瘤微环境(tumor enviroment,TME)。肿瘤微环境中,慢性炎症是促进肿瘤发生、发展的一个关键环节。炎性微环境中存在的活性氮和活性氧物质导致细胞的DNA发生基因突变,诱发了细胞的恶性转变,炎性环境过度激活促增殖通路和抑制凋亡的通路,而持续的炎症状态又为细胞的恶性增殖、血管新生、癌细胞的迁移和侵袭提供了必要的环境,进一步加速了肿瘤的发生、发展进程[4]。在胃肠道癌症的发生、发展中,慢性炎症往往与微生物的感染有关。在多项研究中均发现肠道菌群紊乱与CRC有关,肠道菌群通过其结构蛋白、细菌酶、毒性代谢产物促进肠黏膜局部慢性炎症的发生、发展,同时,研究人员证实,小鼠肠道微生物组不仅影响了局部炎症,还影响了全身炎症的形成[5]。肠道菌群中,Fn已被证实与炎症性肠病、肠腺瘤、CRC等多种肠道疾病发生、发展密切相关[6-7]。Fn可以通过脂蛋白Fad-I被宿主Toll样受体-1/2(TLR-1/2)和Toll样受体2/6(TLR-1/2)识别并上调防御素β2(β-defensin3)表达,而感染Fn的CRC细胞系,在裸鼠体内比未感染的细胞在裸鼠体内更快形成肿瘤,体积也更大[8]。Fn感染结肠细胞后能直接激活 TLR4/MYD88/NF-κB 信号通路[9]。
综合已有的研究,Fn侵袭宿主上皮后可促进炎症和促进肿瘤的发生、发展。Fn侵袭入上皮细胞后促进炎症相关因子 TNF-α、IL-8、IL-1β 等表达上调[4]。在我们的研究中也观察到Fn感染caco-2细胞显著上调IL-8转录水平的表达。Fn的感染能促进细胞增殖[10],在我们的研究中,通过Western blotting检测Cyclin D1表达和EdU发现,Fn感染caco-2细胞能够显著促进caco-2细胞DNA复制,DNA复制积累,进一步增加了DNA复制错误发生率和染色体损伤。在细胞中,细胞每分裂一次,即DNA复制每发生一次,碱基错配的概率为1/1010~1/109,DNA错配发生率增加,也可能造成DNA错配修复异常。Tomasetti等[12]利用其数学模型将来自英国的32种癌症病例患者进行分析,发现66%的癌症驱动基因突变源于DNA复制错误,癌症的发生、发展与DNA复制错误有关。
Fn能通过其毒力因素如FadA、Fap2和梭菌属外膜蛋白FomA识别、侵袭入血管内皮和肠上皮细胞,激活多个信号通路,如 β-catenin[10]、NF-κB[10]等,但目前,较少有研究显示Fn感染引发结肠炎症和致癌作用的下游事件。c-Jun是禽肉瘤逆转录病毒基因ASV17的细胞内同源基因,c-Jun蛋白水平或基因的改变与多种肿瘤的发生、发展有关,c-Jun可能通过抑制WWOX的肿瘤抑制作用促进肿瘤发生、发展[2]。在本研究中,Fn感染能够促进caco-2细胞高表达c-Jun蛋白和Cyclin D1,当caco-2细胞转染c-jun特异性siRNA后,Fn感染不能引起Cyclin D1高表达,因此,Fn感染引起的Cyclin D1高表达与c-Jun高表达直接相关,而Cyclin D1是DNA复制的标志性蛋白,也说明c-Jun高表达在促进DNA复制过程发挥着关键作用。c-Jun是β-catenin信号通路中的靶基因,能够整合细胞内外多种刺激调节下游靶基因的表达。Fn可利用独特的FadA与宿主细胞内Ecadherin结合,抑制抑癌基因的抑制作用,激活β-catenin信号通路,上调相关转录因子[11]。因此,Fn感染引起的c-Jun蛋白高表达与促进DNA复制作用可能是通过β-catenin信号通路的激活来实现。目前,普遍认为癌症是癌症驱动基因发生突变后造成细胞异常增殖引起,而引起癌症驱动基因发生突变的原因主要有遗传、环境和DNA复制错误等[11]。本研究发现,Fn感染能够引起DNA复制相关蛋白Cyclin D1表达增加,促进DNA复制,Fn感染能够上调c-Jun表达,Fn感染对DNA复制的调控可能是通过上调c-Jun表达介导的。
综上所述,Fn感染促进caco-2细胞c-Jun表达上调,促进caco-2细胞DNA复制,且Fn感染对DNA复制的促进作用与高表达c-Jun显著相关,Fn感染促进c-Jun的表达可能与β-catenin信号通路激活有关。但是c-Jun同时也是MAPK信号通路中的下游靶基因,本实验中尚未检测Fn感染caco-2细胞后β-catenin的表达情况,也并未进行β-catenin特异性si-RNA转染实验检测c-Jun表达,以确定Fn感染后高表达c-Jun与β-catenin的直接联系。
[1]Kostic AD,Gevers D,Pedamallu CS,et al.Genomic analysis identifies association of Fusobacterium with colorectal carcinoma [J].Genome Res,2012,22(2):292-298.
[2]Gaudio E,Palamarchuk A,Palumbo T,et al.Physical association with WWOX suppresses c-Jun transcriptional activity[J].Cancer Res,2006,66(24):11585-11589.
[3]Turpaev KT.Role of transcription factor AP-1 in integration of cellular signalling systems[J].Mol Biol(Mosk),2006,40(6):945-961.
[4]O’Connor PM,Lapointe TK,Beck PL,et al.Mechanisms by which inflammation may increase intestinal cancer risk in inflammatory bowel disease[J].Inflamm Bowel Dis,2010,16(8):1411-1420.
[5]Viaud,Saccheri F,Mignot G,et al.The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide[J].Science,2013,342(6161):971-976.
[6]Han YW.Commentary:Oral bacteria as drivers for colorectal cancer[J].J Periodontol,2014,85(9):1155-1157.
[7]Flanagan L,Schmid J,Ebert M,et al.Fusobacterium nucleatum associates with stages of colorectal neoplasia development,colorectal cancer and disease outcome[J].Eur J Clin Microbiol Infect Dis,2014,33(8):1381-1390.
[8]Bhattacharyya S,Ghosh SK,Shokeen B,et al.FAD-I,a fusobacterium nucleatum cell wall-associated diacylated lipoprotein that mediates human beta defensin 2 induction through receptor-1/2(TLR-1/2)and TLR-2/6[J].Infect Immun,2016,84(5):1447-1456.
[9]Yang Y,Weng W,Peng J,et al.Fusobacterium nucleatum increases proliferation of colorectal cancer cells and tumor decelopment in mice by activating toll-like receptor 4 signaling to nuclear fator-κB,and upregulating expression of microRNA-21 [J].Gastroenterology,2017,152(4):851-866.
[10]Rubinstein MR,Wang X,Liu W,et al.Fusobacterium nucleatum promotes colorectal carcinogenesis by modulating E-cadherin/β-catenin signaling via its FadA adhesion [J].Cell Host Microbe,2013,14(2):195-206.
[11]Tomasetti C,Lu L,Vogelstein B.Stem cell divisions,somatic mutations,cancer etiology,and cancer prevention [J].Science,2017,355(6331):1330-1334.
[12]Tomasetti C,Li L,Vogelstein B.Stem cell divisions,somatic mutations,cancer etiology,and cancer prevention [J].Science,2017,355(6331):1330-1334.
(责任编辑:王全楚)
Up-regulated expression of c-Jun by Fusobacterium nucleatum to promote DNA replication in caco-2 cell line
ZENG Lihong,LIN Xin,HE Jie,HUANG Huikang,DU Yanlei,ZHAO Chong,WEI Fang,WANG Hong
Department of Gastroenterology,Guangzhou First People’s Hospital,Guangzhou Medical University,Guangzhou 510180,China
ObjectiveTo investigate the DNA-replication induced by Fusobacterium nucleatum(Fn)in human colorectal cancer(CRC)cell line caco-2 cells,in order to make a preliminary discussion on the mechanism.MethodsThe DNA-replication was detected by EdU(5-Ethynyl-2'-deoxyuridine)and the expression of c-Jun was detected by RT-PCR and Western blotting after caco-2 cells infected with Fn.The expression of CCND1 was detected by Western blotting after caco-2 cells infected with Fn.c-Jun was knocked down by specific siRNA transfection cells,while these cells were infected by Fn,the DNA-replication was detected by EdU as wells as the expression of CCND1 was detected by Western blotting.ResultsAfter 6 hours infected by Fn,DNA-replication detected by EdU was significantly increased in caco-2 cells.The levels of c-Jun and Cyclin D1 were significantly increased in caco-2 cells during Fn infection.Furthermore,When Fn was infected and c-Jun was knocked down,the DNA-replication was decreased in caco-2 cells and the expression of Cyclin D1 protein was significantly decreased.ConclusionFn can stimulate the DNA-replikation of caco-2 cells via increasing the expression of c-Jun.
Fusobacterium nucleatum;Colorectal cancer;c-Jun;Caco-2 cells
R735.3
A
1006-5709(2017)08-0852-05
2017-04-05
10.3969/j.issn.1006-5709.2017.08.004
广州市胃肠病临床医学与转化中心(00742)
曾利红,硕士,研究方向:具核梭杆菌与结直肠癌。E-mail:455024851@qq.com
王红,教授,主任医师,硕士生导师,研究方向:肠道菌群与结直肠癌。E-mail:wong.hong@163.com

