HIF-2α基因沉默对人肝癌细胞株 HepG2增殖能力的影响
李伟伟,耿晓松,王宏伟,侯丽娟,宋新文
1.新乡医学院第一附属医院感染疾病科,河南卫辉453100;2.新乡医学院护理学院
HIF-2α基因沉默对人肝癌细胞株 HepG2增殖能力的影响
李伟伟1,耿晓松2,王宏伟1,侯丽娟1,宋新文1
1.新乡医学院第一附属医院感染疾病科,河南卫辉453100;2.新乡医学院护理学院
目的 探讨缺氧诱导因子-2α(hypoxia-inducible factors-2α,HIF-2α)表达水平对人肝癌细胞株HepG2增殖能力的影响。方法 用氯化钴(CoCl2)诱导细胞模拟缺氧微环境,并根据 CoCl2浓度不同分为 50 μmol/L、100 μmol/L、200 μmol/L、400 μmol/L 组,选择CoCl2浓度为200 μmol/L模拟肿瘤内缺氧微环境。采用siRNA干扰沉默HepG2细胞中HIF-2α的表达,分别应用RT-PCR、Western blotting方法检测HIF-2α mRNA和蛋白的表达,MTT方法检测HepG2细胞增殖,绘制细胞生长曲线,流式细胞技术观察细胞周期的改变。结果 建立细胞缺氧模型,作为低氧组;采用浓度为50 nmol/L的HIF-2α siRNA转染缺氧环境下的HepG2细胞,作为低氧+HIF-2α siRNA组,结果显示:低氧组、低氧+Control siRNA组的HIF-2α mRNA和蛋白表达显著高于常氧组和低氧+HIF-2α siRNA组(P<0.05);细胞生长曲线结果显示:低氧组、低氧+Control siRNA组的光密度值显著高于常氧组和低氧+HIF-2α siRNA组(P<0.05);细胞周期结果显示:低氧组、低氧+Control siRNA组HepG2细胞在DNA合成前期(G0/G1期)细胞比率显著低于常氧组和低氧+HIF-2α siRNA组,合成期(S)及合成后期(G2/M)细胞比率显著高于常氧组和低氧+HIF-2α siRNA组(P<0.05)。结论 缺氧微环境通过促进人肝癌细胞株HepG2细胞中HIF-2α的表达进一步促进HepG2细胞增殖,而针对HIF-2α的靶向siRNA能有效抑制肝癌HepG2细胞中HIF-2α的表达,从而抑制HepG2细胞的增殖。
缺氧诱导因子-2α;氯化钴;RNA干扰;肝癌;细胞增殖
恶性肿瘤在生长过程中会出现肿瘤内部的缺氧微环境,肿瘤细胞通过改变自身内源基因的表达来适应变化的微环境,缺氧诱导因子家族能够适应细胞内氧气浓度的降低,并对多种基因进行调控[1-2]。研究[3]发现,HIF-1α主要与肿瘤急性缺氧相关,而在肿瘤的长期慢性缺氧过程中,发挥主要作用的调控因子为HIF-2α。HIF-2α在肾癌、肝癌等肿瘤中高表达,它能通过启动其下游靶基因,导致肿瘤细胞增殖、转移,加速疾病恶化[4-5]。本研究通过诱导缺氧环境,应用RNA干扰技术沉默人肝癌细胞株HepG2细胞中HIF-2α的表达,观察下调HIF-2α表达对人肝癌细胞增殖能力的影响。
1 材料与方法
1.1 材料 人肝癌细胞株HepG2购自中国科学院上海细胞库;RPMI 1640培养液、Trizol、RT-PCR试剂盒及LipofectamineTM2000脂质体转染盒购自美国Invitrogen公司;胎牛血清购自美国Gibco公司;CoCl2购自美国Sigma公司;HIF-2α引物由上海生工生物工程有限公司合成;HIF-2α siRNA由广州市锐博生物科技有限公司合成。
1.2 方法
1.2.1 建立细胞缺氧模型:HepG2细胞为贴壁细胞,置于100 g/L胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的RPMI 1640培养液,于体积分数为5%的CO2、37℃培养箱中培养,每2~3 d传代1次。取对数生长期细胞,接种于24孔板,接种细胞数量为1×104个/孔,37℃,体积分数为5%的CO2培养24 h后,培养基调换成含不同浓度 CoCl2(50 μmol/L、100 μmol/L、200 μmol/L、400 μmol/L)的培养基,模拟肿瘤内缺氧微环境,37℃,体积分数为5%的CO2再培养24 h后收集细胞用于检测。
1.2.2 HIF-2α mRNA表达的检测:收集各组HepG2细胞,按照Trizol RNA试剂盒说明书步骤操作,反转录成cDNA,然后以cDNA为模板,以荧光定量PCR的方法扩增HIF-2α mRNA,RT-PCR方法检测各组细胞中HIF-2α mRNA的表达。HIF-2α引物序列:上游:5'-GGTGAAAGTCTACAACAACTGCC-3',下游:5'-ATGGGTGCTGGATTGGTTC-3',扩增片段 104 bp。GAPDH 引物序列:上游:5'-TGGCACCCAGCACAATGAA-3',下游:5'-CTAAGTCATAGTCCGCCTAGAAGCA-3',片段长度133 bp。PCR反应条件:95℃预变性5 min、95℃变性30 s、60℃退火30 s和72℃延伸30 s,共40个循环。
1.2.3 细胞转染及实验分组:取对数生长期HepG2细胞,接种24孔板,接种细胞数量为1×104个/孔,37℃,体积分数为5%的CO2培养24 h后,混合稀释好的HIF-2α siRNA和脂质体 LipofectamineTM2000载体试剂,形成HIF-2α siRNA/LipofectamineTM2000复合物。分为常氧组、低氧(+200 μmol/L CoCl2)组、低氧+Control siRNA组、低氧+HIF-2α siRNA组。培养48 h后收集各组 HepG2细胞,检测 HIF-2α mRNA的表达。
1.2.4 HIF-2α蛋白表达的检测:将常氧组、低氧组、低氧+Control siRNA组、低氧+HIF-2α siRNA组分别进行培养,48 h后提取各组核蛋白,Western blotting方法检测各组HepG2细胞中HIF-2α蛋白的表达,扫描分析软件计算光密度扫描后的灰度值。
1.2.5 细胞增殖的检测:取对数生长期HepG2细胞,计数后接种96孔板,接种细胞数量为1×104个/孔,37℃,体积分数为5%的CO2培养24 h后,在培养基中加入200 μmol/L CoCl2并进行转染。设常氧组、低氧组、低氧 +Control siRNA组、低氧 +HIF-2α siRNA组,于转染后24 h,加入5 g/L,pH为7.4的MTT溶液20 μl培养 4 h,吸弃孔内培养上清液,加入 150 μl/孔二甲基亚砜(DMSO),平板震荡仪震荡10 min后,在490 nm波长测定光密度值(OD值)。OD值越大,表示细胞增殖能力越强。每24 h重复上述操作1次,连续测定5次。在酶联免疫检测仪上测定各孔OD值,记录结果,以时间为横坐标,平均OD值为纵坐标,绘制细胞生长曲线图。
1.2.6 细胞周期变化的检测:收集各组HepG2细胞,用不含EDTA的胰蛋白酶收集处理后的细胞,800 r/min离心10 min,70%乙醇4℃固定细胞过夜,预冷的磷酸盐缓冲液(PBS)洗3次,加入 200 μl RNase A(1 mg/ml),37 ℃温育30 min。再加入800 μl碘化乙啶(PI)染色液(100 ng/ml)混匀,4℃避光放置30 min。使用流式细胞仪测定细胞周期。
1.3 统计学分析 采用SPSS 17.0统计软件进行分析,计量资料以±s表示。多样本均数比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 成功建立HepG2细胞缺氧模型 RT-PCR结果显示,HIF-2α cDNA扩增片段大小为104 bp,内参GAPDH片段大小为133 bp,常氧培养HepG2细胞即有一定量HIF-2α表达,HIF-2α mRNA在4组不同浓度的CoCl2作用下培养的HepG2细胞中均有目的条带出现,经半定量分析结果显示,随着CoCl2浓度的增加(50 μmol/L、100 μmol/L、200 μmol/L、400 μmol/L),HIF-2α mRNA的相对表达量递增,各浓度组与常氧组比较,差异均有统计学意义(P<0.05)。在CoCl2浓度为200 μmol/L 和 400 μmol/L 时,HIF-2α mRNA 表达差异无统计学意义(P>0.05),考虑到细胞在200 μmol/L CoCl2浓度时较 400 μmol/L 时损伤轻,故选择200 μmol/L CoCl2浓度作为后续实验的缺氧损伤浓度(见表1、图1)。
表1 不同浓度CoCl2作用下HepG2细胞中HIF-2α mRNA的相对表达量(±s)Tab 1 Expressions of HIF-2α mRNA in HepG2 cells under the impact of different concentrations of CoCl2(±s)
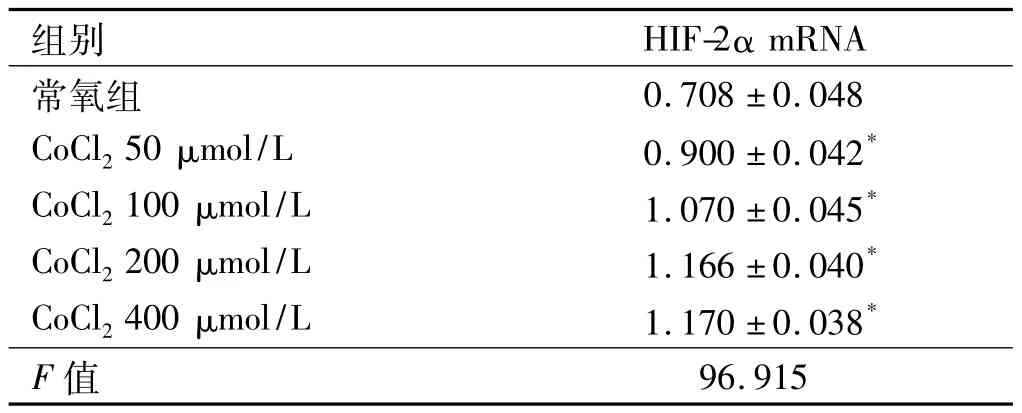
表1 不同浓度CoCl2作用下HepG2细胞中HIF-2α mRNA的相对表达量(±s)Tab 1 Expressions of HIF-2α mRNA in HepG2 cells under the impact of different concentrations of CoCl2(±s)
注:与常氧组比较,*P<0.05。
组别 HIF-2αmRNA常氧组0.708±0.048 CoCl250 μmol/L 0.900 ±0.042*CoCl2100 μmol/L 1.070 ±0.045*CoCl2200 μmol/L 1.166 ±0.040*CoCl2400 μmol/L 1.170 ±0.038*F值96.915

图1 不同浓度 CoCl2组 HepG2细胞中 HIF-2α mRNA的表达Fig 1 Expressions of HIF-2α mRNA of HepG2 cells in different concentrations of CoCl2groups
2.2 转染48 h后各组HepG2细胞中HIF-2α mRNA的表达 RT-PCR结果显示:HIF-2α mRNA在4组细胞中均有目的条带出现。半定量分析结果显示,HIF-2α mRNA的表达在低氧组、低氧+Control siRNA组均比常氧组和低氧 +HIF-2α siRNA组显著升高(P<0.05);低氧+Control siRNA与低氧组相比,差异无统计学意义(P>0.05);低氧+HIF-2α siRNA组与常氧组相比,差异无统计学意义(P>0.05,见表2、图2)。
2.3 转染48 h后各组HepG2细胞中HIF-2α蛋白的表达 Western blotting结果显示:HIF-2α蛋白的相对表达量在低氧组、低氧+Control siRNA组均比常氧组和低氧+HIF-2α siRNA组显著升高(P<0.05);低氧+Control siRNA组与低氧组相比,差异无统计学意义(P>0.05);低氧+HIF-2α siRNA组与常氧组相比,差异无统计学意义(P>0.05,见表3、图3)。
表2 转染48 h后各组细胞中HIF-2α mRNA的表达(±s)Tab 2 Expressions of HIF-2α mRNA in each group cell after 48 hours transfection(±s)

表2 转染48 h后各组细胞中HIF-2α mRNA的表达(±s)Tab 2 Expressions of HIF-2α mRNA in each group cell after 48 hours transfection(±s)
注:与常氧组比较,*P <0.05;与低氧组比较,#P <0.05。
组别 HIF-2αmRNA常氧组 0.617±0.078#低氧组 1.127±0.069*低氧+Control siRNA组 1.060±0.060*低氧+HIF-2α siRNA组 0.557±0.082#F值98.95

图2 转染48 h后各组细胞中HIF-2α mRNA的表达Fig 2 Expressions of HIF-2α mRNA in each group cell after 48 hours transfection
表3 转染48 h后各组细胞中HIF-2α蛋白的表达(±s)Tab 3 Expressions of HIF-2α protein in each group cell after 48 hours transfection(±s)
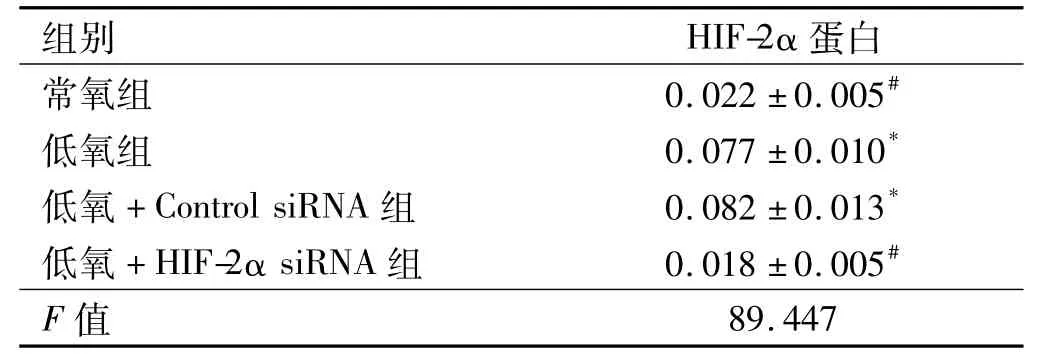
表3 转染48 h后各组细胞中HIF-2α蛋白的表达(±s)Tab 3 Expressions of HIF-2α protein in each group cell after 48 hours transfection(±s)
注:与常氧组比较,*P <0.05;与低氧组比较,#P <0.05。
组别 HIF-2α蛋白常氧组 0.022±0.005#低氧组 0.077±0.010*低氧+Control siRNA组 0.082±0.013*低氧+HIF-2α siRNA组 0.018±0.005#F值89.447

图3 转染48 h后各组细胞中HIF-2α蛋白的表达Fig 3 Expressions of HIF-2α protein in each group cell after 48 hours transfection
2.4 MTT 结果 分别于 24 h、48 h、72 h、96 h、120 h检测各组HepG2细胞的OD值,结果显示:低氧组、低氧+Control siRNA组的OD值显著高于常氧组与低氧+HIF-2α siRNA组,差异有统计学意义(P<0.05),说明细胞增殖能力加快,生长速度加快。低氧+Control siRNA组与低氧组相比,差异无统计学意义(P>0.05);低氧+HIF-2α siRNA组与常氧组相比,差异无统计学意义(P>0.05,见图4)。

图4 各组HepG2细胞生长曲线Fig 4 HepG2 cell growth curve drawn by the MTT method
2.5 细胞周期 按照1.2.6方法,通过流式细胞仪检测,结果显示,低氧组、低氧+Control siRNA组HepG2细胞在DNA合成前期(G0/G1期)细胞比率显著低于常氧组和低氧+HIF-2α siRNA组,合成期(S)及合成后期(G2/M)细胞比率显著高于常氧组和低氧+HIF-2α siRNA组(P<0.05);低氧组与低氧+Control siRNA组相比,差异无统计学意义(P>0.05);低氧+HIF-2α siRNA组与常氧组相比,差异无统计学意义(P>0.05,见图 5)。
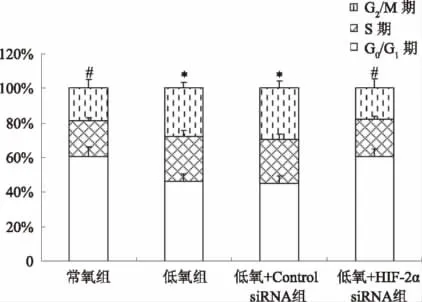
图5 流式细胞仪检测各组HepG2细胞的细胞周期分布柱状图Fig 5 The cell cycle distribution histogram of HepG2 cells in each group
3 讨论
恶性肿瘤在生长过程中,由于组织增生过快及血管形成不足,其内部处于相对缺氧的微环境,缺氧是肝癌等实体瘤微环境的基本特征之一[6]。缺氧诱导因子(hypoxia inducible factors,HIFs)通过调控多条信号通路,使肿瘤组织适应缺氧环境,HIF-2α是细胞内氧信号调节途径中关键的转录调节因子,与维持肿瘤细胞能量代谢、糖酵解、新生血管形成、细胞增殖等恶性生物学行为密切相关[7-10],因此,构想能否通过影响HIF-2α的表达,从而干预肝癌的发生、发展。本实验通过模拟缺氧环境及沉默HepG2细胞中HIF-2α的表达,观察HIF-2α对人肝癌细胞增殖能力的影响,为肝癌的基因治疗提供一定的实验基础。
CoC12与 HIF-α氧依赖降解域结合,抑制脯氨酸残基羟化,从而阻碍HIF-α降解导致HIF-α堆积,模拟缺氧对HIF-α的诱导作用[11]。RNA干扰是近年发展的基因阻断技术,导入双链RNA阻断同源基因的表达促其mRNA降解,从而诱导该细胞目的基因功能丧失或出现特定基因缺失的表型,具有高选择性、特异性强、细胞毒性低及作用持久等优点,是目前肿瘤基因治疗的重要手段[12-13]。本研究运用CoCl2建立缺氧模型,模拟肿瘤内部缺氧微环境[14],转染HIF-2α siRNA于HepG2细胞,结果显示,转染 HIF-2α siRNA 48 h后,肝癌HepG2细胞中内源性HIF-2α mRNA及蛋白表达均显著低于低氧组,表明缺氧环境能够促进人肝癌细胞株HepG2细胞中HIF-2α的表达,靶向HIF-2α siRNA具有特异性效果,使得HIF-2α基因有效沉默,从而干扰肿瘤细胞的生物学行为。
肿瘤的发生、发展与细胞的生长速度、细胞周期分布密切相关[15]。为进一步明确HIF-2α在肝癌HepG2细胞增殖和细胞周期中的作用,采取MTT法分析转染后24 h、48 h、72 h、96 h 和 120 h 肝癌 HepG2 细胞增殖的变化,结果显示:HIF-2α siRNA转染组各个时间点的OD值均显著低于低氧组。流式细胞术检测细胞周期,结果显示:HIF-2α siRNA转染组G0/G1期细胞比率显著高于低氧组,而合成期(S)及合成后期(G2/M)细胞比率显著低于低氧组,说明靶向siRNA沉默HIF-2α基因表达后,细胞更多的阻滞于G0/G1期,S期及G2/M期细胞比例显著下降,提示HIF-2α siRNA对HepG2细胞的生长具有显著抑制作用。
综上所述,靶向siRNA能显著降低人肝癌HepG2细胞内源性HIF-2α mRNA及蛋白的表达,进一步抑制细胞增殖,且其抑制增殖作用与增加G0/G1期细胞阻滞有关,对其作用途径与具体分子机制的进一步研究有可能为临床治疗肝癌提供理论及实验依据。
[1]王智娜,张春清,王启志,等.肝癌组织中Vasohibin1和HIF-1α表达及临床意义[J].胃肠病学和肝病学杂志,2013,22(7):628-631.
Wang ZN,Zhang CQ,Wang QZ,et al.The clinical significance and the expression of Vasohibin1 and HIF-1α in hepatocellular carcinoma[J].Chin J Gastroenterol Hepatol,2013,22(7):628-631.
[2]Yang SL,Liu LP,Niu LL,et al.Downregulation and pro-apoptotic effect of hypoxia-inducible factor 2 alpha in hepatocellular carcinoma[J].Oncotarget,2016,7(23):34571-34581.
[3]董小锋,张庆梅,陈元元,等.缺氧诱导因子-2α通过血管生成素-2途径调控缺氧诱导血管形成的研究[J].中华消化外科杂志,2016,15(7):729-734.
Dong XF,Zhang QM,Chen YY,et al.Hypoxia inducible factor-2 alpha regulating hypoxia-induced angiogenesis via angiopoietin-2 pathway[J].Chin J Dig Surg,2016,15(7):729-734.
[4]余小庆,蔡璨,杜轩,等.低氧诱导因子-2α—酰基辅酶A去饱和酶-1通路对低氧诱导的肝癌细胞生物学行为的影响[J].中华肝脏病杂志,2016,24(7):506-512.
Yu XQ,Cai C,Du X,et al.Effect of hypoxia-inducible factor-2α/stearoyl-CoA desaturase-1 pathway on biological behaviors of hepatoma cells induced by hypoxia[J].Chin J Hepatol,2016,24(7):506-512.
[5]Yao J,Li JX,Geng PL,et al.Knockdown of a HIF-2α promoter upstream long noncoding RNA impairs colorectal cancer stem cell properties in vitro through HIF-2α downregulation [J].Onco Targets Ther,2015,8:3467-3474.
[6]Xue X,Taylor M,Anderson E,et al.Hypoxia-inducible factor-2α activation promotes colorectal cancer progression by dysregulating iron homeostasis[J].Cancer Res,2012,72(9):2285-2293.
[7]Qiu B,Ackerman D,Sanchez DJ,et al.HIF-2α dependent lipid storage promotes endoplasmic reticulum homeostasis in clear cell renal cellcarcinoma[J].Cancer Discov,2015,5(6):652-667.
[8]Keith B,Johnson RS,Simon MC.HIF1α and HIF2α:sibling rivalry in hypoxic tumor growth and progression[J].Nat Rev Cancer,2011,12(1):9-22.
[9]Chiavarina B,Martinez-Outschoorn UE,Whitaker-Menezes D,et al.Metabolic reprogramming and two-compartment tumor metabolism:opposing role(s)of HIF1αand HIF2αin tumor-associated fibroblasts and human breast cancer cells[J].Cell Cycle,2012,11(17):3280-3289.
[10]任亚君,熊枝繁,曹仕琼,等.HIF-1α、MMP2在大肠癌中的表达及相关性研究[J].胃肠病学和肝病学杂志,2015,24(4):425-427.
Ren YJ,Xiong ZF,Cao SQ,et al.Correlation and expression of HIF-1αand MMP2 in human colorectal cancer tissue[J].Chin J Gastroenterol Hepatol,2015,24(4):425-427.
[11]潘新亭,吴力群,刘福国,等.靶向HIF-2 siRNA对人胰腺癌BXPC-3细胞增殖和凋亡的影响[J].山东医药,2012,52(2):18-20.
Pan XT,Wu LQ,Liu FG,et al.Effect of HIF-2 siRNA on proliferation and apoptosis in human pancreatic carcinoma cell line BXPC-3 [J].Shandong Medical Journal,2012,52(2):18-20.
[12]Amberkar S,Kiani NA,Bartenschlager R,et al.High-throughput RNA interference screens integrative analysis:Towards a comprehensive understanding of the virus-host interplay [J].World J Virol,2013,2(2):18-31.
[13]李娜,王洪兴,张洁,等.siRNA干扰缺氧诱导因子-2α对乳腺癌细胞增殖能力的影响[J].临床与实验病理学杂志,2014,30(1):6-9.
Li N,Wang HX,Zhang J,et al.Effects of hypoxia inducible factor-2α siRNA on proliferation of human breast cancer cells[J].J Clin Exp Pathol,2014,30(1):6-9.
[14]许林锋,倪嘉延,陈耀庭,等.HIF-1α基因沉默对大鼠肝癌CBRH-7919细胞p27和ki67表达的影响[J].中国病理生理杂志,2012,28(10):1825-1829.
Xu LF,Ni JY,Chen YT,et al.Effects of HIF-1αsilencing on expression of p27 and Ki67 in rat hepatoma cell line CBRH-7919 [J].Chinese Journal of Pathophysiology,2012,28(10):1825-1829.
[15]Pascual S,Herrera I,Irurzun J.New advances in hepatocellular carcinoma[J].World J Hepatol,2016,8(9):421-438.
(责任编辑:王全楚)
Effect of HIF-2α gene silencing on multiplication capacity of human hepatocellular carcinoma cell HepG2
LI Weiwei1,GENG Xiaosong2,WANG Hongwei1,HOU Lijuan1,SONG Xinwen1
1.Department of Infectious Diseases,the First Affiliated Hospital,Xinxiang Medical University,Weihui 453100;2.School of Nursing,Xinxiang Medical University,China
ObjectiveTo investigate the impacts of expression level of hypoxia-inducible factors-2α (HIF-2α)on the multiplication capacity of human hepatocellular carcinoma cell HepG2.MethodsCobalt chloride(CoCl2)cells were induced by simulated hypoxic microenvironment,and depending on the concentration of CoCl2into 50 μmol/L group,100 μmol/L group,200 μmol/L group,400 μmol/L group,200 μmol/L concentration of CoCl2was selected to simulate hypoxia in tumor microenvironment.siRNA was transfected into human hepatocellular carcinoma HepG2 cell to silent HIF-2α.Application of RT-PCR and Western blotting method respectively to detect the expression of HIF-2α mRNA and protein,MTT method to detect the proliferation of HepG2 cells,to curve the cell growth,and Flow cytometry to observe the changes of cell cycle.ResultsEstablishment of cellular hypoxia model as the hypoxia group.The concentration of 50 nmol/L HIF-2α siRNA transfection of HepG2 cells under hypoxia environment as the hypoxia+HIF-2α siRNA group.Resultsshowed that the HIF-2α mRNA and protein expression of hypoxia group and hypoxia+control siRNA group were significantly higher than normal oxygen group and hypoxia+HIF-2α siRNA group(P<0.05).The results of cell growth curve showed that the optical density of hypoxia group and hypoxia+control siRNA group were significantly higher than normal oxygen group and hypoxia+HIF-2α siRNA group(P <0.05).Cell cycle showed that in the beginning of DNA synthesis in HepG2 cells(G0/G1period)cells of hypoxia group and hypoxia+control siRNA group were significantly lower than normal oxygen group and hypoxia+HIF-2α siRNA group;but synthesis phase(S)and later synthesis(G2/M)cell rate were significantly higher than normal oxygen group and hypoxia+HIF-2α siRNA group(P<0.05).ConclusionHypoxic microenvironment can promote the expression of HIF-2α in HepG2 cells to further promote the proliferation of HepG2 cells.Whereas,for siRNA targeting HIF-2α can effectively inhibit the expr-ession of hepatocellular carcinoma HepG2 cells in the HIF-2α,thus inhibit the proliferation of HepG2 cells.
Hypoxia induced factors-2α;CoCl2;RNA interference;Hepatocellular carcinoma;Multiplication
R735.7
A
1006-5709(2017)08-0921-05
2017-05-15
10.3969/j.issn.1006-5709.2017.08.022
李伟伟,硕士,主治医师,研究方向:肝病临床和基础。E-mail:liweiweicyk@163.com
宋新文,硕士,主任医师,研究方向:肝病临床和基础。E-mail:283521725@qq.com

