灵芝孢子粉对癫痫大鼠脑组织线粒体钙和c-Fos的影响
刘 辉
(江苏省南通卫生高等职业技术学校护理系,江苏 南通 226001)
灵芝孢子粉对癫痫大鼠脑组织线粒体钙和c-Fos的影响
刘 辉
(江苏省南通卫生高等职业技术学校护理系,江苏 南通 226001)
目的研究灵芝孢子粉对癫痫大鼠脑组织组织线粒体钙和c-Fos的影响。方法对健康雄性Wistar大鼠45只进行建模,随机分成对照组(生理盐水腹腔注射+生理盐水灌胃),模型组(PTZ腹腔注射+生理盐水灌胃),灵芝孢子粉组(PTZ腹腔注射+灵芝孢子粉灌胃),每组各15只,采用火焰原子吸收法测定3组脑组织线粒体Ca2+的水平,免疫组织化学方法检测脑组织c-Fos。结果c-Fos在大鼠皮质区、海马区均可见表达。与对照组和模型组比较,灵芝孢子粉组的c-Fos表达水平明显降低(P<0.05);灵芝孢子粉组的线粒体Ca2+水平明显增加(P<0.05)。结论灵芝孢子粉通过增加线粒体Ca2+水平及抑制c-Fos的表达来减少癫痫发作对脑细胞线粒体所造成的损伤,进而达到抗癫痫的效果。
灵芝孢子粉;癫痫;大鼠;脑组织;线粒体钙;c-Fos
癫痫属于一种比较常见的神经系统疾病,此病对患者的生存质量危害比较大[1]。目前,治疗癫痫的药物比较多,但是效果不尽相同[2-3]。同时,一些新的抗癫痫药物也随着药物学的发展而不断出现,虽然在抗癫痫方面获得了突破性进展,但是对于难治性癫痫尚是一大顽疾,有待新的治疗此类难治性癫痫的药物的出现。灵芝孢子粉是近年来人们比较关注的一类药物[4],但是关于其在抗癫痫过程中的作用机制尚不是很明确。本研究着重探讨灵芝孢子粉对癫痫大鼠脑组织组织线粒体钙和c-Fos的影响,以揭示灵芝孢子粉在抗癫痫中的作用机制。
1 材料与方法
1.1 实验材料。灵芝孢子粉:购自山东云海灵芝专业合作社;戊四氮(PTZ):购自上海博顿生物化工有限公司;兔抗大鼠c-Fos多克隆抗体:购自武汉博士德生物工程有限公司。DAB显色试剂盒:购自武汉博士德生物工程有限公司。
1.2 实验动物分组:健康雄性Wistar大鼠36只,体质量152~234 g,普通级动物,由某医科大学动物实验中心提供。实验过程中大鼠的处置符合动物伦理学标准。依据体质量把45只大鼠随机分成3组:分成对照组(生理盐水腹腔注射+生理盐水灌胃),模型组(PTZ腹腔注射+生理盐水灌胃),灵芝孢子粉组(PTZ腹腔注射+灵芝孢子粉灌胃),每组各15只。
1.3 脑组织细胞线粒体钙测定:将3组大鼠运用断头低温快速取出大脑,脑膜给予剔除干净之后,运用蔗糖-Tris缓冲液及玻璃匀浆器把脑组织制作成匀浆,实施差速离心,获得线粒体沉淀物,收集线粒体悬液在阴暗处进行硝化1周。使用原子火焰吸收分光计对线粒体钙吸光度进行测定。
1.4 脑组织c-Fos的测定:将3组大鼠麻醉后进行断头处死操作,低温下快速取脑,并分离出海马组织,运用中性甲醛溶液对其行24 h以上的固定操作,接着采用PBS水给予冲洗5次,使用酒精梯度实施脱水之后,运用石蜡进行包埋大脑皮质和海马组织,采用锡纸包裹好之后置入冰箱中用于脑组织c-Fos的检测。
使用免疫组织化学方法测定各组大鼠大脑皮质和海马组织中的c-Fos水平,操作步骤分别严格按照兔抗大鼠c-Fos试剂盒说明书操作。染色切片在BI-2000医学图像分析系统显微镜下观察,呈棕黄色颗粒者为阳性。每张切片观察10个有代表性的视野,并计数每一个视野的阳性细胞数以检测c-Fos的表达情况。
1.5 统计学处理:应用SPSS 20.0统计分析软件包进行统计分析。计量资料采用表示,组间比较采用t分析,计数资料采用χ2分析,均以α=0.05作为检验水准,P<0.05具有统计学差异。
2 结 果
2.1 各组大脑组织织线粒体Ca2+比较:与对照组和模型组比较,灵芝孢子粉组的织线粒体Ca2+含量明显增加(P<0.05),见表1。
表1 各组大脑组织织线粒体Ca2+比较(μg/mL,
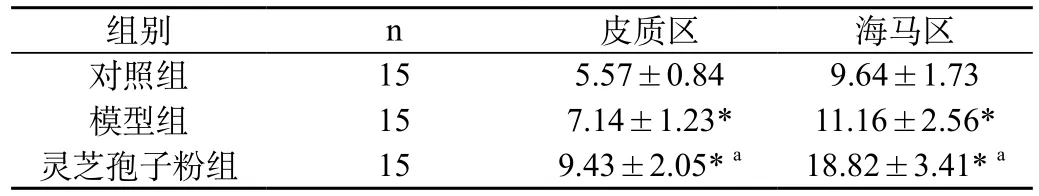
表1 各组大脑组织织线粒体Ca2+比较(μg/mL,
注:与对照组比较,*P<0.05;与模型组比较,aP<0.05
组别n皮质区海马区对照组155.57±0.849.64±1.73模型组157.14±1.23*11.16±2.56*灵芝孢子粉组159.43±2.05*a18.82±3.41*a
2.2 各组大脑组织c-Fos表达水平比较:与对照组和模型组比较,灵芝孢子粉组的c-Fos表达水平明显减少(P<0.05),见表2。c-Fos表在大鼠皮质区的表达见图1~2;c-Fos表在大鼠海马区的表达见图2。
表2 各组大脑组织c-Fos表达水平比较(个/视野,

表2 各组大脑组织c-Fos表达水平比较(个/视野,
注:与对照组比较,*P<0.05;与模型组比较,aP<0.05
组别n皮质区海马区对照组1525.34±2.1421.15±5.37模型组1563.57±4.27*43.56±9.64*灵芝孢子粉组15124.35±5.16*a86.24±10.35*a
3 讨 论
一般情况下,Ca2+对神经细胞膜兴奋性具有稳定及维持的作用,如果血液中的Ca2+水平减少,则神经细胞膜电位就会出现不稳定,进而激发癫痫的发作,产生异常放电[5-7]。因此,Ca2+水平发生失衡为癫痫发病的一个可能机制。本研究显示,与对照组和模型组比较,灵芝孢子粉组的线粒体Ca2+水平明显增加(P<0.05)。说明,灵芝孢子粉可以调节Ca2+含量而对神经元起到一定的保护作用。
相关研究表明[8-9],癫痫发作时c-Fos会发生改变。由此可见,c-Fos在一定程度上可以反映出神经元之兴奋状态,通过c-Fos的影响因素进行干预,能够调节c-Fos的表达,使之上调或者下调[10]。本研究显示,c-Fos在大鼠皮质区、海马区均可见表达。与对照组和模型组比较,灵芝孢子粉组的c-Fos表达水平明显降低(P<0.05)。说明,灵芝孢子粉是通过减少脑内c-fos基因表达的途径来起到抗癫痫的效果。

图1 c-Fos表在大鼠皮质区的表达(DAB,×200)

图2 c-Fos表在大鼠海马区的表达(DAB,x200)
综上所述,灵芝孢子粉通过增加线粒体Ca2+水平及抑制c-Fos的表达来减少癫痫发作对脑细胞线粒体所造成的损伤,进而发挥抗癫痫的作用。
[1] 赵璐,王淑秋,王喆.灵芝孢子粉对戊四氮致痫大鼠脑组织GDNF与NT-3表达的影响[J].中国病理生理杂志,2010,26(4):812-815.
[2] Deshpande LS,Lou JK,Mian A,et al.Time course and mechanism of hippocampal neuronal death in an in vitro model of status epilepticus: Role of NMDA receptor acti- vation and NMDA dependent calcium entry[J] .Eur J Pharmacol,2008,583(1):73-83.
[3] Faught E,Richman J,Martin R,et al.Incidence and prevalence of epilepsy among older US Medicare beneficiaries[J]. Neurology,2012, 78(7):448-453.
[4] 赵春霞,郝冰.灵芝孢子粉对戊四氮致痫大鼠NGF的影响[J].牡丹江医学院学报,2013,34(2):28-29.
[5] 赵爽,张胜昌,王淑秋.灵芝孢子粉对戊四氮慢性点燃大鼠学习记忆及胆碱乙酰转移酶、乙酰胆碱酯酶活性的影响[J].中国老年学杂志,2013,33(1):354-356.
[6] 赵春霞,郝冰.灵芝孢子粉对戊四氮致痫大鼠 NGF 的影响[J].牡丹江医学院学报,2013,34(2):28-29.
[7] Goodkin HP,Yeh JL,Kapur J.Status epilepticus increases the intracellular accumulation of GABAA receptors[J].J Neurosci, 2005,25(23):5511-5520.
[8] van Drongelen W,Lee HC,Hereld M,et al.Emergent epileptiform activity in neural networks with weak excitatory synapses[J]. IEEE Trans Neural Syst Rehabil Eng,2005,13(2):236-241.
[9] Sun C,Mtchedlishvili Z,Bertram EH,et al.Selective loss of dentate hilar interneurons contributes to reduced synaptic inhibition of granule cells in an electrical stimulation- based animal model of temporal lobe epilepsy[J].J Comp Neurol,2007,500(5):876-893.
[10] 赵璐,王淑秋,王喆.灵芝孢子粉对戊四氮致痫大鼠脑组织GDNF与NT-3表达的影响[J].中国病理生理杂志,2010,26(4):812-815.
R742.1
B
1671-8194(2017)22-0051-02
江苏省卫生科研项目JZ201319

