基于学生核心素养发展的实验设计
邓育红
摘要:中学生从微观层次上认识物质具有一定的难度,巧妙的实验设计可以变抽象为形象,帮助学生克服认知困难。精心设计了3个实验:影响化学反应速率的因素及液态均相体系中催化剂作用机理的探究、熵增吸热反应和铁离子颜色的探究。这些实验能生动、直观地呈现化学学习的对象,有助于学生理解知识,以及促进学生在宏微结合、变化守恒、实践创新等方面学科核心素养的发展。
关键词:核心素养;实验设计;化学反应速率;熵变与焓变;铁离子颜色
文章编号:1005–6629(2017)7–0052–04 中图分类号:G633.8 文献标识码:B
化学是在原子、分子水平上研究物质的组成、结构、性质、变化及其应用的一门基础学科。对于中学生来说,从微观层次认识物质具有一定的难度。化学实验能适应中学生的认知特点,为他们形成化学知识技能提供直观、生动、具体的感性材料和例证,帮助他们克服认知困难和提高认知质量[1]。在多年的教学实践中,笔者发现教学中有一些难以讲清讲透的知识点和学生困惑的问题,为解决这些问题进行了实验设计。如学生对于催化剂参与化学反应的过程十分感兴趣,但教材中没有均相体系中催化剂参与反应过程的相关实验,因此在学习相关内容时设计了氯化钴催化酒石酸钾钠与过氧化氢的实验,通过溶液颜色的变化证明催化剂参与了化学反应;熵变与焓变比较抽象,学生难以理解,一直是教学的难点之一,用生活中常用的自发热热敷袋和学生熟悉的碳酸氢盐与氯化钙的反应实验,通过观察物态和温度的变化来帮助学生理解熵变与焓变;铜盐和铁盐在生活中很常见,但它们的颜色却令人困惑,铁离子颜色的探究实验能帮助学生答疑解惑。通过这些实验设计,巧妙地变抽象为形象,破译教材难点,解答学生困惑,促进学生在宏微结合、变化守恒、实践创新等方面学科核心素养的发展。
1 影响化学反应速率的因素及液态均相体系中催化剂作用机理的探究
化学反应速率是高中化学的重要内容。温度、浓度、压强、催化剂对化学反应速率的影响,教材中通过不同类型的典型实验来展现。其中,催化剂对化学反应速率的改变最为显著,学生对催化剂改变化学反应速率的作用机理十分感兴趣。与温度、浓度、压强这几种因素对反应速率的影响机理相比,催化剂的催化原理较难理解。各版本高中选修教材《化学反应原理》中均有阐述:催化剂能改变反应的路径,使发生反应所需的活化能降低,从而加快反应速率。但这一反应机理光靠理论阐述和图示讲解很难使学生信服。通过以下实验可让学生明白催化剂确实参与了化学反应,但反应前后的质量及化学性质并未改变。
实验1 液态均相体系中催化剂作用机理的探究
(1)在锥形瓶中加入5%的酒石酸钾钠溶液40mL和10%的过氧化氢溶液10mL,加热至40℃。
(2)在锥形瓶中再加入2%的氯化钴溶液10mL,注意观察锥形瓶内溶液及其颜色变化。
[反应现象]加入氯化钴后,溶液呈钴离子(Co2+)的淡红色,很快变为浅棕色,有小气泡产生。随着反应的进行,溶液逐渐变为绿色。反应最剧烈时,溶液呈深绿色,并伴随着大量气体放出。然后颜色逐渐变浅,反应结束后又恢复为原来的淡红色。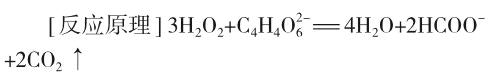
酒石酸根离子与过氧化氢反应生成二氧化碳,加入氯化钴作为催化剂,气体迅速产生。反应中钴离子颜色的变化十分清楚地显示催化剂参与了反应,有中间体生成。催化反应的途径不是越过单一的高能垒,而是越过两个较低的能垒。
酒石酸钾钠与过氧化氢的反应不仅可以揭示催化剂的催化原理,也能用于其他有关影响化学反应速率因素的实验。
扩展实验1 浓度对化学反应速率的影响
(1)取两个锥形瓶,在锥形瓶1中加入5%的酒石酸钾钠溶液40mL和10%的过氧化氢溶液10mL;在锥形瓶2中加入10%的酒石酸钾钠溶液40mL和15%的过氧化氢溶液10mL,均加热至40℃。
(2)在两个锥形瓶中均加入2%的氯化钴溶液10mL,注意观察锥形瓶内溶液的变化并加以比较。
[实验现象]两锥形瓶溶液颜色的变化一致,但可以观察到瓶2中产生的气泡更多,比瓶1反应更剧烈。
扩展实验2 温度对化学反应速率的影响
(1)取两个锥形瓶,均加入10%的酒石酸钾钠溶液40mL和15%的过氧化氢溶液10mL。
(2)瓶1加热至40℃,停止加热;瓶2继续加热,观察现象并加以比较。
[实验现象]瓶1中无现象;瓶2加热至近沸,看到有小气泡产生,停止加热,仍有气泡产生(但没有加入催化剂时反应剧烈),用盛过澄清石灰水的烧杯罩在锥形瓶口,可看到烧杯壁出现白色浑浊。
此组实验直观明了地诠释影响化学反应速率的因素及其机理,尤其是将催化剂参与化学反应这一微观过程通过颜色变化形象鲜明地呈现在学生眼前,帮助学生理解有效碰撞模型、活化分子和活化能的概念。有助于培养学生的证据推理与模型认知、宏观辨识与微观探析等学科核心素养。
2 生活中的实例与化学反应的熵变与焓变
化学反应进行的方向是一个比较复杂的问题,焓判据和熵判据均有道理,综合了熵变和焓变的自由能变化对高中生来说较难理解。平时在教学中,讲授化学反应时我们更重视新物质的生成,书写化学方程式也只写出反应物和生成物的化学式,一般不标注反应物和生成物的状态和反应的能量变化(热化学方程式除外)。而国外的一些教材,在开始介绍化学反应时即强调物质变化和能量变化是化学反应的标志,化学方程式必须标注物质的状态和反应是吸热还是放热[2]。因此我们的学生对化学反应中的能量变化(焓变)和物态变化(熵变)不太关注。其实,熵变和焓变不仅在自然界中普遍存在,也廣泛存在于我们所熟悉的化学实验以及日常生活中。
市场上出售的自发热热敷袋就利用了熵减放热的原理:
CH3COONa·3H2O(l)→CH3COONa·3H2O(s)+热量
液态的水合醋酸钠处于无序状态,在金属片的触发下结晶成为固态,混乱度减小,放出能量。将结晶后的热敷袋放在热水中吸热融化,即可反复使用,故名为“自发热”。
如果将结晶后的袋子放在身体需要冷敷的部位,发热袋就变成了冷敷袋。冷热均可,备受欢迎。
泡腾片的溶解是熵增吸热的过程。夏天,在凉开水中放入一片泡腾片,看到气泡翻腾,同时可以喝到凉爽的饮料,何等惬意。这是因为泡腾片中的柠檬酸与碳酸氢钠反应,生成二氧化碳气体,体系的混乱度增大,同时该反应吸收热量,溶液变冷。
生活是最大的课堂,实践是最佳的老师。课余,抱着热(冷)敷袋,喝着泡腾饮料,回味熵增(减)原理,别有一番情趣。
在课堂上,亦可用如下实验释疑,帮助学生化解某些吸热反应能够自发進行的难点。
实验2 熵增吸热反应示例
(1)分别量取1mol/L的氯化钙溶液和2mol/L的碳酸氢钾溶液各50mL,测量此时溶液的温度。
(2)将两溶液同时倒入锥形瓶中,观察现象并测量混合液温度。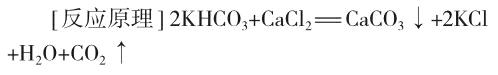
[实验现象及解释]溶液混合后即出现白色浑浊,同时有大量气泡产生,同时观察到温度降低。(当时室温为14℃,两室温下的溶液混合后温度降为12℃。)氯化钙溶液和碳酸氢钾溶液反应生成了二氧化碳气体,体系混乱度增大。同时,温度的测量直观地显示了反应的焓变,提供了现象明显的熵增吸热反应示例。
教材中一般较多讨论碳酸氢钠溶液和氯化钙溶液的反应,而本实验用溶解度相对较大的碳酸氢钾替换碳酸氢钠,反应原理相同,但实验现象变得十分清晰。
此实验可用于探究氯化钙溶液鉴别碳酸盐和碳酸氢盐的方法是否严密,以此培养学生严谨求实的科学态度和证据意识。本实验亦可用来展示碳酸氢根离子电离平衡的移动,从而培养学生的物质变化观念与平衡思想。
化学可以说是应用宏观与微观结合、思维与实验结合的方法研究实物材料(化学物质)的组成、结构、性质和变化,以及它们的相互联系,为人类利用自然、改造自然、保护自然、提高生活质量和生存安全服务,满足人类的实际需要以及有关的好奇心和兴趣的科学[3]。此组实验贴近生活和学生已有的知识经验,从新视角审视熟悉的问题,突出了实验是一种重要的科学方法和思维方法,很好地演绎了学习化学的意义和目的。
3 铁离子颜色的探究
在教学中,经常会遇到这样的问题:实验时,学生往往不关注教师着重强调的问题,冷不防提出其他问题。这时,教师或因与教学内容无关,或因相关解释超越学生的知识水准,往往避而不答。其实,认知是多层面的,如此时趁热打铁,借台唱戏,可取得意想不到的效果。
在做电解氯化铜水溶液的实验时,学生敏锐地发现氯化铜溶液呈绿色,与硫酸铜溶液颜色不一样,违背了他们认为铜盐溶液呈蓝色的常识。面对学生的质询,教师可随手取少量氯化铜溶液,加水稀释,发现溶液由绿变蓝,并发问:能否变回绿色?让学生课后思考并探究原因。
氯化铜溶液稀释过程中颜色的变化很好地诠释了化学平衡的移动。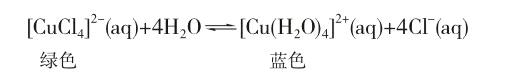
在硫酸铜溶液中加入浓盐酸或氯化钠固体,可观察到溶液颜色逐渐由蓝变绿,十分悦目。
受这一问题的启发,学生讨论三氯化铁溶液的颜色问题,有学生说因氯离子存在的缘故三价铁离子才呈黄色,立即有学生反驳说:三氯化铁溶液稀释时溶液颜色只是变浅,所以三氯化铁溶液的颜色应是水合铁离子的颜色。针对这种情况,我们从实验室分别取不同铁盐少许,观察样品颜色:无水硫酸铁为白色粉未,九水合硝酸铁是接近无色的浅紫色晶体,六水合氯化铁呈黄棕色。为什么同样是结晶水合物,硝酸铁与氯化铁颜色相去甚远?
实验3 铁(Ⅲ)离子的颜色
(1)配制0.5mol/L的硝酸铁溶液100mL,观察溶液的颜色(呈黄色)并备用。
(2)在三支试管中分别加入等量上述硝酸铁溶液,在一支试管中滴加浓硝酸,在一支试管中滴加浓盐酸(对照组试管中加水,保持体积相等),观察溶液颜色的变化。
[实验现象及解释]
九水合硝酸铁虽然晶体接近无色,但配制成0.5mol/L的硝酸铁溶液呈黄色,这是因为:
铁盐、铜盐的颜色问题是生活中极普通的问题,但却蕴含着较复杂的原理。我们不能因为原理深奥就绕着问题走,使化学变成空洞无用的学问。促进学生核心素养发展的化学课堂应该引导学生学习真实的化学,不拘泥于原理,用事实说话,激发学生学习化学的兴趣,以促进学生学习方式的转变。铜盐和铁盐的颜色差异,起源于真实的问题情境。此实验探究的开展,可鼓励学生面对“异常”现象敢于提出自己的见解,启迪学生发现和提出有探究价值的问题,学会从问题和假设出发,确定探究目的,设计探究方案,在探究中学会思考。
化学实验是化学科学赖以形成和发展的基础,是检验化学科学真理性的标准,是化学教学中学生获取化学经验知识和检验化学知识的重要媒介和手段,是提高学生科学素质的重要内容和途径[4]。巧妙的实验构思,可起到变虚为实、化难为易、答疑解惑的功能,促进学生化学知识与技能的学习、创新意识和社会责任感的形成,从而达到提升学生学科核心素养的目标。
参考文献:
[1]吴俊明.中学化学实验研究导论[M].南京:江苏教育出版社,1997:11.
[2] Wolfang Asseblborn usw. Chemie heute-Sekundarbereich Ⅱ. Bildungshaus Schulbuchverlage,2011:10,91.
[3]吴俊明.关于核心素养及化学学科核心素养的思考与疑问[J].化学教学,2016,(11):3~8.
[4]梁慧姝,郑长龙.化学实验论[M].南宁:广西教育出版社,1996:1.
[5]吴星.从三维目标走向核心素养[J].化学教学,2017,(1):3~7.

