Schwann细胞在髓鞘形成过程中的极性调控
万丽丹,刘厚奇,丁文龙
(1南昌大学基础医学院人体解剖学教研室,南昌 330006;2第二军医大学组织胚胎学教研室,上海200433;3上海交通大学基础医学院解剖学教研室,上海 200025)
Schwann细胞在髓鞘形成过程中的极性调控
万丽丹1,3,刘厚奇2*,丁文龙3
(1南昌大学基础医学院人体解剖学教研室,南昌 330006;2第二军医大学组织胚胎学教研室,上海200433;3上海交通大学基础医学院解剖学教研室,上海 200025)
周围神经系统髓鞘形成依赖Schwann细胞和神经元之间复杂的相互作用。细胞极性分子蛋白Par-3在Schwann细胞与轴突接触面密集分布,为BDNF/p75NTR介导的启动成髓提供分子支架。然而,Par-3在该界面聚集并呈不对称性分布的机制仍是一个谜。不少研究发现,JAM和nectin等细胞粘附分子与Par-3不对称性分布有关。另外,通过改变轴突信号如神经营养因子和神经素的水平,也能影响Schwann髓鞘的形成。本文综述和阐释在髓鞘形成过程中,Schwann细胞极性是如何被调控的。
Schwann细胞;髓鞘形成;细胞极性;Par-3
神经胶质细胞包绕神经元轴突形成髓鞘,从而使郎飞结之间的轴突与外界绝缘,保证神经冲动快速跳跃式的传导。髓鞘的形成是一个复杂的动态的过程,神经元和神经胶质细胞之间的精细调节控制着成髓鞘的各个阶段。以周围神经系统为例,Schwann细胞的成髓过程包含3个阶段:接受轴突信号后迅速增殖和向轴突迁移、沿轴突延长和包裹轴突以及包绕轴突形成致密髓鞘。轴突信号对髓鞘的启动及维持至关重要,综合调控Schwann细胞成髓的3类轴突信号主要有:神经营养因子[1,2]、神经素[3,4]和神经元自身电兴奋性[5,6]。
1 Schwann细胞启动成髓时细胞极性的形成机制
髓鞘的形成有赖于神经胶质细胞中细胞器的两极分化,这种高度极性化需要细胞极性蛋白(polarity complex proteins)的参与[7],如partitioning-defective (Par) proteins[8]、Pals1[9]和Dlg1[10]。以partitioning-defective 3 (Par-3)为例,它分布于细胞膜、细胞核和细胞浆中[11]。位于Schwann细胞膜上的Par-3主要参与髓鞘施琅切迹及结环处紧密连接的形成,结合其他连接蛋白保证大分子物质在髓鞘内的正常分布,避免髓鞘外环境对髓鞘内部的干扰,维持着髓鞘内环境的稳定,确保髓鞘的绝缘性以及神经冲动正确有序的传导[12]。Chan等人[8]研究发现在启动成髓时,Schwann细胞中的Par-3局限分布在与轴突接触一侧胞膜的亚细胞区域,其膜表面p75NTR也汇聚于此,膜内部分借PDZ结构域与Par-3结合形成p75NTRPar-3复合体,膜外部分则结合BDNF。他们进一步研究发现,Schwann细胞内Rac1也被限制到该处激活,而敲除Par-3基因会抑制Rac1在正确位点的激活[13]。由此看来,分布于Schwann细胞中的Par-3就像一个分子支架,可以将形成髓鞘所需的关键蛋白召集起来,介导BDNF对髓鞘形成的启动。进一步研究又发现[14],与Par-3共定位于Schwann细胞膜下区域的LKB1复合物通过调控Par-3的分布影响着Schwann细胞极性的建立和髓鞘的形成,首先,LKB1本身的定位有赖于PKA在ser-431位点的磷酸化,然后与Par-3形成复合物并聚集于Schwann细胞膜下,同时与膜表面的p75NTR形成复合物介导BDNF对髓鞘形成的启动,后续Pals1[9]和Dlg1[10]调整髓鞘厚度,而LKB1就在这多种信号通路中发挥整合作用。这一以细胞极性Par蛋白为核心的供应链通过协调和分配胞内多个信号复合物,对Schwann细胞启动和控制髓鞘形成发挥重要作用(图1)。反过来说,Schwann细胞首先必须形成极性,才能判断细胞的哪一侧和轴突接触了,而Par蛋白尤其是Par-3就是Schwann细胞极性化的分子基础,同时还承担着募集膜表面受体和某些胞内信号的任务。当这个由Par-3参与形成的分子支架被打乱后,细胞就不能启动成髓,也无法形成正常的髓鞘。
2 细胞粘附分子在Schwann细胞形成极性中的作用
虽然已知Par-3是Schwann细胞极性化的分子基础,然而,Par-3本身是被什么力量牵引到Schwann细胞与轴突接触这一侧的尚不清楚。Jonah R Chan等发现[8],单个孤立的Schwann细胞中Par-3呈弥散分布,而与其他Schwann细胞或神经元轴突接触后才呈极性分布。这一现象说明与细胞连接有关的物质参与了Par-3的极性分布,例如细胞粘附分子。当Schwann细胞与轴突接触时,N-cadherin与Par-3的这种极性分布保持一致[8,15]。进一步研究发现,体外敲除Schwann细胞而不是神经元N-cadherin基因会破坏Par-3的分布,延迟启动成髓;敲除N-cadherin基因的小鼠只表现出轻度延迟和轻微的髓鞘缺损,消除N-cadherin下游效应器β-Catenin基因的小鼠则表现出更严重的启动成髓迟缓,但没有任何髓鞘缺损[15]。这说明N-cadherin和β-catenin在Schwann细胞极性化和启动成髓发挥重要作用,对髓鞘的成熟则不是必须的。另有学者发现,分布于Schwann细胞中的粘附分子junctional adhesion molecule (JAM)-C对维持髓鞘的完整性和功能也发挥重要作用[16],但这份研究并没有明确指出JAM-C在启动成髓时扮演何种角色。不过,人们在对上皮细胞极性化的研究中观察到在形成细胞连接的过程中,细胞间需先形成不成熟的原始黏附物(primordial adgesiuons, PAs),在此基础上,JAM率先集中到PAs处,并开始募集内源性Par-3[17],而且在众多与紧密连接相关的免疫球蛋白样穿膜蛋白中Par-3仅选择性的与JAM家族结合[18]。Par-3在被JAM募集到PAs处后,作为绞手架分子,第一个PDZ结构域与Par-6结合,再通过atypical protein kinase C (aPKC)结合域与aPKC结合形成三元复合物,aPKC还能以Par-3依赖性的方式磷酸化JAM,以此来调整细胞间连接的成熟程度[19]。Par-3和Par-6都拥有PDZ结构,它们可以在胞膜的亚细胞区域作为合成蛋白复合物的支架蛋白[20]。研究发现,Schwann细胞高表达Par-6也会破坏Par-3极性分布,最终表现为抑制髓鞘的形成[8]。Sir-two-homolog 2 (Sirt2)可通过操纵Par-3乙酰化来调整aPKC的活化状态,进而影响髓鞘的形成过程[21]。事实上,这些蛋白之间的相互作用非常复杂,作为Par-3的募集者JAM本身在细胞特定区域的极性分布也受其他分子如Nectin调节[22]。除此之外,某些细胞内信号分子如phosphatidylinositol 3 kinase (PⅠ3K)可能影响Par-3在PAs中的定位,这可能与PⅠ3K可调控Cdc42的激活,影响Cdc42与Par-6的结合而引起下游效应有关[23]。然而,关于Schwann细胞中Par-3是否能与JAM结合并被其募集至Schwann细胞与轴突接触面的胞膜下区域,以及细胞粘附分子家族其他成员和胞内信号分子是否也参与了Par-3的极性分布尚不清楚。
3 神经营养因子BDNF参与调控Schwann细胞极性化
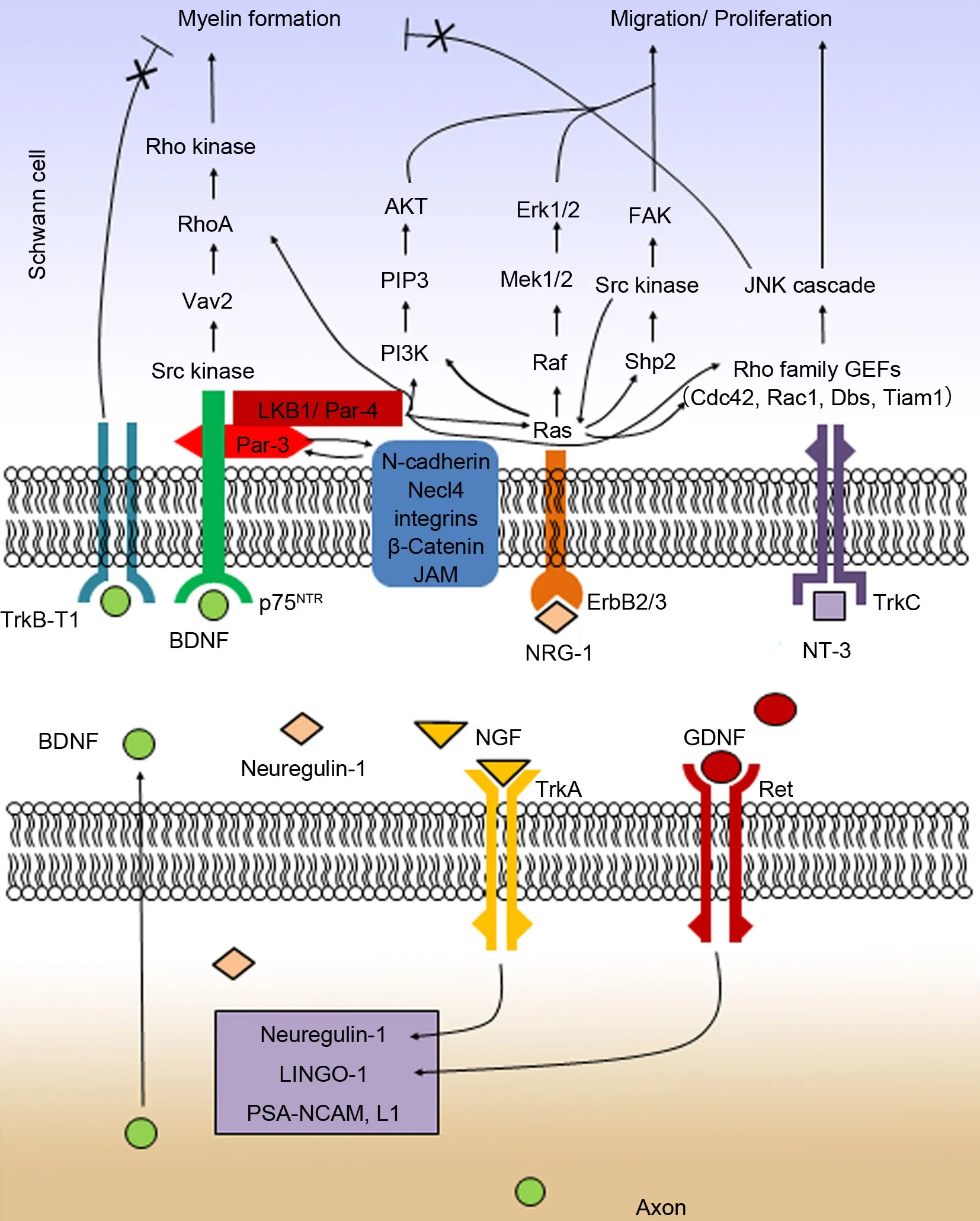
图1 Schwann细胞在髓鞘形成过程中的极性化及胞内信号通路示意图Fig. 1 A schematic illustration of the intracellular signaling for the Schwann cell polarization during myelin formation. Par-3, partitioning-defective 3; LKB1, liver kinase B1; PKA, protein kinase A; BDNF, brain-derived neurotrophic factor; TrkB-T1, truncated tropomyosin receptor kinase B; p75NTR, p75 nerve growth factor receptor; NT-3, neurotrophin-3; TrkC, tropomyosin receptor kinase C; GEF, guanine nucleotide exchange factor; Tiam, T-lymphom invasion and metastasis; Dbs, Dbl’s big sister; Cdc42, cell division control protein 42; JNK, jun N-terminal kinase; NGF, nerve growth factor; TrkA, tropomyosin receptor kinase A; GDNF, glial cell-derived neurotrophic factor; NRG-1, neuregulin-1; ErbB2/3, epidermal growth factor receptor2/3; PⅠP3, phosphatidylinositol (3,4,5)-trisphosphate; Akt, protein kinase B; FAK, focal adhesion kinase; JAM, junctional adhesion molecule; LⅠNGO-1, immunoglobin-like domain-containing protein 1
在DRG神经元与Schwann细胞共培养体系中加入外源性BDNF会增强p75NTR与Par-3的结合,而去除内源性BDNF会削弱两者结合,这一结果表明p75NTR与Par-3的结合受BDNF调节,是供体依赖性的[8]。简单来说,Par-3在哪,p75NTR就往哪迁移,但是被Par-3集结的p75NTR的数量多少与胞外BDNF浓度高低有关。或者可以理解为,Par-3定向分布于Schwann细胞与轴突接触面,本来就是为募集p75NTR于此以便接收胞外BDNF信号用的,但是在没有或者缺少足够的BDNF结合p75NTR的情况下,Par-3这种极性分布也是徒劳无功,甚至还可能导致Schwann细胞错误地认为轴突不需要成髓鞘或启动成髓鞘已经完成,而将Par-3和p75NTR撤退。由于BDNF和Par-3都是在启动成髓时达峰值,在启动成髓前和完成启动成髓后,Par-3表达量很少甚至没有,而去除内源性BDNF导致p75NTR和Par-3的结合减少,似乎BDNF是根据自己的需要上调Par-3表达为其服务。研究证实,通过增强DRG神经元高表达内源性BDNF,并沿轴浆顺行运输和分泌,能促进和加快Schwann细胞成髓鞘[24],这种作用甚至能一直持续至动物成年[25]。因此,自轴突部位释放BDNF浓度升高对髓鞘形成的促进作用原理之一可能是通过增强p75NTR-Par-3复合体的形成,最终加快成髓鞘的启动。这些结果提示启动成髓时,高浓度的BDNF正是上调Par-3表达的重要轴突信号。这说明,轴突的存在和轴突信号都能通过调控Schwann细胞极性化影响其髓鞘形成过程。
我们曾以大鼠坐骨神经挤压伤模型为研究对象,检测和观察了损伤后髓鞘再生状况是否与轴突和轴突信号对Schwann细胞极性化有关[26]。我们的研究发现,正常大鼠坐骨神经中即有非常少量的Par-3表达,这一结果提示正常神经组织中就存在非常少量的动态的偶然的脱髓鞘现象,脱髓鞘后也可能自行再形成髓鞘。损伤后1周,Par-3开始表达并不断增强。至损伤后2~3周,Par-3达到峰值,损伤后4周和8周则逐渐降低,Beirowski等人的研究也得出类似的结果[21]。此外,Par-3在Schwann细胞中的分布也和以上结果趋于一致,损伤后1周,损伤远端经历Wallerian变性,大部分再生轴突尚未穿过损伤区域,损伤远端部位的绝大多数Schwann细胞还未与轴突接触,这时绝大多数Schwann细胞内不存在Par-3不对称性分布,也就是说它们还未极性化为包绕轴突做准备。损伤后2周,大量再生轴突跨越损伤区域到达远端并与Schwann细胞接触,从神经横断面上观察Schwann细胞内Par-3呈新月形或C形分布,似与轴突接触或包绕轴突。但是,尽管损伤后4周和8周再生轴突已长入损伤远端,Par-3的这种不对称性分布却未观察到。这说明神经损伤后,与轴突失去联系对Schwann细胞来说是一种上调Par-3表达同时调整其分布的强有力信号,当Schwann细胞迁移至轴突附近准备包绕轴突启动成髓时,Par-3会达到峰值并呈极性分布。笔者还检测了神经组织中BDNF的表达,损伤后1周BDNF为峰值水平,以后逐步减少,其表达规律并非与Par-3一一对应,但是增强表达BDNF时髓鞘再生情况比单纯损伤组更好,更接近于未损伤神经[26]。结合以上研究工作,笔者初步推测,神经损伤后通过增强神经组织表达BDNF,可能能在Schwann细胞与轴突发生接触时,促使Schwann细胞形成极性,从而加快启动成髓,促进髓鞘再生。
4 Schwann细胞成髓鞘过程中的信号通路调控
在髓鞘形成过程中,不同神经营养因子对Schwann细胞发挥不同甚至截然相反的作用(图1),如NT-3/TrkC则通过激活Rho GTPases Rac1和Cdc42以及下游信号c-Jun N-terminal kinase (c-JNK),促进Schwann细胞迁移,抑制其成髓[27-29];BDNF/p75NTR通过Src kinase/Vav2/RhoA/Rho-kinase信号通路抑制Schwann细胞迁移,启动髓鞘的形成[30,31]。那么,在启动成髓前Schwann细胞沿轴突迁移阶段,高浓度的NT-3对启动成髓的抑制是否包含了它对Par-3表达的不允许呢?以BDNF和NT-3为例,我们假设它们对Par-3表达的调控,正是经由上述信号通路,也就是说在启动成髓前,NT-3/TrkC通过激活Rac1和Cdc42以及c-JNK,抑制Par-3表达,阻止Schwann细胞极性化,保持其迁移状态;在启动成髓时,BDNF/p75NTR通过Src kinase/Vav2/ RhoA/Rho-kinase,上调Par-3表达;分布于Schwann细胞与轴突接触面的Par-3为BDNF募集大量p75NTR使它更高效地启动成髓。另外,NGF和GDNF通过分别结合神经元表面TrkA和Ret受体,最终表现为促进髓鞘形成[32,33],其机制可能是两者使神经元高表达内源性BDNF,间接上调Schwann细胞中Par-3的表达水平。除神经营养因子外,还有一种重要的轴突信号Neuregulin-1 (Nrg-1)通过Schwann细胞表面ErbB2/3受体,参与了其髓鞘形成的全部过程[4]以及神经损伤后的髓鞘再生[34],研究指出不同浓度Nrg-1 ⅠⅠⅠ和Nrg-1 ⅠⅠ对Schwann细胞成髓鞘效果不同[35],低浓度Nrg-1 ⅠⅠ能引起了Schwann细胞沿轴突延长和包裹轴突的效果。然而,高剂量Nrg-1 ⅠⅠⅠ和Nrg-1 ⅠⅠ则通过激活Mek/Erk上调c-JNK的表达抑制髓鞘形成。这些结果表明,旁分泌Nrg-1信号对Schwann细胞成髓鞘起浓度依赖性的双重影响。但是Nrg-1/ErbB2/3及其下游信号通路是否参与调控Schwann细胞中Par-3的表达,目前还没有研究报道。总之,BDNF、NT-3、NGF、GDNF、Nrg-1 ⅠⅠⅠ和Nrg-1 ⅠⅠ浓度的高低对Schwann细胞中Par-3表达有何影响,尚未开始探讨。调控Schwann细胞中Par-3合成的胞内信号通路也不明了。有关BDNF/p75NTR、NT-3/TrkC、NGF/TrkA、GDNF/Ret、Nrg-1/ErbB2/3信号通路与Schwann细胞Par-3表达和在正确位点的极性分布之间的关系尚需进一步研究探索。
5 结语
国内外研究结果揭示出周围神经脱髓鞘后髓鞘形成不良的发生发展机制之一,可能与Schwann细胞极性化异常有关,那么哪些因素的出现将导致Schwann细胞极性化被打破或无法形成,以及如何修复呢?要探讨这些问题,我们认为至少存在以下两种情形(以p75NTR-Par-3支架为例):一种是Schwann细胞中Par-3表达下调,这种情况主要由轴突是否存在和轴突信号是否失调所致。因此,上调Par-3表达的信号至少包含两部分:Schwann细胞是否与轴突接触、BDNF水平是否足够;另一种是在Schwann细胞中Par-3和p75NTR均表达正常,Par-3没有在与轴突接触面出现极性分布,例如它不被JAM募集或者能影响它定位的某些胞内信号失调,此时,下Par-3无法为BDNF募集p75NTR,BDNF就不能更快更有效的发挥启动成髓的作用了。值得注意的是,Par-3表达并非越高越好,事实上Par-3过度表达反而破坏了它在Schwann细胞中的极性分布,最终表现为抑制成髓[8]。不论是以上何种原因导致Par-3支架瓦解,如果能通过某些途径帮助Schwann细胞建立这个支架或更好的利用这个支架,或者使这个支架免于攻击将对髓鞘再生起到积极的作用。
[1] Chan JR, Cosgaya JM, Wu YJ, et al. Neurotrophins are key mediators of the myelination program in the peripheral nervous system. PNAS, 2001 ,98(25): 14661-14668.
[2] Rosenberg SS, Ng BK, Chan JR. The quest for remyelination: A new role for neurotrophins and their receptors. Brain Pathol, 2006, 16(4): 288-294.
[3] Nave KA, Salzer JL. Axonal regulation of myelination by neuregulin-1. CurrOpinNeurobiol, 2006, 16 (5): 492-500.
[4] Newbern J, Birchmeier C. Nrg1/ErbB signaling networks in Schwann cell development and myelination. Semin Cell DevBiol, 2010, 21(9): 922-928.
[5] Demerens C, Stankoff B, LogakM,etal.Induction of myelination in the central nervous system by electrical activity. PNAS, 1996, 93(18): 9887-9892.
[6] Stevens B, Tanner S, Fields RD. Control of myelination by specific patterns of neural impulses. J Neurosci, 1998, 18(22): 9303-9311.
[7] Etienne-Manneville S. Polarity proteins in glial cell functions. Curr Opin Neurobiol, 2008, 18(5): 488-494.
[8] Chan JR, Jolicoeur C, Yamauchi J, et al. The polarity protein Par-3 directly interacts with p75NTRto regulate myelination. Science, 2006, 314(5800): 832-836.
[9] Ozçelik M, Cotter L, Jacob C, et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci, 2010, 30(11): 4120-4131.
[10] Cotter L, Ozçelik M, Jacob C, et al. Dlg1-PTEN interaction regulates myelin thickness to prevent damaging peripheral nerve overmyelination. Science, 2010, 328(5984): 1415-1418.
[11] Assémat E, Bazellières E, Pallesi-Pocachard E, et al. Polarity complex proteins. Biochem Biophys Acta, 2008, 1778(3): 614-630.
[12] Poliak S, Matlis S, Ullmer C, et al. Distinct claudins and associated PDZ proteins form different autotypic tight junctions in myelinating Schwann cells. J Cell Biol, 2002, 159(2): 361-372.
[13] Tep C, Kim ML, Opincariu LⅠ, et al. Brain-derived neurotrophic factor (BDNF) induces polarized signaling of small GTPase (Rac1) protein at the onset of Schwann cell myelination through partitioning-defective 3 (Par3) protein. J Biol Chem, 2012, 287(2): 1600-1608.
[14] Yun-An A. Shen, Yan Chen, Dang Q. Dao, et al. Phosphorylation of LKB1/Par-4 establishes Schwann cell polarity to initiate and control myelin extent. Nat Commun, 2014, 5: 4991.
[15] Lewallen KA, Shen YA, De la Torre AR, et al. Assessing the role of the cadherin/catenin complex at the Schwann cell-axon interface and in the initiation of myelination. J Neurosci, 2011, 31(8): 3032-3043.
[16] Scheiermann C, Meda P, Aurrand-Lions M, et al. Expression and function of junctional adhesion molecule-C in myelinated peripheral nerves. Science, 2007, 318(5855): 1472-1475.
[17] Ⅰtoh M, Sasaki H, Furuse M, et al. Junctional adhesion molecule (JAM) binds to PAR-3: a possible mechanism for the recruitment of PAR-3 to tight junctions. J Cell Biol, 2001, 154(3): 491-497.
[18] Ebnet K, Aurrand-Lions M, Kuhn A, et al. The junctional adhesion molecule (JAM) family members JAM-2 and JAM-3 associate with the cell polarity protein PAR-3: a possible role for JAMs in endothelial cell polarity. J Cell Sci, 2003, 116(Pt 19): 3879-3891.
[19] Ⅰden S, Misselwitz S, Peddibhotla SS, et al. aPKC phosphorylates JAM-A at Ser285 to promote cell contact maturation and tight junction formation. J Cell Biol, 2012, 196(5): 623-639.
[20] Fanning AS, Anderson JM. PDZ domains: fundamental building blocks in the organization of protein complexes at the plasma membrane. J Clin Ⅰnvest, 1999, 103(6): 767-772.
[21] Beirowski B, Gustin J, Armour SM, et al. Sir-two-homolog 2 (Sirt2) modulates peripheral myelination through polarity protein Par-3/atypical protein kinase C (aPKC) signaling. PNAS, 2011, 108(43): E952-961.
[22] Fukuhara A, Ⅰrie K, Nakanishi H, et al. Ⅰnvolvement of nectin in the localization of junctional adhesion molecule at tight junctions. Oncogene, 2002, 21(50): 7642-7655.
[23] Mertens AE, Pegtel DM, Collard JG. Tiam1 takes PARt in cell polarity. Trends Cell Biol, 2006, 16(6): 308-316.
[24] Ng BK, Chen L, Mandemakers W, et al. Anterograde transport and secretion of brain-derived neurotrophic factor along sensory axons promote Schwann cell myelination. J Neurosci, 2007, 27(28): 7597-7603.
[25] Tolwani RJ, Cosgaya JM, Varma S, et al. BDNF overexpression produces a long-term increase in myelin formation in the peripheral nervous system. J Neurosci Res, 2004, 77(5): 662-669.
[26] Wan LD, Xia R, Ding WL. Short-term low-frequency electrical stimulation enhanced remyelination of injured peripheral nerves by inducing the promyelination effect of BDNF on Schwann cell polarization. J Neurosci Res, 2010, 88(12): 2578-2587.
[27] Yamauchi J, Chan JR, Shooter EM. Neurotrophin 3 activation of TrkC induces Schwann cell migration through the c-Jun N-terminal kinase pathway. PNAS, 2003, 100(24): 14421-14426.
[28] Yamauchi J, Miyamoto Y, Tanoue A, et al. Ras activation of a Rac1 exchange factor, Tiam1, mediates neurotrophin-3-induced Schwann cell migration. PNAS, 2005, 102(41): 14889-14894.
[29] Yamauchi J, Chan JR, Miyamoto Y, et al. The neurotrophin-3 receptor TrkC directly phosphorylates and activates the nucleotide exchange factor Dbs to enhance Schwann cell migration. PNAS, 2005, 102(14): 5198-5203.
[30] Cosgaya JM, Chan JR, Shooter EM. The neurotrophin receptor p75NTRas a positive modulator of myelination. Science, 2002, 298(5596): 1245-1248.
[31] Yamauchi J, Chan JR, Shooter EM. Neurotrophins regulate Schwann cell migration by activating divergent signaling pathways dependent on Rho GTPases. PNAS, 2004, 101(23): 8774-8779.
[32] Chan JR, Watkins TA, Cosgaya JM, et al. NGF controls axonal receptivity to myelination by Schwann cells or oligodendrocytes. Neuron, 2004, 43(2): 183-191.
[33] Höke A, Ho T, Crawford TO, et al. Glial cell line-derived neurotrophic factor alters axon schwann cell units and promotes myelination in unmyelinated nerve fibers. J Neurosci, 2003, 23(2): 561-567.
[34] Fricker FR, Bennett DL. The role of neuregulin-1 in the response to nerve injury. Future Neurol, 2011, 6(6): 809-822.
[35] Syed N, Reddy K, Yang DP, et al. Soluble neuregulin-1 has bifunctional, concentration-dependent effects on Schwann cell myelination. J Neurosci, 2010, 30(17): 6122-6131.
Regulation of the polarization of Schwann cell during myelination
Wan Lidan1,3, Liu Houqi2*, Ding Wenlong3
(1Department of Anatomy , Basic medical school , Nanchang University, Nanchang 330006;2Department of Histology and Embryology, The Second Military Medical University , Shanghai 200433 ;3Department of Anatomy , School of Medicine , Shanghai Jiaotong University , Shanghai 200025, China)
The cellular events that preceding myelination in the peripheral nervous system is dependent on complex reciprocal interactions between Schwann cell (SC) and axon. The Par-3, as an intracellular scaffold, is enriched at SC-axon interface and functions for BDNF/p75NTRto promote myelination initiation. However, the mechanism of Par-3 recruitment and asymmetrical distribution at this polarized-apical domain remains a mystery. Many studies have found that junctional adhesion molecule(JAM) and Nectin and other cell adhesion molecules were related to the asymmetric distribution of Par-3 at SC-axon interface. Ⅰn addition, changes in axonal signaling, such as neurotrophic factor or neuregulin-1, can also contribute to the formation of Schwann myelin. The purpose of this paper is to summarize and explain how the polarity of Schwann cells is regulated during myelination.
Schwann cell; Myelination; Cell polarity; Par-3
R338.1+1
A DOⅠ:10.16705/ j. cnki. 1004-1850.2017.04.011
2017-02-10
2017-07-10
江西省自然科学基金(00014918);南昌大学博士科研启动基金
万丽丹,女(1980年),汉族,讲师,博士
*通讯作者(To whom correspondence should be addressed):houqiLiu@126.com

