多标记免疫荧光染色及多光谱成像技术在组织学研究中的应用
钱帮国,焦磊
(珀金埃尔默企业管理(上海)有限公司,上海 201203)
多标记免疫荧光染色及多光谱成像技术在组织学研究中的应用
钱帮国,焦磊*
(珀金埃尔默企业管理(上海)有限公司,上海 201203)
免疫组织化学染色及成像分析是研究组织形态和组织原位抗原表达不可或缺的检测技术,广泛应用于临床病理诊断和医学及生物学研究的各个领域。组织切片样本中蕴含着丰富的信息,但是受制于传统单标记免疫组织化学染色方法的限制,通常只能对组织中的一到两种抗原进行染色分析,而且定量结果的判读往往依赖于肉眼观测,缺乏客观标准。随着蛋白组学的发展,对现代组织学分析提出了更高的要求,例如不同的蛋白共表达和共定位分析、低丰度分子的检测、异质性分析、细胞表型统计乃至复杂组织微环境的描绘等,都需要在同一张组织切片样本上同时检测多种靶标分子。这对于理解组织微环境中各种细胞间的关系,推演信号通路上下游蛋白表达的关系,制定临床诊断和治疗方案都有着非常重要的意义。本文介绍一种基于酪胺信号放大(TSA)技术衍生而来的多标记免疫荧光染色方法,能够在同一组织切片样本上复染7种以上抗原并进行区别标记,配合光谱成像技术和定量分析软件,能够将组织中蕴含的丰富信息准确的呈现出来。这套流程化的分析方案为临床诊断和基础科研提供了更高精度和更可靠的组织学数据,将免疫组织化学分析的技术水平提升到一个新的高度。
多色标记免疫组织化学;多光谱成像;酪胺信号放大;定量病理学
随着新型测序、基因和蛋白芯片以及流式分析技术的发展,已经可以从正常或疾病组织中获取越来越多的基因或细胞表型信息。这些基于均相样本的分析方法因为缺少形态学数据,一般只能测定平均含量,而无法揭示特定表型在组织中的原位分布特点。组织中的蛋白或细胞往往表现为异质性分布[1],其空间定位以及与组织结构的相互关系对于理解各组分在组织微环境中的角色和作用有着重要意义。免疫组织化学染色法是利用抗原和抗体间的特异性结合来检测细胞或组织中特定目标蛋白的实验方法[2],兼顾蛋白表达定量和形态定位检测两方面的要求。受益于抗体标记和成像检测技术的进步,已经有方法可以摆脱常规免疫组织化学染色和成像技术的限制,将过去局限于一到三种蛋白检测的传统免疫组织化学分析,提升为同时检测多达7种分子靶标的新型免疫组织化学分析方案(PerkinElmer PhenopticsTM),进而满足组织微环境中复杂表型分析的需求。本文从多标记免疫组织化学染色、光谱成像和信号拆分以及组织形态学定量分析三个环节对新型免疫组织化学分析方法进行介绍(图1),并对该方法在生物医学研究中的应用前景进行了探讨。

图1 Phenoptics新型免疫组织化学分析方案的分析流程。A,多色免疫荧光染色;B,光谱成像和信号拆分;C,组织形态学定量软件分析Fig. 1 Flowchart of Phenoptics analysis. A, multiplexed immunohistochemistry; B, multispectral imaging; C, tissue image quantitative analysis
1 多标记免疫组织化学染色
1.1 传统方法在多标记免疫组织化学染色中的局限性
抗体种属限制:自19世纪60年代起,酶标抗体就被用在免疫组织化学染色中显示特定目标抗原在组织中的定量表达和定位分布,后来拓展到荧光标记。免疫组织化学染色按报告蛋白的结合方式可以分为一抗直接标记和二抗间接标记两种类型[3]。一抗直标的方法操作简单,但是标记信号微弱,一般难以满足弱信号检测及精细的成像要求。为了达到足够的染色强度,通常采用二抗标记的方式。在多标记免疫组织化学染色中,为了保证抗原标记的特异性,必须要求在染色中针对不同抗原使用不同种属来源的一抗抗体,借此保证二抗对目标一抗种属的特异性识别。但是实际科研工作中,抗体种属来源的选择非常少,很难积累到足够多种类的优质抗体,因此常规免疫组织化学方法一般只能在同一样本上同时标记一到3种标记物。
染料颜色重叠:限制多标记免疫组织化学染色的另一个因素是染料重叠带来的信号识别问题。由于组织中不同靶标分子会在空间上出现位置重叠(即使没有生物学意义上的相互作用),在成像检测时不同染料信号在同一像素上的叠加就在所难免。基于明场成像的免疫组织化学检测一般采用酶标记染色,在同一组织切片上进行3种不同的酶链抗体显色是非常困难的[4]。另外相近色染料如DAB(棕色)、AEC(红色)、PermaRed(红色)、Eosin(红色)的组合使用,或者深色染料对浅色染料的遮盖,都会使颜色混合在一起时变得难以区分;而且明场光学信号的非线性分布和较窄的动态范围,密集的染料沉积也无法进行有效的定量比较。另一种光学检测方法是免疫荧光成像。荧光标记具备更高的信噪比和强度线性相关性而在多标记染色中获得更广泛的使用。借助窄带通的滤光片可以对荧光信号进行有效的区分,但是当标记染料达到4种或以上时,潜在的信号串色风险同样成为不容忽视的问题,加之较强的组织自发荧光背景干扰,使得高精度的光谱成像检测成为多标记免疫荧光检测的必备方案[4-5]。除了光学检测,质谱技术因其较高的信号分辨率,也被用于免疫组织化学成像分析[6-7]。但是金属标记、烧蚀样本的一次性检测方式以及昂贵的质谱设备都限制了这种方法的广泛使用。
连续切片和顺次染色法:为了摆脱抗体种属来源冲突的限制,有研究者采用连续切片或多次洗脱复染的方式来实现多种抗原的关联检测[8]。连续切片样品要求样本数量要足够,对于较小的组织样本或珍贵的临床标本并不适合。而且由于切片厚度的限制和损耗,即使连续的两张切片之间也难以做到微米级的精准对齐,无法保持细胞的连贯性,也不能进行单细胞级别的共定位分析。另一种尝试是循环洗脱复染(SⅠMPLE技术),即对同一张组织切片进行单标记染色,采集图像,然后洗脱染料和抗体后,再次进行染色和成像,如此循环多次后再将每轮染色的图像结果重叠起来以此实现多标记检测[9-10]。这种方法的缺点是多轮洗脱造成的样本损伤(特别是抗原丢失)。因为是多轮成像,后期不同批次图像的对齐分析,尤其是单细胞和亚细胞结构的对齐定位也是一个巨大的挑战。而且每一轮染色之后信号会被彻底洗脱,因此无法对染色结果进行二次检测验证(比如更换不同物镜倍率进行观察),这也限制了该方法的应用范围[11]。
1.2 TSA信号放大技术及Opal多色标记染色技术
近期一种新的基于酪胺信号放大(tyramine signal amplification,TSA) 技术衍生而来的多标记免疫组织化学染色方法(PerkinElmer OpalTMKit)在研究报道中被广泛使用[12-14]。酪胺信号放大技术已有20多年的历史,是一类利用辣根过氧化酶(HRP)对靶抗原进行高密度原位标记的检测方法,被广泛应用于ELⅠSA、ⅠSH、ⅠHC等技术中进行生物学抗原的检测,大幅提高被检测信号的灵敏度(图2A,图2B)[15]。带有染料标记的底物酪胺(T)分子在过氧化氢氧化环境下,被抗体或探针固定的HRP转化为具有短暂活性的中间状态(T*),然后被激活的中间态分子(T*)迅速与相接蛋白分子的富含电子区域(酪氨酸残基)进行稳定的共价结合,未被标记的酪胺分子将被洗脱,借此实现对抗原的特异性染色。由于相接的蛋白(包括HRP,抗体,目标抗原)都含有大量的酪氨酸结合位点,所以目标抗原处会富集大量标记分子,使信号被有效放大[16](图2C)。Opal技术利用TSA染色中酪胺分子与其结合的抗原蛋白之间共价键的稳定性,其键能远高于抗原、抗体间的非共价键结合力,通过微波加热法就可以在保留抗原标记信号的同时去除结合在抗原上的一抗和二抗分子,借此实现抗原的直接标记(图2D)。后续可以再次使用同一种属来源的抗体标记其他抗原靶点,只需更换不同的标记颜色,而不必考虑上一轮抗体的交叉干扰。Opal技术彻底解决了多标记免疫组织化学染色中抗体种属选择的限制,在设计抗体组合时只需根据各抗体的效价来为各个靶点选择最优的抗体即可。
Opal技术的染色流程与普通免疫组织化学染色相近,只是在每一轮染色过程中增加了一个抗体洗脱步骤(图3)。抗体洗脱一般采用微波加热的方式,与抗原修复过程近似,所以不会对样本及抗原造成过分的损伤。通过微波洗脱处理可以将以非共价键结合在抗原上的抗体去除,但是保留以共价键结合在抗原表面的TSA荧光信号,从而实现无抗体干扰的抗原直接标记,再经过多轮染色循环实现多色标记。
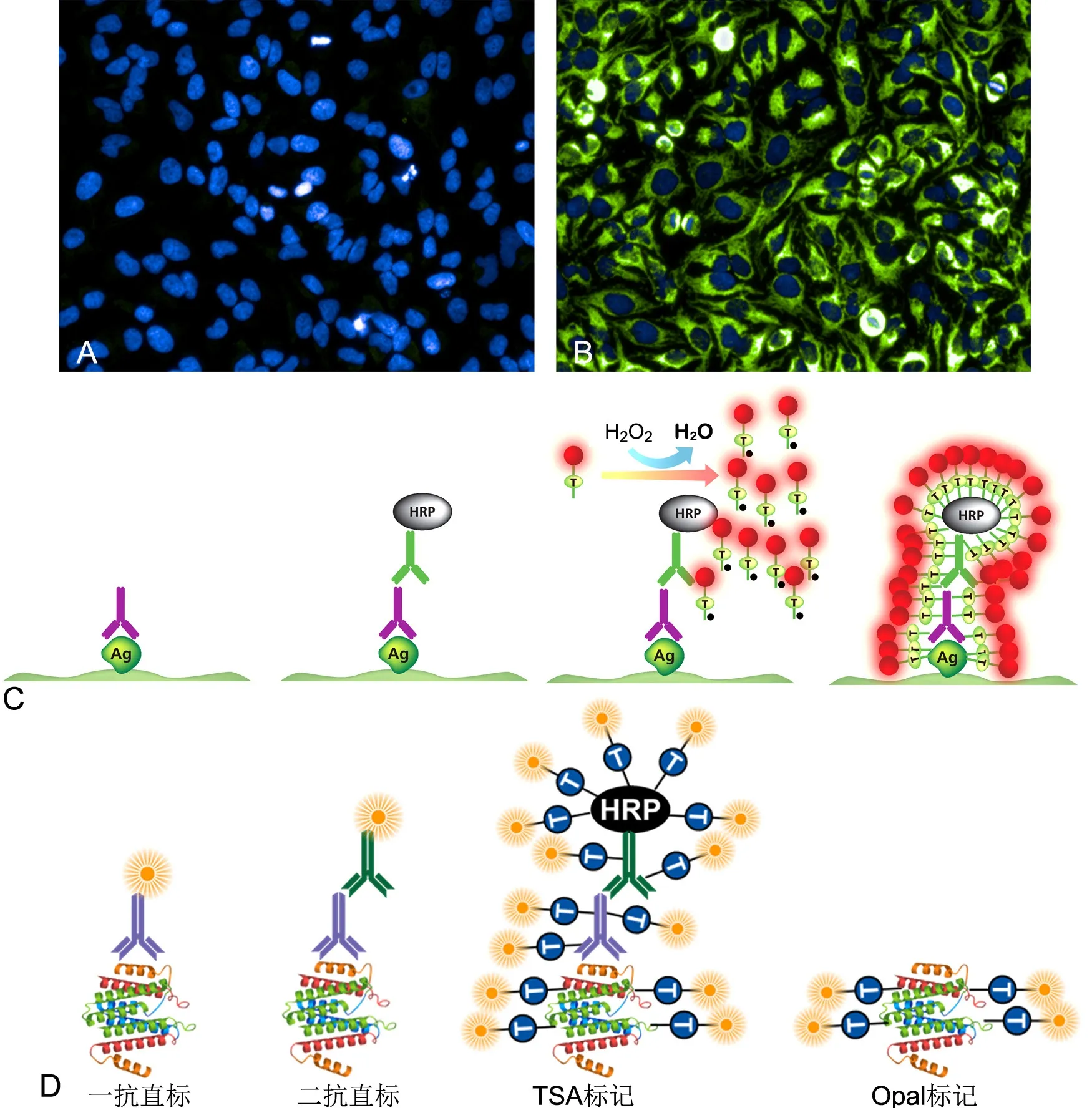
图2 酪胺信号放大(TSA)染色与传统组织化学染色比较。A,Hela细胞细胞色素C经常规二抗标记的免疫荧光染色的结果;B,相同浓度下经TSA信号放大的结果;C,TSA染色过程;D,TSA/Opal与传统免疫染色标记方法的比较Fig. 2 Comparison between TSA and conventional immunostaining. A, conventional detection of cytochrome C in Hela cell with fluorescence labeled secondary antibody; B, TSA detection of cytochrome C in Hela cell where the deposition of fluorescence labels was amplified proximal to the target antigens; C, TSA staining process; D, comparison between different staining methods
虽然都是采用顺次单标、多轮复染的方式,但是Opal与SⅠMPLE等染色洗色、多轮拍照的方法存在着本质的不同。Opal在每轮染色中间的洗脱环节只需去除抗体,不需要对抗原上的标记进行彻底洗脱,所以对样本的损伤会更小;经由Opal染色的多种抗原标记物可以在样本上同时存在,同时拍摄检测记录在同一张图像画面上,而无需后期对不同画面进行加工对齐,这样就保证了标记物间定位的准确性和稳定性;并且样本可以保存长达一年的时间,随时可以根据需要进行再次采图拍摄查验[4]。三色以下的Opal复染样本对成像检测设备的要求不高,可以用普通荧光显微镜或共聚焦设备来采集图像。但是对更多色标记的复染样本,尤其是获得无组织自发荧光干扰的高信噪比图像,就需要借用专业的光谱成像设备来进行检测。
2 光谱成像和信号拆分
经由多色免疫荧光染色的样本包含多维的生物学信息,包括组织结构信息、不同细胞型的空间分布信息、不同信号通路蛋白或细胞功能标识物的共表达信息等。对这些信息的完整记录和充分解读,对于研究疾病发生发展的机制,探讨诊断和治疗疾病的有效方法有着重要意义。然而如上文所述,连续切片成像和普通滤光片成像的方式都难以完整记录或准确识别混杂重叠的多标记信号,需要专业的检测方法才能对多标记染色样本中的信息进行有效的记录和解读。
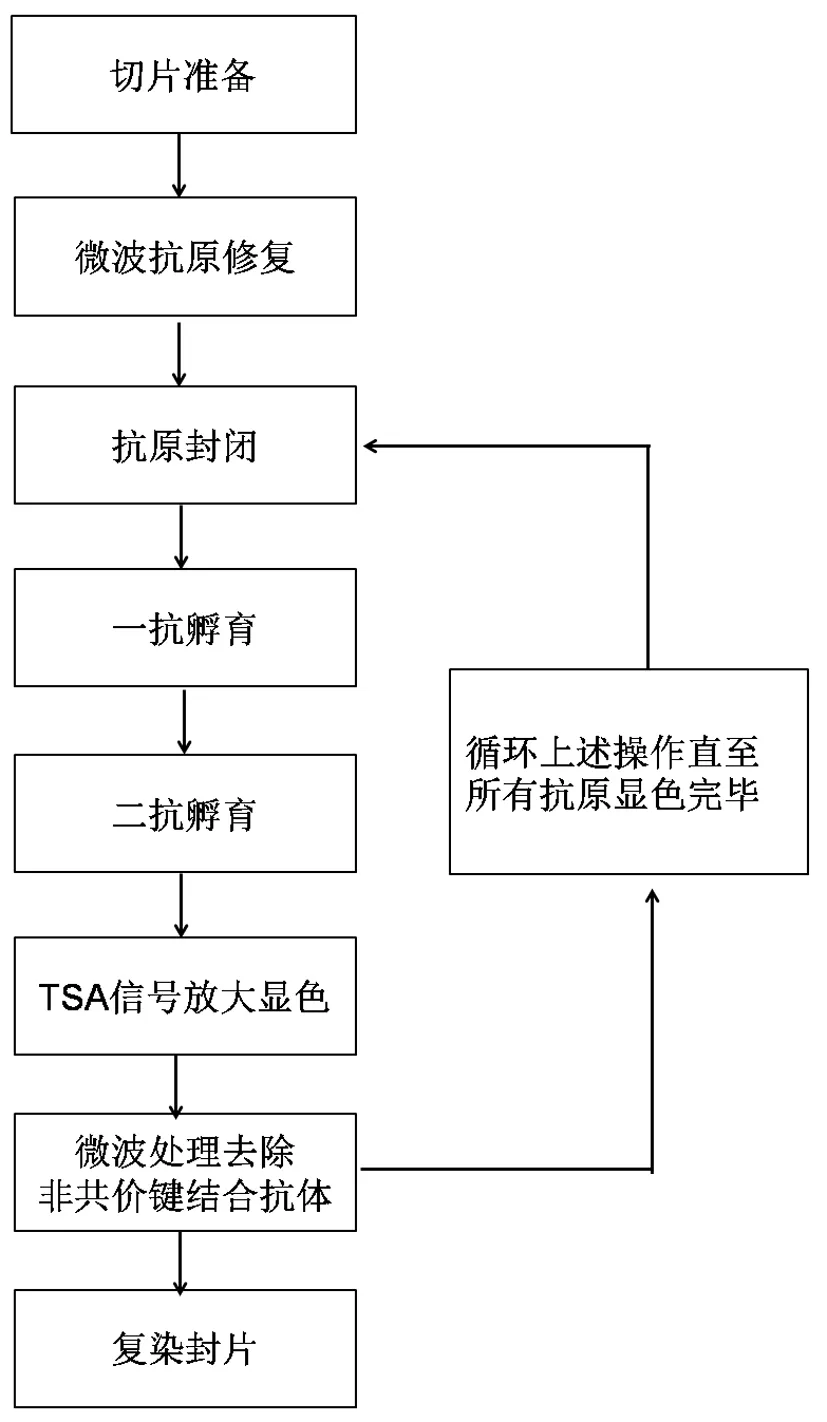
图3 Opal多色免疫荧光染色流程图Fig. 3 The Opal multiplex IHC workflow
多光谱成像是检测复杂染色样品信号的有效手段,不仅能对混杂的各色信号进行识别,而且能够去除自发荧光的干扰。实现光谱成像的设备包括光谱型共聚焦显微镜(如Zeiss LSM880,Leica SP8等等)和多光谱组织成像系统(PerkinElmer Vectra®)。前者主要用于亚细胞结构的细微成像或厚样本的深层观察,对于普通的组织切片(3~5μm),在20×物镜的解析度下,共聚焦提供的光学层切功能并不是一个必要的选项。而点扫描共聚焦较慢的扫描速度、高强度的光漂白以及缺少配套的组织分析软件,都使其难以成为组织切片多色成像及定量分析的首选方案。
多光谱组织成像系统是专为组织切片定量分析设计的专业成像系统,其最大的特色在于图像光谱信息的采集,同时提供生物组织样本的形态结构和光学图谱两方面的信息。传统的光学成像只记录样本二维画面中的灰度或者色彩信息,而光谱图像是由不同波段二维图像构成的三维图组(Cube)[4,5]。在Vectra成像系统中,采用液晶可调谐滤波器(LCTF)以20nm的步进在420~720nm可见光范围内的进行光谱扫描,各波段采集的高分辨率图像被相机完整的记录并合为一体。因此光谱图像中的任何一个像素点都包含着一段完整的光谱曲线,每一种染料(包括自发荧光)也都有其对应的特征光谱(图4)。利用样品标记中的已知染料光谱,就可以将各色信号从多光谱图像中拆分出来,变成富含光密度信息的独立单通道图像[5]。
光谱成像在组织学分析中具有其独特的技术优势。对于明场免疫组织化学染色样品,借助多光谱成像可以对混杂的染料进行有效的识别、拆分和定量,即使是颜色相近的DAB(棕色)或PermaRed(红色)染料也能被拆分开来,并实现精准的定量[17]。而且经光谱记录的明场图像,可以把拆分得到的单通道图像的颜色进行任意调整,或者转变为荧光效果(图5A,图5B)来呈现不同通道间的共定位效果[18]。对于荧光染色的样品,特别是福尔马林固定石蜡包埋的样品,光谱成像可以通过去除组织自发荧光来提高图像的信噪比达十倍以上[19]。多于多标记免疫荧光染色的样品,借助多光谱成像技术可以对多达十色复染的信号进行准确拆分,获得清晰的、无串扰的、高清晰图单通道图像[12-14]。同样经光谱记录的荧光染色样品图像,也可以转变为传统HE或免疫组织化学样式的明场效果图(图5C—图5F)便于形态结构的辨识和病理观察[19]。
3 智能组织定量软件分析
在传统组织学研究中,对于免疫组织化学和免疫荧光图像的评判多采用人工判读的方式。通过人工计数来观察阳性着色组织的面积比例和分布是一种常用的半定量分析方法,但是需要耗费大量的人力和时间,而且其结果因为存在较大的判读误差和主观倾向性而导致难以做到客观准确[20]。随着信息技术的发展,很多图像分析软件如Ⅰmage Pro、Ⅰmage J等被用来辅助进行组织学定量分析。但是对于复杂组织的自动化分析,因为组织样本的形态结构与组成极为复杂(如肿瘤组织、癌旁组织、血管、坏死组织等),造成普通软件无法自动识别不同的组织类型,难以满足研究者定量分析特定区域抗原表达的要求,极大的限制了自动化批量定量组织分析的应用。
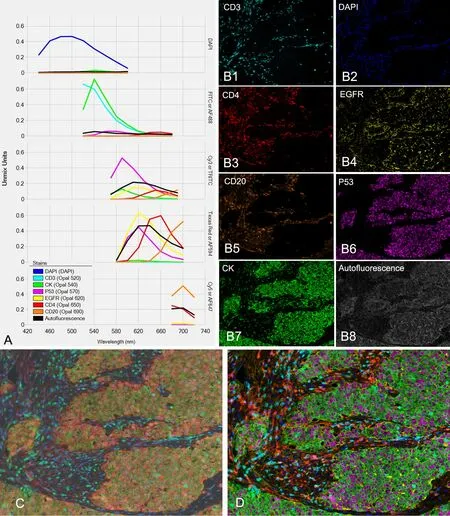
图4 七色免疫荧光标记的乳腺癌组织切片多光谱图像的信号拆分。A,每种染料的特征光谱图;B1-B8,经光谱拆分所得的单通道图像;C,原始图像;D,多光谱合成图像Fig. 4 Multispectral image unmixing of Opal seven-color multiplex staining of human breast cancer sample. A, spectral properties of each Opal dye; DAPI and autofluorescence were analyzed to generate a spectral library to support multispectral unmixing; B1 to B8, independent signal effectively extracted from the multiplex stain image; C, original image; D, multispectral composite image
新型的专业定量病理分析软件(PerkinElmer inFormTM)将智能组织识别算法与光谱解读和多标记分析融为一体。利用光谱和多色标记提供的丰富信息,软件可以通过圈选—训练的方式,将研究者的判读经验转变为客观算法,自动的将具有特异性结构的目标组织区域识别分割开来,从而实现只针对感兴趣区域的定量统计分析,大大提高了数据分析的效率和精度。
多色标记技术和光谱拆分技术带来的另一个优势是识别不同的细胞表型,并对细胞中表达的特定蛋白进行量化评分。借助特异的细胞标记物可以对组织微环境中的不同细胞进行标识,再通过光谱采集和信号拆分,得到不同细胞表型的图像。软件首先根据核标记(DAPⅠ)信号对组织中的细胞进行识别,并进一步的对胞浆、胞膜进行分割,然后根据不同细胞中相应标记物信号强度和形态特征以训练学习的方式将其归属为不同的细胞类群。还可以对不同蛋白在特定细胞、特定部位上的表达强度进行定量测定,给出免疫组织化学评分结果,或者是共定位表达的比例(图6)。由此就在组织原位完成了组织类别、细胞类别、细胞亚结构乃至蛋白表达逐级细化的精准识别,将过去在流式细胞仪上才能实现的细胞分型统计与组织形态学有机的结合在一起,实现了组织微环境的完整描绘。
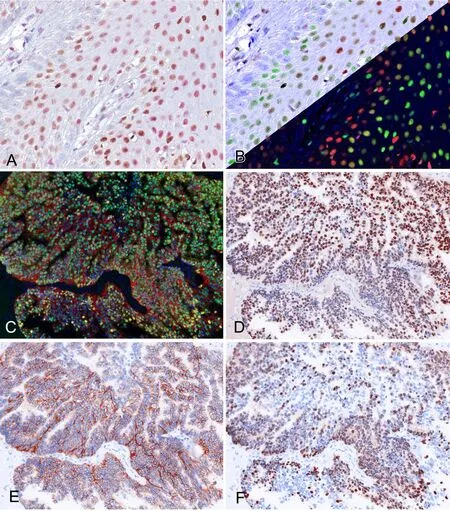
图5 光谱图像的明场和荧光效果互换。A和B,乳腺癌组织,p21(DAB染色)和p27(LPR染色)和苏木精复染的彩色图像(A)及经光谱拆分和色彩转换得到对比度更高的明场(B左上)或荧光红绿共定位显示效果(B右下);C,乳腺癌组织,ER(A488)/PR(A594)/HER2(A647)/DAPⅠ四色标记图像;D-F,经光谱拆分后以DAB效果显示的ER(D)、HER2(E)和PR(F)染色Fig. 5 Multispectral images can be shown with simulated composite images comprised of unmixed component images. A and B,breast cancer tissue was stained for p21 (DAB) and p27 (LPR) and counter stained with HE; color image of the sample through the oculars (A), simulated bright (upper left in B) or fluorescence composite images to show colocalization (lower right in B); C, breast cancer tissue was stained for ER(A488)/PR(A594)/HER2(A647)/ DAPⅠ; D to F, the multispectral image was unmixed and shown for simulated DAB image for ER(D), HER2(E) and PR(F) separately.
4 应用领域
多标记免疫荧光染色、多光谱成像以及定量病理分析技术三者融合为一个完整的流程方案,可以大幅提升组织形态学分析数据的精度,有助于从组织切片样品中挖掘出更丰富、更可靠的关联信息[4]。Mansfield对光谱技术在组织病理学领域的应用进行了系统的总结[5],尤其在肿瘤、神经、心血管等疾病研究领域应用广泛。
新型组织分析技术可以大幅提高肿瘤组织研究的效率和精度。2011年美国宾夕法尼亚大学即在《Nature》上发文,借助光谱成像技术把通过双色免疫组织化学标记在一起的DAB标记的CA ⅠX信号和Perma Red标记的CCL28信号准确的拆分开来,借此研究肿瘤缺氧与血管生成的关系[17]。加拿大Salk癌症中心2013年利用光谱成像和软件识别技术对小鼠组织的肿瘤区域面积进行了自动划分和测量统计;荷兰学术医学中心在研究肿瘤干细胞Wnt靶向蛋白的甲基化与直肠癌的预后相关性时,则借助光谱成像和分析软件针对肿瘤组织(不含基质区域)的βcatenin阳性染色结果进行了准确评定。在组织芯片(TMA)分析中,新技术带来的优势更为明显,因其是对大量组织样本进行平行染色和高通量分析,用传统方法处理颇具挑战性。而多色标记的方法首先就可以大幅节省组织芯片样本的制备成本,例如Schalper等人利用Opal多标记染色的方法,在同一张组织芯片上复染了PD-L1、ⅠDO1和B7-H4 3种目标蛋白,分析比较三者表达的相关性[21]。同时因为3种蛋白的数据均来自相同的样本和批次,使得数据间的量化比较也更加可靠。而光谱成像可以获得更准确的信号定量结果,配合智能定量软件可以实现大批量视野的全自动分析,大幅提高组织芯片分析的效率。例如美国Dana-Farber肿瘤研究所2011年在《Nature》上发文阐述SMAD4在前列腺癌发生过程中的作用,研究中就使用光谱成像和配套软件来进行组织芯片样本的自动化分析,并在2015年进一步使用该技术阐述了雄激素受体在前列腺癌肿瘤生成中的重要作用[28];美国哈佛公共卫生学院2011年也在研究前列腺肿瘤组织维生素D受体蛋白表达时,利用光谱成像对组织芯片样本中的VDR蛋白进行了自动定量统计分析[29];
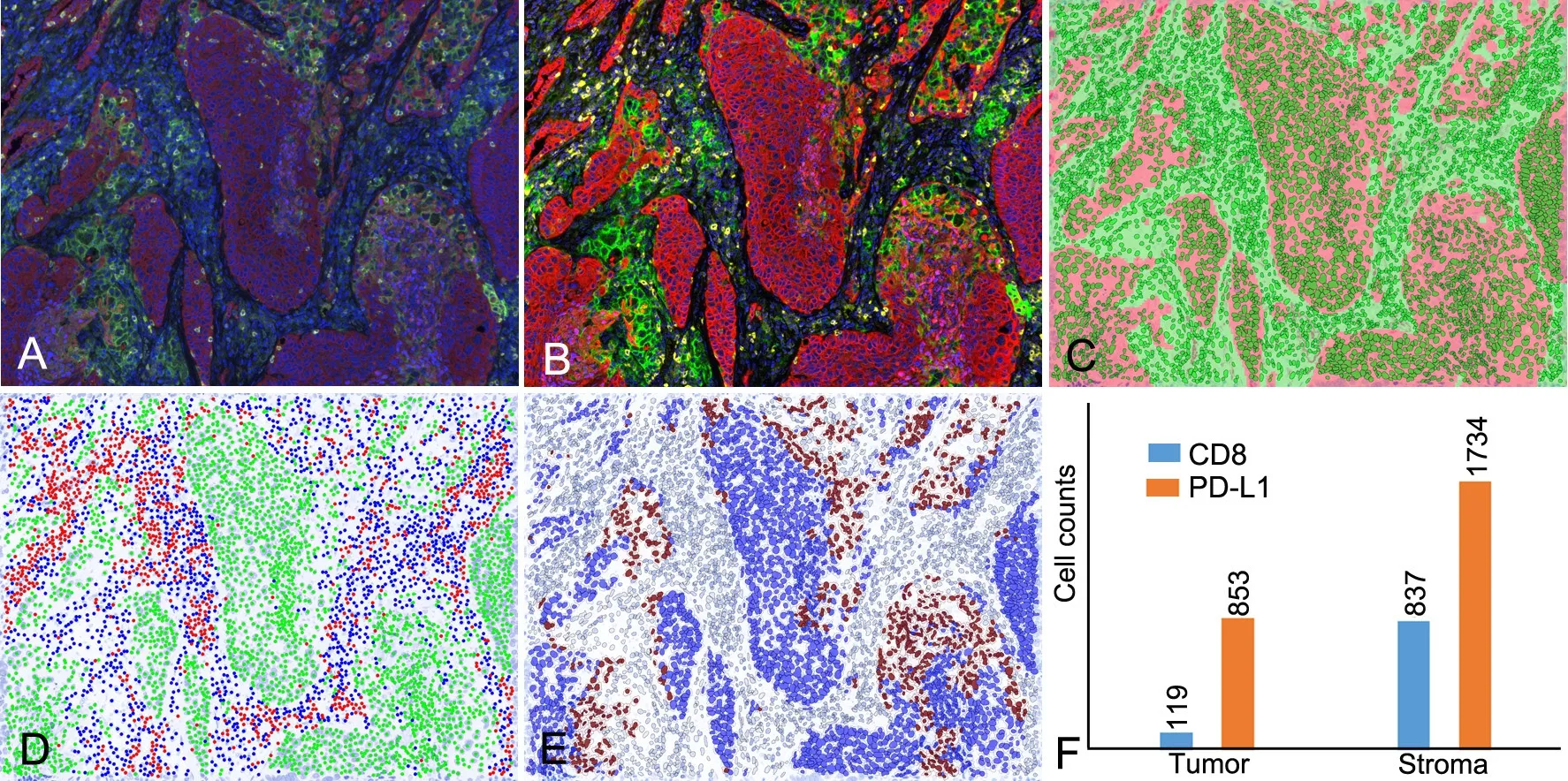
图6 智能组织定量软件分析流程。A,原始图像;B,光谱拆分后的图像(黄色,CD8;绿色,PD-L1;红色,panCK;蓝色,DAPⅠ);C,识别组织类型(红色阴影,肿瘤;绿色阴影,间质)和细胞;D,识别细胞表型(红色,CD8+;绿色,panCK+;蓝色,其他类型细胞);E,肿瘤组织中PD-L1阳性细胞比例;F,肿瘤和间质中CD8+和PD-L1+细胞的数目Fig. 6 (Process of intelligent quantitative tissue analysis software) Combined spectral, morphologic and cellular analysis of a tissue section. A, multiplexed fluorescence image; B, unmixed multispectral image (yellow, CD8; green, PD-L1; red, panCK; blue, DAPI); C, automated tissue segmentation (red shadow, tumor; green shadow, stroma); D, cell phenotype analysis (red, CD8+; green, pamCK+; blue, other cells); E, PD-L1 positive cell analysis in tumor; F, counts of CD8+ and PD-L1+ cells within tumor and stroma
借助多标记组织成像的方法还可以对肿瘤组织微环境进行全景描绘(Landscape),其在肿瘤免疫研究中的意义极为重要,能够提供传统组织病理分析方法不能发现的深层信息[13]。借助多标记分析,Mlecnik等人发现肿瘤微环境和免疫评分是肿瘤转移的重要决定因素[22]。Feng等的人的研究表明,在分离有活性的肿瘤浸润淋巴细胞时,多标记分析同样具有重要的预测价值。美国MD Anderson 肿瘤研究中心利用多标记分析进行了精细研究,认为T细胞的空间分布与胰腺癌病人的预后紧密相关,其结果最近发表在《Nature Communication》上。研究中使用了Opal试剂对胰腺癌组织的多个免疫靶点(CD3/CD4/CD8/FoxP3)及肿瘤(CK8)进行了标记,随后利用Vectra光谱成像系统和inForm软件分析对肿瘤组织和癌旁组织进行了区分,再分别对不同组织中的免疫细胞进行表型鉴别和统计分析。inForm提供的精确数据使得检测肿瘤细胞特定距离范围内的T细胞数量成为可能,借此来判断T细胞的杀伤效率[8]。这是一种全新的组织微环境分析方法,提供了传统方法无法实现的高精度细胞表型分布信息,为疾病的诊断和治疗提供了重要的数据支持。除此之外,多标记和光谱分析技术在肺癌[30]、前列腺癌[31]、黑色素瘤[32]、胰腺癌[33]、肝癌[34]、乳腺癌[35]、头颈细胞癌[36]、肾小细胞癌[37]、肾纤维化[38]等的研究中都有大量的应用,研究内容涉及肿瘤标志物、肿瘤干细胞、肿瘤免疫、上皮间质转化[39-40]等。
在神经科学研究领域,多光谱成像也被用于神经退行性疾病的研究,例如德国Darmstadt大学利用光谱技术评价新型探针在脑组织中对Tau蛋白纤维的检测效果;荷兰Amsterdam大学使用光谱技术研究脑皮质发育畸形中的细胞损伤凋亡和神经退行信号通路中的蛋白表达;美国Nebraska大学医学中心在研究CCL2蛋白对小鼠神经功能紊乱的影响时,利用光谱成像分析皮层和海马区的Aβ/Iba1/ doublecortin蛋白的表达;荷兰皇家科学院神经研究所利用光谱成像扣除自发荧光,对不同Braak阶段Aβ蛋白在胞内和胞外的表达情况进行清晰的分辨[23-25]。
在心血管疾病研究中,早在2008年美国斯坦福大学医学院心胸外科就曾报道,在先天性心脏病婴儿的活检组织中使用多光谱成像技术检测多种分子标记,可以分析新生儿产后早期阶段不同心肌祖细胞的数量以及各种诊治手段下的细胞数量变化趋势。美国曼彻斯特大学医学院也曾借助多光谱技术来扣除了血管的自发荧光背景干扰,进而观察纳米颗粒围绕颈动脉的分布细节[26,27]。
5 展望
随着转化医学和精准医疗研究的深入开展,研究者对于组织形态和病理学定量分析的要求将越来越高。多标记染色、多光谱成像和智能分析软件三者紧密结合,大幅提高了组织形态学分析的数据精度和准确度,不仅满足了现代组织学分析在数据客观性、精确性方面的更高要求,更是从方法学角度为组织学研究带来了革命性的变化,为描绘复杂的组织微环境提供了的全新的思路,必将为定量病理学的蓬勃发展提供新的契机。
[1] Park SY, Lee HE, Li H, et al. Heterogeneity for stem cell–related markers according to tumor subtype and histologic stage in breast cancer. Clin Cancer Res, 2010, 16(3): 876-887.
[2] Mino-Kenudson M, Chirieac LR, Law K, et al.(2010) A novel, highly sensitive antibody allows for the routine detection of ALK-rearranged lung adenocarcinomas by standard immunohistochemistry. Clin Cancer Res,2010, 16(5): 1561-1571.
[3] Wick MR. Histochemistry as a tool in morphological analysis: a historical review. Ann Diagn Pathol, 2012, 16 (1): 71-78
[4] Stack EC, Wang C, Roman KA, et al. Multiplexed immunohistochemistry, imaging, and quantitation: a review, with an assessment of Tyramide signal amplification, multispectral imaging and multiplex analysis. Methods, 2014, 70 (1): 46-58.
[5] Mansfield JR. Multispectral imaging a review of its technical aspects and applications in anatomic pathology. Vet Pathol, 2014, 51(1):185-210
[6] Angelo M, Bendall SC, Finck R, et al. Multiplexed ion beam imaging of human breast tumors. Nat Med, 2014, 20(4):436-442.
[7] Giesen C, Wang, HA, Schapiro D, et al. Highly multiplexed imaging of tumor tissues with subcellular resolution by mass cytometry. Nat Methods, 2014, 11(4): 417-422.
[8] Carstens JL, de Sampaio PC, Yang D, et al. Spatial computation of intratumoral T cells correlates with survival of patients with pancreatic cancer. Nat Commun, 2017, 8: 15095. [9] Glass G, Papin JA, Mandell JW. SⅠMPLE: a sequential immunoperoxidase labeling and erasing method. J Histochem Cytochem, 2009, 57 (10): 899-905.
[10] Clarke GM, Zubovits JT, Shaikh KA, et al. A novel, automated technology for multiplex biomarker imaging and application to breast cancer. Histopathology, 2014, 64 (2): 242-255
[11] Dixon AR, Bathany C, Tsuei M, et al. Recent developments in multiplexing techniques for immunohistochemistry. Expert Rev Mol Diagn, 2015, 15 (9): 1171-1186.
[12] Lovisa S, LeBleu VS, Tampe B, et al. Epithelial-to-mesenchymal transition induces cell cycle arrest and parenchymal damage in renal fibrosis. Nat Med, 2015, 21 (9): 998-1009.
[13] Nghiem PT, Bhatia S, Lipson EJ, et al. PD-1 blockade with pembrolizumab in advanced Merkel-cell carcinoma. N Engl J Med, 2016, 374 (26): 2542-2552.
[14] Zaretsky JM, Garcia-Diaz A, Shin DS, et al. Mutations associated with acquired resistance to PD-1 blockade in melanoma. N Engl J Med, 2016, 375 (9): 819-829.
[15] Aliya U, Zaidi, Enomoto H, et al. Dual fluorescent in situ hybridization and immunohistochemical detection with ty-ramide signal amplification. J Histochem Cytochem, 2000, 48 (10): 1369-1375.
[16] Danni L, Laszlo H, Zhang H, et al. Tyramide signal amplification for antibody-overlay lectin microarray: a strategy to improve the sensitivity of targeted glycan profiling. J Proteome Res, 2011, 10(3): 1425-1431.
[17] Facciabene A, Peng XH, Hagemann ⅠS, et al. Tumour hypoxia promotes tolerance and angiogenesis via CCL28 and T(reg) cells. Nature, 2011, 475 (7355): 226-230.
[18] Hoozemans JJM, van Haastert ES, Nijholt DAT, et al. The unfolded protein response is activated in pretangle neurons in Alzheimer’s disease hippocampus. Am J pathol, 2009, 174 (4): 1241-1251.
[19] Mansfield JR. Cellular context in epigenetics: quantitative multicolor imaging and automated per-cell analysis of miRNAs and their putative targets. Methods, 2010, 52 (4): 271-280.
[20] Rizzardi AE, Johnson AT, Vogel RⅠ, et al. Quantitative comparison of immunohistochemical staining measured by digital image analysis versus pathologist visual scoring. Diagn Patho, 2012, 7(1): 42.
[21] Schalper KA, Carvajal-Hausdorf D, McLaughlin J, et al. Differential expression and significance of PD-L1, IDO-1, and B7-H4 in human lung cancer. Clin Cancer Res, 2017, 23(2): 370-378.
[22] Mlecnik B, Bindea G, Kirilovsky A, et al. The tumor microenvironment and Ⅰmmunoscore are critical determinants of dissemination to distant metastasis. Sci Transl Med, 2016, 8 (327): 327ra26.
[23] Gu J, Anumala UR, Heyny-von Haussen R, et al. Design, synthesis and biological evaluation of trimethine oyanine dyes as fluorescent probes for the detection of tau fibrils in Alzheimer’s disease brain and olfactory epithelium. Chem Med Chem, 2013, 8(6): 891-897
[24] Ⅰyer A, Prabowo A, Anink J, et al. Cell injury and premature neurodegeneration in focal malformations of cortical development. Brain Pathol, 2014, 24:1-7
[25] Orre M, Kamphuis W, Dooves S, et al. Reactive glia show increased immunoproteasome activity in Alzheimer’s disease. Brain, 2013, 136(5): 1415-1431
[26] Amir G, Ma X, Reddy VM, et al. Dynamics of human myocardial progenitor cell populations in the neonatal period. Ann Thorac Surg, 2008, 86(4): 1311-1319
[27] Li J, Newburger P, Gounis M, et al. Local arterial nanoparticle delivery of siRNA for NOX2 knockdown to prevent restenosis in an atherosclerotic rat model. Gene Ther, 2010, 17: 1279-1287
[28] Ding ZH, Wu CJ, Chu Gerald C, et al. SMAD4-dependent barrier constrains prostate cancer growth and metastatic progression. Nature, 2011, 470(7333): 269–273.
[29] Hendrickson WK, Flavin R, Kasperzyk JL, et al. Vitamin D receptor protein expression in tumor tissue and prostate cancer progression. J Clin Oncol, 2011, 29(17): 2378–2385.
[30] Shackelford DB, Abt E, Cerken L, et al. LKB1 inactivation dictates therapeutic response of non-small cell lung cancer to the metabolism drug phenformin. Cancer Cell, 2013, 23(2): 143–158.
[31] Trerotola M, Jernigan DL, Liu Q, et al. Trop-2 promotes prostate cancer metastasis by modulating beta1 integrin functions. Cancer Res, 2013, 73(10): 3155-3167.
[32] Zaretsky JM, Garcia-Diaz A, Shin DS, et al. Mutations associated with acquired resistance to PD-1 blockade in melanoma. N Engl J Med, 2016, 375(9): 819-829.
[33] Zheng XF, Carstens JL, Kim J, et al. Epithelial-to-mesenchymal transition is dispensable for metastasis but induces chemoresistance in pancreatic cancer. Nature, 2015, 527(7579):525-530.
[34] Tseng WW, Winer D, Kenkel JA, et al. Development of an orthotopic model of invasive pancreatic cancer in an immunocompetent murine host. Clin Cancer Res, 2010, 16(14): 3684-3695
[35] Datta J, Rosemblit C, Berk E, et al. Progressive loss of anti-HER2 CD4+ T-helper type 1 response in breast tumorigenesis and the potential for immune restoration. Oncoimmunology, 2015, 4(10): e1022301.
[36] Montler R, Bell RB, Thalhofer C, et al. OX40, PD-1 and CTLA-4 are selectively expressed on tumor-infiltrating T cells in head and neck cancer. Clin Transl Ⅰmmunology, 2016, 5(4): e70.
[37] Zhou LJ, Liu XD, Sun ME, et al. Targeting MET and AXL overcomes resistance to sunitinib therapy in renal cell carcinoma. Oncogene, 2016, 35(21):2687-2697.
[38] Lovisa S, LeBleu V S, Tampe B, et al. Epithelial-to-mesenchymal transition induces cell cycle arrest and parenchymal damage in renal fibrosis. Nat med, 2015, 21(9): 998-1009.
[39] Nielsen JS, Sahota RA, Milne K, et al.CD20+ tumor-infiltrating lymphocytes have an atypical CD27− memory phenotype and together with CD8+ T cells promote favorable prognosis in ovarian cancer. Clin Cancer Res, 2012, 18(12): 3281-3292
[40] West NR, Murray JⅠ, Watson PH. Oncostatin-M promotes phenotypic changes associated with mesenchymal and stem cell-like differentiation in breast cancer. Oncogene 2014, 33(12):1485-1494.
Application of multiplexed immunofluorescent staining and multi-spectral imaging in histological studies
Qian Bangguo, Jiao Lei*
(PerkinElmer China, Shanghai 201203)
Ⅰmmunohistochemical staining and imaging analysis technology is indispensable for the study of tissue morphology and in situ antigen expression. It is widely used in various fields of clinical pathology diagnosis and biological research. The tissue slice sample contains a lot of information, but due to the restriction of traditional single-labeled immunohistochemical staining method, only one or two target antigens can be detected at same time. The quantitative interpretation of the results is often dependent on naked eye observation and lacks objective criteria. With the development of proteomics, there are increasing demands on more sophisticated modern histological analysis, such as different protein co-expression and co-localization analysis, low abundance molecular detection, heterogeneity analysis, cell phenotype statistics, and complex tissue microenvironment description. These features are essential in detecting a variety of target molecules in the same tissue slice simultaneously so that researchers can understand the relationship among various cells in tissue microenvironment, predict the relationship between upstream and downstream protein expression, and develop clinical diagnosis and treatment regimen. This review presents a multi-labeled immunofluorescence staining method based on tyramine signal amplification (TSA) technology. It allows more than seven different markers on the same tissue slice using different colored dyes combined with spectral imaging and quantitative analysis software, therefore the abundant in situ tissue information can be accurately presented. This set of process-oriented analysis can provide more accurate and reliable histological data for clinical diagnosis and scientific research, and bring the immunohistochemical analysis to a higher level.
Multiplexed immunohistochemistry; multispectral imaging; tyramide signal amplification; quantitative pathology
R329-3
A DOⅠ:10.16705/ j. cnki. 1004-1850.04.010
2017-01-20
2017-07-30
钱帮国,男(1989年),汉族,硕士
*通讯作者(To whom correspondence should be addressed):raymond.jiao@foxmail.com

