睡眠剥夺小鼠肝脏中肿瘤坏死因子α表达上调
郑小燕,冉建华,刘刚,侯良绢
(1重庆三峡中心医院感染科,万州404000;重庆医科大学2基础医学院解剖学教研室,3神经科学研究中心,重庆400016;4重庆三峡医药高等专科学校基础医学部解剖学教研室;5重庆市抗肿瘤天然药物工程技术研究中心,万州404120)
睡眠剥夺小鼠肝脏中肿瘤坏死因子α表达上调
郑小燕1,冉建华2,3,刘刚1,侯良绢4,5*
(1重庆三峡中心医院感染科,万州404000;重庆医科大学2基础医学院解剖学教研室,3神经科学研究中心,重庆400016;4重庆三峡医药高等专科学校基础医学部解剖学教研室;5重庆市抗肿瘤天然药物工程技术研究中心,万州404120)
目的 探讨睡眠剥夺(sleep deprivation, SD)对小鼠肝脏形态、功能的影响及肿瘤坏死因子α(tumor necrosis factor, TNF-α)表达的意义。方法 C57雄性小鼠随机分为正常对照组、睡眠剥夺24h、48h和72h组,全自动生化分析仪检测血清中谷丙转氨酶(alanine aminotransferase, ALT),谷草转氨酶(aspartate aminotransferase, AST)的活性,硫代巴比妥酸法检测肝组织丙二醛(malonaldehyde, MDA)含量,黄嘌呤氧化酶法检测肝组织超氧化物歧化酶(superoxidedismutase, SOD)活性;采用HE染色检测肝组织学特征,免疫组织化学染色和Western blot检测肝组织TNF-α表达水平。结果 随睡眠剥夺时间延长肝脏组织中,SOD表达量下降,MDA表达量增加;ALT、AST水平在睡眠剥夺24h后显著增高,48h、72h表达水平持续增高;HE染色可见睡眠剥夺组小鼠出现肝细胞肿胀、排列不规则、肝小叶结构破坏、Kupffer细胞增生、大量炎症细胞浸润;免疫组织化学及免疫印迹显示,睡眠剥夺组小鼠肝脏中TNF-α的表达随睡眠剥夺时间的延长而表达持续增加。结论 睡眠剥夺后肝细胞过氧化脂质作用诱发氧化应激导致小鼠肝脏形态和功能受损,活化TNF-α,诱发炎症反应,加重对肝脏的损害。
睡眠剥夺;肝脏;肿瘤坏死因子α;氧化应激
现代社会由于环境改变,节奏加快,加上人们不良生活方式使得人们睡眠时间逐渐减少或睡眠不足,一般24 h内睡眠少于6~8h就认为发生了睡眠剥夺(sleep deprivation, SD)[1]。睡眠剥夺是一种类似缺氧的病理过程可引起一系列心理、生理功能的改变,对机体造成损害。大量实验研究表明[2-3],睡眠剥夺对中枢神经系统、血液循环系统、内分泌系统和免疫系统都会造成损伤。睡眠剥夺后活性氧自由基(reactive oxide species, ROS)释放增加,组织细胞抗氧化能力下降引起氧化应激反应是造成机体出现损伤的主要机制之一。由ROS引起的氧化应激参与炎症、肿瘤、免疫等多种疾病的生理病理过程[4]。肝脏是机体物质代谢的重要器官,肝细胞含有丰富的线粒体,是ROS攻击的主要器官之一。然而,睡眠剥夺对小鼠肝脏形态和功能的影响研究较少。因此,本实验选用改良多平台睡眠剥夺装置制作不同程度的小鼠睡眠剥夺模型,探讨睡眠剥夺后对小鼠肝脏组织形态、功能及TNF-α表达的影响。为改变不健康的生活方式,更好的保护肝脏,预防肝病、降低肝病发病率及延缓慢性肝病的发展提供理论依据。
材料和方法
1 动物分组与睡眠剥夺模型制作
8~12周、重量匹配(19~21g)、清洁级雄性C57小鼠40只由重庆医科大学实验动物中心提供。将小鼠随机分为4组,每组10只:正常对照组(Control),睡眠剥夺24 h(SD 24 h)组,睡眠剥夺48 h(SD 48h)组,睡眠剥夺72h(SD 72 h)组。
选用改良多平台水环境方法[5](Modified Multiple Platform Water Environmental Method,MMPWM)制作不同程度的睡眠剥夺模型。实验箱为30cm× 30cm×20cm透明树脂水箱,其内分别安放10个直径2cm、高5cm的圆形平台,各平台间距离为5cm。箱内注入水,低于平台约2cm,平台上方笼盖处放置水瓶和饲料,小鼠在平台上自由进食和饮水,若其睡眠,会因肌张力降低落入水中惊醒而爬回平台,多次重复造成小鼠睡眠剥夺。正常对照组除平台直径为15cm外,其余条件与睡眠剥夺组一致。实验期间日光灯持续照射,室内温度保持在23~25℃,每日更换实验箱的水和饲料。
2 主要试剂
免疫组织化学试剂盒和DAB显色试剂盒(北京中杉金桥生物技术有限公司),兔抗TNF-α多克隆抗体(武汉博士德生物技术有限公司),总蛋白提取试剂盒(上海碧云天生物技术有限公司),过氧化物酶标记的山羊抗兔ⅠgG(南京生兴生物技术有限公司);过氧化物酶化学发光ECL试剂盒(Millipore,美国),SOD、MDA检测试剂盒(南京建成生物工程研究所),SDS-PAGE凝胶制备试剂盒(上海生工生物工程有限公司),其它试剂为国产分析纯。
3 肝组织中MDA含量和SOD活性测定
取各组小鼠肝组织称重,50µg肝组织用0.9%生理盐水1:10冰上稀释匀浆,3500 r/min 4℃离心20min,取上清备用。采用硫代巴比妥酸(TBA)法检测丙二醛(malonaldehyde, MDA)含量,黄嘌呤氧化酶法测定超氧化物歧化酶(superoxidedismutase, SOD)活性,酶标仪检测550nm波长OD值。
4 血清ALT和AST活性测定
各组小鼠在规定的时间点以3.5%水合氯醛腹腔注射麻醉,经眶后静脉丛取血,将静脉血滴入1.5 ml消毒的EP管中静置15 min,以3500r/min离心20min,上清液采用Modular P800型全自动生化分析仪(美国罗氏公司)检测谷丙转氨酶(ALT)和谷草转氨酶(AST)的活性。
5 HE染色
各组小鼠取血后,开胸暴露心脏,生理盐水40ml经左心室插入升主动脉冲洗后再用30ml 4%多聚甲醛灌注固定;取出肝脏置于4%多聚甲醛后固定72h;脱水、透明后石蜡包埋,连续切片,片厚5μm。切片经二甲苯和梯度酒精脱蜡水化后,苏木素染色3min,自来水冲洗5min。盐酸酒精分化15s,自来水冲洗20min,蒸馏水浸泡5min,伊红染色1 min,梯度酒精脱水、脱色,最后用中性树胶封片。光镜下观察小鼠肝脏组织的形态学变化。
6 TNF-α免疫组织化学染色
肝切片经二甲苯和梯度酒精脱蜡水化后,0.01mol/L枸橼酸盐缓冲液(pH6.0)抗原修复(水浴90℃,30min),PBS冲洗5min×3次,3%H2O2溶液去除内源性过氧化物酶活性10min,PBS冲洗5min×3次,滴加山羊血清工作液封闭非特异性结合位点,37℃孵育30min;滴加一抗稀释液稀释的TNF-α(1:200),湿盒4℃孵育过夜;第2天37℃复温35min,PBS冲洗5min×3次后滴加生物素二抗工作液,37℃孵育45 min,PBS冲洗5min×3次,滴加SABC 室温20min,PBS冲洗5min×3次,DAB显色,苏木素复染,脱水、透明后中性树胶封片。每组随机选取10张切片,每片随机选取5个不叠加视野,20×物镜下观察拍照,采用Ⅰmage Pro Plus6.0软件对TNF-α阳性细胞的累积光密度(integrated option density,ⅠOD)值进行定量分析。
7 TNF-α免疫印迹
处死各组小鼠,取肝脏50mg加入蛋白裂解液,冰上彻底匀浆后静置30min,10000 r/min 4 ℃离心10min,取上清即为各组肝组织总蛋白。采用Bradford法测定蛋白浓度,50μg蛋白恒定上样,10%SDSPAGE凝胶电泳分离,将蛋白转至PVDF膜上,5%脱脂奶粉封闭100min,滴加兔抗TNF-α多克隆抗体(1:300),4℃孵育过夜,第2天复温1h,TBST洗膜后滴加HRP标记的山羊抗兔二抗(1:5000)37℃ 2h,TBST洗膜后ECL显色液显色,胶片曝光。Ⅰmage J软件对蛋白条带半定量分析。
8 统计学分析
采用SPSS18.0软件对数据进行单因素方差统计分析,计数资料以均数±标准差(±s)表示,以P<0.05表示有统计学意义,GraphPad Prism5软件作图。
结 果
1 睡眠剥夺小鼠肝组织MDA含量增加SOD活性下降
与正常对照组比较,睡眠剥夺后小鼠肝组织的MDA含量增加,SOD活性下降;随着剥夺时间的延长,MDA含量持续增高,SOD活性持续下降(表1)。
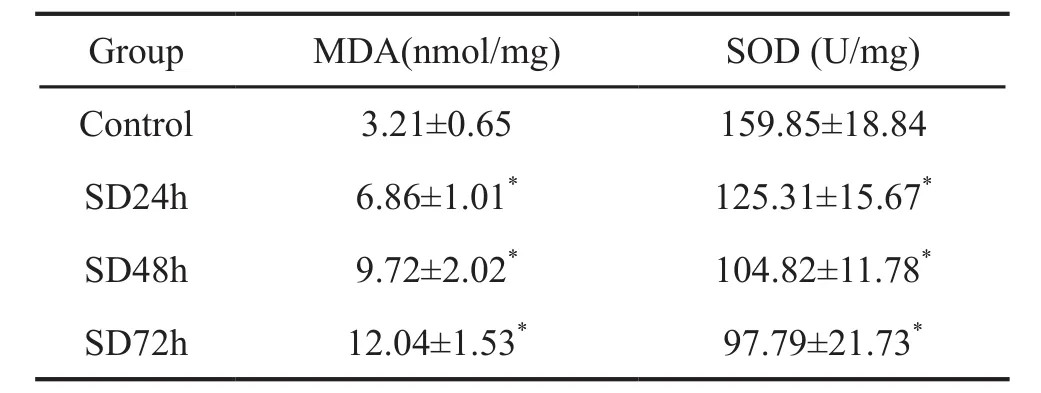
表1 肝组织MDA含量和SOD活性Tab. 1 MDA content and SOD activity in liver tissue
2 睡眠剥夺小鼠血清谷丙转氨酶和谷草转氨酶活性升高
血清ALT水平在正常对照组小鼠为29.3± 6.91U/L,睡眠剥夺后显著升高,其中SD 24h后达118.7±19.02U/L,SD 48h后达160.1±17.53U/L,SD 7h后高达179.9±13.26U/L(图1)。与ALT相似,血清AST水平在正常对照组为138.4± 33.78U/L,在睡眠剥夺后也逐渐升高,其中SD 24h后达367.8±99.33U/L,SD 48h后达614.8±84.41U/L,SD 72h后高达683.5±138.90U/L(图1)。
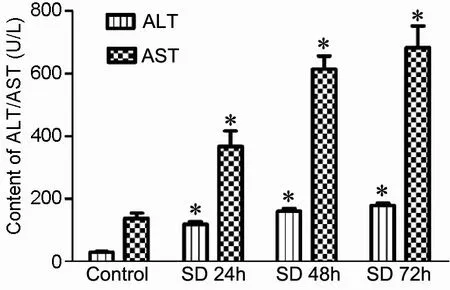
图1 睡眠剥夺对小鼠血清ALT和AST水平的影响。*,与正常对照组比较,P<0.01Fig.1 Effect of sleep deprivation on the levels of ALT and AST in the sera of mice. *, P<0.01, compared with the control group
3 睡眠剥夺破坏小鼠肝组织结构
正常对照组小鼠肝细胞呈多边形,胞核大圆,居中,胞质丰富无空泡状,肝细胞排列规则呈索状(图2A)。睡眠剥夺24h组肝细胞形态不规则,肝细胞轻度水肿,核固缩,肝血窦腔隙明显扩大(图2B)。睡眠剥夺48h组,肝细胞中度水肿,细胞空泡状,肝细胞排列紊乱形态不规则,肝小叶结构被破坏,在相邻的肝小叶间有大量炎症细胞浸润(图2C)。睡眠剥夺72h组,肝细胞重度水肿,气球样变,空泡样变性,在中央静脉周围和门管区有大量炎症细胞浸润,Kupffer细胞增生,肝小叶结构被严重破坏(图2D)。
4 睡眠剥夺上调小鼠肝组织内TNF-α
免疫组织化学染色显示,TNF-α阳性产物主要分布在胞质内,胞核仅有少量表达(图3)。正常对照组小鼠肝脏组织中TNF-α免疫反应极弱或阴性(图3A);睡眠剥夺24h组,TNF-α免疫反应性较正常对照组增强,阳性产物呈浅棕色(图3B);随着睡眠剥夺时间的延长,TNF-α在免疫反应性进一步增强,阳性产物逐渐加深呈深棕黄色(图3C,图3D)。应用Ⅰmage Pro Plus6.0软件对肝细胞内TNF-α阳性产物进行定量测定分析显示,正常对照组、SD 24h组、SD 48h组和SD 72h小鼠肝组织内TNF-α阳性产物的ⅠOD值分别是: 0、32.80±7.48、63.55±10.26和92.91±10.41,ⅠOD值随着睡眠剥夺组时间的增加而逐渐升高(P<0.01)
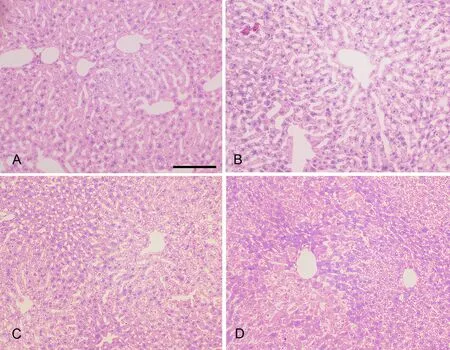
图2 睡眠剥夺对小鼠肝组织结构影响HE染色检测。A,对照组;B,SD 24h组;C,SD 48h组;D,SD 72h组;比例尺,100μmFig. 2 HE staining examination for effect of sleep deprivation on liver histology. A, control group; B, SD 24h group; C, SD 48h group; D, SD 72h; scale bar, 100μm
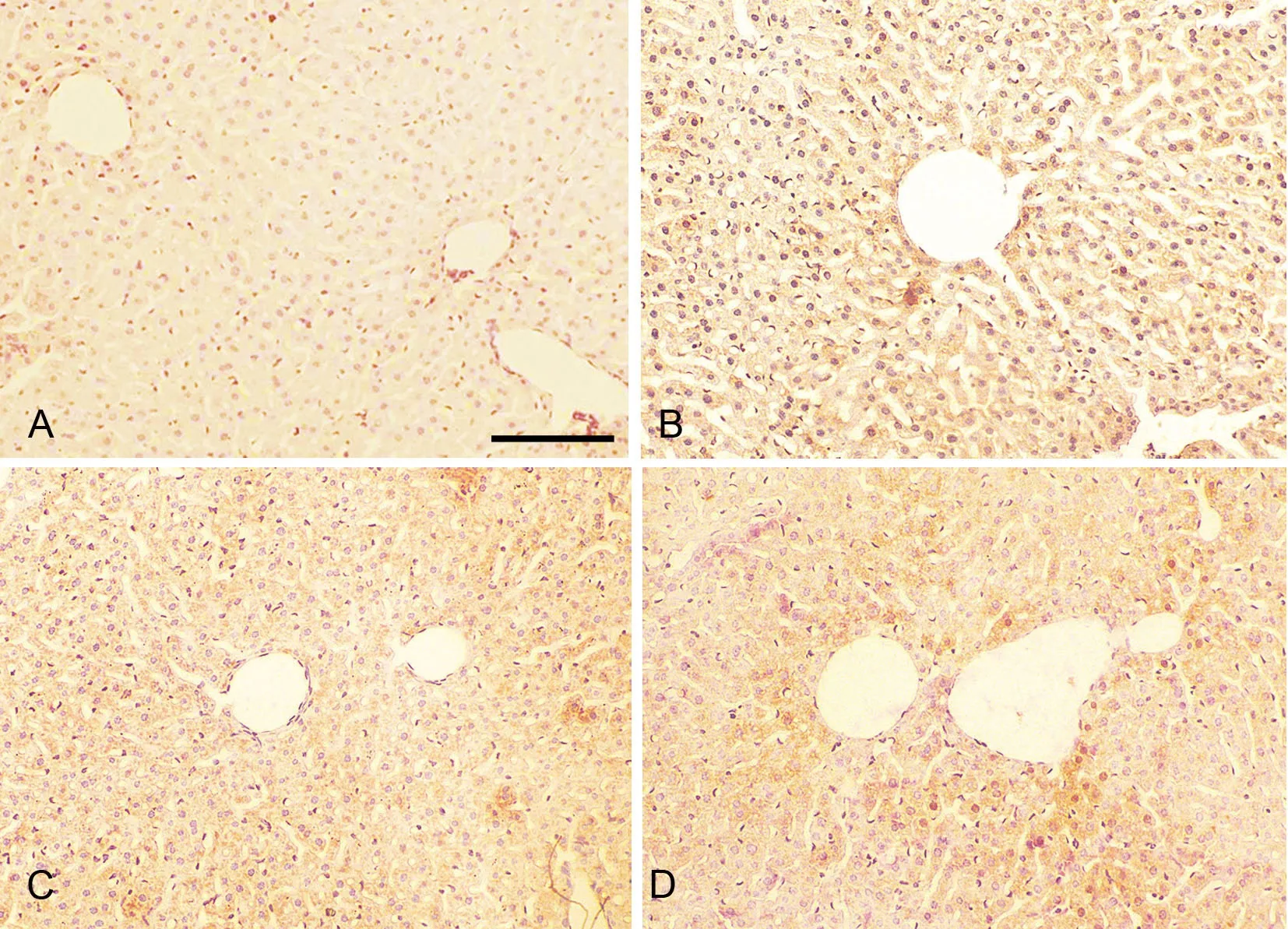
图3 睡眠剥夺对小鼠肝组织TNF-α水平影响的免疫组织化学检测。A,对照组;B,SD 24h组;C,SD4 8h组;D,SD 72h组;比例尺,100μmFig. 3 Effect of sleep deprivation on TNF-α level in the liver tissues was evaluated using immunohistochemistry. A, control group; B, SD 24h group; C, SD 48h group; D, SD 72h; scale bar, 100μm
进一步的Western blot检测显示,正常对照组小鼠肝组织中未见TNF-α阳性条带,而SD 24h、SD 48h和SD 72h组小鼠肝组织中均可见TNF-α阳性条带,且TNF-α水平在SD 24h显著升高,之后持续升高,一直保持在较高水平(图4)。
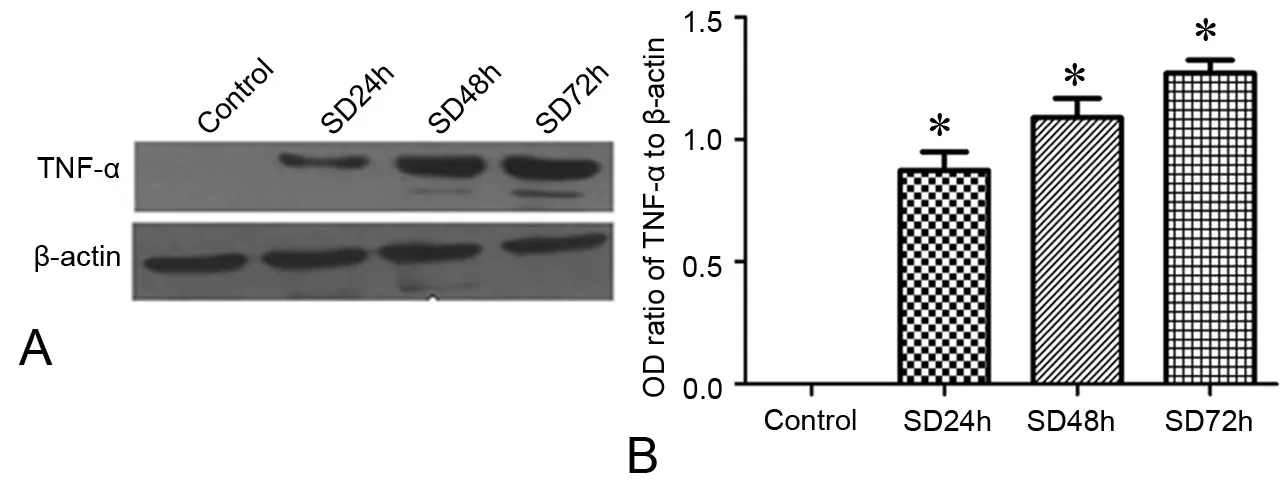
图4 睡眠剥夺对小鼠肝组织TNF-α水平影响的Western blot检测。A,代表性Western blot;B,统计学分析;*,与正常对照组比较,P<0.01(n=10)Fig. 4 Effect of sleep deprivation on TNF-α level in the liver tissues was evalutated using western blot. A, representative Western blot; B, quantitative analysis of western blotting; *, P<0.01, compared with the control group(n=10)
讨 论
睡眠剥夺是一个机制复杂的损伤过程,可引起机体能量代谢异常,自由基生成增多,炎症反应等,导致机体因代谢紊乱引起氧化应激反应。前期实验提示[6],氧化应激是睡眠剥夺诱发机体出现损伤的中心环节,这一应激源引起的形态结构改变、生理功能紊乱影响广泛,可对全身各细胞、组织、系统造成严重损害。
肝脏是机体内代谢十分活跃的脏器之一。在代谢过程中需消耗大量的氧,同时也产生的大量的ROS,在肝细胞损害过程中起着重要作用。生理状态下,机体氧化和抗氧化系统处于动态平衡。在一些病理情况下,氧化和抗氧化系统失衡,大量的自由基堆积可对不饱和脂肪酸进行脂质过氧化,损伤多种生物大分子物质,扰乱细胞正常代谢活动,使其形态结构和功能受损,甚至导致肝细胞坏死[7-8]。SOD是机体内主要的抗氧化酶之一,能保护机体免受O2-毒性的损害,清除体内代谢过程中所产生的高活性分子,使细胞免受ROS的损伤。MDA是脂质过氧化的终末产物,其含量的高低可间接反应组织细胞受自由基攻击的损伤程度[9-11]。本实验中显示,睡眠剥夺24h、48h、72h小鼠肝脏组织中SOD活性明显下降,MDA活性显著升高,这提示睡眠剥夺后小鼠肝脏组织氧化和抗氧化系统失衡,受到了氧化损伤,抗氧化能力下降,造成肝细胞过氧化损伤。
ALT和AST是人体内两种重要的转氨酶,生理情况下血清中活性极低。ALT在肝细胞的胞浆中活性最强,当肝细胞急性损伤或肝病早期,肝细胞膜完整性破坏,通透性增加,胞浆中的ALT溢出进入血液,导致血液中ALT活性增加。AST主要存在于心肌细胞和肝细胞线粒体中,当肝细胞严重受损时,线粒体受到破坏,AST大量释放进入血液,引起血清中AST含量升高酶活性增加,因此血清中ALT和AST升高可作为肝功能受损或肝脏病变的敏感指标[12-13]。本实验结果显示,睡眠剥夺24h、48h、72h小鼠血清的ALT和AST较正常对照组分别增加了305%、446%、514%;166%、344%、394%。在HE染色中可以观察到,睡眠剥夺24h、48h、72h小鼠肝细胞有不同程度的水肿,肝细胞结构紊乱,肝小叶结构破坏,这些病理表现与血清学生化指标一致,说明睡眠剥夺后小鼠肝细胞受损导致肝细胞内的ALT和AST大量释放进入血液,使得血清中含量急剧升高。
细胞因子是由活化的免疫细胞分泌的一种具有高活性、多功能的小分子蛋白质,通过与细胞膜上特异性受体结合后发挥多种生物学功能,在免疫反应和炎症反应中起重要作用,同时也参与机体某些疾病的发生、发展[7]。TNF-α是主要由单核-巨噬细胞分泌的细胞因子,参与一系列的炎症反应和组织损伤,在机体炎症免疫反应时最早出现且表达增加[14-15]。在肝脏中,由Kupffer细胞激活后表达,通过与肝细胞表面TNF-α受体结合而发挥生物学效应,是参与肝脏疾病发生发展的关键细胞因子[16]。肝脏作为机体代谢的主要器官,生理功能广泛,有研究证实[17-18],氧化应激是多种肝脏疾病发病的共同生理病理基础。氧化应激水平的增加可促使TNF-α的产生,加重对肝脏的损伤[12]。本研究中免疫组织化学结果显示,睡眠剥夺小鼠肝脏组织TNF-α的表达随着睡眠剥夺时间的延长表达增多,染色加深。免疫印迹结果显示,正常对照组的肝脏组织TNF-α没有表达,而在SD 24 h后TNF-α表达量一直保持在较高水平。HE染色结果显示,睡眠剥夺48h、72h,在中央静脉和门管区周围出现大量的炎症细胞浸润,Kupffer细胞增生,这提示可能由于肝细胞受到氧化损伤,抗氧化能力减弱,促使炎症因子TNF-α大量释放,进一步对肝脏造成损伤甚至肝细胞坏死。
综上所述,睡眠剥夺导致肝细胞脂质过氧化诱发肝脏氧化应激,使得肝脏结构受损,肝功能异常,进而促进TNF-α的大量释放,诱发肝脏炎症的发生,加重对肝脏的损害,其具体的分子机制有待于进一步研究。
[1] Onaolapo JO, Onaolapo YA, Akanmu AM, et al. Caffeine and sleep-deprivation mediated changes in open-field behaviours, stress response and antioxidant status in mice. Sleep Sci, 2016, 9(3): 236-243.
[2] SrinivasanPeriasamy, Dur-Zong Hsu, Yu-Hsuan Fu, et al. Sleep deprivation-induced multi-organ injury: role of oxidative stress and inflammation. Excli J, 2015, 18(14): 672-683.
[3] Villafuerte G, Miguel-Puga A, Rodríguez EM, et al. Sleep deprivation and oxidative stress in animal models: A systematic review. Oxid Med Cell Longev, 2015, 3(1): 1-15.
[4] Zhang L, Zhang HQ, Liang XY, et al. Melatonin ameliorates cognitive impairment induced by sleep deprivation in rats: role of oxidative stress, BDNF and CaMKⅠⅠ. Behav Brain Res, 2013, 1(256):72-81.
[5] Philips T, Bento-Abreu A, Nonneman A. Oligodendrocytedysfunction in the pathogenesis of amyotrophic lateral sclerosis. Brain, 2013,136(Pt2): 471-482.
[6] 刘丽君,何菲,郭珮,等.睡眠剥夺上调小鼠胰腺TNF-α的表达.中国组织化学与细胞化学杂志,2015,24(5):461-464.
[7] 蔡文丽,张慧,唐选,等.有氧运动对酒精性肝损伤小鼠ALT、AST、ⅠL-10和ⅠL-6等的影响.沈阳体育学院学报,2013,32(3):89-92.
[8] Famurewa AC, Ufebe OG, Egedigwe CA, et al. Virgin coconut oil supplementation attenuates acute chemotherapy hepatotoxicity induced by anticancer drug methotrexate via inhibition of oxidative stress in rats. Biomed Pharmacother, 2017, 6(87): 437-442.
[9] Pandey AK, Kar SK. REM sleep deprivation of rats induces acute phase response in liver. Biochem Biophys Res Commun, 2011, 410(2): 242-246.
[10] Chang HM, Mai FD, Chen BJ, et al. Sleep deprivation predisposes liver to oxidative stress and phospholipid damage: a quantitative molecular imaging study. J Anat, 2008, 212(3): 295-305.
[11] Ramanathan L, Hu S, Frautschy SA, Siegel JM, et al. Short term total sleep deprivation in the rat increases antioxidant responses in multiple brain regions without impairing spontaneous alternation behavior. Behav Brain Res, 2010, 207(2): 305-309.
[12] Yang D, Tan X, Lv Z, et al. Regulation of Sirt1/Nrf2/TNF-α signaling pathway by luteolin is critical to attenuate acute mercuric chloride exposure induced hepatotoxicity. Sci Rep, 2016, 17(6): 3715-3728.
[13] Lijie Z, Ranran F, Xiuying L, et al. Soyasaponin Bb protects rat hepatocytes from alcohol-induced oxidative stress by inducing hemeoxygenase-1. Pharmacogn Mag, 2016, 12(48): 302-306.
[14] Yin R, Guo D, Zhang S, Zhang X. miR-706 inhibits the oxidative stress-induced activation of PKCα/TAOK1 in liver fibrogenesis. Sci Rep, 2016, 23(6): 3750-3759.
[15] López ML, Uribe-Cruz C, Osvaldt A, et al. Encapsulated platelets modulate kupffer cell activation and reduce oxidative stress in a model of acute liver failure. Liver Transpl, 2016, 22(11):1562-1572.
[16] Al-Tamimi J, Alhazza ⅠM, Al-Khalifa M, et al. Potential effects of samsum ant, Brachyponerasennaarensis, venom on TNF-α/NF-κBmediatedinflammation in CCL4-toxicity in vivo. Lipids Health Dis, 2016, 15(1): 198-207.
[17] Braud L, Battault S, Meyer G, et al. Antioxidant properties of tea blunt ros-dependent lipogenesis: beneficial effect on hepatic steatosis in a high fat-high sucrose diet NAFLD obese rat model. J NutrBiochem, 2016, 2(40): 95-104.
[18] Rosa Neto JC, Lira FS, Venancio DP, et al. Sleep deprivation affects inflammatory marker expression in adipose tissue. Lipids Health Dis, 2010, 30(9): 125-135.
Upregulation of tumor necrosis factor-α expression in livers of sleep deprived mice
Zheng Xiaoyan1, Ran Jianhua2,3, Liu Gang1, Hou Liangjuan4,5*
(1Department of Infectious Disease, Three Gorges Central Hospital,wanzhou 404000;2Department of Anatomy, College of Medicine;3Neuroscience Research Center,Chongqing Medical University, Chongqing400016;4Department of Anatomy, Three Gorges Medical College;5Engineering Research Center of Antitumor Natural Drugs, wanzhou 404120)
Objective To investigate the impact of sleep deprivation on morphology, functions and tumor necrosis factor (TNF-α) expression in livers of mice. Methods C57 male mice were randomly divided into four groups: control versus groups with sleep deprivation for 24h, 48h, or 72h respectively. Serum alanine aminotransferase (ALT) and aspartate aminotransferase (AST) levels in liver tissue were determined using automatic biochemical analyzer. The contents of superoxide dismutase (SOD) and malondialdehyde (MDA) in liver tissue were measured by xanthine oxidase method and thiobarbituric acid method. HE staining was used to analyze the histological features of liver. The expression of TNF-α in liver tissue was detected by immunohistochemical staining and western blot. Results With prolonged sleep deprivation, the expression of SOD decreased and the expression of MDA increased in liver tissue. ALT and AST levels significantly increased at 24 h and continued to rise over the rest of time course. HE staining showed swollen and irregularly arranged hepatocytes, hepatic lobular structure destruction, Kupffer cell proliferation, and extensive inflammatory cell infiltration. Immunohistochemistry and immunoblotting showed that the increased expression of TNF-α in the liver was associated with prolonged sleep deprivation time. Conclusion The elevated lipid peroxidation in response to sleep deprivation induces oxidative stress which may lead to impaired liver morphology and functions. Upregulation of TNF-α elicits inflammatory response, which may further contribute to liver damage.
Sleep deprivation; liver; TNF-α; oxidative stress
R749.7
A DOⅠ:10.16705/ j. cnki. 1004-1850.04.007
2017-02-13
2017-07-10
重庆三峡医专校级苗圃工程自然科学项目(2016mpxz17);重庆市教委科学技术研究项目(KJ1725384)
郑小燕,女( 1980年),汉族,主管护师
*通讯作者(To whom correspondence should be addressed):409846096@qq.com

