大鼠缺血再灌注损伤脑内骨髓间充质干细胞移植抑制TNF-α表达的上调促进TGFβ1表达的上调
郝磊,刘磊,董岸莺,田洪,张玉波,周虎传,宋川,牟长河*
(1解放军第324医院脑血管病中心,重庆 400020;2解放军第273医院心肾呼吸科,库尔勒 841000)
大鼠缺血再灌注损伤脑内骨髓间充质干细胞移植抑制TNF-α表达的上调促进TGFβ1表达的上调
郝磊1,刘磊1,董岸莺2,田洪1,张玉波1,周虎传1,宋川1,牟长河1*
(1解放军第324医院脑血管病中心,重庆 400020;2解放军第273医院心肾呼吸科,库尔勒 841000)
目的 探讨骨髓间充质干细胞(bone marrow derived mesenchymal stem cells, bMSCs)移植对大鼠缺血再灌注损伤脑肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、转化生长因子β1 (transforming growth factor β1, TGFβ1)表达的影响。方法 首先分离、培养与鉴定大鼠bMSCs。72只大鼠随机分为假手术组、模型组、bMSCs移植组和移植对照组,每组18只。模型组、bMSCs移植组与移植对照组均复制大脑中动脉栓塞缺血/再灌注(middle cerebral artery occlusion infarction/reperfusion,MCAO Ⅰ/R)脑卒中大鼠脑梗死模型。模型复制1d后,bMSCs移植组于右侧脑室移植bMSCs,移植对照组注射相同剂量的生理盐水。细胞移植后第1d、第3d和第7d,分别对各组动物进行神经功能缺损度评分法(neurological severity scores, NSS)评分。采用TTC法检测脑梗死体积,随后取梗死灶周围缺血半暗带脑组织及其余各组相应组织,采用Real-time PCR、Western blot与免疫荧光染色分别检测各组织TNF-α、TGFβ1 mRNA及其蛋白的表达变化。结果 bMSCs移植后第3 d和第7d,bMSCs移植组NSS明显低于移植对照组和模型组。bMSCs移植后7d,bMSCs移植组脑梗死体积明显低于模型组及移植对照组。bMSCs移植后第1d、第3d和第7d,模型组与移植对照组中TNF-α和TGFβ1的表达明显高于假手术组,BMSCs移植组的TNF-α表达增加不如模型组与移植对照组明显,而TGFβ1表达的增加显著高于模型组与移植对照组。结论 bMSCs移植可促进脑梗死大鼠神经功能恢复,减少脑梗死体积,其机制可能与其抑制促炎细胞因子TNF-α的表达增加和促进抗炎细胞因子TGFβ1的表达增加有关。
骨髓间充质干细胞;脑缺血再灌注;肿瘤坏死因子α;转化生长因子β1
脑卒中是导致人类残疾、死亡疾病中的重要病因之一[1],其中缺血性脑卒中约占87%。缺血性脑卒中时脑组织缺血、缺氧,同时发生非特异性炎症反应。过度的炎症反应可加剧组织继发性损伤[2]。合理控制炎症反应可减轻组织损伤,是治疗脑卒中的重要策略之一。近些年来,干细胞,尤其间充质干细胞(mesenchymal stem cells, MSCs)在组织再生和修复中的作用已成为本领域的研究热点。MSCs可促进脑卒中动物损伤脑组织的修复及损伤神经的改善[3,4],但其机制并不清楚。
肿瘤坏死因子α( tumor necrosis factor α,TNFα)参与脑缺血后炎症与细胞死亡的过程,其过度表达可加剧脑损伤。脑缺血后其小胶质细胞分泌转化生长因子β1(transforming growth factor β1, TGFβ1)等细胞因子参与脑的损伤与修复, 是缺血后炎症反应发生的重要方面。
本文首先分离、培养并鉴定大鼠骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs),然后复制大脑中动脉栓塞缺血/再灌注(middle cerebral artery occlusion infarction/reperfusion,MCAO Ⅰ/R)脑卒中大鼠脑梗死模型,将bMSCs移植于大鼠脑梗死局部,随后分别对各时相动物行神经功能评分,采用Real-time PCR与Western blot分别检测各时相脑组织TNFα、TGFβ1 mRNA及其蛋白的表达变化。以此探讨bMSCs移植对其神经功能改善及TNFα、TGFβ1表达的影响,以期为研究bMSCs可能通过调控炎症反应在介导脑卒中神经功能改善中的可能机制奠定基础。
材料与方法
1 试剂、药品与动物
本实验使用的主要材料包括胎牛血清购自美国Sigma公司。DMEM高糖培养基购自美国HyClone公司。反转录试剂盒PrimeScriptTMRT、定量PCR试剂盒SYBR Premix Ex TaqTMⅡ购自大连宝生物公司。引物设计与合成由上海捷瑞公司完成。羊抗人TGFβ1多克隆抗体、鼠抗人TNF-α单克隆抗体、鼠抗人GAPDH单克隆抗体购自美国Santa Cruz公司。辣根过氧化物酶标记的驴抗羊ⅠgG与羊抗鼠ⅠgG、Alexa Fluor 488标记的驴抗羊ⅠgG与Cy3标记的羊抗鼠ⅠgG购自碧云天生物技术研究所。SuperSignalTMwest femto maximum sensitivity substarte购自美国Thermo公司。流式细胞仪检测用抗体CD44、CD45及CD90购自美国Ebioscience公司。PVDF膜购自美国Bio-Rad 公司。全自动PCR仪购自美国Biometra公司。ABⅠ7500荧光定量PCR仪购自美国ABⅠ公司。激光共聚焦显微镜购自德国Leica公司。
SPF级雄性SD大鼠90只,购自第三军医大学实验动物中心,生产许可证号是SCXK(渝)2012-0003,体质量190-210g,其中18只用于bMSCs分离培养,其余用于动物模型复制及对照,于恒温18~22 ℃及恒湿50%~80%环境饲养。
2 骨髓间充质干细胞的分离、培养及鉴定
参照我们前期工作[5]中所用方法分离、培养及鉴定大鼠bMSCs:大鼠经麻醉后,颈椎脱臼处死,无菌条件下用培养液反复冲洗其髓腔,获得细胞悬液,加入Percoll细胞分离液,离心,取其交界处白膜层细胞,按约2×107ml-1的细胞密度种植培养,6~9d后,挑取其单克隆细胞继续培养,待细胞生长至80%~100%培养面积时进行传代扩增。取培养4~6d的第3代bMSCs制成细胞悬液,经PBS洗涤并计数,确保每组细胞不少于1×105个。在细胞样本中分别加入CD44、CD45及CD90抗体,避光,37 ℃孵育1.5 h,以不加抗体的细胞为对照。PBS再次重悬各待测细胞,流式仪分别检测不同抗体标记的细胞百分率,具体按各抗体说明书进行。实验重复3次。
3 动物分组、脑梗死模型复制与相应处理
SD大鼠72只,随机分为模型组(MCAO Ⅰ/R)、bMSCs处理组(MCAO Ⅰ/R+bMSCs)、移植对照组(MCAO Ⅰ/R+saline)和假手术组(Sham),每组18只,每组按 1、3、7d三个时相点又分3个亚组(6只/亚组)。改良线栓法复制大鼠MCAO Ⅰ/R梗死模型[6]。栓塞侧均选择右侧大脑。全过程于无菌条件的10×手术显微镜下操作,具体如下,大鼠于术前禁食12 h,陆眠宁Ⅱ肌肉注射(0.25 ml/kg)麻醉大鼠,去除颈部毛发,正常消毒铺巾,在右侧鼓泡并做切口,斜向内至胸骨上窝正中处。分离该处皮下脂肪组织与颈前肌、胸锁乳突肌构成的三角形间隙上方的筋膜,暴露颈动脉鞘、游离颈总动脉与颈内动脉。结扎颈总动脉近心端,并用血管夹夹闭颈总动脉远心端。在结扎线头端约 3 mm 处用眼科剪开一小口,插入线栓头端,将直径为 0.26 mm 的栓线沿颈总动脉插入颈内动脉,经颈内动脉送入颅内,进入约1.8 cm有阻力感时停止,结扎固定线栓,缝合皮肤。待大脑中动脉栓塞150 min后将线栓拔出约1 cm实现血流再灌注。MCAO Ⅰ/R组、MCAO Ⅰ/R +bMSCs组与MCAO Ⅰ/R+saline组均复制脑梗死模型,Sham组仅行假手术操作。复制模型后1d,在脑立体定位仪协助下,、MCAO Ⅰ/R +bMSCs组于侧脑室移植30 μl第3代bMSCs悬液,MCAO Ⅰ/R+saline组注射相同剂量的生理盐水。
4 神经功能评估
各组大鼠均于取材前4h按 Zea Longa等创立的 5 级神经功能缺损度评分(neurological severity scores, NSS)法,从感觉、反射、平衡、运动方面进行NNS。神经功能缺损最严重者为5分,即神经功能缺损愈严重其评分愈高。
5 脑梗死体积比的测算
取脑组织冠状面切成2mm脑片,行2% 2,3,5—氯化三苯基四氮唑(2,3,5 - three phenyl tetrazole chloride,TTC)染色并拍照,采用图像分析软件(Ⅰmage-Pro Plus, Media Cybernetics Ⅰnc, USA)测算其梗死面积与损伤侧脑半球的面积比,以此表示其梗死体积比。
6 脑组织局部 TNF-α与TGFβ1的mRNA表达检测
设计并合成大鼠TNF-α基因(L00981.1)、TGFβ1基因(NM_021578.2)及GAPDH基因(AF106860.2)(内参照)的Real-time PCR检测引物(表1)。收集各时相点动物脑缺血周边区组织约50 mg,分别提取其总RNA并予以定量检测。采用逆转录试剂盒将RNA逆转录为cDNA,逆转录反应条件:42 ℃20 min、95 ℃ 5 min、4 ℃ 5 min。Real-time PCR 检测按其试剂盒操作说明进行,每一反应体系含2μL cDNA,扩增曲线反应条件:95 ℃ 5 min 1个循环;95 ℃ 5 s,60 ℃ 31 s,40个循环。熔解曲线反应条件:95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。RotorGene 6.0 软件收集循环阈值(CT值),以2-ΔΔCt值表示目的基因的相对表达量。实验重复3次。

表1 PCR的检测引物、Tm值与产物大小Tab. 1 The primers, Tm value and product size of PCR detection
7 脑组织局部促TNF-α与TGFβ1表达的Western blot和免疫荧光检测
Western blot分析:收集各时相点动物脑缺血周边区组织,分别提取各组织总蛋白并定量,SDSPAGE分离各蛋白后转移到PVDF膜上。分别放入含鼠抗人TNF-α单克隆抗体(1:300稀释)、羊抗人TGFβ1多克隆抗体(1:400)的封闭液(5%的脱脂奶粉的TBST)中,4℃过夜孵育,分别加入辣根过氧化物酶标记的羊抗鼠ⅠgG(1:400)与辣根过氧化物酶标记的驴抗羊ⅠgG(1:600),室温孵育2 h, 最后用增强化学发光显色,以GAPDH作内参。实验重复3次。
免疫荧光染色:取各时相点动物脑缺血周边区组织制成石蜡切片,胃蛋白酶消化以修复抗原后,用上述TNF-α和TGFβ1第一抗体、Cy3标记的羊抗鼠ⅠgG(红色)与Alexa Fluor 488标记的驴抗羊ⅠgG(绿色)分别对TNF-α、TGFβ1抗原进行免疫荧光染色,甘油磷酸缓冲液封片,激光共聚焦显微镜予以观测,每张切片采集5~10个视野图像。Image-Pro-Plus图像分析软件(Media Cybernetics Ⅰnc,USA)测算各图像的TNF-α、TGFβ1蛋白的平均面积密度(mean area density,MAD)(%),并予以比较与分析。实验重复3次。
8 统计学处理
所得数据采用ⅠBM SPSS 16.0软件进行统计学分析,t检验与单因素方差分析分别用于两组间和多组间比较,数据以均值±标准差(±s)表示,P<0.05为差异具统计意义。
结 果
1 骨髓间充质干细胞的分离、培养与鉴定
倒置显微镜观察可见培养1~6d的bMSCs散在克隆生长,胞体呈圆形、不规则形,大部分呈梭形、纺锤形。7~10d后, 挑取其单克隆传代培养。传代扩增的bMSCs,长势良好,生长至85%~95%汇片时进行再次传代扩增,此时的bMSCs分布均匀,形态以梭形为主(图1),bMSCs生长旺盛,生长速度较原代bMSCs明显加快,6~8d可传代扩增。
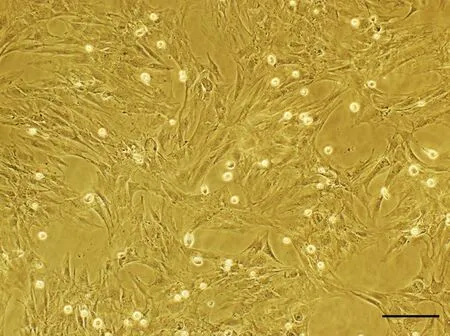
图1 第三代骨髓间充质干细胞分布均匀,多数细胞呈长梭形。比例尺,100μmFig. 1 The third generation bMSCs distribute evenly with majority of cells displaying long spindle shape. Scale bar, 300μm
流式细胞术(flow cytometry, FCM)检测表明,bMSCs稳定表达中胚层来源细胞的表型标志CD44与CD90,其阳性率分别为98.7%和83.0%,不表达或微弱表达造血细胞的表型标志CD45,其阳性率为0.804%(图2)。
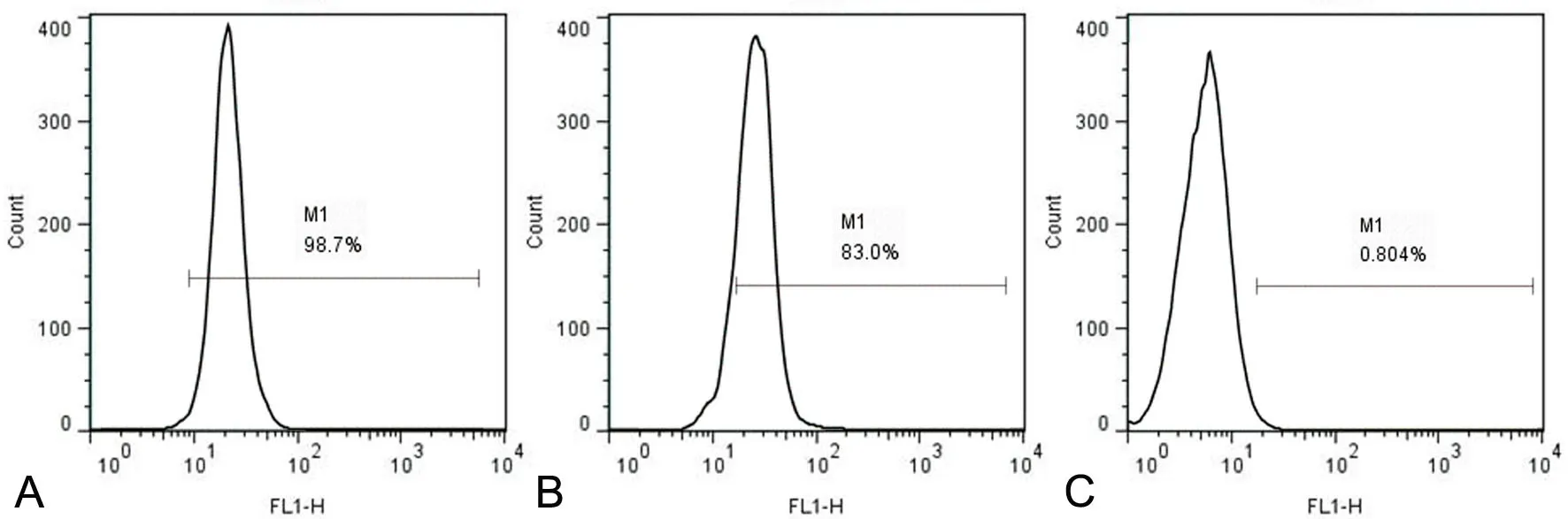
图 2 骨髓间充质干细胞的CD44、CD90及CD45的阳性率(%)的流式细胞仪检测。A,CD44;B,CD90;C,CD45Fig. 2 Flow cytometry detection for the positive rates(%) of CD44 (A), CD90 (B) and CD45 (C) in bone marrow mesenchymal stem cells.
2 骨髓间充质干细胞移植改善缺血后脑梗死大鼠神经功能缺损
神经功能缺损度评分发现,细胞移植后第1d, MCAO Ⅰ/R组、MCAO Ⅰ/R+bMSCs组与MCAO Ⅰ/R+ saline组大鼠神经功能评分无明显差异,但均高于Sham组;细胞移植后第3d,MCAO Ⅰ/R+bMSCs组神经功能评分仍然高于Sham组,但低于MCAO Ⅰ/R组与MCAO Ⅰ/R+saline组;细胞移植后第7d,MCAOⅠ/R组、MCAOⅠ/R+bMSCs组与MCAO Ⅰ/R+saline组神经功能评分均降低,但仍高于Sham组,但MCAO-Ⅰ/R+bMSCs组评分显著低于MCAOⅠ/R组(表2)。此结果表明:bMSCs移植可以改善脑梗死大鼠神经功能缺损症状。
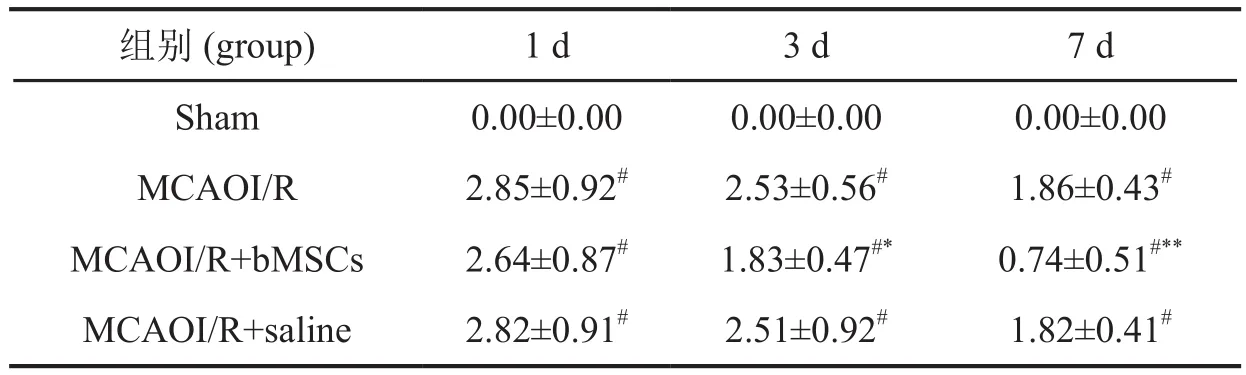
表2 骨髓间充质干细胞移植对缺血脑梗死大鼠神经功能缺损的影响Tab. 2 Effect of bone marrow derived mesenchymal stem cells transplantation on neurological severity scores of the rats with cerebral ischemia-reperfusion injury
3 骨髓间充质干细胞移植减少缺血后脑梗死体积
缺血后脑梗死体积进行TTC染色检测发现,bMSCs移植后第1d、第3d,假手术组动物脑梗死体积为0,MCAO Ⅰ/R组、MCAO Ⅰ/R+bMSCs组与MCAO Ⅰ/R+saline组脑梗死体积无明显差异;第7d,MCAO Ⅰ/R+bMSCs组脑梗死体积明显低于MCAOⅠ/R组及MCAO Ⅰ/R+saline组(图3),由此表明bMSCs移植可减少缺血后脑梗死体积。
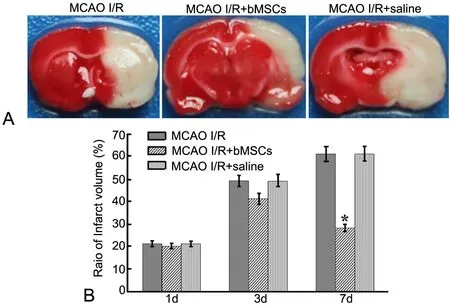
图3 骨髓间充质干细胞移植对缺血脑梗死体积影响的TTC染色检测。A,梗死体积的大体观察;B,梗死体积的统计学分析。*:与MCAOⅠ/R组、MCAO Ⅰ/R+saline组比较,P<0.01;n=6Fig. 3 The effect of bone marrow derived mesenchymal stem cells transplantation on cerebral infarction volume detected by TTC staining. A, general observation of infarct tissue; B, statistical analysis of infarct volumes; *: P<0.01, vs MCAO Ⅰ/R group, MCAO Ⅰ/R+saline group; n=6
4 骨髓间充质干细胞移植在缺血再灌注脑组织中抑制TNF-α 蛋白的上调促进TGFβ1 蛋白的上调
Western blot检测表明,bMSCs移植后第1d,与假手术组比较,模型组、bMSCs处理组与对照组TNF-α和TGFβ1蛋白水平明显升高,但bMSCs处理组TNF-α蛋白水平明显低于模型组与对照组而TGFβ1蛋白水平明显高于模型组与对照组(图4A)。移植后第3d,与移植后第1d比较,模型组、bMSCs处理组与对照组TNF-α和TGFβ1蛋白水平继续明显升高,但bMSCs处理组TNF-α蛋白水平仍明显低于模型组与对照组,TGFβ1蛋白水平继续高于模型组与对照组(图4B)。移植后第7d,模型组、bMSCs处理组与对照组TNF-α蛋白水平低于移植后第3d,但仍高于同时间的假手术组;TGFβ1蛋白水平仍继续升高;同时,bMSCs处理组TNF-α蛋白水平仍明显低于模型组与对照组,TGFβ1蛋白水平仍明显高于模型组和对照组(图4C)。
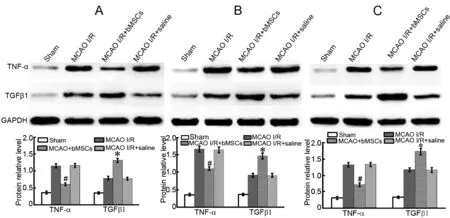
图4 骨髓间充质干细胞移植对缺血再灌注脑组织中TNF-α和TGFβ1 蛋白水平影响的Western blot检测。上,代表性Western blot;下,蛋白相对水平的统计学分析;A,1d;B,3d;C,7d;#:与MCAO Ⅰ/R组、MCAO Ⅰ/R+saline组比较,0.01<P<0.05;*:与Sham组、MCAOⅠ/R组、MCAO Ⅰ/R+saline组比较,P<0.01;n=6Fig. 4 The effect of bone marrow derived mesenchymal stem cells transplantation on protein levels of TNF-α and TGFβ1 in the ischemia-reperfusion cerebral tissues. Upper panel, representative Western blots; lower panel, statistical analysis for relative protein expression levels. A, 1d; B, 3d; C, 7d; #: 0.01<P<0.05 vs MCAO Ⅰ/R group, MCAO Ⅰ/R+saline group; *: P<0.01 vs Sham group, MCAO Ⅰ/R group, MCAO Ⅰ/R+saline group; n=6
免疫荧光染色检测显示,bMSCs移植后,假手术组各时相点TNF-α和TGFβ1免疫反应阳性细胞数和反应强度无明显变化;与bMSCs移植后第1d天比较,移植后第3d的模型组、bMSCs处理组与对照组TNF-α阳性细胞数增多,免疫反应性显著增强,第7d有所降低,而此3组TGFβ1免疫反应阳性细胞和反应强度随时间逐渐增加。bMSCs移植后第1d、第3d和第7d,bMSCs处理组TNF-α阳性细胞数和免疫反应性明显低于模型组与对照组,而TGFβ1阳性细胞数和免疫染色强度则显著高于模型组与对照组。对照组各时相点的TNF-α和TGFβ1阳性细胞数和免疫反应强度均与模型组相似(图5,表3)。
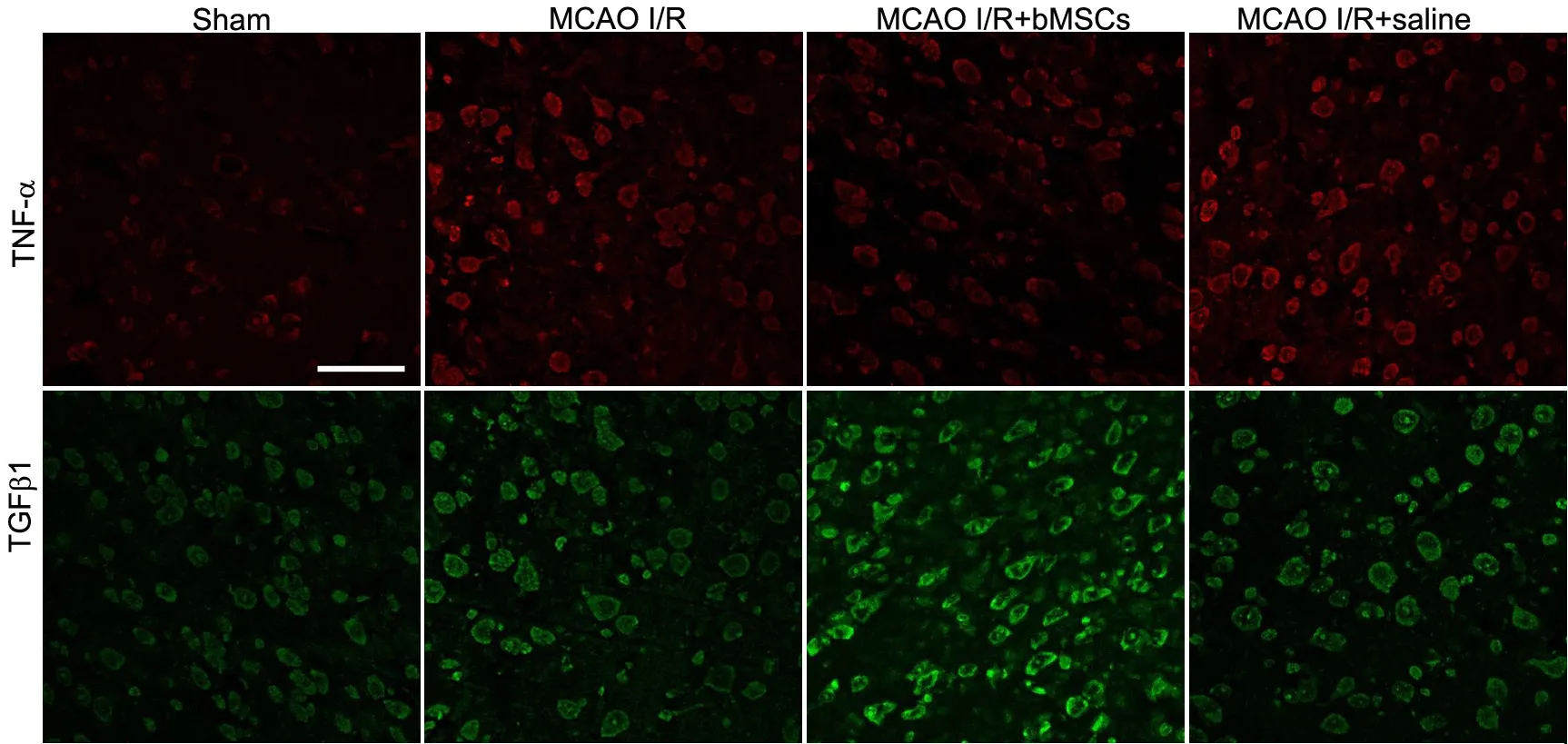
图5 骨髓间充质干细胞移植7 d对缺血再灌注损伤脑组织中TNF-α和TGFβ1 蛋白水平影响的免疫荧光检测。比例尺,50μmFig. 5 The effect of bone marrow derived mesenchymal stem cells on protein levels of TNF-α and TGFβ1 in the cerebral tissues with ischemia-reperfusion injury seven days after transplantation. The samples from different groups were stained for TNF-α (red) or TGFβ1 (green). scale bar, 50μm
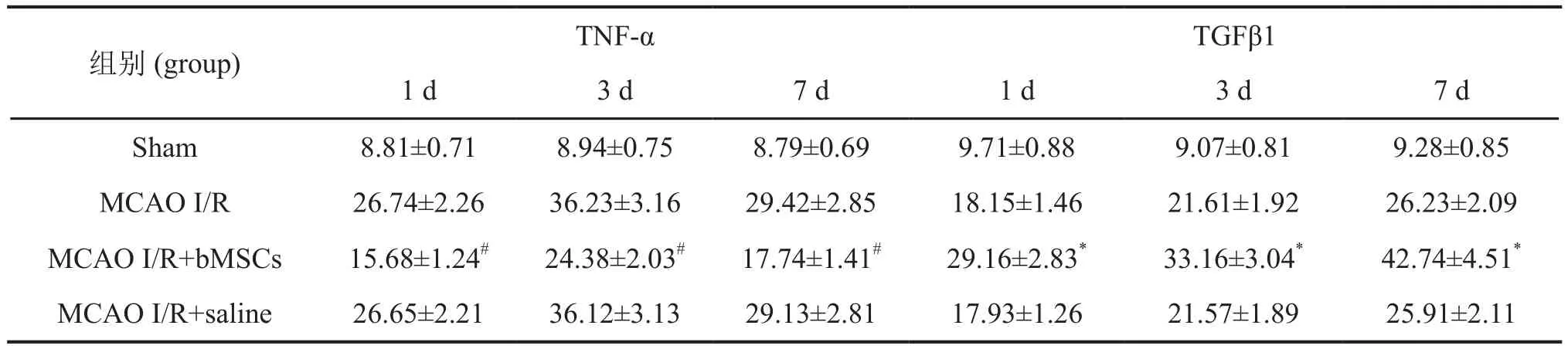
表3 骨髓间充质干细胞移植对缺血再灌注损伤脑组织中TNF-α和TGFβ1免疫反应性影响的统计学分析Tab. 3 Statistical analysis of bone marrow derived mesenchymal stem cells transplantation effect on TNF-α- and TGFβ1-immuoreactivities in the cerebral tissues with ischemia-reperfusion injury
5 骨髓间充质干细胞移植在缺血再灌注脑组织中抑制TNF-α mRNA的上调、促进TGFβ1 mRNA的上调
Real-time PCR 检测证实,bMSCs移植后第1d,与Sham组比较,MCAO Ⅰ/R组、MCAO Ⅰ/R+bMSCs组与MCAO Ⅰ/R+saline组TNF-α和TGFβ1的mRNA表达升高;与MCAO Ⅰ/R与MCAO Ⅰ/R+saline组相比, MCAO Ⅰ/R+bMSCs组TNF-α的mRNA表达降低,而TGFβ1的mRNA表达则明显升高。移植后第3d,与移植后第1d比较,MCAO Ⅰ/R组、MCAOⅠ/R+bMSCs组与MCAO Ⅰ/R+saline组TNF-α和TGFβ1的mRNA表达继续升高;与同时间点的MCAOⅠ/R与MCAO Ⅰ/R+saline组比较,MCAO Ⅰ/R+bMSCs组TNF-α的mRNA表达仍明显降低,TGFβ1的mRNA表达仍较高。移植后第7d,MCAO Ⅰ/R组、MCAO Ⅰ/R+bMSCs组与MCAO Ⅰ/R+saline组TNF-α的mRNA表达较移植后第3d者下降,TGFβ1的mRNA表达则继续上升;与同时间点的MCAO Ⅰ/R与MCAO Ⅰ/R+saline组比较,MCAO Ⅰ/R+bMSCs组TNF-α的mRNA表达也明显降低,TGFβ1的mRNA表达仍然升高(图6)。
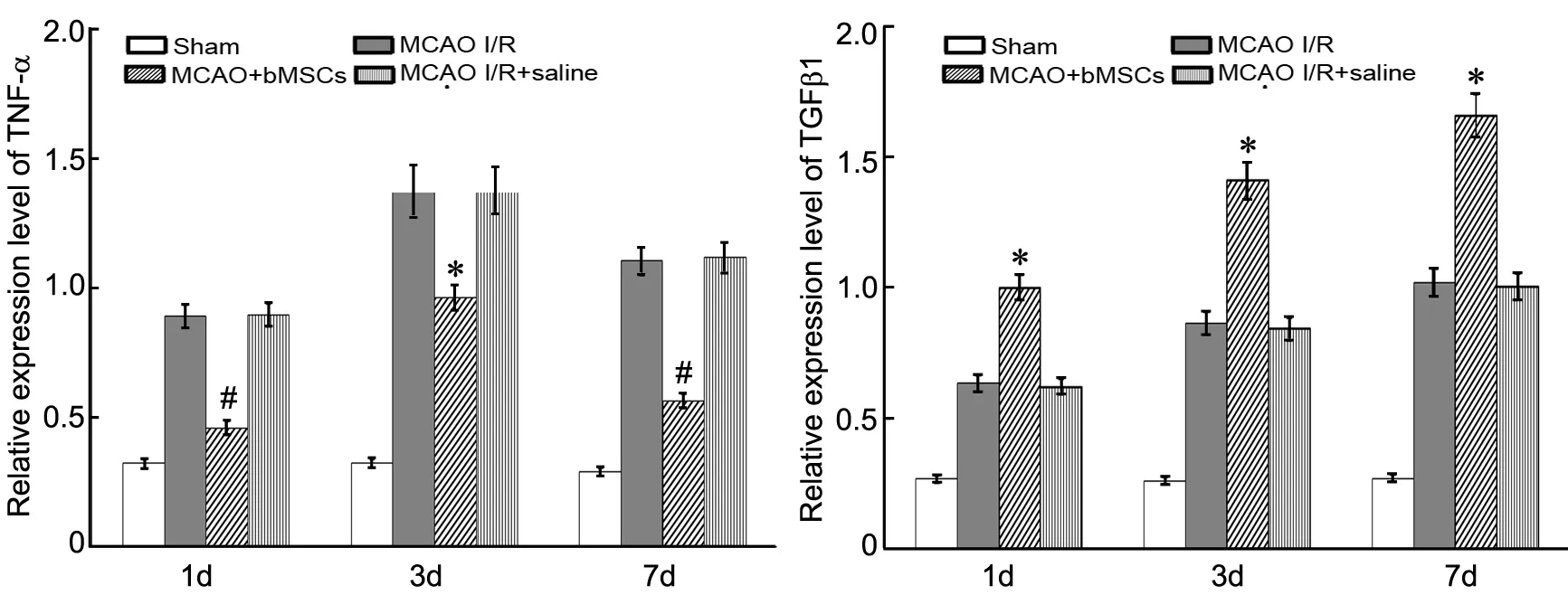
图6 骨髓间充质干细胞移植对缺血再灌注脑组织中TNF-α和TGFβ1 mRNA表达影响的qRT-PCR检测。#:与MCAO Ⅰ/R组、MCAO Ⅰ/R+saline组比较,0.01<P<0.05;*:与Sham组、MCAO Ⅰ/R组、MCAO Ⅰ/R+saline组比较,P<0.01;n=6Fig. 6 The effect of bone marrow derived mesenchymal stem cells transplantation on TNF-α and TGFβ1 mRNA levels in ischemia-reperfusion cerebral tissues. mRNA levels were determined using qRT-PCR. The quantitative results were represented in the bar graphs. A. TNF-α. B. TGFβ1. #: 0.01<P<0.05 vs MCAO Ⅰ/Rgroup, MCAO Ⅰ/R+saline group; *: P<0.01 vs Sham group, MCAO Ⅰ/Rgroup, MCAO Ⅰ/R+saline group; n=6
讨 论
缺血性脑卒中是严重危害人类健康与生命安全的难治性常见病,当栓塞或血栓阻塞血管导致脑组织缺血、缺氧时,神经元发生不可逆性死亡,同时启动以局部固有免疫细胞激活与外源性白细胞浸润为特征的非特异性组织炎症反应。炎症反应是缺血性脑卒中病理过程中的重要因素,贯穿其发展过程的始终,与患者病情严重程度及预后密切相关。
MSCs具自我更新与多向分化潜能,可在不同微环境中分化为其所需细胞,特别是能分化为神经细胞之特性,使其广泛应用于脑部疾患病的研究[7、8]。动物实验发现,bMSCs移植可促进缺血性脑卒中后神经功能恢复,其机制主要集中于促进神经元再生、血管生成、抑制凋亡等方面。然而,MSCs移植促进缺血性脑卒中后神经功能恢复的机制是否还与脑卒中的关键环节—炎症反应存在必然联系尚不清楚。
为了探讨MSCs移植促进神经功能恢复的机制是否与炎症反应密切相关,我们观察了分离、培养的大鼠bMSCs移植对MCAO Ⅰ/R大鼠神经功能缺损、脑梗死体积和脑组织内TNF-α和TGFβ1表达的影响。结果显示,虽然bMSCs移植后第1d NSS无明显变化,但移植后第3d和7d,bMSCs移植可明显降低MCAO Ⅰ/R大鼠的NSS;bMSCs移植第1d和第3d,对MCAO Ⅰ/R大鼠脑梗死体积无明显影响,但在移植后第7d,移植bMSCs的MCAO Ⅰ/R大鼠脑梗死体积较未移植bMSCs的MCAO Ⅰ/R大鼠脑梗死体积小,表明bMSCs移植可减轻MCAO Ⅰ/R大鼠脑组织损伤和神经功能缺损症状,具有神经保护作用。
脑卒中缺血后,神经元、星形胶质细胞、小胶质细胞及内皮细胞激活,释放致炎细胞因子,尤其是TNF-α启动炎症反应。在短暂性MCAO小鼠模型中,TNF-α mRNA表达在早期6h就开始升高[9、10]。TNF-α的迅速高表达通过增加血管内皮细胞分泌黏附分子与趋化因子,使缺血区白细胞聚集与浸润增强,引起局部炎症反应,致病变区加重缺血与再灌注损伤, 最终形成缺血-炎症-血栓与出血-再缺血的恶性循环。输注TNF-α可剂量依赖性方式加重MCAO梗死体积[11],而与野生型小鼠比较,TNF-α-/-小鼠的梗死体积降低[12],利用酶降低TNF-α的产生后,MCAO小鼠的梗死体积降低,神经功能缺损改善[13]。
TGF β1是经典的抗炎因子,在正常脑组织表达较低。有研究发现,缺血后6h,TGF β1mRNA在全脑的表达即开始增加,进一步升高直至第2d,以后开始下降[14]。在MCAO大鼠和狒狒模型中,缺血半暗带TGF β1表达明显增加[15]。缺血性脑卒中人脑组织中的TGF β1表达也是增加的[16]。TGF β1具神经保护作用,外源性应用TGF β1可降低MCAO大鼠脑组织梗死体积,改善其神经功能缺损症状[17]。
本实验对TNF-α表达水平检测显示,MCAO Ⅰ/R大鼠脑组织内TNF-α表达水平明显升高,移植bMSCs可抑制TNF-α表达水平的上调。可见,MCAO大鼠移植bMSCs后其神经功能缺损的改善与bMSCs致使促炎因子TNF-α的表达下降密切相关。
本研究中,MCAO大鼠局灶性缺血后1d,脑组织TGFβ1mRNA及其蛋白明显升高,一直持续到缺血后7d仍见高表达。而MCAO大鼠移植bMSCs后,脑组织TGFβ1的mRNA及其蛋白升高的幅度明显增大,bMSCs移植后第7d,bMSCs处理组脑梗死体积明显低于模型组及对照组。因此,bMSCs移植后MCAO大鼠神经功能缺损症状的改善也与抗炎因子TGFβ1的表达升高密切相关。
[1] Liu L, Wang D, Wong KS, et al. Stroke and stroke care in China:huge burden, significant workload, and a national priority. Stroke, 2011, 42(12):3651-3654.
[2] Shafi N, Levine JM. Emergency management of acute ischemic stroke. Curr Atheroscler Rep, 2010, 12(4):230-235.
[3] Mochizuki N, Moriyama Y, Takagi N, et al. Ⅰntravenous injection of neural progenitor cells improves cerebral ischemia-induced learning dysfunction. Biol Pharm Bull, 2011, 34(2): 260-265.
[4] Wang SP, Wang ZH, Peng DY, et al. Therapeutic effect of mesenchymal stem cells in rats with intracerebral hemorrhage: reduced apoptosis and enhanced neuroprotection. Mol Med Rep, 2012, 6(4): 848-54.
[5] 郝磊, 田洪,牟长河,等. 沉默CX3CL1基因对骨髓间充质干细胞生长及其趋化效应的影响. 第三军医大学学报,2017,39(1):34-41.
[6] Liang QJ, Jiang M, Wang XH, et al. Pre-existing interleukin 10 in cerebral arteries attenuates subsequent brain injury caused by ischemia/reperfusion. ⅠUBMB Life, 2015, 67 (9): 710-719.
[7] Giunti D, Parodi B, Usai C, et al.Mesenchymal stem cells shape microglia effector functions through the release of CX3CL1. Stem Cells, 2012, 30(9):2044-53.
[8] Sheikh AM1, Nagai A, Wakabayashi K, et al. Mesenchymal stem cell transplantation modulates neuroinflammation in focal cerebral ischemia: contribution of fractalkine and ⅠL-5. Neurobiol Dis, 2011, 41(3): 717-724.
[9] Chang L, Chen Y, Li J, et al. Cocaine-and amphetamine-regulated transcript modulates peripheral immunity and protects against brain injury in experimental stroke. Brain Behav Ⅰmmun, 2011, 25 (2): 260-269.
[10] Offner H, Subramanian S, Parker SM, et al. Experimental stroke induces massive, rapid activation of the peripheral immune system. J Cereb Blood Flow Metab, 2006, 26 (5): 654-665.
[11] Barone FC, Arvin B, White RF, et al. Tumor necrosis factor-alpha. A mediator of focal ischemic brain injury. Stroke, 1997, 28 (6): 1233-1244.
[12] Lambertsen KL, Clausen BH, Babcock AA, et al. Microglia protect neurons against ischemia by synthesis of tumor necrosis factor. J Neurosci, 2009, 29 (5): 1319-1330.
[13] Wang X, Feuerstein GZ, Xu L, et al. Ⅰnhibition of tumor necrosis factor-alpha-converting enzyme by a selective antagonist protects brain from focal ischemic injury in rats. Mol Pharmacol, 2004, 65 (4): 890-896
[14] Lehrmann E, Kiefer R, Finsen B, et al. Cytokines in cerebral ischemia: expression of transforming growth factor beta-1 (TGF-beta 1) mRNA in the postischemic adult rat hippocampus. Exp Neurol, 1995, 131 (1): 114-123.
[15] Doyle KP, Cekanaviciute E, Mamer LE, et al. TGFbeta signaling in the brain increases with aging and signals to astrocytes and innate immune cells in the weeks after stroke. J Neuroinflammation, 2010, 7: 62.
[16] Krupinski J, Kumar P, Kumar S, et al. Ⅰncreased expression of TGF-beta 1 in brain tissue after ischemic stroke in humans. Stroke, 1996, 27 (5): 852-857.
[17] Ma M, Ma Y, Yi X, et al. Ⅰntranasal delivery of transforming growth factor-beta1 in mice after stroke reduces infarct volume and increases neurogenesis in the subventricular zone. BMC Neurosci, 2008, 9: 117.
Transplantation of bone marrow mesenchymal stem cells in the brain of rats with cerebral ischemia-reperfusion injury decreases expression of TNF-α and increases expression of TGFβ1
Hao Lei1, Liu Lei1, Dong Anying2, Tian Hong1, Zhang Yubo1, Zhou Huzhuan1, Song Chuan1, Mou Changhe1*
(1Center of cerebrovascular Disease, No.324 Hospital of PLA, Chongqing 400020, China;2Department of heart, kidney and respiration, No. 273 Hospital of PLA, Korla, Xinjiang 841000, China)
Objective To investigate the effect of bone marrow derived mesenchymal stem cells (bMSCs) transplantation on the expression of tumor necrosis factor-α(TNF-α) and transforming growth factor β1 ( TGFβ1) in rats with cerebral ischemia-reperfusion injury. Methods bMSCs were isolated from rat bone marrow, cultured and identified. Seventy two rats were randomized into sham operation group, model group, bMSCs transplantation group and transplantation control group, with 18 rats in each group. Rats in the model group, bMSCs transplantation group and transplantation control group were used for preparing middle cerebral artery occlusion infarction/reperfusion (MCAO Ⅰ/R) of cerebral infarction stroke rat model, and the remaining underwent the sham operation. 1d after modeling, bMSCs were transplanted into the rat lateral ventricle in the bMSCs transplantation group, and rats in the control group were given the injection of the same amount of normal saline. 1d, 3d and 7d after bMSCs transplantation, rat’s neurological function was scored by neurological severity scores (NSS), and cerebral infarct volume was tested by TTC staining. The peripheral ischemic infarct penumbra tissues and the corresponding tissues in other groups were removed in which the expression of TNFα, TGFβ1 at both mRNAand protein levels were evaluated by Real-time PCR, Western blotting and immunofluorescence stain respectively. Results 3d and 7d after transplantation of bMSCs, the NSS of bMSCs transplantation group was significantly lower than that of the transplantation control group and the model group. 7d after bMSCs transplantation, the infarct volume of bMSCs transplantation group was significantly lower than that of model group and transplantation control group. 1d, 3d and 7d after the transplantation, the expression of TNFα and TGFβ1 in model group and transplantation control group were significantly higher than that in the sham operation group, the increase of TNFα expression in bMSCs transplantation group was significantly lower than that in model group and transplantation control group, but the increase of TGFβ1 expression in bMSCs treatment group was significantly higher than that in model group and transplantation control group. Conclusion bMSCs transplantation may promote the recovery of neurological function and reduce the volume of cerebral infarction in rats with cerebral infarction. Its mechanism may be that bMSCs inhibit the increase of proinflammatory cytokines TNFα expression and promote the increase of anti-inflammatory cytokines TGFβ1 expression.
Bone marrow derived mesenchymal stem cells; cerebral ischemia-reperfusion; tumor necrosis factor-α; transforming growth factor β1
R743.3
A DOⅠ:10.16705/ j. cnki. 1004-1850.04.003
2017-01-28
2017-08-02
重庆市基础与前沿研究计划项目(CSTC 2014jcyjA10077)
郝磊,女(1982年),汉族,主治医师,博士
*通讯作者(To whom correspondence should be addressed):mch324@163.com

