新生期缺氧缺血大鼠脑白质损伤及脑内Fyn、p-ERK和MBP下调
林凌,张更,邱荣晖,罗道枢,林清
(福建医科大学基础医学院人体解剖学与组织学胚胎学系,神经生物学研究中心,福州 350122)
新生期缺氧缺血大鼠脑白质损伤及脑内Fyn、p-ERK和MBP下调
林凌,张更,邱荣晖,罗道枢,林清*
(福建医科大学基础医学院人体解剖学与组织学胚胎学系,神经生物学研究中心,福州 350122)
目的 检测新生大鼠缺氧缺血后脑内酪氨酸蛋白激酶Fyn、p-ERK及髓鞘碱性蛋白(myelin basic protein, MBP)表达的变化,探讨Fyn-ERK通路在缺氧缺血脑白质损伤中的作用。方法 新生3日龄SD大鼠24只,随机分为对照组和缺氧缺血(HⅠ)组。缺氧缺血后4周,应用HE染色法观察脑组织病理学改变;应用免疫荧光染色法和Western blot法观察Fyn、p-ERK及MBP在大鼠脑内的定位定量表达变化。结果 HE染色显示缺氧缺血大鼠出现缺氧缺血脑白质损伤病理改变;免疫荧光染色和Western blot检测显示脑内Fyn、p-ERK和MBP水平均明显下调。结论 新生期缺氧缺血损伤4周后,可能通过Fyn与p-ERK水平的下调而使MBP减少,进而使少突胶质细胞成熟障碍,引起脑白质损伤。
新生期缺氧缺血;Fyn蛋白;髓鞘碱性蛋白;脑白质
缺氧缺血脑白质损伤(hypoxic-ischemic white matter injury,WMⅠ)是早产儿脑损伤的重要类型,可致患儿出现脑瘫、智力低下、视听障碍等多种后遗症,给社会和家庭带来沉重的负担[1]。缺氧缺血WMⅠ的主要病理改变是髓鞘生成障碍,脑白质变稀疏甚至软化。WMⅠ中髓鞘生成障碍的具体机制仍未明确,目前依旧是国内外研究的热点。
Src蛋白酪氨酸激酶(protein tyrosine kinases, PTKs)家族成员共有10 种,具有高度同源性,分别由不同基因编码,通过调节蛋白酪氨酸磷酸化,参与调节细胞增殖、分化、迁移和细胞形态的维持[2]。Fyn 是该家族的一员,是细胞内一种非受体型酪氨酸激酶[3]。大量研究表明,Fyn信号通路可通过激活髓鞘碱性蛋白(myelin basic protein, MBP)基因而在髓鞘形成中发挥不可或缺的作用[4,5]。当新生大鼠脑白质发生炎症后Fyn表达量降低,髓鞘形成障碍[6]。那么,Fyn信号通路在新生大鼠发生缺氧缺血损伤中是否发挥同样的作用?目前未见文献报道。对这一问题的研究将有助于进一步明确缺氧缺血WMⅠ的发病机制,具有重要意义。故本研究拟通过结扎新生3日龄SD大鼠双侧颈总动脉及缺氧法建立缺氧缺血(hypoxia-ischemia, HⅠ)损伤模型,应用HE染色法观察脑组织病理学改变,采用免疫荧光组织化学染色法和Western blot法检测HⅠ后4周大鼠Fyn、p-ERK及MBP在脑内的变化,探讨Fyn-ERK 通路在缺氧缺血脑白质损伤中的作用。
材料和方法
1 实验动物及试剂
新生3日龄SD大鼠24只,体质量8.00~11.00g,雌雄不拘,由福建医科大学实验动物中心提供[SCXK(闽)2012-0001],应用随机数字表法随机分为对照组和缺氧缺血HⅠ组。小鼠抗大鼠MBP抗体(美国abcam公司);兔抗大鼠Fyn抗体(美国Santa Cruz公司);兔抗大鼠ERK、p-ERK抗体(美国cst公司);Alexa Fluor488标记的山羊抗小鼠ⅠgG;Alexa Fluor555标记的山羊抗兔ⅠgG(美国invitrogen公司);小鼠抗大鼠GAPDH抗体,辣根过氧化物酶标记的山羊抗兔ⅠgG、山羊抗大鼠ⅠgG及免疫印迹相关试剂(碧云天生物技术研究所) 。
2 缺氧缺血损伤模型制作
参照本实验室原有方法[7]稍加改进。无水乙醚麻醉大鼠,无菌条件下作长约0.5cm颈腹侧正中切口,分离双侧颈总动脉,以8-0显微外科手术缝线完全结扎双侧颈总动脉后缝合皮肤;术后在37℃水浴箱内放置10min,至体温和活动恢复正常,返笼饲养。返笼恢复2h后,将大鼠置于低压氧仓全自动控制仪(南京柏曼信息科技服务中心,XF-XC06-Ⅰ)以8%的氧气缺氧30min。对照组大鼠仅分离双侧颈总动脉,不予结扎及缺氧。
3 组织切片标本制备
缺氧缺血后4周分别取对照组和HⅠ组大鼠各6只,10﹪水合氯醛(3ml/kg)麻醉后,通过左心室插管灌注生理盐水;待流出清亮液体后续以4﹪多聚甲醛灌注固定。每组取3只大鼠行石蜡包埋HE染色,另3只行冰冻切片用于免疫荧光染色。
4 免疫荧光染色
对脑组织进行冰冻切片,片厚25μm,行漂片染色。以免疫荧光显色封闭液室温封闭2h;倾去封闭液,分别滴加小鼠抗大鼠MBP抗体(1:200)、兔抗大鼠Fyn抗体(1:200)和兔抗大鼠p-ERK抗体(1:200),4℃孵育过夜;用0.01mol/L PBS清洗后,分别滴加Alexa Fluor488标记的山羊抗小鼠ⅠgG和AlexaFluor555标记的山羊抗兔ⅠgG(1:200),37℃孵育2h;DAPⅠ(1mg/L)染核5min,抗荧光淬灭封片剂封片。激光扫描共聚焦显微镜(德国,Leica SP8)下观察,绿色激发波长为488nm,发射波长为500~530nm;红色激发波长为543nm,发射波长为560~600nm;蓝色激发波长为405nm,发射波长为420~450nm。阴性对照组以PBS代替一抗进行染色。
5 Western blot检测
缺氧缺血后4周分别取对照组和HⅠ组大鼠各6只,以RⅠPA裂解液提取大鼠脑组织总蛋白,BCA法测定蛋白浓度。每孔上样量为50μg蛋白,SDS-PAGE凝胶电泳,湿转于PVDF膜。脱脂奶粉封闭,加入兔抗大鼠Fyn、ERK、p-ERK抗体(1:1000)4℃孵育过夜和辣根过氧化物酶标记的山羊抗兔ⅠgG、抗小鼠ⅠgG(1:1000)室温孵育1h或加入小鼠抗大鼠MBP(1:1000)4℃孵育过夜,辣根过氧化物酶标记的山羊抗小鼠ⅠgG(1:1000)室温孵育1h,清洗后进行化学发光、显影和定影,生物分子成像仪(日本,LAS 4000 mini)成像。以GAPDH作为内参蛋白。
6 统计学分析
用ⅠmageJ 2.1图像分析系统对Western blot结果进行光密度分析,以各组目的蛋白条带光密度值对内参蛋白光密度值计算相对比值(均数±标准差),采用SPSSl9.0统计软件对结果进行分析。以P<0.05时差异有统计学意义。
结 果
1 缺氧缺血使脑白质纤维排列紊乱
于缺氧缺血后4周取脑组织行HE染色,结果显示:对照组脑白质(胼胝体)纤维排列致密、整齐(图1A),缺氧缺血组脑白质纤维排列稀疏、紊乱(图1B)。
2 缺氧缺血降低脑组织内Fyn、p-ERK和MBP水平
免疫荧光染色显示,缺血缺氧组Fyn免疫反应阳性物较相应对照组少(图2),且在胼胝体部位,Fyn表达于细胞胞体和突起(图2A2,图2B2),而在海马则表达于神经元胞核(图2A3,图2B3)。缺氧缺血组p-ERK表达量亦较相应对照组下降(图3),并且p-ERK表达于胼胝体细胞突起(图3A2,图3B2)和海马神经元胞体(图3A3,图3B3)。缺氧缺血组MBP免疫反应阳性物较相应对照组减少(图4);局部放大后可见对照组脑白质MBP免疫反应阳产性物排列整齐、致密、突起较长(图4A2),而缺氧缺血组MBP免疫反应阳性物排列较紊乱、稀疏、突起变短(图4B2)。
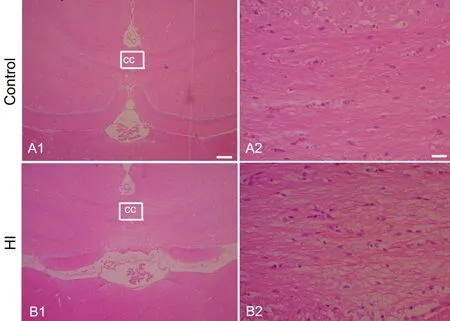
图1 缺氧缺血脑白质病理学变化的HE染色检测。cc,胼胝体;A2和B2分别为A1和B1中方框内cc的高倍像;比例尺:A1和B1,100μm;;A2和B2,10μmFig. 1 The pathological changes in hypoxic-ischemic rat brain. The corpus callosum (cc) region was examined using HE staining. A1: Control rat; B1: Hypoxia-ischemic rat; A2and B2 Boxed regions at higher magnification from A1 and B1 respectively. Scale bar: 100μm in A1 and B1; 10μm in A2 and B2
提取各组大鼠脑组织总蛋白,以Western blot检测Fyn、ERK、p-ERK及MBP水平。结果显示,与对照组相比,缺氧缺血组Fyn和MBP水平显著下降、p-ERK与总ERK的比例明显降低(图5)。
讨 论
本研究通过永久性结扎双侧颈总动脉联合缺氧法致使新生大鼠发生缺氧缺血损伤,应用HE染色法观察脑组织病理学改变,应用免疫荧光组织化学染色法和Western blot 法观察Fyn、p-ERK和MBP在脑内水平变化。我们发现,在缺氧缺血后4周,脑白质纤维变稀疏,Fyn、p-ERK及MBP的表达量均较对照组明显减少,并且Fyn在胼胝体与海马的表达部位不同。
Fyn在海马表达于细胞核,参与神经元的活动,缺氧缺血后其水平显著下降,这与廖家万[8]等的研究结果相一致。他们认为低氧可使大鼠海马神经元Fyn表达降低。而在胼胝体Fyn主要表达于细胞质和突起,由于胼胝体主要成分是少突胶质细胞和神经元突起,故笔者推测,胼胝体中Fyn可能主要作用于少突胶质细胞,但Fyn在海马与胼胝体表达部位不同的具体原因及机制尚不清楚,有待进一步研究证实。
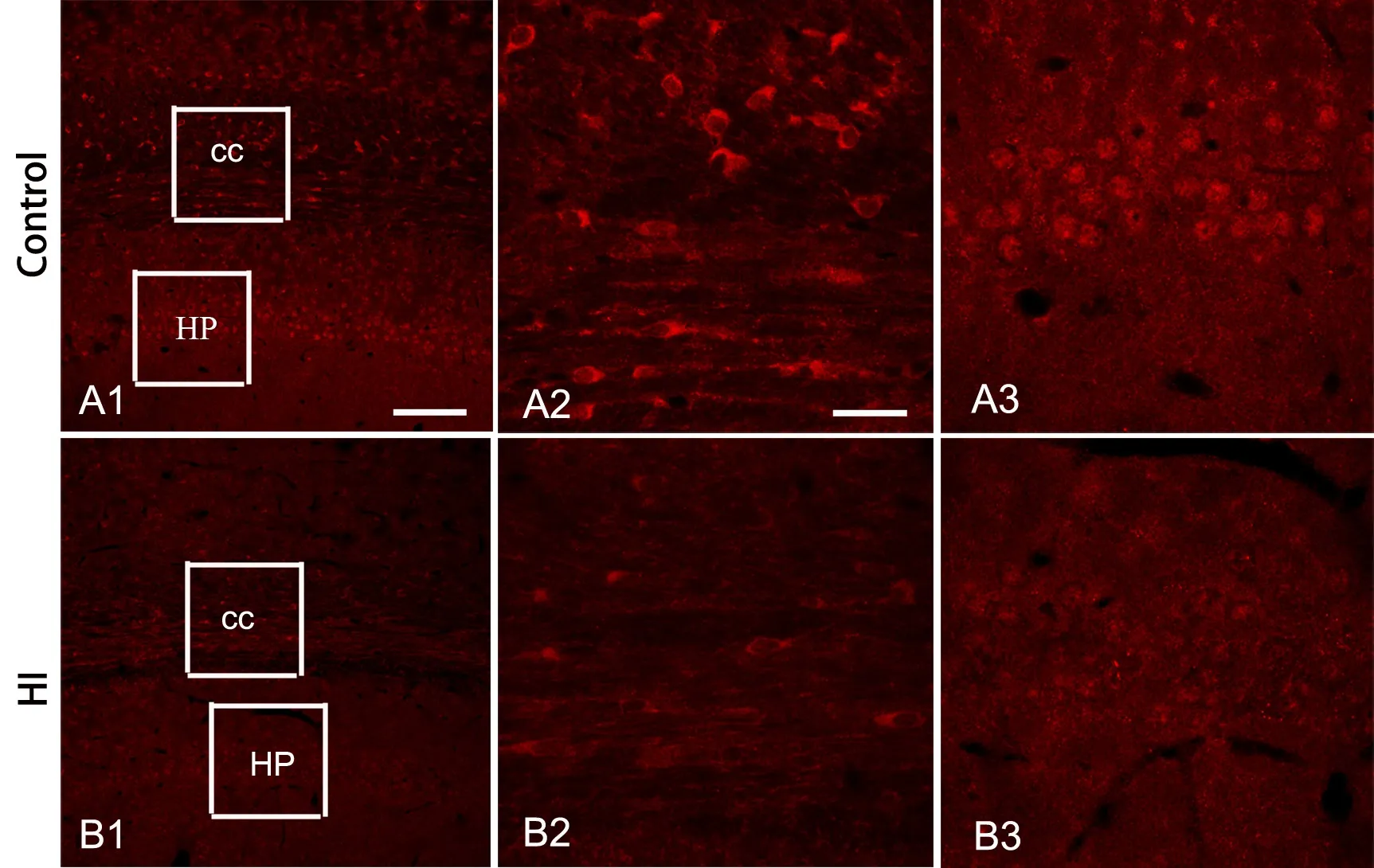
图2 免疫荧光检测缺氧缺血对脑组织Fyn水平的影响。cc,胼胝体;HP,海马;A2和B2,分别为A1和B1中方框内CC的高倍像;A3和B3,分别为A1和B1中方框内HP的高倍像;比例尺:A1和B1,100μm;A2、A3和B2、B3,25μm。Fig. 2 The effects of hypoxia-ischemia on brain Fyn level. cc, corpus callosum; HP, hippocampus; A2 and B2, the images of cc at higher magnification from A1 and B1, respectively; A3 and B3, the images of HP at higher magnification from A1 and B1, respectively; scale bar: 100μm in A1 and B1; 25μm in A2, A3, B2 and B3
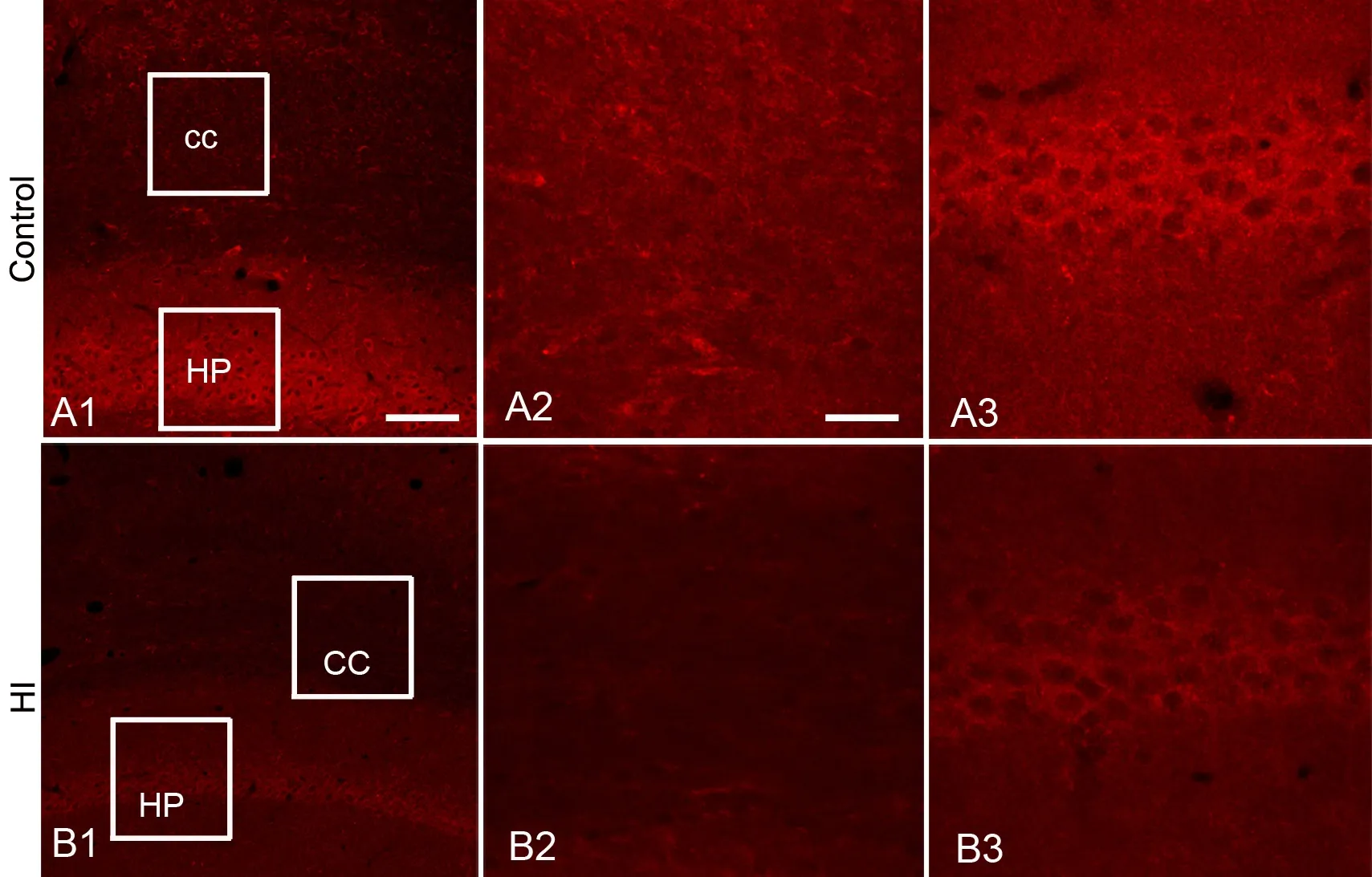
图3 免疫荧光检测缺氧缺血对脑组织p-ERK水平的影响。cc,胼胝体;HP,海马;A2和B2,分别为A1和B1中方框内CC的高倍像;A3和B3,分别为A1和B1中方框内HP的高倍像;比例尺:A1和B1,100μm;A2、A3和B2、B3,25μm。Fig. 3 The effects of hypoxia-ischemia on the brain p-ERK level. cc, corpus callosum; HP, hippocampus; A2 and B2, the high magnification images of cc in A1 and B1; A3 and B3, the high magnification images of HP in A1 and B1; scale bar: 100μm in A1 and B1; 25μm in A2, A3, B2 and B3
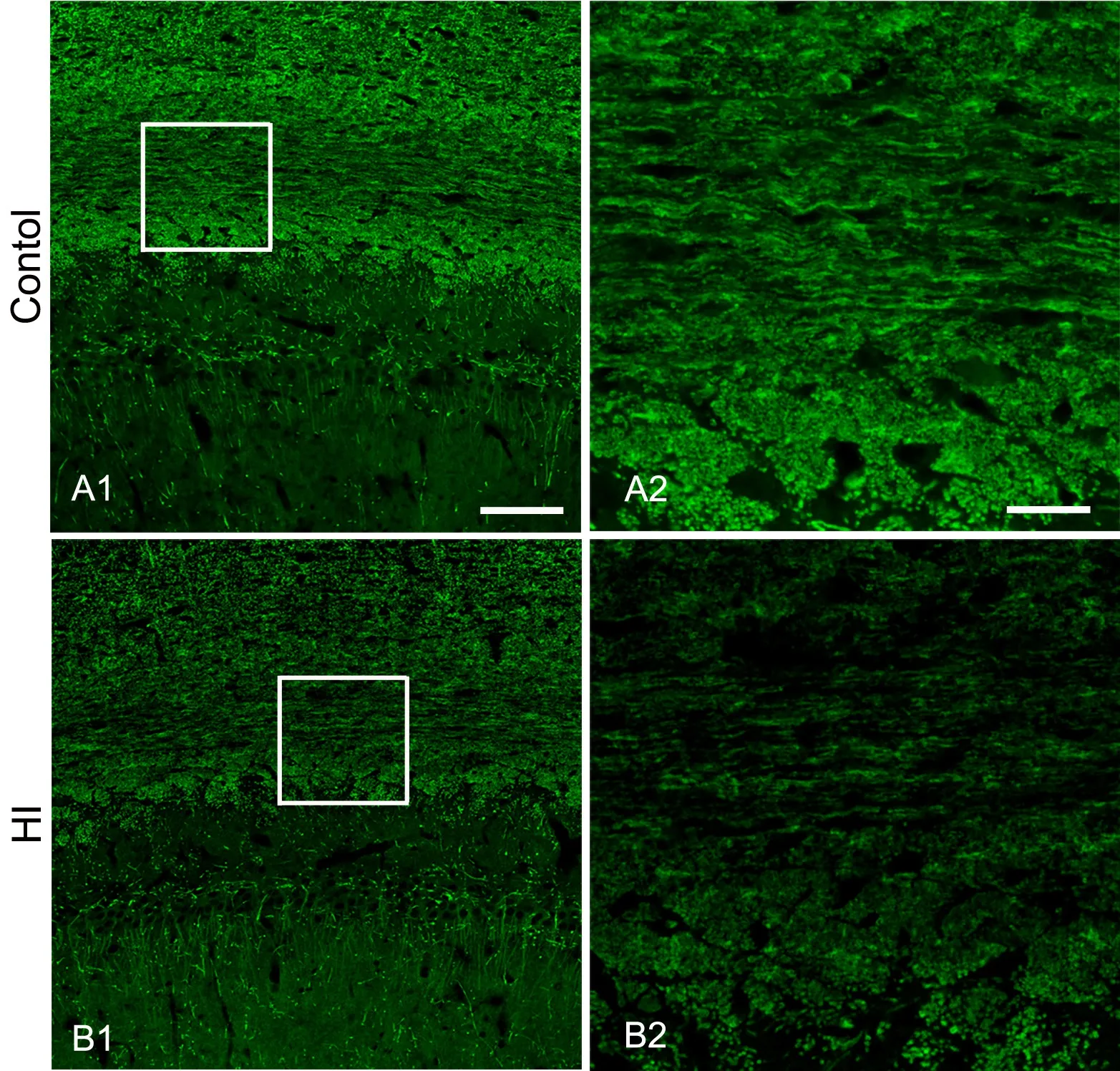
图4 免疫荧光检测缺氧缺血对脑白质MBP水平的影响。A2和B2,分别为A1和B1中方框内白质的高倍像;比例尺:A1和B1,100μm;A2和B2,25μm。Fig.4 The effect of hypoxia-ischemia on MBP level in the white matter of brain; A2 and B2, the high magnification images of the white matter in the frames from A1 and B1; scale bar: 100μm in A1 and B1; 25μm in A2 and B2
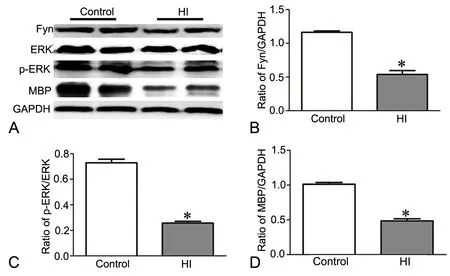
图5 缺血缺氧下调脑白质Fyn、p-ERK、MBP水平。A,Fyn、p-ERK、MBP水平代表性Western blot检测;B,Fyn水平的统计学分析;C,p-ERK水平的统计学分析;D,MBP水平的统计学分析; *,与对照组相比,0.01<P<0.05Fig.5 The effect of hypoxia-ischemia on the Fyn, p-ERK, MBP level of brain white matter. A, levels of Fyn, p-ERK, MBP were determined by western blot; B, statistic analysis for Fyn level; C, statistic analysis for p-ERK level; D, statistic analysis for MBP level; *, 0.01<P< 0.05, compared with the control
由于WMⅠ患儿认知和行为学障碍通常在幼儿期才明显固定化,而1月龄大鼠在神经发育上相当于人类2~5岁幼儿[9]。且研究表明,新生大鼠缺氧缺血后4周可见早期少突胶质前体细胞大量增殖,但新生的早期少突胶质前体细胞虽可向晚期少突胶质前体细胞发育,却无法进一步分化为成熟少突胶质细胞及产生髓鞘蛋白[10,11]。因此,为明确少突胶质细胞无法分化成熟是否与Fyn相关,本实验选择缺氧缺血后4周作为观测点。结果发现,新生大鼠缺氧缺血后4周,脑组织中的Fyn和MBP水平下降,并且组织学显示脑白质纤维排列疏松,说明Fyn水平下降可能引起髓鞘生成障碍,这与其它报道大致吻合。已有的研究证实,Fyn可诱导少突胶质细胞发生迁移[12],促进少突胶质细胞和施万细胞的成熟和发育[13,14],在中枢神经系统髓鞘形成过程中具有不可或缺的作用。Goto等的研究则显示,Fyn基因敲除小鼠与野生型小鼠相比,少突胶质细胞的数量减少且形态发生改变,胼胝体稀疏[15]。Xie等发现,新生大鼠脑白质发生炎症后Fyn含量降低,髓鞘形成障碍[6]。这些研究共同提示Fyn在髓鞘生成中发挥重要作用,这有赖于Fyn的特性。Fyn为细胞内非受体型酪氨酸激酶,为Src家族蛋白酪氨酸激酶中的一员,可通过促使酪氨酸磷酸化发挥作用,酪氨酸激酶磷酸化级联反应参与髓鞘形成过程中信号的传导,其中包括 MAPK/ERK 等信号传导通路[16]。因此,本研究进一步观察了ERK的磷酸化水平,结果显示缺氧缺血后4周p-ERK的表达降低,由此我们推测,ERK磷酸化水平下降可能与Fyn水平下调有关。
缺氧缺血脑白质损伤为早产儿脑损伤的常见类型,主要病理表现为髓鞘合成障碍,脑白质变疏松甚至软化。WMⅠ可致存活患儿出现脑瘫、认知障碍、视觉异常等严重的神经系统后遗症,其发病机制尚未完全明确,至今仍缺乏有效的防治措施。本研究发现新生大鼠缺氧缺血后,Fyn水平下调、ERK磷酸化水平降低,同时MBP水平也明显下调。由此提示,新生期脑缺氧缺血后可能通过Fyn-ERK通路蛋白的下调而使MBP水平降低,进而使髓鞘生成障碍,少突胶质细胞成熟障碍,最终导致脑白质损伤。但缺氧缺血如何诱导Fyn表达下降有待进一步的研究加以证实。
[1] Munck P, Haataja L, Maunu J, et a1. Cognitive outcome at years of age in Finnish infants with very low birth weight born between 2001 and 2006. Acta Paediatr, 2010, 99(3): 359-366.
[2] Thomas SM, Brugge JS. Cellular functions regulated by Src family kinases. Annu Rev Cell Dev Biol, 1997, 13: 513-609. [3] Colognato H, Ramachandrappa S, Olsen ⅠM, et a1. Ⅰntegrins direct Src family kinases to regulate distinct phases of oligodendrocyte development. J Cell Biol, 2004, 167(2): 365-375.
[4] Sperber, BR, Boyle-Walsh EA, Engleka MJ, et al. A unique role for Fyn in CNS myelination. J Neurosci, 2001, 21(6): 2039-2047.
[5] Umemori H, Kadowaki Y, Hirosawa K, et al. Stimulation of myelin basic protein gene transcription by Fyn tyrosine kinase for myelination. J Neurosci, 1999, 19(4):1393-1397. [6] Xie D, Shen F, He S, et al. ⅠL-1beta induces hypomyelination in the periventricular white matter through inhibition of oligodendrocyte progenitor cell maturation via FYN/MEK/ ERK signaling pathway in septic neonatal rats. Glia, 2016, 64(4): 583-602.
[7] 林凌,张更,林巧梅,等. 新生大鼠缺氧缺血脑白质损伤模型学习记忆能力的变化.解剖学报,2016,47(6):738-743.
[8] 廖家万,钟敬亮,胡煜辉,等. 低氧对大鼠海马神经元酪氨酸蛋白激酶Fyn表达的影响.解剖学杂志,2011,34(4): 511-513.
[9] Jiang W, Duong TM, de Lanerolle NC. The neuropathology of hyperthermic seizures in the rat. Epilepsia, 1999, 40(1): 5-19.
[10] Back SA, Miller SP. Brain injury in premature neonates: A primary cerebral dysmaturation disorder? Ann Neurol, 2014, 75(4): 469-486.
[11] Buser JR, Maire J, Riddle A, et al. Arrested preoligodendrocyte maturation contributes to myelination failure in premature infants. Ann Neurol, 2012, 71(1): 93-109.
[12] De Avila M, Vassall KA, Smith GS, et al. The proline-rich region of 18.5 kDa myelin basic protein binds to the SH3-domain of Fyn tyrosine kinase with the aid of an upstream segment to form a dynamic complex in vitro. Biosci Rep, 2014, 34(6): 775-788.
[13] Czopka T, Ffrench-Constant C, Lyons DA. Ⅰndividual oligodendrocytes have only a few hours in which to generate new myelin sheaths in vivo. Dev Cell, 2013, 25(6):599-609.
[14] Yamauchi J, Miyamoto Y, Torii T, et al. Phosphorylation of cytohesin-1 by Fyn is required for initiation of myelination and the extent of myelination during development. Sci Signal, 2012, 5(243): 1-15.
[15] Goto J, Tezuka T, Nakazawa T, et al. Loss of Fyn tyrosine kinase on the C57BL/6 genetic background causes hydrocephalus with defects in oligodendrocyte development. Mol Cell Neurosci, 2008, 38(2):203-212.
[16] Haley Peckham, Lauren Giuffrida, Rhiannon Wood, et al. Fyn is an intermediate kinase that BDNF utilizes to promote oligodendrocyte myelination. Glia, 2016, 64(2): 255-269.
Hypoxic-ischemic white matter injury and down-regulation of Fyn, p-ERK and MBP in neonatal rat brain
Lin Ling, Zhang Geng, Qiu Ronghui, Luo Daoshu, Lin Qing*
(Department of Human Anatomy, Histology and Embryology, School of Basic Medical Science, Research Center for Neurobiology, Fujian Medical University, Fuzhou 350122, China)
Objective To understand the role that Fyn-ERK pathway plays in hypoxic-ischemic white matter injury in neonatal rats. Methods 3-day-old new born SD rats were randomly divided into control and hypoxic-ischemic groups. The histology of rat brain tissues 4 weeks after operation was examined using HE staining. The distribution and expression level of Fyn, p-ERK and MBP protein were detected by immunocytochemistry and western blotting. Results The white matter injury was observed in hypoxic-ischemic rats. The levels of Fyn, p-ERK and MBP protein significantly decreased in the brains of hypoxic-ischemic rats, compared to the control group. Conclusion The results suggest that hypoxia-ischemia may decrease MBP level in neonatal rats through downregulating Fyn and p-ERK protein levels, which may lead to oligodendrocyte maturation disorder and white matter injury.
Neonatal hypoxia-ischemia; Fyn protein; myelin basic protein; white matter
R722.6
A DOⅠ:10.16705/ j. cnki. 1004-1850.04.004
2017-04-25
2017-08-02
国家自然科学基金青年科学基金项目(81501305);福建省教育厅重点项目(JA13135)
林凌,女(1982 年),汉族,硕士,实验师
*通讯作者(To whom correspondence should be addressed):linqing522@126.com

