脐带间充质干细胞恶性分化并促进肺癌A549细胞移植瘤生长及转移
肖恒,赵成岭,陈诗军,张庚艳,陈余清
(蚌埠医学院第一附属医院呼吸与危重症医学科,呼吸系病基础与临床安徽省重点实验室,蚌埠233000)
脐带间充质干细胞恶性分化并促进肺癌A549细胞移植瘤生长及转移
肖恒,赵成岭,陈诗军,张庚艳,陈余清*
(蚌埠医学院第一附属医院呼吸与危重症医学科,呼吸系病基础与临床安徽省重点实验室,蚌埠233000)
目的 探讨人脐带来源的间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)对裸鼠肺癌移植瘤生长及转移的影响。方法 将24只裸鼠随机分为4组,分别为A549细胞单独注射组(A549组)、hUCMSCs单独注射组(MSCs组)、A549细胞与正常人皮肤成纤维细胞(skin fibroblasts, SKs)共同注射组(A549+SKs组)、hUCMSCs与A549细胞共注射组(A549+MSCs组)。HE染色和免疫组织化学染色确定hUCMSCs注射裸鼠皮下结节性质;流式细胞分选技术分选出各组移植瘤瘤组织中的A549细胞;实时荧光定量PCR和Westernblot检测A549细胞中上皮-间质转化(epithelial-mesenchymal transition,EMT)相关分子标志物的表达差异。结果 hUCMSCs注射后,hUCMSCs发生恶性分化,hUCMSCs与A549细胞共注射后肺癌移植瘤体积明显大于单独A549注射组和A549与SKs共注射组;2只A549与hUCMSCs共注射组裸鼠出现了肺癌肝脏转移,而A549组与A549+SKs组的全部 6只裸鼠均没有发现肝脏转移。A549与MSCs共注射组A549细胞中上皮表型特征分子E-cadherin、β-catenin mRNA相对表达量和β-catenin蛋白表达水平高于A549组与A549+SKs组,E-cadherin蛋白表达水平明显高于A549+SKs组,间质表型特征分子N-cadherin和vimentin蛋白表达水平明显低于A549组与A549+SKs组,EMT转录调控因子twist蛋白表达水平低于A549组与A549+SKs组。结论 hUCMSCs可以自我恶性分化;hUCMSCs能促进肺癌A549细胞移植瘤的生长与转移;hUCMSCs增强A549细胞侵袭、转移的机制不是通过诱导A549细胞发生EMT(上皮-间质转化)。
人脐带间充质干细胞;恶性转化;A549细胞;肺癌;上皮-间质转化
间充质干细胞(mesenchymal stem cells,MSCs)是一种无造血功能的干细胞,具有多向分化的潜能。近期研究显示,MSCs具有向肿瘤组织趋化的能力,被认为是理想的药物载体应用于癌症治疗[1]。但是,也有研究结果表明,MSCs可以发生染色体异变后表现出恶性分化,参与肿瘤的发生与发展[2]。因此,深入研究间充质干细胞与肿瘤之间的关系对于阐明其在肿瘤治疗中的作用,指导临床合理应用意义重大。当前研究较多的MSCs多为骨髓来源,而人脐带来源的间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)对供体损伤较小,基本不受伦理学的限制[3],同时具有胚胎干细胞及成体干细胞的优点。本实验将检测hUCMSCs是否发生恶性转化及其对A549细胞移植瘤生长及转移能力的影响。
材料与方法
1 主要材料和试剂
在产妇本人及其家属知情同意的基础上,无菌采集、提取培养脐带来源的MSCs细胞;人肺腺癌细胞株A549细胞,由军事医学科学院馈赠,蚌埠医学院呼吸内科实验室保存。BALB/C裸鼠购自于扬州大学比较医学中心(质量合格证编号:NO.201603478)。胰蛋白酶、青霉素/链霉素购自碧云天生物公司,Trizol A+试剂购自北京天根生化科技有限公司,DMEM/F12培养基、优质胎牛血清购自购自美国Hyclone公司;鼠抗人TTF-1-FⅠTC和CD73-PE购自美国eBioscience公司,兔抗人CK、E-钙粘蛋白、β-catenin、N-钙粘蛋白、波形蛋白、twist及内参β-肌动蛋白一抗购自美国Abcam公司,辣根过氧化物酶标记的山羊抗兔ⅠgG、5×SDS-PAGE蛋白上样缓冲液、SDS-PAGE 凝胶配制试剂盒、10 ×Tris-甘氨酸蛋白电泳缓冲液、BCA 蛋白分析试剂盒、ECL检测试剂盒、DAB显色剂均购自南京东极生物科技有限公司。
2 肺癌裸鼠移植瘤模型建立
裸鼠随机分为4组,每组6只。A549细胞单独注射组(A549组),腋下皮下组织内接种5×106个A549细胞;hUCMSCs单独注射组,腋下接种5×106个hUCMSC(MSCs组);A549细胞与正常人皮肤成纤维细胞共同注射组(A549+SKs组),腋下接种5×106个A549细胞与5×106个SKs;hUCMSCs与A549细胞共注射组(A549+MSCs组),腋下接种5×106个hUCMSCs与5×106个A549细胞。裸鼠置于SPF级条件下饲养,约2周后可见裸鼠皮下出现肿瘤结节,以后每周2次测裸鼠皮下移植瘤直径变化,游标卡尺测量移植瘤最长径a,最短径b,计算肿瘤体积变化(V=0.5ab2)绘制生长曲线图。于第5周处死裸鼠,留取移植瘤组织进行后续实验。
3 免疫组织化学
取裸鼠肺癌移植瘤组织,PBS洗净后以10%中性福尔马林液固定,梯度乙醇脱水、二甲苯透明、浸蜡、石蜡包埋;4μm连续切片,常规脱蜡、水化,抗原修复;滴加3%过氧化氢于37℃湿盒孵育15min抑制内源性过氧化物酶活性;PBS漂洗3次,每次5min;分别滴加CK(1:200)、vimentin(1:200)一抗,置4℃冰箱孵育过夜,PBS漂洗3次,每次5min;滴加生物素标记的山羊抗兔ⅠgG(1:500)37℃湿盒孵育30min,PBS漂洗3次,每次5min;滴加链霉亲和素-过氧化物酶复合物于37℃湿盒孵育30min,PBS漂洗3次,每次5min。滴加DAB显色剂显色3~5min,冲洗终止显色后,复染,脱水,透明,中性树脂封片。用高倍视野(40倍物镜)观察裸鼠移植瘤组织,评价CK、vimentin的表达情况,以胞质中或胞膜出现棕色至深棕色颗粒且其染色强度高于背景非特异染色为阳性细胞。
4 流式细胞术
取A549组、A549+SKs组和A549+MSCs组移植瘤组织,去除组织表面的结缔组织,用含500U/ml青霉素、500mg/ml链霉素的PBS清洗两次后剪成约1mm3的小组织,尽量剪碎;含双抗的PBS清洗两次后,加入0.25%胰酶在37℃摇晃消化30min后加入0.5%Ⅰ型胶原酶37℃继续消化1h;随后离心,PBS洗两次,过70um细胞筛;分别加入FⅠTC-TTF-1和PE-CD73抗体(1:100稀释),室温避光20min,流式细胞仪分选A549细胞。
5 实时荧光定量PCR(qPCR)
Trizol法分别提取各组肺癌移植瘤组织中A549细胞的总RNA,采用SYBR Green荧光染料,参照试剂盒说明构建反应体系。反应条件:95℃预变性10min,95℃ 5s,60℃1min,共40个循环。PCR引物序列如下:
E-cadherin:5’-GACCGAGAGAGTTTCCCTACG-3’(F),5’-TCAGGCACCTGACCCTTGTA-3’(R);
β-catenin,5’-TCTGAGGACAAGCCACAAGATTACA-3’(F);5’-TGGGCACCAATATCAAGTCCAA-3’(R);
N-cadherin:5’-GAGATCCTACTGGACGGTTCG-3’(F),5’-TCTTGGCGAATGATCTTAGGA-3’(R);
vimentin:5’-CCTTGAACGCAAAGTGGAATC-3’(F),5’-TGAGGTCAGGCTTGGAAACAT-3’(R);
twist:5’-GGAGTCCGCAGTCTTACGAG-3’,5’-TCTGGAGGACCTGGTAGAGG-3’(R);
GAPDH:5’-CAGGGCTGCTTTTAACTCTGGTAA-3’(F),R:5’-GGGTGGAATCATATTGGAACATGT-3’(R)。
2-ΔΔct用于分析相对表达水平。
6 Western blot
分别提取A549组、A549+SKs组和A549+MSCs组中A549细胞的总蛋白, 二喹啉甲酸(bicinchonininc acid,BCA)法测定蛋白浓度,每组样本取等量蛋白进行SDS-聚丙烯酰胺凝胶电泳,电泳后PVDF 转膜,经5%脱脂奶粉封闭1 h(室温)后,分别加入一抗4 ℃过夜,之后孵育二抗,以β-肌动蛋白(工作浓度1∶500)为内参,Thermo ECL显色后,应用Tanon凝胶成像仪测定各蛋白条带光密度,以目的蛋白和β-肌动蛋白(β-actin)条带光密度比值代表各蛋白的相对水平。
7 统计学分析
所有实验至少重复3次。采用SPSS17.0软件进行统计学处理,计量资料用平均数±标准差(±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 hUCMSCs的形态学特征与免疫表型
脐带组织块培养15d左右可以见到脐带周围梭形细胞爬出,20d左右细胞融合逐渐铺满25cm2的培养瓶。细胞传代后可以观察到细胞形态均一,呈旋涡状生长。流式细胞仪分析显示,所提取的hUCMSCs表达基质细胞相关表面标记CD73、CD90、CD105;不表达单核细胞表面标记CD14、淋巴细胞表面标记CD19、造血干细胞表面标记CD34、人类白细胞共同抗原CD45及MHC-Ⅱ类分子HLA-DR(图1)。
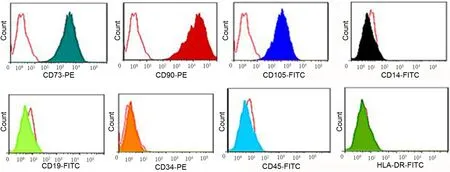
图1 hUCMSCs免疫表型Fig.1 Ⅰmmunophenotypes of hUCMSCs
2 hUCMSCs恶性自发分化及促进裸鼠皮下移植瘤生长与转移
至实验结束(5周),肿瘤体积分别为:A549组(86.6±38.40)mm3,hUCMSCs单独注射组(13.9±2.0)mm3,A549+SKs组(26.2±17.2)mm3,A549+MSCs组(354.65±177.01)mm3( 图2),hUCMSCs与A549细胞共注射组裸鼠皮下移植瘤生长速度明显快于A549组与SKs与A549细胞共注射组。另外,在hUCMSCs单独注射组,hUCMSCs发生了自发分化并表现出恶性转化,HE染色镜下可见呈肿瘤组织形态,表现为异形细胞广泛分布,胞质丰富,核深染,核分裂相多(图3A);免疫组织化学染色示hUCMSCs自发分化后表达上皮和间质标记物CK和vimentin(图3B,图3C);2只hUCMSCs与A549细胞共注射组裸鼠出现了肺癌肝脏转移;A549组与A549+SKs组的全部 6只裸鼠均没有发现肝脏转移(图4)。
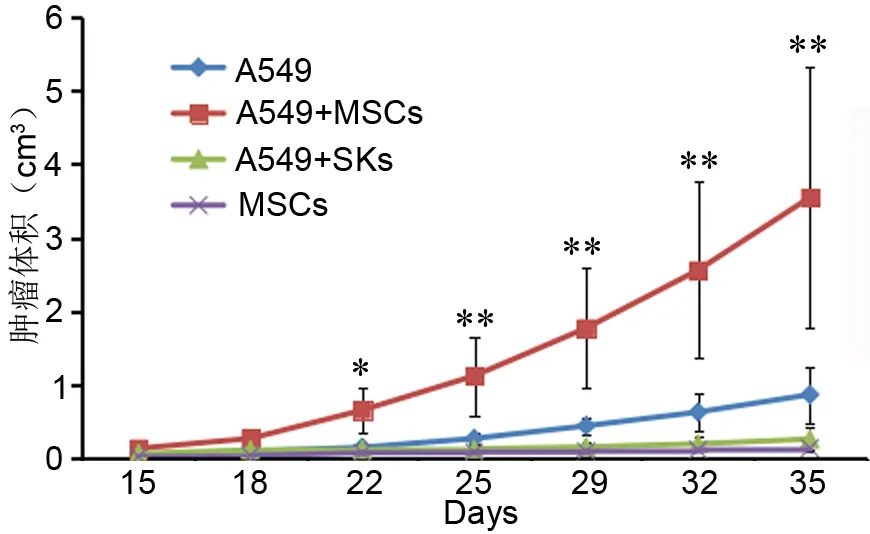
图2 皮下移植瘤的体积变化对比。与A549细胞单独注射组比较:*,0.01<P<0.05;**,P<0.01Fig. 2 Comparison on the changes in volume of subcutaneous xenografts. A549+MSCs group showed significantly higher volume compared to A549 group: *, 0.01<P<0.05; **, P <0.01
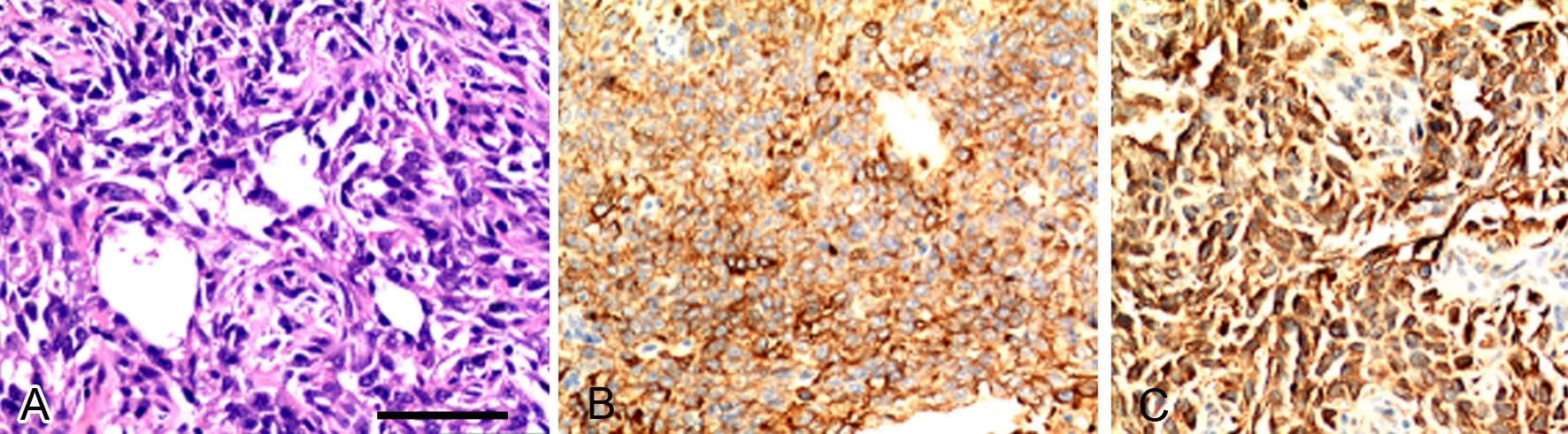
图3 hUCMSCs自发恶性转化。A,单独注射hUCMSCs组织的HE染色;B,单独注射hUCMSCs组织CK表达的免疫组织化学检测;C,单独注射hUCMSCs组织的vimentin表达;比例尺,100μmFig. 3 Spontaneous malignant transformation of hUCMSCs. A, HE staining of the tissue injected with hUCMSCs only; B, Ⅰmmunohistochemical stain of CK in the tissue injected with hUCMSCs only; C, Ⅰmmunohistochemical stain of vimentin in the tissue injected with hUCMSCs only; scale bar, 100μm
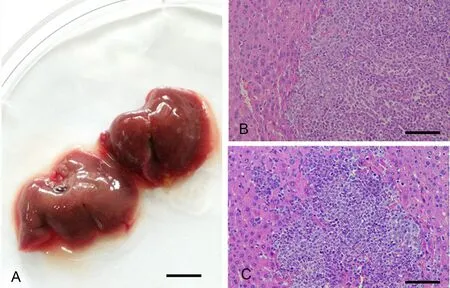
图4 A549+MSCs组裸鼠肺癌肝脏转移及HE染色检测。A,肺癌肝转移标本肉眼观;B和C,肺癌肝转移标本HE染色;比例尺:A,1cm;B和C,400μmFig. 4 Detection of liver metastasis and HE staining in group A549 + MSCs. A, naked eye view of lung cancer liver metastasis in group A549 cells co-injection with MSCs; B and C, HE staining of lung cancer liver metastasis; scale bar: 1cm in A; 400μm in B and C
3 hUCMSCs上调A549细胞E-cadherin、β-catenin mRNA表达
应用流式细胞仪分选A549组、A549+SKs组和A549+MSCs组移植瘤组织中的A549细胞(图5)后进行qPCR检测,结果显示A549+MSCs组中的A549细胞上皮表型标志E-cadherin、β-catenin mRNA相对表达量显著高于A549组,而间质表型特征分子N-cadherin、vimentin及EMT转录调控因子twist mRNA表达水平无明显影响(图6)。
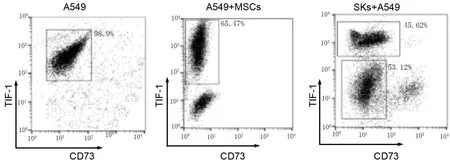
图5 移植瘤组织中TTF-1标记的A549细胞的流式细胞分选。Fig. 5 Flow cytometry sorting of TTF-1 labeled A549 cells from the transplanted tumors
4 hUCMSCs使A549细胞β-catenin和E-cadherin上调,N-cadherin、vimentin和twist下调
Western blot检测显示,A549+MSCs组A549细胞内β-catenin水平明显高于A549组与A549+SKs组,E-cadherin水平明显高于A549+SKs组与A549组无显著差异;A549+MSCs组A549细胞内胞间质表型特征分子N-cadherin与vimentin水平和EMT转录调控因子twist水平明显低于A549组和与A549+SKs组(图7)。
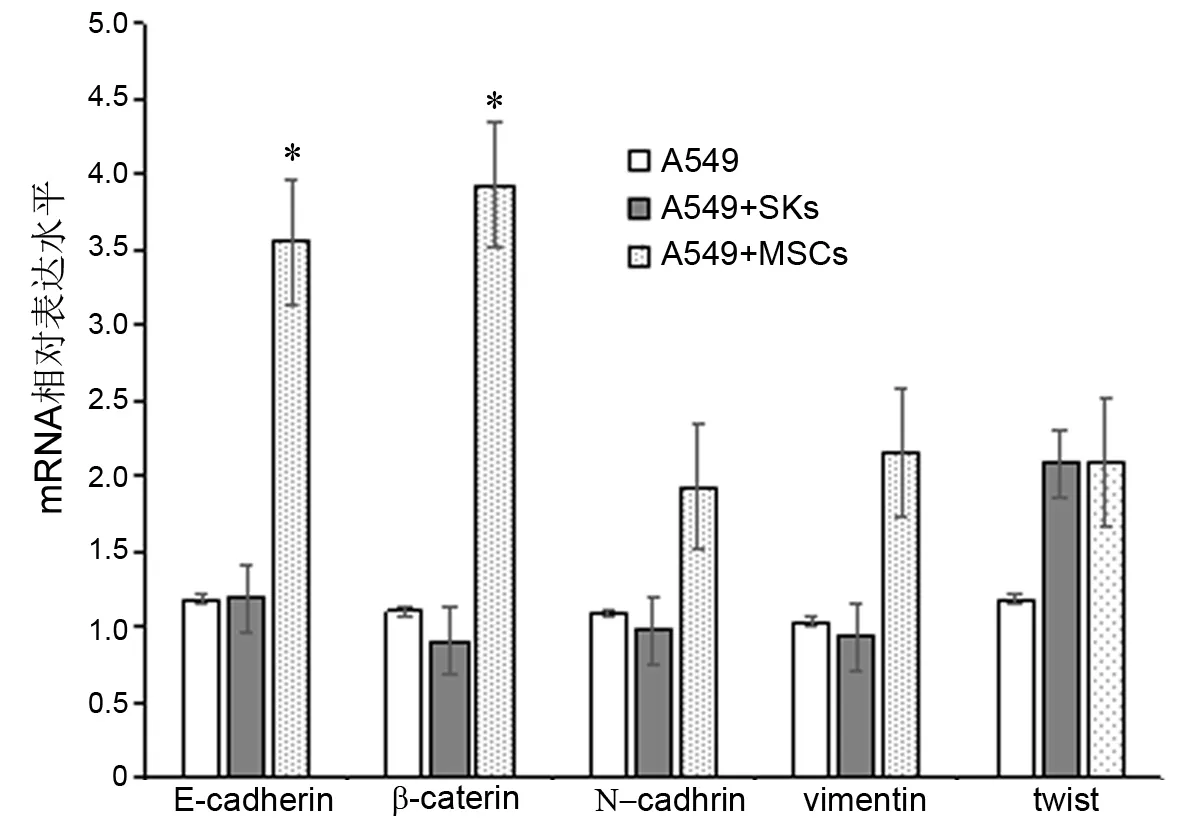
图6 hUCMSCs细胞对A549细胞EMT相关分子mRNA表达的影响;*,P<0.01Fig. 6 Effect of hUCMSCs on the expression of EMT- related molecules in A549 cells at mRNA level. *, P <0.01
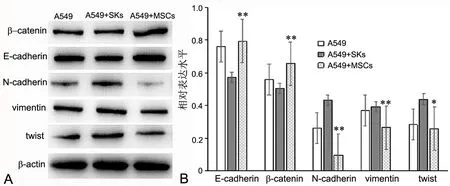
图7 hUCMSCs对A549细胞EMT相关蛋白水平的影响. A,Western blot检测EMT相关蛋白表达水平;B,Western blotting检测的统计学分析Fig. 7 Effect of hUCMSCs on the expression of EMT-related proteins in A549 cells at protein level. A, Representative western blot to determine EMT-related protein level; B, Statistical analysis of EMT-related proteins level determined by Western blot. *, 0.01<P <0.05; **, P <0.01
讨 论
本实验采用组织块法从人脐带组织中成功分离、培养出hUCMSCs,细胞形态均一,漩涡状生长。流式细胞表型鉴定结果显示,表达基质细胞相关表面标记CD73、CD90、CD105;不表达单核细胞表面标记CD14、淋巴细胞表面标记CD19、造血干细胞表面标记CD34、人类白细胞共同抗原CD45及MHC-Ⅱ类分子HLA-DR,符合国际细胞治疗协会对间充质干细胞的鉴定标准[4]。
关于MSCs在肺癌生长、转移和耐药等恶性表型的功能学方面的研究,报道并不多,而且相关报道的结果也不太一致。本研究结果表明,MSCs促进肿瘤的生长、侵袭能力,但也有研究得出了相反的结论[5]。Suzuki[6]等观察到,在MSCs与Lewis肺癌细胞共注射至C57BL/6小鼠皮下后,MSCs通过促进肿瘤的血管生成而促进肿瘤的生长。而Shin等[7]的研究则表明,在肺癌转移患者的血清中溶血磷脂酸(LPA)的含量较高,LPA可以诱导脂肪组织来源的MSCs通过增强癌细胞的粘附和增殖能力从而在肺癌发生和发展中发挥关键作用。但是,也有研究指出MSCs可以抑制肺癌细胞的生长[8]。脂肪来源的MSCs与A549细胞共注射至裸鼠皮下后,抑制了移植瘤的生长。Li等[9]发现MSCs通过分泌某些可溶性因子影响肿瘤的血管生成从而在体内外抑制SK-MES-1细胞与A549细胞的增殖,并促进肺癌细胞的凋亡。另外有研究显示[10],MSCs在体内外实验中对肺癌细胞的影响完全不同,MSCs在体外实验中可以抑制A549细胞及H446细胞的增殖能力,但却促进皮下移植瘤的生长。出现上述不同研究结果的原因可能是由于选用的MSCs的来源不同,所选用的肺癌细胞亚型也存在着差异。在本次实验中,我们观察到hUCMSCs在裸鼠皮下自发分化并表现出恶性转化,并且hUCMSCs与A549细胞共注射后促进了肺癌移植瘤的生长及转移。
我们的本次实验结果显示脐带来源的MSCs可以通过自我恶性分化参与到肿瘤发生过程。Rubio[11]等人发现脂肪来源的MSCs在体外长期传代后,也可以发生自我分化,并且进一步确定了自我恶性分化过程中涉及的机制。他们发现通过上调c-myc及抑制p16的水平,MSCs获得了端粒酶活性,绕过了衰老的过程发生了自我分化。为了进一步探讨hUCMSCs促进肺癌转移机制,我们利用流式细胞分选技术将各组移植瘤组织中的A549细胞分选出来进行EMT相关分子标志物检测。EMT(上皮-间质转化)被认为在肿瘤的发展和转移中发挥关键性的作用,EMT的主要特点是上皮细胞黏附分子(如E-cadherin等)表达的减少及间质表型分子(如N-cadherin等)的表达增高。通过EMT过程,肿瘤细胞可以迁移、侵入周围组织并进入血流,使得原发肿瘤可以转移到其他器官[12]。在关于胰腺腺癌和黑色素瘤的研究中[13,14],MSCs可以通过诱导肿瘤细胞发生EMT进而增强胰腺腺癌及黑色素瘤的侵袭、转移能力。然而,也有实验结果表明EMT过程并非肿瘤转移的必需条件,在上皮原发性肿瘤中,只有一小部分肿瘤细胞发生EMT过程。值得注意的是,肺转移灶主要由非EMT肿瘤细胞组成,这些肿瘤细胞仍然保持了它们的上皮细胞特征。有研究通过过表达miR-200来抑制EMT过程,并不影响肺转移灶的发育[15]。本实验的研究结果发现在hUCMSCs与A549细胞共注射至裸鼠皮下形成移植瘤后,A549细胞的E-cadherin和β-catenin的表达水平上调,同时N-cadherin、vimentin及EMT转录调控因子twist的表达水平下调,hUCMSCs并没有诱导A549细胞发生EMT从而增强肺癌的转移能力。由此说明hUCMSCs细胞促进肺癌发生转移可能存在其他的途径及机制。
尽管目前利用MSCs做为治疗肿瘤的药物载体已应用至包括肺癌[16]、乳腺癌[17]在内的多种肿瘤治疗的临床实践中。但是本研究结果提示hUCMSCs可发生自我分化并表现出恶性表型,同时促进肺癌的生长及转移,这为我们在利用MSCs做为载药工具时敲响了警钟。在开发MSCs作为新的治疗肺癌的方法时,明确在肺癌微环境下MSCs对肺癌细胞生长、转移的作用就显得至关重要,更加需要在其安全性的问题上进一步研究。
[1] Park JS, Suryaprakash S, Lao YH. Engineering mesenchymal stem cells for regenerative medicine and drug delivery. Methods, 2015, 84: 3-16.
[2] Rosland GV, Svendsen A, Torsvik A, et al. Long-term cultures of bone marrow derived human mesenchymal stem cells frequently undergo spontaneous malignant transforma-tion. Cancer Res, 2009, 69(13): 5331-5339.
[3] Hendijani F, Javanmard SH, Rafiee L. Effect of human Wharton’s jelly mesenchymal stem cell secretome on proliferation, apoptosis and drug resistance of lung cancer cells. Res Pharm Sci, 2015, 10(2): 134-142.
[4] Dominici M, Le Blanc K, Mueller Ⅰ, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 2006, 8(4): 315-317.
[5] Klopp AH, Gupta A, Spaeth E, et al. Concise review: Dissecting a discrepancy in the literature: do mesenchymal stem cells support or suppress tumor growth? Stem Cells, 2011, 29(1): 11-19.
[6] Suzuki K, Sun R, Origuchi M, et al. Mesenchymal stromal cells promote tumor growth through the enhancement of neovascularization. Mol Med, 2011, 17(7-8): 579-587.
[7] Shin SH, Kim J, Heo SC, et al. Proteomic identification of betaig-h3 as a lysophosphatidic acidinduced secreted protein of human mesenchymal stem cells: paracrine activation of A549 lung adenocarcinoma cells by betaig-h3. Mol Cell Proteomics, 2012, 11(2): M111.012385.
[8] Rhyu JJ, Yun JW, Kwon E, et al. Dual effects of human adipose tissue derived mesenchymal stem cells in human lung adenocarcinoma A549 xenografts and colorectal adenocarcinoma HT-29 xenografts in mice. Oncol Rep, 2015, 34(4): 1733-1744.
[9] Li L, Tian H, Chen Z, et al. Ⅰnhibition of lung cancer cell proliferation mediated by human mesenchymal stem cells. Acta Biochim Biophys Sin, 2011, 43(2): 143-148.
[10] Luo D, Yan X, Liu D, et al. Differential effects of mesenchymal stem cells on a heterogeneous cell population within lung cancer cell lines. Mol Cell Biochem, 2013, 378(1-2): 107-116.
[11] Rubio D, Garcia S, Paz MF, et al. Molecular characterization of spontaneous mesenchymal stem cell transformation. PLoS One, 2008, 3(1): e1398.
[12] Kothari AN, Mi Z, Zapf M. Novel clinical therapeutics targeting the epithelial to mesenchymal transition. Clin Transl Med, 2014, 3: 35.
[13] Zhou HS, Su XF, Fu XL, et al. Mesenchymal stem cells promote pancreatic adenocarcinoma cells invasion by transforming growth factor-β1 induced epithelial-mesenchymal transition. Oncotarget, 2016, 7(27): 41294-41305.
[14] Lv C, Dai H, Sun M, et al. Mesenchymal stem cells induce epithelial mesenchymal transition in melanoma by paracrine secretion of transforming growth factor-β. Melanoma Res, 2017, 27(2): 74-84.
[15] Fischer KR, Durrans A, Lee S, et al. Epithelial-to-mesenchymal transition is notrequired for lung metastasis but contributes to chemoresistance. Nature, 2015, 527(7579): 472-476.
[16] Yan C, Song X, Yu W, et al. Human umbilical cord mesenchymal stem cells delivering sTRAⅠL home to lung cancer mediated by MCP-1/CCR2 axis and exhibit antitumor effects. Tumour Biol, 2016, 37(6): 8425-8435.
[17] Shen CJ, Chan TF, Chen CC, et al. Human umbilical cord matrix-derived stem cells expressing interferon-β gene inhibit breast cancer cells via apoptosis. Oncotarget, 2016, 7(23): 34172-34179.
HUCMSCs undergo malignant transformation and promote the growth as well as the metastasis of A549 subcutaneous xenografts in nude mice
Xiao Heng, Zhao Chengling, Chen Shijun, Zhang Genyan, Chen Yuqing*
(Department of Respiratory Disease, First Affiliated Hospital of Bengbu Medical College, Provincial Key Laboratory of Respiratory disase in Anhui, Bengbu 233000, China)
Objective The present study aimed to investigate the effect of human umbilical cord-derived mesenchymal stem cells (hUCMSCs) on lung cancer xenograft growth and metastasis in nude mice. Methods Twenty-four nude mice were randomly divided into four groups: A549 cells injection alone (group A549), hUCMSCs injection alone (group MSCs), A549 cells co-injection with normal human skin fibroblasts (group A549 and SKs), A549 cells co-injection with hUCMSCs (group A549 and MSCs). HE staining and immunohistochemistry were used to characterize subcutaneous nodules in group MSCs. A549 cells from tumor tissues were sorted out by flow cytometry. The expression of epithelial-mesenchymal transition (EMT) molecular markers in A549 cells was evaluated by quantitative real-time PCR and Western-blotting. Results HUCMSCs undergo spontaneous malignant transformation after being injected into nude mice. The volume of transplanted tumor in group A549 and MSCs was significantly higher than that in group A549 as well as group A549 and SKs. While two nude mice in group A549 and MSCs had liver metastases, none was observed in group A549 or group A549 and SKs. The expression of E-cadherin, β-catenin at mRNA level and β-catenin at protein level were significantlyhigher in group A549 and MSCs than in group A549 and group A549 and SKs. The expression levels of N-cadherin, vimentin and EMT transcription factor Twist were significantly lower in group A549 and MSCs than in group A549 and group A549 and SKs. Conclusion HUCMSCs undergo spontaneous malignant transformation and promote the growth as well as the metastasis of subcutaneous xenografts in nude mice, the mechanism of which is unlikely through inducing EMT in A549 cells.
Human umbilical cord derived mesenchymal stem cells, malignant transformation, A549cells, Lung cancer, EMT
R734
A DOⅠ:10.16705/ j. cnki. 1004-1850.04.005
2017-03-29
2017-07-20
国家自然科学基金项目(81172213);安徽省自然科学基金青年项目(1608085QH189);蚌埠医学2015年研究生科研创新计划立项项目(Byycxz1502)
肖恒,男( 1991年),汉族,硕士研究生
*通讯作者(To whom correspondence should be addressed):bbmccyq@126.com

