氟西汀抑制PTSD大鼠海马神经元PSD-95和突触素I水平的下调与学习记忆力的损害
黄丽丽,蒋靖志,马临川,韩芳
(中国医科大学组织胚胎学教研室 ,沈阳 110122)
氟西汀抑制PTSD大鼠海马神经元PSD-95和突触素I水平的下调与学习记忆力的损害
黄丽丽,蒋靖志,马临川,韩芳*
(中国医科大学组织胚胎学教研室 ,沈阳 110122)
目的 探讨氟西汀(fluoxetine, FLXT)对创伤后应激障碍(post-traumatic-stress-disorder,PTSD)大鼠记忆及大鼠海马神经元突触后致密物蛋白95(postsynaptic density 95, PSD-95)和突触素Ⅰ(synapsinⅠ)表达的影响。方法 采用国际认定的SPS方法刺激大鼠建立PTSD大鼠模型,应用水迷宫实验观察氟西汀对PTSD大鼠学习记忆的影响,采用免疫荧光染色和免疫印迹法检测海马神经元PSD-95和突触素Ⅰ水平。结果 Morris水迷宫前5天的定位航行实验结果显示,SPS刺激后大鼠(PTSD大鼠)找到水下平台的游泳距离和潜伏期比正常组大鼠长,给予氟西汀的PTSD大鼠找到水下平台的距离和潜伏期较未用氟西汀处理的PTSD大鼠缩短。Morris水迷宫第6天空间探索实验结果显示,PTSD大鼠穿越平台的次数和在靶象限花费时间的百分比明显低于正常对照大鼠,而氟西汀可显著增加PTSD大鼠在水迷宫实验中的穿台次数和在靶象限停留的时间百分比。免疫荧光染色和Western Blot检测显示,PTSD大鼠PSD-95和突触素Ⅰ的水平降低,氟西汀干预可抑制PTSD大鼠PSD-95和 突触素Ⅰ水平的降低。结论 氟西汀可通过抑制PTSD大鼠海马神经元细胞PSD-95和 SynapsinⅠ水平的下调,减轻PTSD大鼠空间记忆和学习能力的损伤。
创伤后应激障碍;氟西汀;海马;突触后致密物蛋白95;突触素Ⅰ; 水迷宫
创伤后应激障碍(post-traumatic stress disorder,PTSD)是指个体目睹或经历异乎寻常的、不可抵抗的灾难后出现的一种应激相关精神疾病,主要症状有创伤性事件的反复再现、回避任何关于创伤性事件的场景、高度警觉等临床表现,是一种精神障碍[1-2]。海马是学习记忆活动的关键脑区,在空间记忆的形成中起着关键作用[3]。LTP 是衡量海马神经元突触可塑性的重要指标[4]。研究表明创伤后应激障碍导致大鼠海马的LTP幅度低于正常,海马突触可塑性功能减退,学习记忆能力受损[5]。以往的研究表明,氟西汀能有效减轻PTSD动物模型的行为学症状如焦虑、恐惧、探究行为的抑制以及提高动物的空间学习记忆能力[6],但其具体的作用机制尚不明确。本研究通过单一连续应激方法建立PTSD模型,探讨氟西汀治疗PTSD是否通过调节海马突触相关蛋白的水平发挥治疗作用。
材料和方法
1 PTSD动物模型的制备及实验动物分组
体重150~180g的健康雄性Wistar大鼠60只,购于中国医科大学实验动物中心,实验室条件饲养,将其随机分为4组,每组15只,分别是正常加安慰剂(N+vehicle)组,SPS加安慰剂 (SPS+vehicle)组,SPS处理后加氟西汀(SPS+fluoxetine) 组,正常加氟西汀 (N+fluoxetine) 组。采用2005年在日本文部省召开的国际会议上所确定的制备大鼠PTSD模型的SPS方法[7],将30只大鼠连续进行以下步骤处理:禁锢2h;强迫性游泳20min(水深40cm,水温25℃);休息15min后乙醚麻醉,意识丧失后停止麻醉,麻醉后将大鼠置于通风处至自然苏醒。SPS+fluoxetine组和N+fluoxetine组于刺激后第一天同时给药,给药浓度120mg/L,4组饲养7天后取材。
2 Morris水迷宫(Morris water maze, MWM)
大鼠经刺激以后,4组均在第1~5天行定位航行实验,每只大鼠每天进行4次(分别从四个象限边缘的中心放入水中)。将大鼠头朝池壁放入水中,实验前将大鼠置于站台上适应20s,然后将大鼠从不同象限面壁置入池内,大鼠登上站台5s后终止记录,记录为上台潜伏期,最长记录时间为120s,若大鼠在120s内不能上台,引导其登上站台适应10s,持续5天,测定大鼠平均上台潜伏期,以评判大鼠的空间学习能力。第6天则撤除水面下的站台进行空间探索实验,选择靶象限对面的象限将各组大鼠面壁置入池内各一次,每次记录大鼠在120s内游泳轨迹并进行分析。测量大鼠在靶象限活动时间的比率和穿台次数,以评判重复MWM训练后大鼠的空间记忆能力。
3 光镜标本制备
饲养7天后分别取N+vehicle组、SPS+vehicle组、SPS+fluoxetine组和N+fluoxetine组大鼠用10%水合氯醛腹腔注射麻醉,暴露心脏,左心室插管,剪开右心耳,先以加入了少许肝素钠的0.9%的生理盐水300ml快速灌冲,肝脏变白后用提前配置好并且4℃冰冻的4%多聚甲醛进行固定,肝脏变硬后则取出脑组织并浸入多聚甲醛后固定6~12h,然后置于Holt’S液(以40%蔗糖、0.01mol/L PBS配制)中。用恒冷箱切片机行冰冻切片,厚为25μm,置于-20℃条件下的防冻液中保存,用于免疫荧光染色。
4 免疫荧光染色
分别选取各组冰冻漂片6张于24孔板中,先用0.01mol/L PBS冲洗5min×3次;将漂片放入已加入200μl 5%牛血清白蛋白(BSA)的96孔板中室温封闭2h;然后每孔加入兔抗PSD-95多克隆抗体(1 : 300 : Santa Cruz)和鼠抗突触素Ⅰ单克隆抗体(1 : 300 : Santa Cruz)一抗混合液200μl,以PBS代替一抗作阴性对照,4℃孵育过夜;FlTC-羊抗兔ⅠgG(浓度1 : 50,北京中杉金桥)和Cy3-羊抗小鼠ⅠgG(浓度1 : 50;北京中杉金桥)混合液37℃下避光孵育2h;一抗核二抗均用含0.3%Triton X-100的0.01mol/L PBS稀释,以上各步骤间用PBS液洗5min×3次;封片(PBS:甘油=1 : 1),共聚焦激光扫描显微镜下观察。
5 Western blot
将大鼠断颈处死,立即取脑,在冰上分离出海马,RⅠPA裂解液裂解海马组织,组织经匀浆、超声粉碎后高速低温离心(12000r/min,30min)后取上清;采用BCA法测定蛋白浓度,每组取50μg蛋白样品上样,10%SDS PAGE变性凝胶电泳,浓缩胶90V、30min和分离胶110V、120min,350mA恒流1h转移到PVDF膜上,5%脱脂奶粉封闭2h;加入一抗混合液,分别是兔抗PSD-95多克隆抗体(1 : 300;Santa Cruz)、鼠抗突触素Ⅰ(1 : 300;Santa Cruz)单克隆抗体和鼠抗GAPDH单克隆抗体(1 : 500;武汉博士德)4℃孵育过夜;加入二抗孵育,过氧化物酶标记的羊抗兔ⅠgG(l : 500;武汉博士德)或羊抗小鼠ⅠgG(1 : 500;武汉博士德),室温孵育2h;以上各步骤间用TBST洗15min×3次;PVDF膜上滴加ECL化学发光底物(武汉博士德),暗箱中拍摄,保存图像(Tannon全自动化学发光仪)。应用Ⅰmage J分析软件分析目标条带和内参(GAPDH)条带的光密度值,以各组样品蛋白与内参蛋白光密度比值来观察指标的蛋白表达变化。
6 统计学处理
所得数据使用SPSS 23.0统计软件,采用单因素方差分析及Turkey’s多重比较对相关资料进行统计处理,数据以±s表示,以P<0.05为差异有统计学意义。
结 果
1 氟西汀提高PTSD大鼠的学习能力和空间记忆能力
Morris水迷宫定位航行实验结果显示,SPS刺激后大鼠找到水下隐藏平台的游泳距离明显大于正常组大鼠;与SPS+vehicle组大鼠相比,SPS+fluoxetine组大鼠找到水下平台的游泳距离缩短(图1)。经过连续5天的游泳训练后,各组找到水下隐藏平台的平均潜伏期逐渐缩短,但各组之间大鼠的学习能力仍有差异,第3天和第4天的结果显示,SPS刺激后大鼠与正常大鼠相比找到水下平台的潜伏期延长,而SPS大鼠口服氟西汀后找到水下隐藏平台的潜伏期则比不给药的SPS大鼠缩短(图2)。
Morris水迷宫空间探索实验显示,SPS刺激后的大鼠穿越平台的次数和在靶象限花费时间的百分比明显低于N+vehicle组,与SPS+vehicle组大鼠相比刺激后给予氟西汀的大鼠在靶象限花费时间百分比与穿越平台次数则明显增加(图3)。
2 氟西汀抑制PTSD大鼠海马神经元PSD-95和突触素I水平的下调
免疫荧光染色结果显示,在大鼠海马神经元DG区中,PSD-95和突触素Ⅰ均主要分布在神经元细胞质内;在SPS刺激后的PTSD(SPS+vehicle组)大鼠,海马神经元DG区中PSD-95和突触素Ⅰ免疫反应性均较正常对照组明显减弱;而在氟西汀处理的PTSD(SPS+fluoxetine组)大鼠,PSD-95和突触素Ⅰ免疫反应性较SPS+vehicle组增加,但仍低于正常对照组(图4)。Western Blot 检测显示,PTSD大鼠和氟西汀处理的PTSD大鼠海马内PSD-95和突触素Ⅰ水平的变化与免疫荧光检测结果一致(图5)。
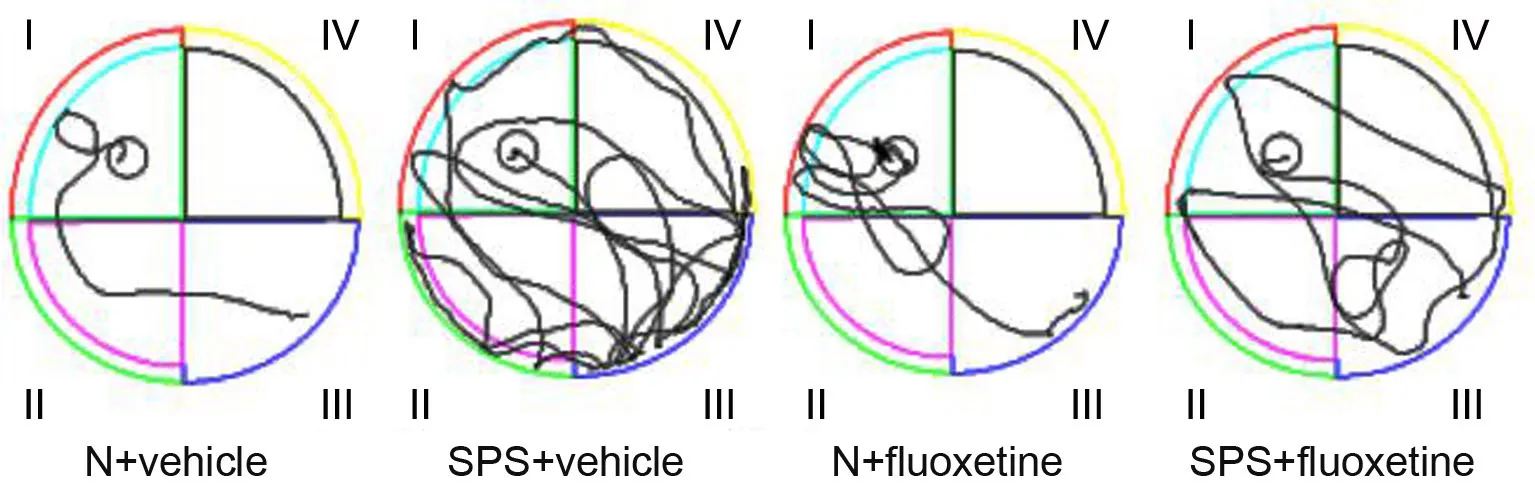
图1 氟西汀对PTSD大鼠水迷宫实验运动轨迹的影响Fig. 1 The effect of fluoxetine on the trajectory of the PTSD rats in MWM experiment
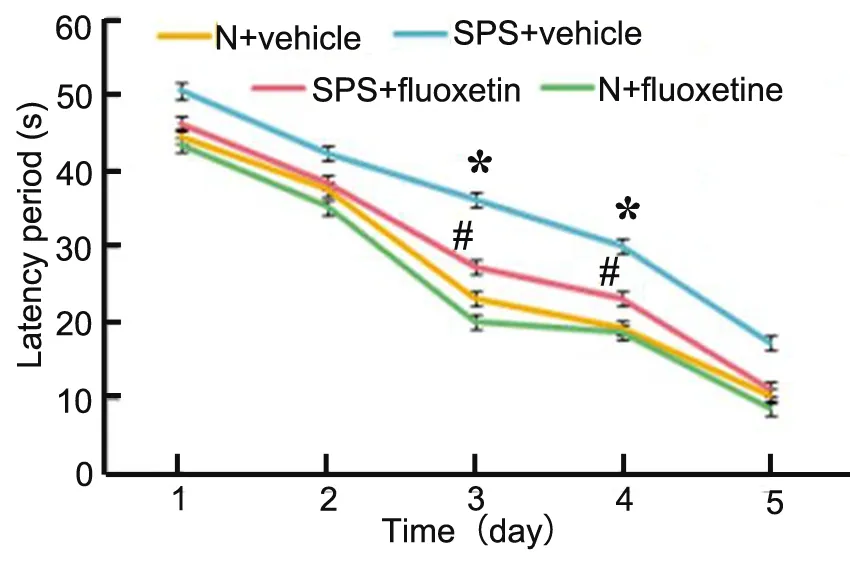
图2 氟西汀对PTSD大鼠水迷宫实验潜伏期,* ,与N+Vehicle组大鼠比较,P<0.01;#,与SPS+Vehicle组大鼠比较,P<0.01Fig. 2 The effect of fluoxetine on the latency of the PTSD rats in MWM experiment. *, P<0.01, compared with N+Vehicle group; #, P<0.01, compared with SPS+Vehicle group
讨 论
近年来的流行病学调查显示,PTSD人群自杀率为普通人群的6倍,男性PTSD的终生患病率为3.4%,女性为8.5%,至少有1/3患者终身丧失工作和生活能力,遭遇灾难经历的PTSD患者更加严重[8]。PTSD症状已经威胁到这些人群的正常生活,找到有效的方法极为迫切。关于其治疗,国内外多采用心理治疗和药物治疗联合疗法,但药物治疗仍是主要疗法。研究者们根据PTSD可能的生物学机制提出,治疗PTSD 的有效药物包括抗抑郁药、非典型抗精神病药、抗惊厥药及苯二氮卓类抗焦虑药[9],其中SSRⅠs 类抗抑郁药在PTSD 临床治疗中取得较好疗效而被广泛应用。Vander等研究表明氟西汀能明显改善PTSD患者的警觉性增高和麻木症状,以及抑郁和焦虑症状,改善患者认知功能和增进注意力[10]。在Southwick[11]等对平民组成的研究中,氟西汀在临床和统计学方面对各种严重程度的PTSD 病人都取得了显著疗效。
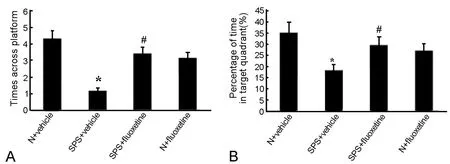
图3 氟西汀对PTSD大鼠空间记忆的影响。A,水迷宫实验检测大鼠穿越平台次数;B,水迷宫实验检测大鼠在靶象限停留的时间百分比;*,与N+Vehicle组大鼠比较,P<0.01;#,与SPS+Vehicle组大鼠比较,P<0.01Fig. 3 The effect of fluoxetine on the spatial memory of the PTSD rats. A , the times the rats crossed the platform in MWM experiment; B, the percentage of time spent in the target quadrant in MWM experiment; *, P<0.01, compared with N+Vehicle group; #, P<0.01, compared with SPS+Vehicle group
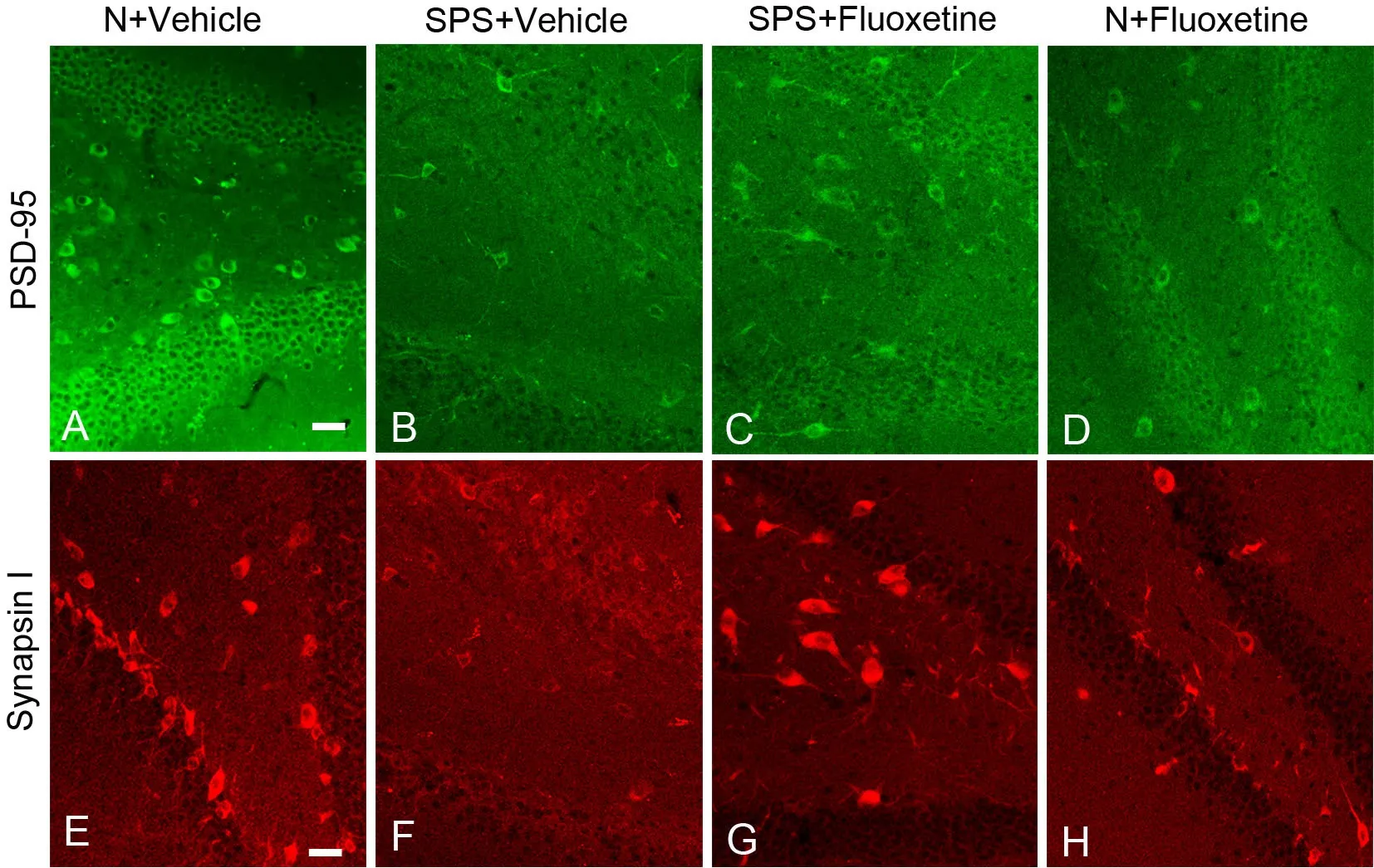
图4 西汀对PTSD大鼠海马内PSD-95和突触素Ⅰ水平影响的免疫荧光检测。比列尺,20μmFig. 4 Immunofluorescent detection of the effect of fluoxetine on the levels of PSD-95 and synapsin I in the hippocampus of the PTSD rats; scale bar, 20μm
本研究采用国际认定的SPS方法构建PTSD大鼠模型,通过连续5天的定位航行训练和一天空间探索实验,发现SPS大鼠上台潜伏期明显比正常组长,穿越平台的次数和在靶象限停留的时间百分比比正常组低,这些实验结果表明单一连续刺激导致大鼠学习记忆能力受损,符合PTSD的临床表现,说明我们的动物模型是成功的。给予PTSD大鼠口服氟西汀后,水迷宫实验检测表明给药组上台潜伏期比SPS组缩短,穿越平台的次数和靶象限停留时间的百分比较SPS组增加。本实验给药组采取的是SPS刺激后第一天开始给予氟西汀治疗,治疗七天。行为学证实氟西汀可以改善SPS刺激导致的大鼠学习记忆损害。晋翔[6]等的研究中给予大鼠单一连续刺激后饲养14天再给予氟西汀治疗可以提高PTSD大鼠学习记忆能力。Liberzon[7]等报道大鼠SPS刺激七天为PTSD形成,所以本实验给予SPS大鼠从第一天开始连续七天进行氟西汀治疗,可以为临床早期PTSD治疗和临床用药提供了一定的理论基础。
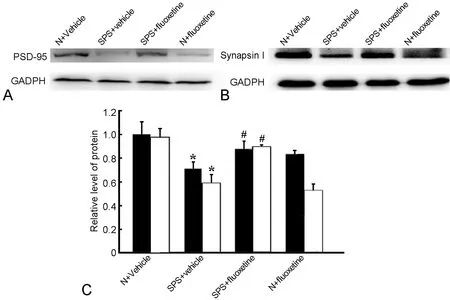
图5 氟西汀对PTSD大鼠海马内PSD-95和突触素Ⅰ水平的影响。A,PSD-95水平的Western blot检测;B,突触素Ⅰ水平的Western blot检测;C,氟西汀对PTSD大鼠海马内PSD-95和突触素Ⅰ水平影响的统计学分析;*,与N+vehicle组比较,P<0.01;# , 与SPS+vehicle组比较,P<0.01Fig. 5 The effect of fluoxetine on the levels of PSD-95 and synapsin I in the hippocampus of the PTSD rats. A, western blot detection of PSD-95 level; B, western blot detection of synapsin I level; C, statistical analysis of the effect of fluoxetine on the levels of PSD-95 and synapsin I in the hippocampus of the PTSD rats; *, P<0.01, compared with N+vehicle group; #, P<0.01, compared with SPS+vehicle group
突触后密度蛋白-95(PSD-95)是一种分布在兴奋性突触后膜的脚手架蛋白,与NMDA受体直接相互作用,在突触的成熟和突触可塑性中发挥重要作用。NMDA受体被公认为是与学习记忆关系最密切的一种谷氨酸离子型受体,对海马突触可塑性起着参与和调控的作用。研究表明,PSD-95能够介导逆行性信号传递,促进突触前膜突触素的表达增加,增强大鼠的空间记忆能力[12]。PSD-95表达量变化与阿尔茨海默症、抑郁症病人学习记忆能力的下降有关。林玲[5]等研究表明SPS大鼠空间学习记忆能力受损,PSD-95表达下降,这与本研究中SPS组PSD-95的变化一致,但是本实验新颖的一点是给予SPS大鼠氟西汀治疗证实了此药物可以通过逆转PSD-95表达下降来改善大鼠行为学。突触前膜囊泡蛋白SynapsinⅠ大量表达在海马的CA3区和DG区[13-15],参与中枢神经系统突触连接的形成和维持,还通过其磷酸化作用调节神经递质的释放和突触可塑性,形成LTP,促进学习和记忆。Leonie[16]等研究表明氟西汀促进CA3区、DG区SynapsinⅠ的表达来改善小鼠PTSD症状,本实验用行为学进一步证实氟西汀可以通过增加SynapsinⅠ的表达来提高PTSD大鼠空间学习记忆能力。
以上的研究表明,PTSD动物模型中海马神经元内突触相关蛋白的表达区域存在差异。本研究证实了氟西汀通过提高DG区突触相关蛋白的表达来改善大鼠学习记忆。海马分为CA区和齿状回DG区,其中DG区终身保持新生神经元的能力即神经再生,相关文献报道,齿状回的神经干细胞位于海马门区与颗粒细胞层之间的下颗粒带,成年大鼠海马中新生成的神经元会从门区迁移到颗粒层,接受突触信息传入冲动,把轴突进入苔藓纤维,参与信息传导[17]。而有研究发现应激对海马的损伤主要是抑制齿状回区DG区神经元的再生,降低新生神经元的存活而导致PTSD 持续发生[18]。那么这里我们可以设想氟西汀是否能通过提高DG区突触相关蛋白的表达而促进新生神经元的再生、抑制海马神经元的凋亡来增加突触可塑性,提高PTSD大鼠学习记忆?此疑问有待于我们进一步研究证实。
[1] 中华医学会精神科分会. 中国精神障碍分类与诊断标准第三版(CCMD-3).济南:山东科学技术出版社,2001,97-98.
[2] Citrome L, Stensbøl TB, Maeda K. The preclinical profile of brexpiprazole: what is its clinical relevance for the treatment of psychiatric disorders? Expert Rev Neurother, 2015, 15(10): 1219-1229.
[3] Ⅰsaac CL, Cushway D, Jones GV. Ⅰs posttraumatic stress disorder associated with specific deficits in episodic memory ? Clin Psychol Rev, 2006, 26(8): 939-955.
[4] Migaud M, Charlesworth P, Dempster M, et al. Enhanced long-term potentiation and impaired learning in mice with mutant postsynaptic density-95 protein. Nature, 1998, 396(6710): 433-439.
[5] 林玲,刘国良,孙缦利. 海马CA1 区5-HT1A 受体调控PTSD大鼠空间记忆的作用. 中国病理生理杂志,2017,33(1):98-103.
[6] 晋翔,谭庆荣,王化宁. 氟西汀对大鼠创伤后应激障碍预防作用的实验研究. 中华行为医学和脑科学杂志,2010,19(5):389-391.
[7] Liberzon Ⅰ, Krstov M, Young EA. Stress-restress: effects on ACTH and fast feedback. Psychoneuroendocrino. 1997, 22(6) : 443-53.
[8] Cloitre M. Effective psyehotherapies for posttraumatie stress disorder: a review and critique. CNS Spectr, 2009, 14(1 Suppl 11): 32-43.
[9] Hageman Ⅰ, Anderesen H, Jorgensen MB. Post-traumutic stress disorder:a review of psycholiology and phermaccherspy. Acta Psychiarr Scand, 2001, 104(6): 411-422.
[10] Davidson JR, Rothbaum BO, Vander Kolk BA, et al. Multicenter, double-blind comparison of sertralineand placebo in the treatment of posttraumatic stress disorder. Arch Gen Psychiatry, 2001, 58(5): 485-492.
[11] Southwick SM, Krystal JH, Bremner JD, et al. Noradrenergic and seroton ergic function in postttaumatic stress disorder. Arch Gen Psychiatry, 1997, 54(8): 749-758.
[12] Sohn YⅠ, Lee NJ, Chung A, et al. Antihypertensive drug valstartan promotes dendritic spine density by altering AMPA receptor trafficking. Biochem Biophys Res Commun, 2013, 439(4): 464-470.
[13] Melloni RH, Hemmendinger LM, Hamos JE, et al. SynapsinⅠ gene expression in the adult rat brain with comparative analysis of mRNA and protein in the hippocampus. J Comp Neurol, 1993, 327(4): 507–520.
[14] Vaynman S, Ying Z, Go´mez-Pinilla F . Exercise induces BDNF and synapsin I to specific hippocampal subfields. J Neurosci Res, 2004, 76(3): 356–362.
[15] Nowicka D, Liguz-Lecznar M, Skangiel-Kramska J. A surface antigen delineating a subset of neurons in the primary somatosensory cortex of the mouse. Acta Neurobiol Exp (Wars) , 2003, 63(3): 185–195.
[16] Leonie Herrmann, Ⅰrina A. Ⅰonescu, Kathrin Henes, et al. Long-lasting hippocampal synaptic protein loss in a mouse model of post traumatic stress disorder. PLoS One, 2012, 7(8): 1–13.
[17] Pedersen WA, Wan R, Mattson MP. Ⅰmpact of aging on stress-responsive neuroendocrine systems. Mech Ageing Dev. 2001,122(9):963-983.
[18] Gao J, Chen C, Liu L, et al. Lycium barbarum polysaccharide improves traumatic cognition via reversing imbalance of apoptosis/regeneration in hippocampal neurons after stress. Life Sci. 2015, 15(121):124-134.
Fluoxetine inhibits down-regulation of PSD-95 and synapsin Ⅰ in the hippocampal neurons and impairment of the learning and memory ability of PTSD rats
Huang Lili, Jiang Jingzhi, Ma Linchuan, Han Fang*
(Department of Histology and Embryology, China Medical University,Shenyang 110001, China)
Objective To investigate the effect of fluoxetine on the memory post-traumatic-stress-disorder (PTSD) rats and the expression of postsynaptic density 95 (PSD-95) and synapsin Ⅰ in the hippocampal neurons of PTSD rats. Methods The PTSD rat model was established by the internationally recognized SPS method. Morris water maze (MWM) experiment was performed to observe the effect of fluoxetine on the learning ability and memory of PTSD rats. The expression of PSD-95 and synapsinⅠin hippocampal neurons was detected by immunofluoresent staining and western blot. Reults In the positioning navigation test during the first five days of MWM experiment, the swimming distance and latency taken by the PTSD rats to find the underwater platform were longer than those taken by normal rats or PTSD rats treated with fluoxetine; on the sixth day of MWM experiment in the space exploration test, the times the rats crossed the platform and the percentage of time spent in the target quadrant were obviously lower in the PRSD group than in the normal group, and fluoxetine treatment significantly increased these two indexes. Immunofluoresent staining and western blot results showed that the levels of PSD-95 and synapsin Ⅰ decreased in the PTSD rats and that fluoxetine treatment could inhibit this effect. Conclusion Fluoxetine can relieve the impairment of the special memory and learning ability of PTSD rats by inhibiting the decrease of the levels of PSD-95 and synapsin Ⅰ in the hippocampal neurons of the rats.
Post-traumatic stress disorder; fluoxetine; hippocampus; postsynaptic density protein 95; synapsinⅠ; water maze
R641
A DOⅠ:10.16705/ j. cnki. 1004-1850.04.002
2017-02-06
2017-05-25
国家自然科学基金(81571324);沈阳市科技项目(F16-205-1-53)
黄丽丽,女(1990年),汉族,硕士研究生
*通讯作者(To whom correspondence should be addressed):fhan@cmu.edu.cn

