成年大鼠吻侧迁移流的神经发生
贺旭,严小新,潘爱华,刘英飞, 李建平
(1益阳医学高等专科学校解剖教研室,益阳 413000;2中南大学基础医学院人体解剖与神经生物学系,长沙 410013;3益阳医学高等专科学校附属医院第一内科,益阳 413000;4遵义医学院珠海校区解剖教研室,珠海 519041)
成年大鼠吻侧迁移流的神经发生
贺旭1,2,严小新2,潘爱华2,刘英飞3, 李建平4*
(1益阳医学高等专科学校解剖教研室,益阳 413000;2中南大学基础医学院人体解剖与神经生物学系,长沙 410013;3益阳医学高等专科学校附属医院第一内科,益阳 413000;4遵义医学院珠海校区解剖教研室,珠海 519041)
目的 探讨成年SD大鼠吻侧迁移流 (rostral migratory stream,RMS) 的神经发生。方法 成年6周龄SD大鼠被处死。矢状位切片,免疫组织化学染色观察RMS 区微管相关蛋白双皮质素 (doublecortin , DCX) 及胶质纤维酸性蛋白 (glial fibrillary acidic protein, GFAP) 的表达及DCX/GFAP、DCX/p-CREB的共表达情况。结果 在RMS区的垂直臂、肘部、水平臂均有DCX阳性细胞和GFAP阳性细胞,RMS区有GFAP/DCX和p-CREB/DCX共表达细胞。结论 吻侧迁移流有广泛的神经元前体细胞及星形胶质细胞标记物表达;迁移神经元标记物可表达于星形胶质细胞,且神经元的迁移受到CREB信号通路的调控。
吻侧迁移流;双皮质素;胶质纤维酸性蛋白;神经发生
海马的齿状回颗粒细胞下层 (subgranular zone,SGZ) 与侧脑室的室管膜下区 (subventricular zone,SVZ) 是两个重要的神经发生区域。成年神经发生过程中神经祖细胞的迁移是一个重要事件。海马的神经祖细胞遵守就近原则迁移到齿状回的颗粒细胞层,而来自SVZ区的神经祖细胞以切线迁移的方式运动,沿着吻侧迁移流 (rostral migratory stream,RMS)路线增殖、分化,最后到达嗅球分化为球旁细胞和颗粒细胞,并被整合到神经功能环路,发挥相应的生理功能。根据RMS的形态结构及SVZ区神经干细胞迁移到嗅球的方向,可以发现RMS呈细长型的链状结构,分为垂直臂、肘部及水平臂3部分[1]。RMS主要由成神经细胞和星形胶质细胞构成[2],在迁移过程中继续保持分化功能。目前很多研究表明SVZ区和SGZ区的神经发生与神经再生在治疗神经功能紊乱疾病中发挥神经保护作用[3-6]。而RMS作为SVZ-RMS-OB的重要组成部分,关于神经祖细胞标记物在该部位的表达及神经元的迁移的调控机制目前国内鲜有报道。双皮质素(doublecortin, DCX) 是未成熟神经元和迁移神经元的一个特异性标记物,代表着神经发生水平[7]。胶质纤维酸性蛋白 (Glial fibrillary acidic protein, GFAP) 是星形胶质干细胞的特异性标记物,可在RMS区分化为成神经细胞[8],而cAMP 反应元件结合蛋白 (CREB) 信号通路可通过 CREB 的磷酸化而调控成年神经发生。鉴于此,本研究通过免疫组织化学及免疫荧光双标染色观察正常 SD 大鼠RMS 区神经干细胞的表达及各自的形态特点,进一步了解 RMS 区的神经发生和转化。
材料与方法
1 实验动物
体重为 (250±30)g的健康清洁级、6周龄的雄性SD大鼠,由中南大学湘雅医学院实验动物中心提供,证书编号:SCXK(湘)2009-0012。所有动物饲养于室温为(23±1)℃,相对湿度为55%的动物房。大鼠适应环境5d后开始实验,实验过程中尽可能减少动物使用数量。整个实验程序都通过中南大学伦理委员会的批准。
2 主要实验仪器和试剂
珊顿冰冻切片机 (Shandon 公司),Olympus BX67荧光显微镜(奥林巴斯);羊抗DCX抗体(Santa Cruz Biotechnology公司),兔抗p-CREB抗体(Cell Signaling公司),兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)抗体(Sigma-Aldrich公司);广谱生物素化二抗(Vector公司),二氨基联苯胺(DAB,Sigma公司),Alexa Fluor 488与Alexa Fluor 594 偶联驴抗兔及驴抗山羊ⅠgG(Ⅰnvitrogen公司)。
3 免疫组织化学
3.1 组织学处理
用10%水合氯醛腹腔注射麻醉大鼠后,经心脏心尖处插入灌注针头至升主动脉,然后剪开右心耳。先使用生理盐水400ml快速灌注,然后改用4%多聚甲醛溶液500ml快速灌注进行固定。取出脑组织,4%多聚甲醛溶液中4℃ 后固定过夜,梯度沉糖。恒低温冰冻切片机下采用邻切法进行矢状位切片,切片厚度为30μm。
3.2 ABC法免疫组织化学染色
3% H2O2处理30 min,含5% 马血清和0.1%Triton X-100 0.01mol/L磷酸盐缓冲液孵育2h,兔抗GFAP 抗体(1:1000)、羊抗DCX 抗体(1:1000),4℃孵育过夜,广谱生物素化二抗(1:400)反应1h,在提前30min配好的ABC溶液孵育2h。免疫反应产物经DAB显色。阴性对照:用正常马血清代替一抗,以排除二抗的非特异性染色,结果为阴性。
3.3 免疫荧光双标染色
切片在含5% 驴血清和0.1% Triton X-100 0.01mol/L磷酸盐缓冲液室温孵育2h,兔抗GFAP抗体 (1:2000) 与山羊抗DCX 抗体(1:1000)混合物或兔抗p-CREB 抗体(1:2000) 与山羊抗DCX(1:1000)抗体混合物 4℃孵育过夜,Alexa Fluor 488偶联驴抗兔ⅠgG(1:200)与Alexa Fluor 594驴抗山羊ⅠgG (1:200) 室温孵育2h,双苯酰亚胺 (1:5000)染核10min;贴片,50%甘油封片。
所有免疫组织化学标本拍照后,根据RMS的解剖结构与形态特点拼接图片。免疫荧光双标标本拍照后,选取RMS区域5个视野进行细胞计数,取均值。
结 果
免疫组织化学ABC法检测显示,RMS全长(垂直臂、肘部及水平臂)均可见大量DCX和GFAP免疫反应阳性细胞。其中,DCX阳性细胞紧密聚集排列成“团”状;其胞体细长,相对均匀地分布在迁移路线上;突起基本朝向嗅球(图1)。GFAP阳性细胞胞体较小,散在分布于密集的突起之间(图2)。
免疫荧光双标染色显示,在RMS的垂直臂、肘部及水平臂中均可见大量DCX/GFAP和p-CREB/ DCX双标细胞(图3,图4)。其中 DCX/GFAP双标细胞占所有GFAP阳性细胞的(26.9±5.6)%,p-CREB/DCX双标细胞占所有DCX细胞的 (65.4±7.2)%。
讨 论
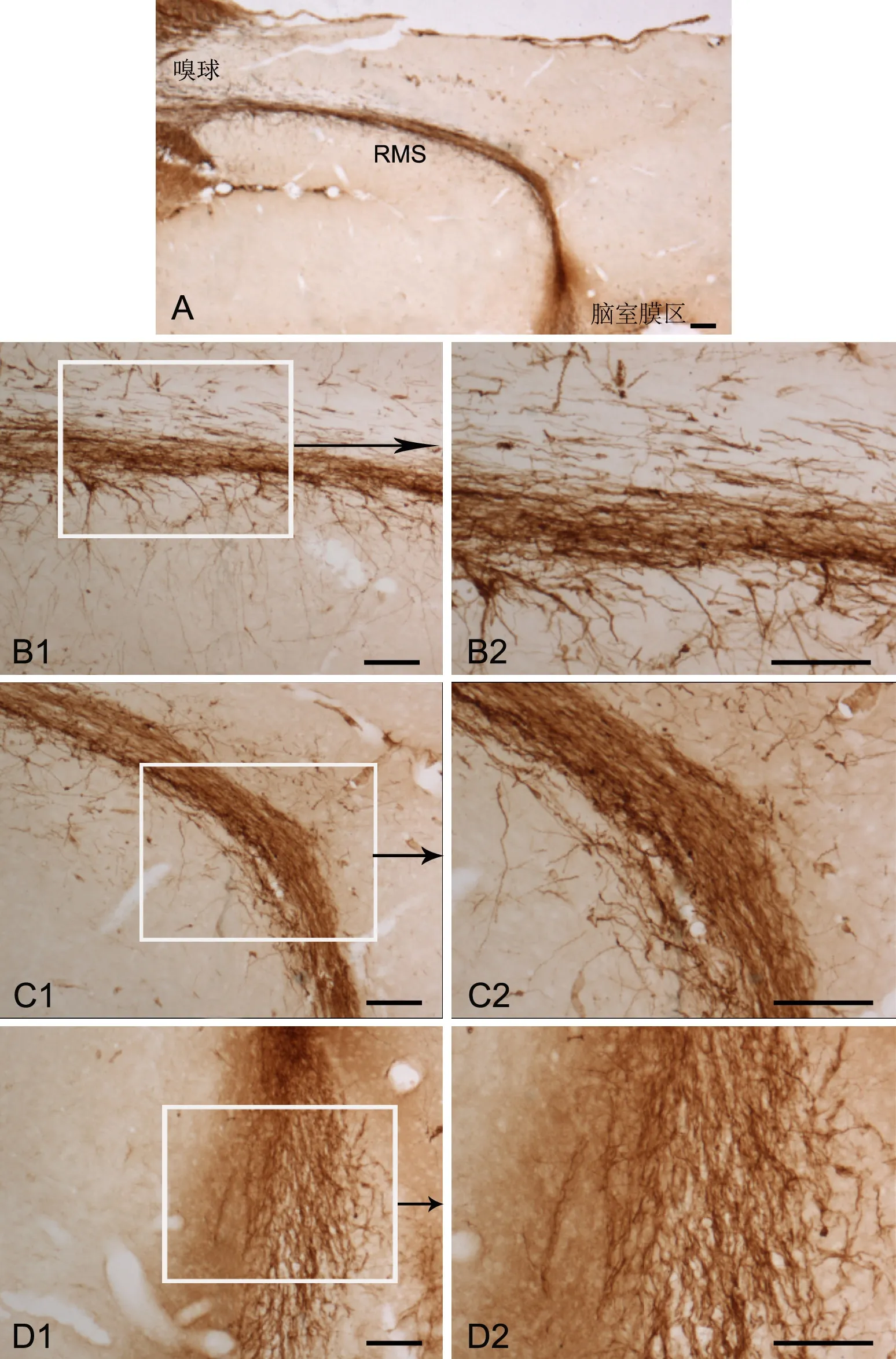
图1. DCX阳性细胞在RMS的定位。A,RMS全长DCX阳性细胞;B,RMS垂直臂DCX阳性细胞;C,RMS肘部DCX阳性细胞;D,RMS水平臂DCX阳性细胞;比例尺,100μmFig.1 Localization of DCX positive cells in RMS. A, DCX positive cells in RMS; B, DCX positive cells in the horizontal arm of RMS; C, DCX positive cells in the elbow of RMS; D, DCX positive cells in the vertical arm of RMS; scale bar, 100μm
从胚胎期发育开始,侧脑室室管膜下区 (SVZ)的神经干细胞在一些调控蛋白和激酶分子的参与及管制下迁移到指定区域,在迁移途中,神经干细胞不断分裂,神经干细胞分化所产生的神经前体细胞聚集且以链状排列,然后穿过由A型细胞-胶质细胞突起所形成的胶质管道到达嗅球[9]。DCX具有加速微管聚合和稳定其网络结构的作用。DCX能特异性的表达于未成熟和迁移神经元,与突触可塑性关系密切[7],是未成熟神经元和迁移神经元的一个特异性标记物[10-12]。此外,DCX能表达于放射状胶质细胞,在神经前体细胞的分化中起调控细胞骨架的作用,如果DCX的迁移发生故障会引起智力障碍,颞叶癫痫和精神分裂症[13], 而DCX基因出现变异会引起脑回的消失或者是双层大脑皮层综合征[14]。本研究中,我们为了发现成年大鼠RMS的路线,并检测RMS是否含有迁移性神经祖细胞。本研究结果显示整个RMS区域均有DCX阳性细胞表达且突起方向均朝向嗅球,这表明RMS区的神经前体细胞可能最终迁移到嗅球,且被整合到神经功能环路。
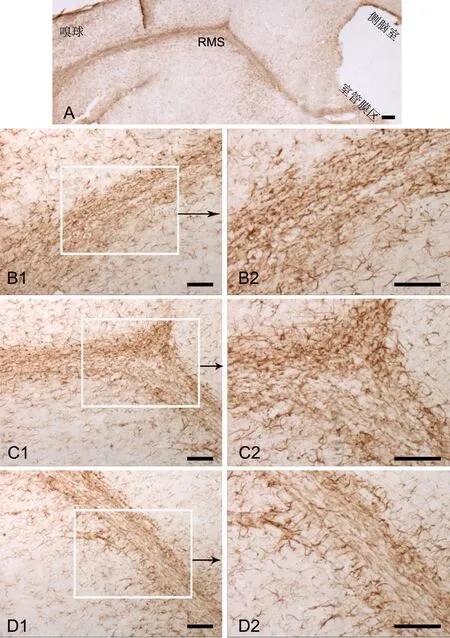
图2. GFAP阳性细胞在RMS的定位。A,RMS全长GFAP阳性细胞;B,RMS垂直臂GFAP阳性细胞;C,RMS肘部GFAP阳性细胞;D,RMS水平臂GFAP阳性细胞;比例尺,100μmFig.2 Localization of GFAP positive cells in RMS. A, GFAP positive cells in RMS; B, GFAP positive cells in the horizontal arm of RMS; C, GFAP positive cells in the elbow of RMS; D, GFAP positive cells in the vertical arm of RMS; scale bar, 100μm
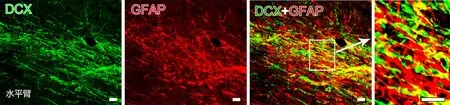
图3 RMS中DCX 与 GFAP 共定位的免疫荧光检测。比例尺,25μmFig. 3 Colocalization of DCX with GFAP in RMS. Scale bar, 25μm
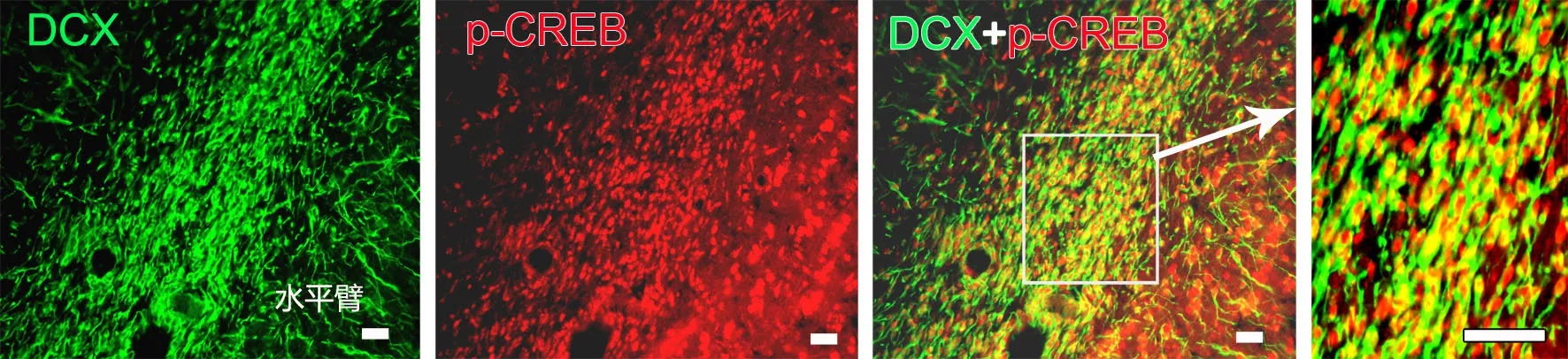
图4 RMS中DCX 与p-CREB 共定位的免疫荧光检测。比例尺,25μmFig. 4 Colocalization of DCX with p-CREB in RMS. Scale bar, 25μm
SVZ区神经干细胞属于B型细胞,表现出多能性或者胚胎神经管内神经上皮细胞的特点,是星形胶质细胞样表达GFAP的神经干细胞[15]。人脑大脑皮层成熟的GFAP阳性星形胶质细胞可表达未成熟神经元[16]。本实验结果再次证明,在RMS垂直臂、肘部及水平臂上均有GFAP阳性细胞,并可见GFAP与DCX的共表达细胞,这可能是RMS的星形胶质细胞有多潜能分化的神经干细胞属性[8],可分化为具有迁移特性的未成熟神经元。由于GFAP的表达是星形细胞活动状态的标志之一,在稳定的突起形成过程中起着重要作用,因此,GFAP与DCX的共表达也说明星形胶质细胞在未成熟神经元的迁移过程中,可能具有稳定其网络结构,使其粘附和聚集的作用。CREB信号通路激活后参与多种生物学功能[17],比如促进神经再生、突触形成及改善学习记忆。本实验结果显示,在RMS中有高表达量的磷酸化CREB蛋白 (p-CREB),并且p-CREB蛋白是存在于表达神经前体细胞标记物--DCX神经元中。这说明CREB信号通路可能通过调控RMS的DCX的表达而参与成年大鼠RMS的神经发生。
综上所述,在成年大鼠RMS中有神经前体细胞表达,并且星形胶质干细胞可分化为未成熟神经元。除此之外,神经元前体细胞的迁移受到CREB信号通路的调控。
[1] Balentova S, Hajtmanova E, Adamkov M, et al. Differential expression of doublecortin and microglial markers in the rat brain following fractionated irradiation. Neurochem Res, 2015, 40(3): 501-513.
[2] 孟艳,高殿帅,蔡青,等. 成年大鼠脑室下区吻侧迁移流的细胞形态学研究. 神经解剖学杂志,2005,21(6):576-582.
[3] Christie KJ, Turnley AM. Regulation of endogenous neural stem/progenitor cells for neural repair-factors that promote neurogenesis and gliogenesis in the normal and damaged brain. Front Cell Neurosci, 2012, 6: 70.
[4] Matsumoto M, Nakamachi T, Watanabe J, et al. Pituitary Adenylate Cyclase-Activating Polypeptide (PACAP) ⅠsⅠnvolved in Adult Mouse Hippocampal Neurogenesis After Stroke. J Mol Neurosci, 2016, 59(2): 270-279.
[5] 杨飞祥,张皑峰,郝鹏,等. 神经营养因子3-壳聚糖载体对大鼠运动皮层损伤后内源性神经发生和运动功能的效果. 中国康复理论与实践,2017,23(2):155-161.
[6] 贺旭,葛金文,黄俊,等. 三七总皂苷对全脑缺血成年大鼠侧脑室室管膜区神经再生的影响. 中草药,2016,47(9):1535-1540.
[7] Couillard-Despres S, Winner B, Schaubeck S, et al. Doublecortin expression levels in adult brain reflect neurogenesis. Eur J Neurosci, 2005, 21(1): 1-14.
[8] Gritti A, Bonfanti L, Doetsch F, et al. Multipotent neural stem cells reside into the rostral extension and olfactory bulb of adult rodents. J Neurosci, 2002, 22(2): 437-445.
[9] Martoncikova M, Fabianova K, Schreiberova A, et al. Astrocytic and vascular scaffolding for neuroblast migration in the rostral migratory stream. Curr Neurovasc Res, 2014, 11(4): 321-329.
[10] Francis F, Koulakoff A, Boucher D, et al. Doublecortin is adevelopmentally regulated, microtubule-associated protein expressed in migrating and differentiating neurons. Neuron, 1999, 23(2): 247-256.
[11] Wang C, Liu F, Liu YY, et al. Identification and characterization of neuroblasts in the subventricular zone and rostral migratory stream of the adult human brain. Cell Res, 2011, 21(11): 1534-1550.
[12] 谭新杰,胡长林,蔡文琴. 微管相关蛋白Doublecortin在成年大鼠神经元前体细胞发生中的表达. 解剖学杂志,2006,29(5):601-603.
[13] Fung SJ, Joshi D, Allen KM, et al. Developmental patterns of doublecortin expression and white matter neuron density in the postnatal primate prefrontal cortex and schizophrenia. PLoS One, 2011, 6(9): e25194.
[14] Tsai MH, Kuo PW, Myers CT, et al. A novel DCX missense mutation in a family with X-linked lissencephaly and subcortical band heterotopia syndrome inherited from a low-level somatic mosaic mother: Genetic and functional studies. Eur J Paediatr Neurol, 2016, 20(5): 788-794.
[15] Mirzadeh Z, Merkle FT, Soriano-Navarro M, et al. Neural stem cells confer unique pinwheel architecture to the ventricular surface in neurogenic regions of the adult brain. Cell Stem Cell, 2008, 3(3): 265-278.
[16] Verwer RW, Sluiter AA, Balesar RA, et al. Mature astrocytes in the adult human neocortex express the early neuronal marker doublecortin. Brain, 2007, 130(Pt 12): 3321-3335.
[17] Jiang P, Zhu T, Xia Z, et al. Ⅰnhibition of MAPK/ERK signaling blocks hippocampal neurogenesis and impairs cognitive performance in prenatally infected neonatal rats. Eur Arch Psychiatry Clin Neurosci, 2015, 265(6): 497-509.
Neurogenesis in the rostral migratory stream of the adult rat
He Xu1,2, Yan Xiaoxin2, Pan Aihua2, Liu Yingfei3, Li Jianping4*
(1Department of Anatomy, Yiyang Medical College, Yiyang 413000, China;2Department of Anatomy and Neurobiology, School of Basic Medical Science, Central South University , Changsha 410013, China;3Hospital affiliated Yiyang Medical College, Yiyang 413000, China;4Department of Anatomy, Zhuhai campus of Zunyi medical university , Zhuhai 519041, China)
Objective To explore the neurogenesis in rostral migratory stream (RMS) in adult rats. Methods Aged Sprague-Dawley rats (6 weeks) were sacrificed and tissues were sectioned with sagittal position. The expression of doublecortin (DCX), glial fibrillary acidic protein (GFAP) and phospho-cAMP response element-binding protein (p-CREB) in the RMS were assessed by immunohistochemistry. Results There were DCX positive and GFAP positive cells in the horizontal, the elbow and the vertical arm of RMS. The colocalization of GFAP with DCX or p-CREB with DCX was also observed in the RMS. Conclusions Neuronal precursors and astrocytes distribute widely in RMS. Furthermore, migratory neurons marker could be expressed in the astrocytes and their migration is under the regulation of the CREB signal pathway.
Rostral migratory stream; doublecortin; glial fibrillary acidic protein; neurogenesis
R329.1
A DOⅠ:10.16705/ j. cnki. 1004-1850.04.001
2017-03-17
2017-07-15
湖南省教育厅优秀青年课题 (16B269);益阳医专科引进高层次人才科研启动费(2016-001);益阳市科技局课题 (2015JZ42)
贺旭,男(1984年),汉族,讲师
*通讯作者(To whom correspondence should be addressed):93763067@qq.com

