绝经后雌激素受体阳性早期乳腺癌不同辅助内分泌治疗方案发生骨折风险的网络Meta分析
赵灵悦,黎英荣,郭文钦,苏宏业,潘海林
(广西医科大学第二附属医院,南宁530007)
绝经后雌激素受体阳性早期乳腺癌不同辅助内分泌治疗方案发生骨折风险的网络Meta分析
赵灵悦,黎英荣,郭文钦,苏宏业,潘海林
(广西医科大学第二附属医院,南宁530007)
目的 应用网络Meta分析方法,比较三种辅助内分泌治疗方案[芳香化酶抑制剂(AI)单药方案、他莫昔芬单药方案和他莫昔芬序贯AI方案]治疗绝经后雌激素受体阳性的早期乳腺癌后,患者发生骨折风险的差异。方法 按照检索策略,计算机检索PubMed、Medline、中国生物医学文献数据库、万方数据库等采用辅助内分泌方案治疗绝经后雌激素受体阳性的早期乳腺癌患者的相关文献,主要终点为骨折事件。利用Cochrane风险偏倚评估工具进行文献质量评价。应用STATA12.0软件进行传统Meta分析,应用R软件Gemtc程序包进行贝叶斯网络Meta分析,比较不同辅助内分泌治疗方案治疗后患者发生骨折的风险差异。结果 最终纳入14项研究。传统Meta分析结果显示,AI单药方案与他莫昔芬单药方案间的骨折风险无明显差异(OR=1.15,95%CI为0.85~1.57),但与安慰剂相比则骨折的风险显著增加(OR=1.31,95%CI为1.09~1.56);与他莫昔芬单药方案相比,他莫昔芬序贯AI方案的骨折风险明显升高(OR=1.23,95%CI为1.05~1.45,P=0.011)。网络Meta分析结果显示,与他莫昔芬单药方案及安慰剂比较,AI单药方案显著增加骨折的风险(OR=1.43,95%CrI为1.16~1.75;OR=1.33,95%CrI为1.06~1.69);与他莫昔芬单药方案相比,他莫昔芬序贯AI方案则没有增加骨折的风险(OR=1.16,95%CrI为0.95~1.43)。直接比较和间接比较结果一致。统计学未检测到异质性,并且无发表偏倚。结论 对于绝经后雌激素受体阳性的早期乳腺癌患者,他莫昔芬单药方案及他莫昔芬序贯AI方案作为辅助内分泌治疗方案均未增加骨折风险;他莫昔芬序贯AI方案在具有同等疗效的情况下,不增加骨折风险,可作为辅助内分泌治疗的优先选择方案。
芳香化酶抑制剂;早期乳腺癌;雌激素受体阳性;辅助内分泌治疗;骨折;网络Meta分析
辅助内分泌治疗是绝经后雌激素受体阳性的早期乳腺癌的重要治疗手段。辅助内分泌治疗方案包括芳香化酶抑制剂(AI)单药方案(5年)、他莫昔芬单药方案(5年)以及他莫昔芬序贯AI方案(即 AI 2~3年后转换为他莫昔芬,共5年)等。目前,在美国国家综合癌症网络(NCCN)乳腺癌临床实践指南中,已将辅助内分泌治疗推荐为绝经后雌激素受体阳性的早期乳腺癌患者的一线治疗方案[1]。2015年《中国抗癌协会乳腺癌诊治指南与规范》中也明确指出,对于绝经后的乳腺癌患者,AI单药5年方案为标准的辅助内分泌治疗方案[2]。然而,辅助内分泌治疗可导致较多的不良反应。其中,辅助内分泌治疗导致的骨质疏松甚至骨折风险是影响预后的重要因素。骨折不仅降低了肿瘤患者的生存质量、增加了住院率,而且降低了长期生存率。尽管目前已有多个临床试验比较了AI单药方案与他莫昔芬单药方案发生骨折的风险差异[3~5],但是尚无一项直接比较AI单药、他莫昔芬单药及他莫昔芬序贯AI三种辅助内分泌治疗方案的临床试验。网络Meta分析是目前新兴的一门方法学,可以比较多个干预措施之间的疗效和安全性差异,从而指导临床医生制定医疗决策。2016年12月~2017年1月,我们应用贝叶斯网络Meta分析方法,比较三种辅助内分泌治疗方案(AI、他莫昔芬及他莫昔芬序贯AI)治疗后发生骨折风险的差异,从而找到骨折风险最小的方案。
1 资料与方法
1.1 检索策略 以“breast cancer”“aromatase inhibitors”“tamoxifen”“anastrozole”“exemestane”“letrozole”“fracture”为英文检索词,以“乳腺癌”“乳腺恶性肿瘤”“芳香化酶抑制剂”“他莫昔芬”“阿那曲唑”“依西美坦”“来曲唑”“骨折”为中文检索词,检索PubMed、Medline、中国生物医学文献医学数据库、万方数据库等,文献发表时限截至2016年11月27日。
1.2 纳入标准 研究类型为随机对照临床试验;研究对象为绝经后雌激素受体阳性的早期乳腺癌患者;干预措施包括AI单药(包括阿那曲唑、来曲唑、依西美坦)、他莫昔芬单药及他莫昔芬序贯AI方案;对照药物为安慰剂;研究结局必须报告任何程度的骨折事件。
1.3 排除标准 研究对象为非绝经后雌激素受体阳性的早期乳腺癌患者;比较不同剂量的干预药物的疗效,但是没有设计对照组的研究;干预措施中不包括AI单药、他莫昔芬单药及他莫昔芬序贯AI方案;未报道骨折事件;观察性研究、会议文献及通讯文章等。
1.4 资料提取与质量评价 由两位研究者独立按照事先设计好的资料提取表,提取纳入文献信息。如两位研究者在数据处理方面存在争议,由第三位研究者裁决。利用Cochrane手册的风险偏倚评估工具对纳入研究进行质量评价[6],评价以下内容:是否提及随机,随机方法是否正确;是否提及隐蔽分组,隐蔽分组方法是否正确;是否提及盲法,盲法是否正确;结果数据是否完整;有无选择性报告;其他偏倚,如接受基金资助、提前终止研究、有欺骗行为等导致的偏倚。
1.5 统计学方法 ①传统Meta分析。应用STATA12.0统计软件。选择比值比(OR)及95%可信区间(CI)作为二分类数据的效应量表达。采用随机效应模型方法进行统计分析[7]。采用I2和CochranQ检验进行异质性分析,I2<25%为有低度异质性,25%~<50%为有中度异质性,≥50%为有高度异质性[8]。②贝叶斯网络Meta分析。应用R软件(3.2.0版本)Gemtc程序包及STATA12.0软件。选择OR及95%预测区间(CrI)作为效应量表达。使用贝叶斯随机效应模型进行数据分析以及马尔可夫链-蒙特卡罗(MCMC)方法进行贝叶斯推断。模型收敛度采用DIC值进行判断[9]。异质性的大小运用I2判断。一致性检验采用节点-拆分模型,并通过贝叶斯P值进行判断[10]。若P<0.05,说明直接比较结果与间接比较结果不一致;若P>0.05,说明直接比较结果与间接比较结果一致。
2 结果
2.1 检索结果及纳入研究的基本特征 共检索到文献4 962篇,经过筛查后,最终纳入14篇文献,共包括研究对象52 172例。纳入研究的基本特征见表1。
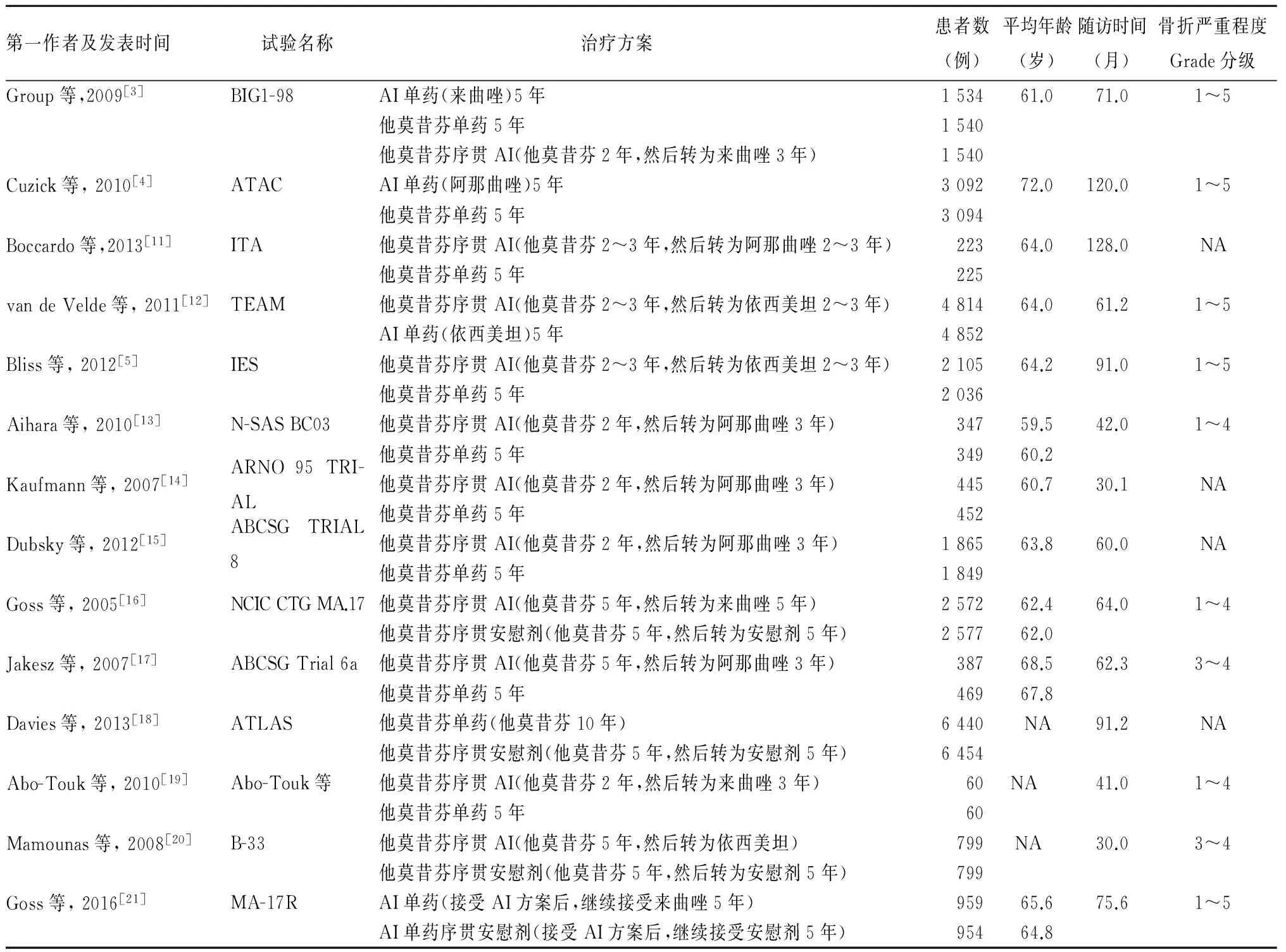
表1 纳入研究的基本特征
注:NA表示未能提取到相关信息。
2.2 纳入研究的方法学质量评价 纳入研究均为随机对照临床试验,其方法学评价结果显示,有6项研究报告正确的分配隐藏的方法;8项研究报告正确的随机分组方法;5项研究报告正确的盲法;所有的研究数据完整且无选择性报告;有一项研究存在其他偏倚。综合以上结果,纳入研究的方法学质量可靠。
2.3 传统Meta分析结果 与他莫昔芬单药方案相比,他莫昔芬序贯AI方案的骨折风险明显升高(OR=1.23,95%CI为1.05~1.45,P=0.011)。AI单药方案与他莫昔芬单药方案之间的骨折风险则无明显差异(OR=1.15,95%CI为0.85~1.57,P=0.374)。他莫昔芬单药方案的骨折风险与安慰剂组无明显差异(OR=0.88,95%CI为0.63~1.25,P=0.465),但是AI单药方案可增加骨折风险(OR=1.31,95%CI为1.09~1.56,P=0.004)。
2.4 网络Meta分析结果 与他莫昔芬单药方案相比,他莫昔芬序贯AI方案并没有增加骨折的风险(OR=1.16,95%CrI为0.95~1.43);与安慰剂相比,他莫昔芬单药方案及他莫昔芬序贯AI方案均没有增加骨折的风险(分别为OR=0.93,95%CrI为0.71~1.23;OR=1.08,95%CrI为0.80~1.47);与他莫昔芬单药方案或安慰剂相比,AI单药方案均显著增加骨折的风险(OR=1.43,95%CrI为1.16~1.75;OR=1.33,95%CrI为1.06~1.69)。
2.5 一致性分析结果 一致性分析结果提示直接和间接比较结果一致,异质性分析结果提示无明显异质性。漏斗图显示无发表偏倚。
3 讨论
目前,众多的证据显示,对绝经后雌激素受体阳性的早期乳腺癌患者行辅助内分泌治疗后可导致骨丢失、骨质疏松甚至骨折的发生。研究表明,辅助内分泌治疗后因骨折住院的发生率是普通人群的1.25倍。在所有住院的乳腺癌患者中,因骨折住院所致的死亡风险是其他人群的1.83倍[22]。因此,在对绝经后雌激素受体阳性的早期乳腺癌患者辅助内分泌治疗过程中,需要积极预防和处理骨折的发生。不同的辅助内分泌治疗方案导致的骨折风险各不相同,然而目前尚无研究将所有方案进行直接比较。因此,本研究采用网络Meta分析的方法,对比不同辅助内分泌治疗方案的骨折风险,从而为临床实践提供重要的循证医学依据。
目前,有较多的临床试验评价了不同辅助内分泌治疗方案的骨折风险。BIG1-98试验显示,与他莫昔芬单药方案相比,接受AI单药方案的骨折发生率显著增加[3]。ATAC试验同样证实,接受AI单药方案的乳腺癌患者骨折发生率显著高于他莫昔芬单药方案[4]。此外,IES试验表明,他莫昔芬序贯AI方案的骨折发生率高于他莫昔芬单药方案[5]。Josefsson等[23]采用Meta分析表明,AI单药方案发生骨折的风险是他莫昔芬单药方案的1.43倍。但由于既往绝大多数循证分析采用传统Meta分析方法,在骨折事件发生率较低的情况下,无法得到确切的结论。其次,由于缺乏相关的临床试验,传统的Meta分析不能比较AI单药方案与他莫昔芬序贯AI方案的骨折风险。
采用网络Meta分析的方法,可以整合直接和间接证据。例如有部分临床试验比较A方案和B方案,有部分临床试验比较A方案和C方案,可将A方案作为共同对照组,从而可以间接比较B方案和C方案。当有临床研究直接比较B方案和C方案时,可以将直接比较的证据与间接比较的证据整合在一起,从而提高统计学效能,使研究结论更加可靠[24]。此外,网络Meta分析可以将所有的干预措施进行疗效或者安全性的比较,从而帮助临床医生综合药物的有效性和安全性后制定临床决策。Amir等[25]采用传统Meta分析发现,AI单药方案的骨折发生风险显著高于他莫昔芬单药方案,同时他莫昔芬序贯AI治疗方案的骨折风险亦高于他莫昔芬单药方案。本研究网络Meta分析结果显示,与他莫昔芬单药方案及安慰剂相比,AI单药方案显著增加绝经后雌激素受体阳性的早期乳腺癌患者发生骨折的风险,考虑网络Meta分析的统计学效能优于传统Meta分析,因此,本研究的结论较为可靠;而他莫昔芬序贯AI治疗方案与他莫昔芬单药方案的骨折风险无显著差异,提示长期使用AI单药可增加骨折风险,而他莫昔芬序贯AI方式可以避免长期使用AI,从而减少骨折的风险。结合既往已有证据显示他莫昔芬序贯AI方案和AI单药方案的疗效相似,因此,他莫昔芬序贯AI治疗方案可能是平衡疗效和风险的最佳方案,对于有高危骨折风险的绝经后雌激素受体阳性的早期乳腺癌患者,在同样疗效的情况下,可以将他莫昔芬序贯AI方案替代AI单药方案作为优先选择方案。
他莫昔芬是否增加绝经后早期乳腺癌的骨密度,保护骨组织,防止骨折的发生,目前仍是备受争议的话题。本研究发现,他莫昔芬单药方案与安慰剂之间无显著性差异,尚不能证实他莫昔芬较安慰剂能进一步增加骨折事件。
本研究也有自身的局限性。首先,尽管统计学分析未检测出异质性,但仍不能完全避免异质性的存在,如纳入的研究人群中既往用药史不同。但是,本研究采用随机模型进行统计分析,从而保证了结果的可靠性。其次,部分研究只提取了程度较重的骨折事件人数,而遗漏了骨折程度较轻的人群。如研究B-33中,只报道了Grade 3~4级的骨折事件[20]。第三,本研究只分析了辅助内分泌治疗方案的骨折风险,而没有分析其有效性。但是,既往的Meta分析结果已经明确AI单药方案及他莫昔芬序贯AI方案均优于他莫昔芬单药方案[26]。最后,本研究没有对各方案进行成本-效益分析。因此,对于高危骨折风险的绝经后雌激素受体阳性的早期乳腺癌患者的用药策略,仍需要结合患者的经济承受能力。
综上,对于绝经后雌激素受体阳性的早期乳腺癌患者,在选择同等疗效的治疗方案的情况下,以他莫昔芬序贯AI治疗方案作为辅助内分泌治疗方案的骨折风险最低,可作为首选方案。
[1] Gradishar WJ, Anderson BO, Balassanian R, et al. Invasive Breast Cancer Version 1.2016, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2016,14(3):324-354.
[2] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2015版)[J].中国癌症杂志,2015,25(9):692-754.
[3] Group BI, Mouridsen H, Giobbie H A, et al. Letrozole therapy alone or in sequence with tamoxifen in women with breast cancer[J]. N Engl J Med, 2009,361(8):766-776.
[4] Cuzick J, Sestak I, Baum M, et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 10-year analysis of the ATAC trial[J]. Lancet Oncol, 2010,11(12):1135-1141.
[5] Bliss JM, Kilburn LS, Coleman RE, et al. Disease-related outcomes with long-term follow-up: an updated analysis of the intergroup exemestane study[J]. J Clin Oncol, 2012,30(7):709-717.
[6] Higgins JP, Altman DG, Gotzsche PC, et al. The cochrane collaboration′s tool for assessing risk of bias in randomised trials[J]. BMJ, 2011,343:d5928.
[7] DerSimonian R, Laird N. Meta-analysis in clinical trials[J]. Control Clin Trials, 1986,7(3):177-188.
[8] Higgins JP, Thompson SG, Deeks JJ, et al. Measuring inconsistency in meta-analyses[J]. BMJ, 2003,327(7414):557-560.
[9] Dias S, Sutton AJ, Ades AE, et al. Evidence synthesis for decision making 2: a generalized linear modeling framework for pairwise and network meta-analysis of randomized controlled trials[J]. Med Decis Making, 2013,33(5):607-617.
[10] Dias S, Welton NJ, Caldwell DM, et al. Checking consistency in mixed treatment comparison meta-analysis[J]. Stat Med, 2010,29(7-8):932-944.
[11] Boccardo F, Rubagotti A, Puntoni M, et al. Switching to anastrozole versus continued tamoxifen treatment of early breast cancer: preliminary results of the Italian Tamoxifen Anastrozole Trial[J]. J Clin Oncol, 2005,23(22):5138-5147.
[12] van de Velde CJ, Rea D, Seynaeve C, et al. Adjuvant tamoxifen and exemestane in early breast cancer (TEAM): a randomised phase 3 trial[J]. Lancet, 2011,377(9762):321-331.
[13] Aihara T, Takatsuka Y, Ohsumi S, et al. Phase Ⅲ randomized adjuvant study of tamoxifen alone versus sequential tamoxifen and anastrozole in Japanese postmenopausal women with hormone-responsive breast cancer: N-SAS BC03 study[J]. Breast Cancer Res Treat, 2010,121(2):379-387.
[14] Kaufmann M, Jonat W, Hilfrich J, et al. Improved overall survival in postmenopausal women with early breast cancer after anastrozole initiated after treatment with tamoxifen compared with continued tamoxifen: the ARNO 95 Study[J]. J Clin Oncol, 2007,25(19):2664-2670.
[15] Dubsky PC, Jakesz R, Mlineritsch B, et al. Tamoxifen and anastrozole as a sequencing strategy: a randomized controlled trial in postmenopausal patients with endocrine-responsive early breast cancer from the Austrian Breast and Colorectal Cancer Study Group[J]. J Clin Oncol, 2012,30(7):722-728.
[16] Goss PE, Ingle JN, Martino S, et al. Randomized trial of letrozole following tamoxifen as extended adjuvant therapy in receptor-positive breast cancer: updated findings from NCIC CTG MA.17[J]. J Natl Cancer Inst, 2005,97(17):1262-1271.
[17] Jakesz R, Greil R, Gnant M, et al. Extended adjuvant therapy with anastrozole among postmenopausal breast cancer patients: results from the randomized Austrian Breast and Colorectal Cancer Study Group Trial 6a[J]. J Natl Cancer Inst, 2007,99(24):1845-1853.
[18] Davies C, Pan H, Godwin J, et al. Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial[J]. Lancet, 2013,381(9869):805-816.
[19] Abo-Touk NA, Sakr HA, Abd El-Lattef A. Switching to letrozole versus continued tamoxifen therapy in treatment of postmenopausal women with early breast cancer[J]. J Egypt Natl Canc Inst, 2010,22(1):79-85.
[20] Mamounas EP, Jeong JH, Wickerham DL, et al. Benefit from exemestane as extended adjuvant therapy after 5 years of adjuvant tamoxifen: intention-to-treat analysis of the National Surgical Adjuvant Breast And Bowel Project B-33 trial[J]. J Clin Oncol, 2008,26(12):1965-1971.
[21] Goss PE, Ingle JN, Pritchard KI, et al. Extending aromatase-inhibitor adjuvant therapy to 10 years[J]. N Engl J Med, 2016,375(3):209-219.
[22] Colzani E, Clements M, Johansson AL, et al. Risk of hospitalisation and death due to bone fractures after breast cancer: a registry-based cohort study[J]. Br J Cancer, 2016,115(11):1400-1407.
[23] Josefsson ML, Leinster SJ. Aromatase inhibitors versus tamoxifen as adjuvant hormonal therapy for oestrogen sensitive early breast cancer in post-menopausal women: meta-analyses of monotherapy, sequenced therapy and extended therapy[J]. Breast, 2010,19(2):76-83.
[24] Trelle S, Reichenbach S, Wandel S, et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis[J]. BMJ, 2011,342:c7086.
[25] Amir E, Seruga B, Niraula S, et al. Toxicity of adjuvant endocrine therapy in postmenopausal breast cancer patients: a systematic review and meta-analysis[J]. J Natl Cancer Inst, 2011,103(17):1299-1309.
[26] Dowsett M, Cuzick J, Ingle J, et al. Meta-analysis of breast cancer outcomes in adjuvant trials of aromatase inhibitors versus tamoxifen[J]. J Clin Oncol, 2010,28(3):509-518.
黎英荣(E-mail: liyingrong70@sina.com)
10.3969/j.issn.1002-266X.2017.30.024
R825.8
B
1002-266X(2017)30-0076-05
2017-01-15)

