心房颤动患者行肺静脉大环隔离消融术后复发的影响因素分析
王勇,李杰
(新疆维吾尔自治区人民医院,乌鲁木齐830001)
心房颤动患者行肺静脉大环隔离消融术后复发的影响因素分析
王勇,李杰
(新疆维吾尔自治区人民医院,乌鲁木齐830001)
目的 探讨心房颤动(简称房颤)患者行肺静脉大环隔离导管射频消融术后复发的影响因素。方法 选择房颤患者110例,包括阵发性房颤86例、持续性房颤24例。均采用肺静脉大环隔离行射频消融治疗,术中线性消融双侧环肺静脉。术后口服抗心律失常药物胺碘酮及抗凝药物华法林(或利伐沙班)3个月。术后3、6、9、12个月时随访心电图与24 h动态心电图,以手术3个月后发生的持续大于30 s的房性心律失常为房颤复发标准,评价术后的房颤复发情况。采用Logistic回归法分析术后复发的影响因素分析,采用COX回归分析法评价术前不同左心房前后径对房颤患者术后复发的影响。结果 术后1年阵发性房颤的复发率为30.2%,持续性房颤的复发率为50.0%。左心房前后径是房颤患者导管消融术后复发的独立预测因子(HR=2.33,95%CI为1.41~4.61)。左心房前后径>40 mm是导致房颤患者术后复发的危险因素。结论 肺静脉大环隔离术治疗房颤患者具有一定的术后复发率,术前左心房前后径>40 mm是导致术后房颤复发的危险因素。
心房颤动;导管射频消融术;环肺静脉隔离;复发;左心房前后径
心房颤动(简称房颤)是严重危害人类健康的疾病,转复房颤并长期维持窦性心律是目前研究的难点。由于药物维持窦性心律的成功率不理想且有多种不良反应,导管消融术已成为治疗药物无效的症状性房颤的一线疗法[1]。肺静脉驱动是多数阵发性房颤的主要机制,导管消融术中隔离肺静脉可使阵发性房颤的单次消融成功率达到60%~80%。持续性房颤除了肺静脉驱动机制外,尚存在因广泛心房结构和电生理性质改变而构成的房颤维持基质,常需要进行辅助线消融以保证成功率。目前,射频消融治疗房颤的基石是肺静脉前庭电隔离,即同侧肺静脉进行一个环形消融,以使肺静脉电活动与左心房电活动完全隔离。然而临床治疗中,即使成功达到所有消融终点,术后仍有相当比例的房颤患者复发,并随着随访时间的延长,复发比例逐渐增高,单次消融后的房颤复发率仍高达40%~60%。因此,明确导致房颤患者肺静脉大环隔离术后复发的影响因素,对于提高手术成功率、预防术后复发至关重要。我们随访了110例采用肺静脉大环隔离术行导管射频消融治疗的房颤患者,分析导致患者房颤复发的影响因素。
1 资料与方法
1.1 临床资料 选择2007年7月~2014年7月在我院接受肺静脉大环隔离术治疗的阵发性或持续性房颤患者110例,男66例、女44例,平均(56.3±11.6)岁。阵发性房颤86例,持续性房颤24例(其中长程持续性房颤8例)。伴高血压33例,冠心病9例。中风风险评估(CHADS2)≥2分者(即存在中风高风险)25例。纳入标准:①年龄30~70岁;②经心电图、动态心动图记录到房颤;③心脏超声射血分数(EF)≥50%,左心房前后径≤55 mm;④消融前2日经食管超声心动图检查未发现左心房血栓;⑤患者同意行导管消融术。排除标准:①甲状腺功能亢进;②有心肌梗死病史;③伴严重肝肾功能不全;④NYHA心功能分级Ⅲ级。
1.2 手术方法 均采用肺静脉大环隔离术行导管射频消融治疗。消毒双侧腹股沟和颈部皮肤,1%利多卡因局部麻醉下穿刺右侧股静脉,放置两根L1型Swartz鞘,穿刺右侧颈内静脉置入6 F鞘,放置十极冠状静脉窦标测电极。经Swartz鞘两次房间隔穿刺,鞘管内注入普通肝素60 U/kg,以后外周静脉每小时追加注入肝素1 000 U。送入十极环状电极至肺静脉口标测肺静脉电位(PVP),经另一Swartz鞘进行肺静脉造影以显示肺静脉口。CARTO专用冷盐水灌注导管置入肺静脉和左心房,通过CARTO系统重建左心房的三维构型,并标记双侧肺静脉前庭的位置,在CARTO系统和肺静脉环状标测联合指导下,环形消融双侧肺静脉前庭。消融设置为功率25~30 W,温度43 ℃,盐水流速17 mL/min。每处放电直至该处双极电位振幅降低>50%,或已成为碎裂电位(<0.1 mV)。消融终点为PVP消失或仅能记录到自发PVP,且与心房电活动无关[2]。
1.3 术后处理 术后口服抗心律失常药物胺碘酮及抗凝药物华法林(或利伐沙班)3个月。
1.4 房颤复发评价方法 术后3、6、9、12个月时进行随访,行心电图与24 h动态心电图检查评价术后的房颤复发情况。术后复发定义为手术3个月后发生的持续大于30 s的房性心律失常。
2 结果
2.1 术后房颤复发情况 随访1年,术后共复发41例,其中86例阵发性房颤患者中复发29例,复发率为30.2%;24例持续性房颤患者中复发12例,复发率为50.0%(其中16例非长程持续性房颤患者中复发7例,复发率为43.8%;8例长程持续性房颤患者中复发5例,复发率为62.5%)。
2.2 术后复发与未复发的房颤患者临床特征比较 见表1。
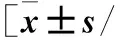
表1 术后复发与未复发的房颤患者临床特征比较例(%)]
2.3 房颤患者导管消融术后复发的影响因素 Logistic回归分析示,调整年龄、性别、房颤类型、收缩压、CHADS2评分、EF等因素后,左心房前后径是房颤患者导管消融术后复发的独立预测因子(HR=2.33,95%CI为1.41~4.61)。
2.4 术前不同左心房前后径对房颤患者术后复发的影响 左心房前后径增大时,术后房颤复发的风险较高。左房前后径>40 mm是导致房颤患者术后复发的危险因素。见表2。
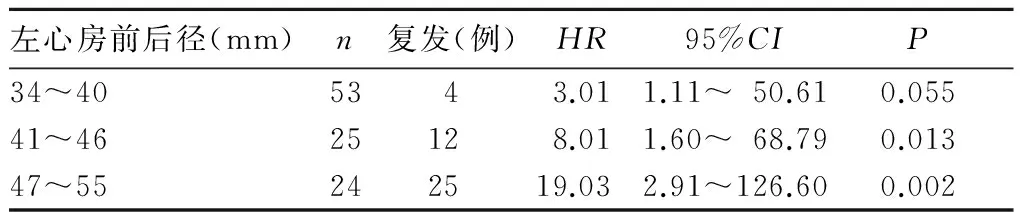
表2 术前不同左心房前后径的房颤患者术后复发情况及其HR结果
3 讨论
房颤是临床最常见的心律失常之一,也是缺血性卒中的重要危险因素。近年来,导管射频消融术已成为治疗房颤的主要治疗手段。2014年美国心律学会/欧洲心律学会(HRS/EHRA/ESC)房颤管理指南指出,导管射频消融术可作为有症状的阵发性房颤患者的Ⅰa推荐方法、持续性房颤患者的Ⅱa推荐方法[3]。2016年HRS/EHRA/ESC指南再次明确,导管射频消融治疗可替代药物作为改善患者症状、预防房颤复发的一线治疗方法。导管射频消融术中完成所有肺静脉的完全电隔离是最基本的目标,三维标测技术对肺静脉前庭及左房精确的解剖标测可大大提高手术的安全性及准确性[4]。随着导管射频消融技术的推广,接受导管消融治疗的房颤患者日趋增多,但术后房颤复发的问题愈发突出,关于复发危险因素的研究日益广泛,但目前结果尚不统一。
Calkins等[5]采用Meta分析发现,单次导管射频消融术治疗房颤的1年成功率为57%,多次导管射频消融术后1年成功率为71%,合用抗心律失常药物则可使成功率分别提高至72%、77%。对于阵发性房颤,以肺静脉隔离为终点的环肺静脉前庭消融可以取得较好疗效。对于持续性房颤,肺静脉及其肺静脉前庭同样是维持房颤的关键部位,但是成功率明显低于阵发性房颤的消融效果,提示肺静脉线性消融并不足以治愈所有持续性房颤[6]。对于病史较长的持续性房颤患者,除行肺静脉隔离外,有必要通过监测房颤周长进行肺静脉之外的消融,如左心耳、冠状静脉窦及左心房顶部等关键部位[7]。本研究发现,随访1年时,阵发性房颤患者的复发率为30.2%,持续性房颤患者的复发率为43.8%,长程持续性房颤患者的复发率为62.5%,提示肺静脉大环隔离术治疗房颤患者具有一定的术后复发率,持续性房颤患者的复发率较高,术后房颤复发与房颤类型有关。
左心房增大被认为是左心房结构重塑的标志,往往伴随心房间质的进行性纤维化,导致心房内传导的异质性,促进房颤的发生和维持。左心房前后径增大被认为是房颤消融复发的独立预测因素[8]。在多项已确定的消融后房颤复发的因素中,左心房前后径增大是最常见的因素。Hsieh等[9]研究发现,房颤患者左心房前后径>40 mm是影响导管消融术后复发的主要因素。Zhuang等[10]对22篇涉及3 750例房颤患者的研究进行荟萃分析,认为左心房扩大是导致房颤患者心脏重构的进展标志,可增加导管消融术后复发的风险。另一项荟萃分析显示,左心房前后径>50 mm是房颤复发的独立预测因素,左心房扩大与心房纤维化增加导致的心房重构相关,由于基质的改变阻碍了消融深度,有利于房颤的持续,影响消融效果[11~13]。Park等[14]采用测定左心房脉冲压力来评价左心房顺应性,发现在左心房前后径及容量正常的房颤患者中,由于广泛的瘢痕形成可导致左心房僵硬度增加、顺应性下降,进而导致左心房脉冲压力增高,与导管消融术后房颤复发密切相关。Kiuchi等[15]采用三维计算机断层成像研究发现,二尖瓣峡部增宽、右上肺静脉横截面积减小的患者房颤导管消融术后复发率显著增高。本研究发现,随着左心房前后径的增大,射频术后复发的风险增高,左心房前后径>40 mm是导致房颤患者术后复发的危险因素,提示随着左心房前后径的增大、导管消融房颤的复发率增高,左心房前后径>40 mm是房颤复发的独立预测因素。
综上所述,肺静脉大环隔离术治疗房颤患者具有一定的术后复发率,左房前后径是房颤患者导管消融术后复发的独立预测因子,左房前后径>40 mm是导致术后复发的危险因素。
[1] Pappone C, Oreto G, Rosanio S, et al. Atrial electroanatomic remodeling after circumferential radiofrequency pulmonary vein ablation: efficacy of an anatomic approach in a large cohort of patients with atrial fibrillation[J]. Circulation, 2001,104(21):2539-2544.
[2] Furnkranz A, Bordignon S, Schmidt B, et al. Improved procedural efficacy of pulmonary vein isolation using the novel second-generation cryoballoon[J]. J Cardiovasc Electrophysiol, 2013,24(5):492-497.
[3] Janury CT, Wann LS, Alpert JS, et al. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society[J]. J Am Coll Cardiol, 2014,64(21):1-76.
[4] von Bary C, Fredersdorf HS, Heinicke N, et al. Comparison of PV signal quality using a novel circular mapping and ablation catheter versus a standard circular mapping catheter[J]. J Interv Card Electrophysiol, 2011,31(2):131-139.
[5] Calkins H, Reynolds MR, Spector P, et al. Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta-analyses[J]. Circ Arrhythm Electrophysiol, 2009,2(4):349-361.
[6] Bulkova V, Fiala M, Havranek S, et al. Improvement in quality of life after catheter ablation for paroxysmal versus long-standing persistent atrial fibrillation: a prospective study with 3-year follow-up[J]. J Am Heart Assoc, 2014,3(4):e000881.
[7] Fiala M, Wichterle D, Bulkova V, et al. A prospective evaluation of haemodynamics, functional status, and quality of life after radiofrequency catheter ablation of long-standing persistent atrial fibrillation[J]. Europace, 2014,16(1):15-25.
[8] Mantovan R, Macle L, de Martino G, et al. Relationship of quality of life with procedural success of atrial fibrillation (AF) ablation and postablation AF burden: substudy of the STAR AF randomized trial[J]. Can J Cardiol, 2013,29(10):1211-1217.
[9] Hsieh MH, Tai CT, Tsai CF, et al. Clinical outcome of very late recurrence of atrial fibrillation after catheter ablation of paroxysmal atrial fibrillation[J]. J Cardiovasc Electrophysiol, 2003,14(6):598-601.
[10] Zhuang J, Wang Y, Tang K, et al. Association between left atrial size and atrial fibrillation recurrence after single circumferential pulmonary vein isolation: a systematic review and meta-analysis of observational studies[J]. Europace, 2012,14(5): 638-645.
[11] Burstein B, Nattel S. Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation[J]. J Am Coll Cardiol, 2008,51(8):802-809.
[12] D′ascenzo F, Corleto A, Biondi ZG, et al. Which are the most reliable predictors of recurrence of atrial fibrillation after transcatheter ablation: a meta-analysis[J]. Int J Cardiol, 2013,167(5):1984-1989.
[13] Oakes RS, Badger TJ, Kholmovski EG, et al. Detection and quantification of left atrial structural remodeling with delayed-enhancement magnetic resonance imaging in patients with atrial fibrillation[J]. Circulation, 2009,119(13):1758-1767.
[14] Park J, Yang PS, Kim TH, et al. Low left atrial compliance contributes to the clinical recurrence of arial fibrillation after catheter ablation in patients with structurally and functionally normal heart[J]. PLoS One, 2015,10(12):e0143853.
[15] Kiuchi K, Yoshida A, Takei A, et al. Topographic variability of the left atrium and pulmonary veins assessed by 3D-CT predicts the recurrence of atrial fibrillation after catheter ablation[J]. J Arrhythm, 2015,31(5):286-292.
10.3969/j.issn.1002-266X.2017.30.020
R541.7
B
1002-266X(2017)30-0064-04
2017-02-19)

