红细胞压积及其与空腹血糖、血尿酸的交互作用对高血压患病风险的影响
刘莹,刘学奎,杨瑞华
(徐州市中心医院,江苏徐州221009)
红细胞压积及其与空腹血糖、血尿酸的交互作用对高血压患病风险的影响
刘莹,刘学奎,杨瑞华
(徐州市中心医院,江苏徐州221009)
目的 探讨红细胞压积(HCT)及其与空腹血糖(FBG)、血清尿酸(SUA)的交互作用对高血压患病的影响,为高血压的预防提供依据。方法 采用横断面研究,选取2011年在徐州市中心医院体检者32 631例。采集空腹肘静脉血,测定FBG、SUA、肝功能指标(ALT、AST)、血脂(TC、TG、HDL-C)及HCT,并检查患者的血压。将不同性别受检者的HCT按照四分位数分为Q1、Q2、Q3、Q4四个水平,按照FBG三分位数分为低、中等、高三个水平,按照SUA三分位数分为低、中等、高三个水平。用Pearson检验计算HCT与FBG、SUA间的相关性,采用多元线性回归、Logistic回归和最大似然法分层分析趋势性及交互作用。结果 随着HCT增加,高血压的患病率由Q1的23.9%上升到Q4的30.6%,高血压的患病风险增加(趋势P<0.01)。SUA低水平、高水平者的HCT与高血压患病风险的关联性差异无统计学意义趋势(P=0.099)。在FBG的各水平上,高血压患病风险均随HCT的增高而增高(趋势P分别为0.001、0.001、0.040)。SUA、FBG与HCT共同对高血压的患病风险起作用(交互作用P分别为0.001、0.001)。结论 HCT与高血压病患病密切相关,且与FBG、SUA存在交互作用,共同影响高血压的患病。
高血压;红细胞压积;代谢因素;空腹血糖;血尿酸;交互作用
高血压是最常见的慢性病,是心脑血管病发生和死亡的主要危险因素[1]。据估计,我国至少有2亿高血压患者[2]。因此,高血压的防治显得尤为重要。目前研究证实,高血压与血液流变学异常如血液黏滞状态有关[3]。研究发现,红细胞压积(HCT)作为间接反映红细胞数量大小及体积的指标,其增高与血液黏滞状态呈正相关[4]。血液中部分代谢指标也能影响血流黏滞状态,如脂类可影响红细胞膜脂质双分子层,使血液黏度进一步增高;血糖可使红细胞变形能力减弱、活动性降低等[5]。但目前,对HCT与高血压患病之间的关系,以及HCT与多种代谢因素之间是否存在对高血压患病的交互作用尚不明确。2011年1~12月,我们对32 631例体检者的HCT、代谢因素中的空腹血糖(FBG)及血清尿酸(SUA)进行检测,并测量体检者的血压情况,探讨HCT及其与FBG、SUA的交互作用对高血压患病的影响,为高血压的预防提供依据。
1 资料与方法
1.1 临床资料 选择同期在我院进行体检的江苏徐州地区体检者32 631例,男16 357例、女16 274例,年龄20~88岁。纳入标准:在本院体检中心完成全部体检项目;年龄>20岁;同意参与本研究。排除标准:伴急慢性肾小球肾炎、妊娠期高血压、先天性主动脉缩窄、原发性醛固酮增多症等继发性高血压;严重肝肾衰竭;体检资料不全。本研究经我院伦理委员会批准。
1.2 BMI测量及血压检查 测量体质量、身高、腰围和腰臀比,计算BMI。静坐5 min后用汞柱式标准袖带血压计测量右上臂收缩压及舒张压,间隔30 s测量3次,取其平均值。根据中国高血压防治指南的标准[2],收缩压(SBP)≥140 mmHg和(或)舒张压(DBP)≥90 mmHg,只要符合其中一项即定义为高血压。
1.3 FBG、SUA、肝功能、血脂指标、HCT检测 采集空腹肘静脉血,采用酶法在日立7600全自动生化分析仪上测定FBG、SUA、肝功能指标(ALT、AST)、血脂(TC、TG、HDL-C)。采用XE2100D5全血细胞分析仪测定HCT。
1.4 分层方法 ①HCT分层:将不同性别受检者的HCT按照四分位数分为Q1、Q2、Q3、Q4四个水平,Q1为<37.2%(女),<43.4%(男);Q2为37.2%~<38.9%(女),43.4%~<45.1%(男);Q3为38.9%~<40.6%(女),45.1%~<46.8%(男);Q4为≥40.6%(女),≥46.8%(男)。②FBG分层:按照FBG三分位数分为低水平(<4.93 mmol/L)、中等水平(4.93~<5.38 mmol/L)、高水平(≥5.38 mmol/L)共三个水平。③SUA分层:按照SUA三分位数分为低水平(<260 μmol/L)、中等水平(260~<334.6 μmol/L)、高水平(≥334.6 μmol/L)共三个水平。
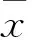
2 结果
2.1 不同HCT水平受检者年龄、BMI、FBG、SUA、肝功能、血脂指标结果 见表1。
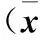
表1 不同HCT水平受检者年龄、BMI、FBG、SUA、肝功能、血脂指标结果±s)
注:*为log转换后数据。
2.2 不同HCT水平与高血压患病风险的关系 随着HCT增加,高血压的患病率由Q1的23.9%上升到Q4的30.6%,高血压的患病风险增加(趋势P<0.01)。校正性别、年龄、血脂、FBG、AST、ALT、SUA后,该趋势效应仍存在(趋势P<0.01)。见表2。
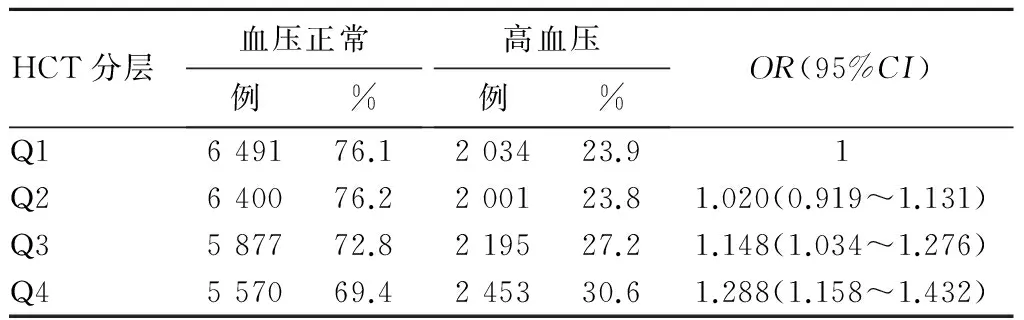
表2 不同HCT水平与高血压患病风险的关系
2.3 FBG、SUA各水平下HCT与高血压患病风险关系的分层分析 SUA低水平、高水平者的HCT与高血压患病风险的关联性差异无统计学意义(趋势P=0.099)。在FBG的各水平上,高血压患病风险均随HCT的增高而增高(趋势P分别为0.001、0.001、0.040)。SUA、FBG与HCT共同对高血压的患病风险起作用(交互作用P分别为0.001、0.001)。见表3。
3 讨论
血液黏度增高是高血压、脑梗死、缺血性脑中风、血栓闭塞性脉管炎、深部静脉栓塞和视网膜动脉栓塞等多种疾病的发病先兆信号之一[6]。红细胞约占人体血液体积的45%,是决定血液黏度的重要因素。HCT作为间接反映红细胞的大小和体积的指标,是决定红细胞对血液黏度影响的主要因素[7]。
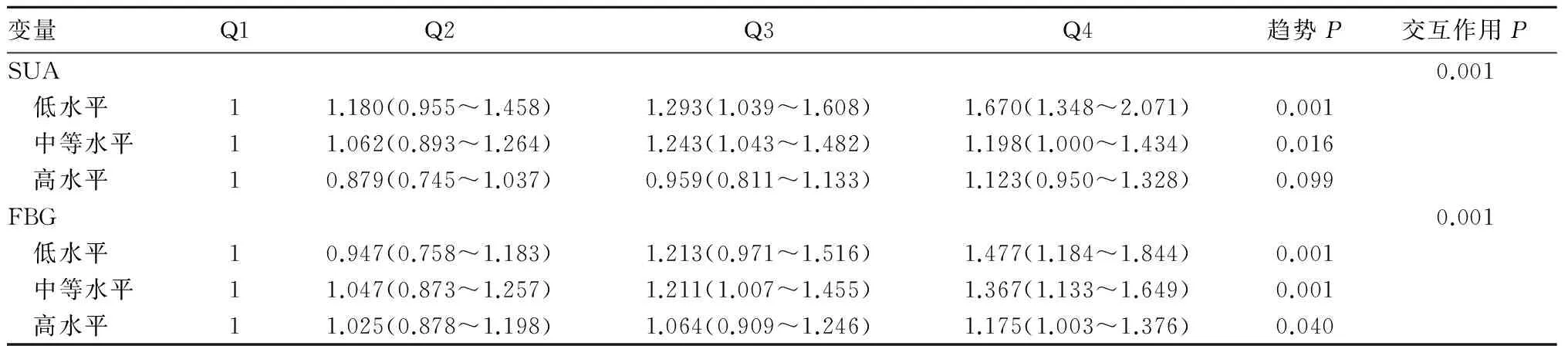
表3 BMI、FBG、SUA各水平下HCT与高血压患病风险关系的分层分析[OR(95%CI)]
注:趋势P为校正了性别、年龄、BMI、血脂、ALT、AST、SUA等代谢因素,但在计算各单独代谢因素水平下HCT与高血压患病风险时,该代谢因素不参与校正。
研究表明,心脑血管疾病[8]、高脂血症[9]的发病常伴随HCT的增高,且糖尿病、肥胖、血脂异常者的HCT高于正常健康者[10]。HCT增高可使红细胞体积减小,变形性降低,血液黏度增高,血液流动阻力增大,血压升高,同时血液中的葡萄糖、SUA等代谢指标在血流缓慢的过程中会在血管壁中大量堆积,进而影响机体的血压状况。因此,探讨HCT与代谢因素的交互作用对高血压的影响,对于预防和控制高血压疾病有一定的临床意义。
目前,关于原发性高血压的发病机制还不明确。已有研究表明,血液黏度增高是高血压疾病病因之一[3],HCT增高对高血压的影响主要是通过增加血液黏度实现的。研究显示,HCT增高可迅速增加血液黏度,HCT降低则血液黏度随之降低[11],提示HCT是影响血液黏度的主要因素。血液黏度增高可使血流较慢,组织器官缺氧,促使细胞内释放细胞因子如血管紧张素等,使血管增厚、弹性降低,导致血压升高及高血压的发病。Shuo等研究发现,在血液参数中,HCT对高血压患病的贡献值最大[12]。Vitool等[13]研究发现,HCT≥40.7%的女性人群中,代谢综合征的发病风险较HCT<37.3%者增加了5倍。本研究发现,随着HCT增加,高血压的患病风险增加,校正性别、年龄、血脂、BMI、ALT、AST、FBG后,其趋势依然存在,提示HCT与高血压的患病风险独立相关。
SUA是反映身体代谢状况的指标之一,诸多研究表明SUA升高是引起高血压疾病的病理机制之一。研究证实,随着SUA的增高,高血压的患病风险也随着增高,当SUA达到一定程度后,会使血管内皮功能紊乱[14],使HCT的作用减低。HCT的增加使血液黏度升高,血流变慢,有利于尿酸结晶沉积于血管内皮细胞,诱发血管内皮的损伤,可导致血液中脂质沉积于损伤的内皮细胞下,进一步诱发动脉粥样硬化;同时血管内皮作为一个屏障,具有抗凝作用,其损伤不仅使抗凝作用削弱,还使得内皮下胶原暴露,诱发血小板的聚集黏附,促进血栓的生成;上述两种机制均可导致高血压的发生与发展[15]。本研究发现,在SUA高水平条件下,同时HCT处于Q4水平下,收缩压的数值高于两者同处于其他分位水平时的状态,但SUA低水平、高水平者的HCT与高血压患病风险的关联性差异无统计学意义,提示虽然HCT增高加剧了血压的升高,但高SUA下的高血压疾病的发生与HCT的关系并不明显。
HCT造成的血液黏度增高、血流变慢可使血液中的糖含量相对增加,增加的葡萄糖渗透到红细胞内,细胞内山梨醇增加,渗透压升高,细胞水肿,胞膜ATP 酶活性下降,造成红细胞易于聚集,红细胞的流动性降低,使血黏度进一步增高,进而使血管收缩,毛细血管关闭,血压升高[17]。本研究结果显示,在FBG的各水平上,高血压患病风险均随HCT的增高而增高,但FBG较高人群中HCT对高血压疾病患病风险的影响低于FBG正常人群,这可能是因为FBG较高的人群存在胰岛素抵抗的风险,而胰岛素抵抗是人体SBP增高的原因之一[16]。
本研究表明,HCT与高血压患病密切相关,且独立于其他因素;同时还发现,SUA、FBG与HCT共同对高血压的患病风险起作用。提示SUA及FBG可与HCT发生协同作用,使SBP的数值进一步升高,对高血压病存在潜在危害,表明在SUA和FBG正常人群中关注HCT对高血压患病的影响更有意义。这些发现对预防心脑血管疾病的发生和改善预后具有重要意义。
[1] 中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华心血管病杂志,2011,39(7):579-616.
[2] 顾东风,Jiang He,吴锡桂,等. 中国成年人高血压患病率、知晓率、治疗和控制状况[J].中华心血管病杂志,2003,37(2):84-89.
[3] 毛江洪,汪青山,钮心怡,等.临床血液流变学的研究现状[J].中国优生与遗传杂志,2013,21(5):148-151.
[4] 赵浩,刘剑刚,雷燕.血脂异常血瘀证患者血液流动性和流变性观察[J].微循环学杂志,2015,25(3):23-26.
[5] 赵南南.不同疾病状态下各项血液流变学指标的异常变化[J].中国实用医药,2009,4(24):126-127.
[6] 王树胜,于翠梅.3712例血黏度、压积与疾病关系的研究[J].中华实用中西医杂志, 2004,4(17):555-556.
[7] Beatriz Y, Salazar V, Judith M, et.al. The variability of blood pressure due to small changes of hematocrit[J]. Am J Physiol Heart Circ Physiol, 2010,299(3):863-867.
[8] Baker IA, Pickering J, Elwood PC, et al. Fibrinogen,viscosity and white blood cell count predict myocardial. But not cerebral infarction:evidence from the caerphilly and speedwell cohort [J]. Thromb Haemost, 2002,87(3):421-425.
[9] Koenig W, Sund M, Lwel H. Association between plasma viscosity and all-cause mortality:results from the MONICA-Augsburg Cohor Study 1984-92[J]. Br J Haematol, 2000,109(2):453-458.
[10] 郑东晗.社区人群红细胞压积与心血管病危险因素的关系[D].沈阳:中国医科大学:2012.
[11] 林汉锋.血液流变学检验及临床应用[J].中国医药指南,2011,9(33):39-41.
[12] Shuo WU, Haiyan L, Chengqi Z, et al. Association between erythrocyte parameters and metabolic syndrome in urban Han Chinese: a longitudinal cohort study[J]. BMC Public Health, 2013,13:989.
[13] Vitool L, Wiroj J, Michelle A. Williams association of hematological parameters with clustered components of metabolic syndrome among professional and office workers in Bangkok, Thailand[J]. Diabetes Metab Syndr, 2007,1(3):143-149.
[14] Jun L, Ying X, Caiyan Z, et al. Serum uric acid and prehypertension among Chinese adults[J]. J Hypertens, 2009,27(9):1761-1765.
[15] 王洪莎,郭蔚莹.高尿酸血症与高血糖、高血压及肥胖的关系[J].中国老年学杂志,2016,36(22):5729-5732.
[16] 王晓春,李海涛.高血压前期人群胰岛素抵抗情况、血清脂联素水平变化及意义[J].山东医药,2016,56(12):57-58.
[17] 朱慧玲.112例糖尿病患者血液流变结果分析[J].中华检验医学杂志,2002,25(3):180-181.
杨瑞华(E-mail: yangrh1018@126.com)
10.3969/j.issn.1002-266X.2017.30.017
R544.1
B
1002-266X(2017)30-0055-03
2016-10-18)

