野生型p53诱导的磷酸酶1基因缺失对小鼠心功能的影响
刘可美,刘臣,周鹏,刘娟,谭宇,李健楠,张连峰,张宏冰,颜红兵
基础与实验研究
野生型p53诱导的磷酸酶1基因缺失对小鼠心功能的影响
刘可美,刘臣,周鹏,刘娟,谭宇,李健楠,张连峰,张宏冰,颜红兵
目的:探讨敲除野生型p53诱导的磷酸酶1(Wip1)基因对小鼠心功能的影响及心脏组织中基因和蛋白表达水平的变化。
方法:随机选取野生型(WT)小鼠和Wip1基因敲除(Wip1-KO)小鼠各10只,分别检测两组小鼠的心功能和心重/体重比,应用苏木精伊红(HE)染色观察小鼠心肌组织的病理形态,应用实时定量反转录聚合酶链式反应(RT-PCR)检测心肌组织中心房利钠肽(ANP)、B型利钠肽(BNP)、单核细胞趋化蛋白-1(MCP-1)和α-平滑肌肌动蛋白(α-SMA)的基因表达水平,并应用蛋白免疫印迹(Western blot)检测凋亡相关蛋白包括B淋巴细胞瘤-2(Bcl-2)、B淋巴细胞瘤-2相关X蛋白(Bax)和活化半胱氨酸天冬氨酸蛋白酶-3(c-Caspase3)的表达水平。
结果:与WT组小鼠相比,Wip1-KO组小鼠心肌组织中Wip1 mRNA表达明显降低(P<0.05),左心室射血分数和左心室缩短分数降低(P<0.05),左心室收缩末期内径增大(P<0.05)。虽然Wip1-KO组小鼠与WT小鼠的心脏重量没有差异,但Wip1-KO组小鼠体重较WT组小鼠减轻(P<0.05),心重/体重比增加(P<0.05)。HE染色显示Wip1-KO组小鼠的心肌形态与WT组小鼠之间没有明显差异。心肌组织中ANP、BNP、MCP-1和α-SMA基因表达水平在两组小鼠之间差异无统计学意义(P>0.05)。Wip1-KO组小鼠心肌组织中凋亡相关蛋白Bax/Bcl-2和c-Caspase3表达水平与WT组小鼠之间没有明显差异(P>0.05)。
结论:敲除Wip1基因可以损害小鼠心功能,但相关的机制还有待进一步阐明。
小鼠,基因敲除;心脏功能试验;细胞凋亡
(Chinese Circulation Journal, 2017,32:792.)
野生型p53诱导的磷酸酶1(wildtype p53-induced phosphatase 1, Wip1)属于丝氨酸-苏氨酸蛋白磷酸酶,含有605个氨基酸,是蛋白磷酸酶2C(Type 2C protein phosphatase,PP2C)家族成员之一[1]。近年来,研究发现,Wip1在很多疾病和生理过程中起着关键作用,其可以通过某些信号通路促进肿瘤发生、发展或调节衰老过程[2]。另外,Wip1在个体发育过程中也起着重要的调节作用。研究显示,Wip1基因敲除(Wip1 knockout, Wip1-KO)小鼠表现出一系列发育异常,包括雄鼠体重减轻、生殖器官萎缩,生殖能力下降和生存期缩短[3]。Wip1-KO小鼠免疫功能存在缺陷,体内T细胞和B细胞数量减少,对炎症反应抵抗能力下降[3]。敲除Wip1基因还可影响小鼠脂质代谢和动脉粥样硬化斑块形成,Wip1-KO小鼠主动脉中粥样硬化斑块明显减少[4]。Wip1在心脏组织中表达水平较高[1],但Wip1基因缺失是否会影响小鼠心血管系统的结构或功能鲜有研究。本课题组初步研究发现,Wip1-KO小鼠心功能减弱。本研究旨在探讨Wip1基因敲除对小鼠心功能的影响并进一步明确心脏组织中可能发生的基因和蛋白水平的改变,为研究Wip1在心脏中的作用提供理论基础。
1 材料与方法
1.1 实验动物及试剂
实验动物:C57BL/6野生型(wildtype,WT)小鼠购买于北京维通利华实验动物技术有限公司,Wip1-KO小鼠由中国医学科学院医学实验动物研究所北京协和医学院比较医学中心提供。Wip1-KO小鼠与WT小鼠在中国医学科学院北京协和医学院阜外医院动物实验中心饲养繁殖,研究用的子代小鼠为8~12周龄雄鼠。所有动物实验均遵守《实验动物管理条例》和相关的实验动物伦理规则。
主要试剂:苏木精伊红(hematoxylin and eosin, HE)染色试剂盒购于碧云天生物技术研究所。组织RNA提取试剂盒购自美国OMEGA公司,反转录试剂盒和实时定量反转录聚合酶链式反应(Realtime PCR,RT-PCR)试剂盒均购于日本Takara公司,Nu-PAGE预制胶Bis-Tris 4%~12%购于美国Invitrogen公司,增强型化学发光免疫印迹底物购于美国ThermoFisher公司。
主要仪器:小动物高频超声系统Vevo2100购自加拿大VisualSonic公司,电子天秤购于德国Satorious公司, PCR仪购自美国Bio-Rad公司,电泳槽和转膜仪购于美国Invitrogen公司,化学发光成像仪购于北京赛智创业科技有限公司。
1.2 超声评估小鼠心功能
Wip1-KO组与WT组分别随机抽取10只小鼠,放置于装有2%异氟烷的密闭箱中麻醉。麻醉好的小鼠左侧卧位平放于检测台,使用Vevo 2100高频小动物超声检测系统行心脏超声检查,选用M型超声模式,测量左心室舒张末期内径(left ventricular internal diameter at end-diastole,LVIDd)和左心室收缩末期内径(left ventricular internal diameter at endsystolic, LVIDs)并计算小鼠的左心室射血分数(left ventricular ejection fraction, LVEF)和左心室缩短分数(left ventricular fractional shortening, LVFS)。
1.3 小鼠体重、心脏重量测量
用电子天秤准确称量每只小鼠体重。小鼠麻醉处死后,迅速取出心脏置于冰浴的磷酸盐缓冲液(PBS)中,挤出心腔内残余血液,用剪刀除去心脏大血管起始部,用滤纸吸干心脏表面液体。于分析天平上称量心脏并记录重量。根据小鼠体重和心脏重量计算心重/体重比。
1.4 HE染色观察小鼠心肌组织的病理形态
小鼠心脏称重后于多聚甲醛溶液中固定,脱水,行石蜡切片,用HE染色试剂盒染色。电镜下观察染色结果并拍照记录。
1.5 检测小鼠心肌组织中基因表达水平
取适量小鼠心肌组织,用组织RNA提取试剂盒提取总RNA,逆转录为cDNA。采用RT-PCR试剂盒检测Wip1、心房利钠肽(atrial natriureticpeptide,ANP)、B型利钠肽(B-type Natriuretic Peptide,BNP)、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)基因表达水平。所有引物均由上海Invitrogen公司合成,引物序列如表1所示,甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因。
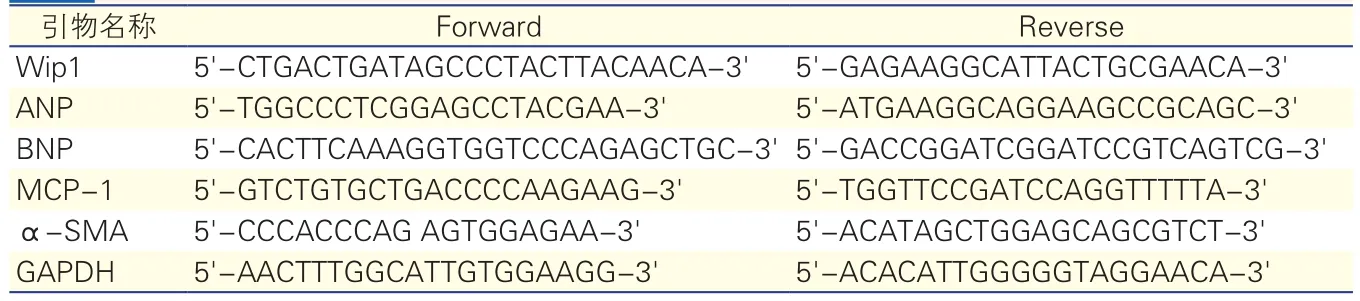
表1 所用引物序列
1.6 检测小鼠心肌组织中凋亡相关蛋白表达水平
取适量心肌组织提取总蛋白。各取等量样品上样,先在80 V电压下电泳30 min,待样品进入分离胶后用100 V电压电泳1.5 h。通过转膜仪将蛋白转移至PVDF膜上。取下PVDF膜,置于5%脱脂牛奶中室温封闭1 h,分别加入一抗B淋巴细胞瘤-2(Bcl-2,1:1000,货号CST2876,Cell Signaling Technology公司,美国)、一抗B淋巴细胞瘤-2相关X蛋白(Bax,1:1000,货号SC493,Santa Cruz公司,美国)、一抗活化半胱氨酸天冬氨酸蛋白酶-3(c-Caspase3,1:1000, 货号CST9664, Cell Signaling Technology公司,美国)和内参GAPDH(1:4000,货号CW0100M,北京康为世纪生物科技有限公司,中国),4℃孵育过夜。用PBST液洗膜3次,每次10 min,加入与一抗相对应的二抗孵育2 h,用PBST液洗膜3次,每次10 min,ECL显影。应用Image J软件分析各条带灰度值,以目的条带与GAPDH的灰度值比值反映蛋白表达水平。
1.7 统计学方法
所有实验均重复3次,数据应用GraphPad Prism 5统计软件进行分析,并用均数±标准差(±s)表示。两组间比较用独立样本t检验进行分析,P<0.05为差异具有统计学意义。
2 结果
两组小鼠心肌组织中Wip1 mRNA表达水平、心功能指标比较:与WT组小鼠相比,Wip1-KO组小鼠心肌组织中Wip1 mRNA表达水平明显降低(图1)。应用超声系统对两组小鼠心功能进行评估的结果显示(图2),Wip1-KO组小鼠的LVEF和LVFS均低于WT组小鼠(P<0.05),LVIDs比WT组小鼠高(P<0.05)。虽然Wip1-KO组小鼠的LVIDd比WT组小鼠稍高,但两组差异无统计学意义(P>0.05)。
两组小鼠的体重、心脏重量及心重/体重比的比较(表2): 通过测量小鼠体重和心脏重量评估小鼠心脏大小。与同龄WT组小鼠相比,Wip1-KO组小鼠的体重减轻,差异有统计学意义(P<0.05)。虽然两组小鼠的心脏重量无明显差异(P>0.05),但心重/体重比在Wip1-KO小鼠中明显增加(P<0.05)。
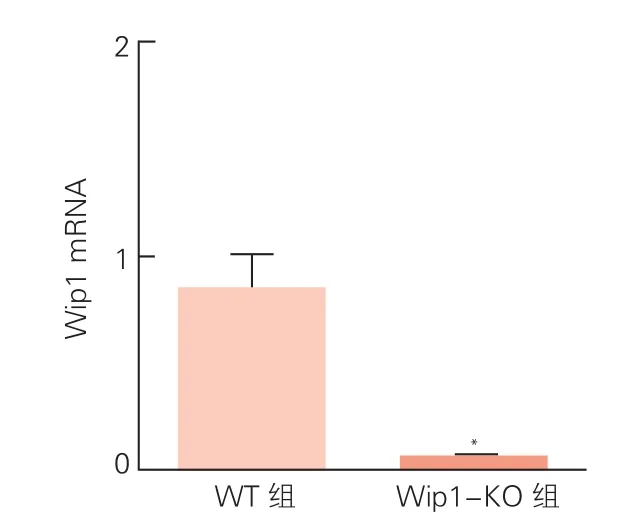
图1 两组小鼠心肌组织中Wip1 mRNA表达比较

图2 两组小鼠的心功能指标的比较

表2 两组小鼠的体重、心脏重量及心重/体重比的比较
两组小鼠心肌病理形态比较(图3):两组小鼠心肌组织切片行HE染色显示,Wip1-KO组小鼠的心肌组织病理形态基本正常,与WT小鼠心肌组织无明显差异。
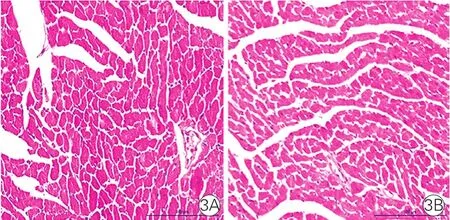
图3 两组小鼠心肌组织病理形态比较(×100)
两组小鼠心脏中ANP、BNP、MCP-1和α-SMA基因表达:受到外界病理因素刺激或应激时,心肌组织中某些基因表达上调,可以反映心肌组织受损。我们检测了两组小鼠的ANP、BNP、MCP-1和α-SMA的表达水平(图4)。与WT组小鼠相比,Wip1-KO组小鼠心肌组织中ANP、BNP和α-SMA mRNA的表达都略有减少,但差异无统计学意义(P>0.05)。Wip1-KO组小鼠心肌组织MCP-1 mRNA基因表达较WT组小鼠升高,但两组差异无统计学意义(P>0.05)。

图4 两组小鼠心肌组织ANP、BNP、MCP-1和α-SMA的mRNA表达水平比较
两组小鼠心脏中凋亡相关蛋白表达的比较(图5):通过Western blot对小鼠心肌组织中凋亡相关蛋白表达水平的检测分析发现,Wip1-KO组小鼠心肌组织中凋亡相关蛋白Bax/Bcl-2比值和c-Caspase3的表达与WT组小鼠之间没有明显差异(P>0.05)。
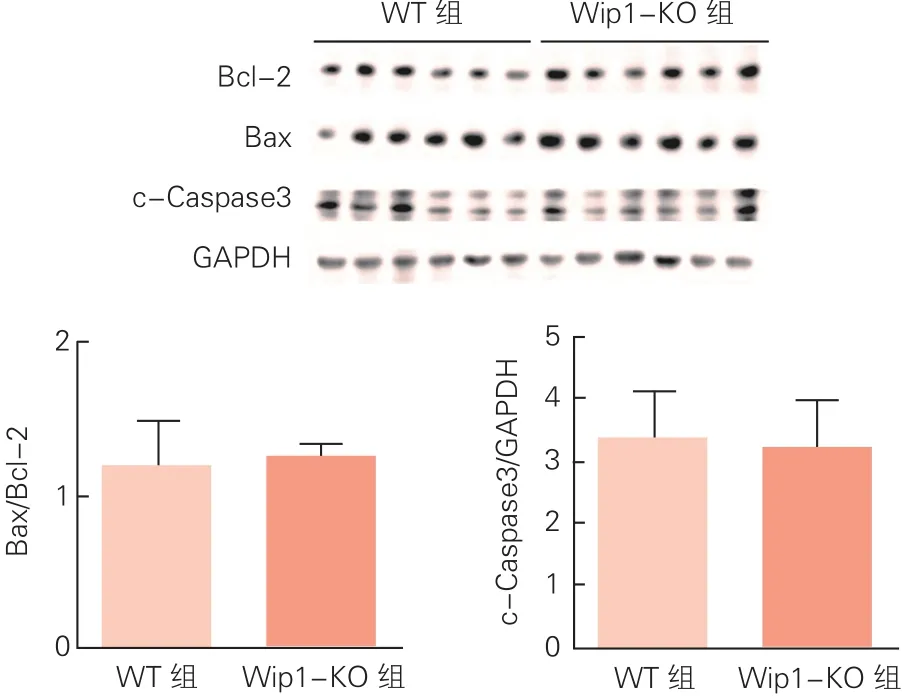
图5 两组小鼠心肌组织中凋亡相关蛋白表达水平的比较
3 讨论
Wip1在很多病理和生理过程中起着重要作用。研究报道,Wip1基因敲除可影响小鼠血糖代谢。敲除Wip1基因的小鼠在高脂饮食时出现糖耐量异常和胰岛素抵抗[5]。Wip1还可以通过调节脂质转化影响动脉粥样硬化斑块形成,并通过哺乳动物雷帕霉素靶蛋白信号通路和自噬影响斑块进展[4]。本研究中敲除Wip1基因的小鼠心功能下降,心重/体重比增加,初步提示Wip1在小鼠心脏中也起着调节作用。
Wip1基因缺失小鼠存在发育缺陷。与野生型小鼠相比,敲除Wip1基因的雄性小鼠体重减轻,皮肤表面容易出现溃疡,生精小管退化,脾脏增大,伴或不伴有正常的脾脏结构缺失,并且对抗原的敏感性增加[3]。敲除Wip1基因可以影响小鼠胸腺发育,胸腺中T细胞数量较少并且发育异常[6]。此外,Wip1基因缺失也可以影响小鼠体内B细胞发育,骨髓、外周血液和脾脏中B细胞数量明显减少,早期B细胞前体出现细胞内在缺陷[7]。与既往研究结果相一致,本研究发现Wip1-KO小鼠的体重比野生型小鼠减轻。虽然两组小鼠之间心脏重量的差异没有统计学意义,但Wip1-KO小鼠的心重/体重比值较野生型小鼠大。本研究还发现敲除Wip1基因可引起小鼠心功能减弱,射血分数和缩短分数都降低,左心室收缩末期内径增大,说明Wip1基因缺失可以损害小鼠心功能。
ANP和BNP是心脏分泌的利钠肽,心脏压力超负荷或容量超负荷时分泌增加。因此,ANP和BNP基因表达水平上调可以反映心脏收缩或舒张功能受损[8]。MCP-1是单核细胞趋化因子,具有诱导单核细胞浸润的作用。MCP-1可以通过调节内皮细胞迁移直接影响损伤部位血管生成[9],并通过刺激细胞外基质促进纤维组织形成[10]。小鼠心肌缺血再灌注损伤模型中,MCP-1可以诱导炎性单核细胞聚集,促进内膜增生,从而使梗死面积扩大并加重心肌损伤[11,12]。α-SMA主要由血管平滑肌细胞和成纤维细胞表达,在发育过程中被α-骨骼肌肌动蛋白和α-心肌肌动蛋白取代。病理性刺激或应激状态可诱导α-SMA表达,心肌梗死后疤痕组织中成纤维细胞表达α-SMA水平上调[13]。近期研究发现,α-SMA可与细胞外基质蛋白相互作用,进而调节心肌细胞的收缩功能[14]。本研究检测了这四种基因在小鼠心肌组织中的表达水平,虽然两组小鼠之间存在一定差异,但差异并不具有统计学意义。
细胞凋亡是一种细胞程序性死亡,主要表现为细胞体积变小,染色质浓缩和核DNA降解[15]。Bcl-2家族在细胞凋亡中起着重要作用,迄今为止,已发现有大约25种蛋白。其中,Bcl-2具有抗凋亡作用,Bax属于促凋亡蛋白[16]。Caspase是一组半胱氨酸蛋白酶,在凋亡过程中主要作用是清除细胞蛋白,引起细胞的生物化学和形态学改变。受到凋亡信号刺激后,Bcl-2家族的促凋亡成员如Bax活化,进而引起线粒体膜上的渗透性转运孔形成。线粒体释放细胞色素C等形成凋亡体,活化Caspase 9和Caspase 3,从而诱发凋亡[17]。p53在细胞凋亡过程中起着重要的调节作用,研究发现Wip1可通过使p53去磷酸化和使上游蛋白失活达到抑制凋亡的作用[18]。本研究检测了WT小鼠和Wip1-KO小鼠心肌组织中凋亡相关蛋白的表达水平,两组小鼠之间无统计学差异,提示Wip1敲除不影响心肌组织中凋亡信号通路。
本研究发现敲除Wip1基因可影响小鼠心功能,但具体的分子学机制尚不清楚,是此研究的局限之一。此外,研究中缺乏Wip1基因敲除小鼠补充外源性Wip1蛋白对照组,是该研究的另一不足。
虽然本研究的结果发现Wip1基因缺失可损害小鼠心功能和影响小鼠心重/体重比,但并不影响小鼠心肌组织病理形态改变,也不影响心脏中相关基因和蛋白表达。Wip1基因敲除通过何种信号通路影响小鼠心功能仍需进一步研究。
[1] Choi J, Appella E, Donehower LA. The Structure and Expression of the Murine Wildtype p53-Induced Phosphatase 1(Wip1). Genomics, 2000, 64: 298-306.
[2] Zhu YH, Bulavin DV. Wip1-Dependent Signaling Pathways in Health and Diseases. Prog Mol Biol Transl Sci, 2012, 106: 307-325.
[3] Choi J, Nannenga B, Demidov ON, et al. Mice deficient for the wild-type p53-induced phosphatase gene (Wip1) exhibit defects in reproductive organs, immune function, and cell cycle control. Mol Cell Biol, 2001, 22: 1094-1105.
[4] Leguezennec X, Brichkina A, Huang YF, et al. Wip1-Dependent Regulation of Autophagy, Obesity, and Atherosclerosis. Autophagy, 2012, 16: 68.
[5] Armata HL, Chamberland S, Watts L, et al. Deficiency of the tumor promoter gene wip1 induces insulin resistance. Mol Endocrinol, 2014, 29: 28-39.
[6] Schito ML, Demidov ON, Saito S, et al. Wip1 phosphatase-deficient mice exhibit defective T cell maturation due to sustained p53 activation. J Immunol, 2006, 176: 4818-4825.
[7] Yi W, Hu X, Chen Z, et al. Phosphatase Wip1 controls antigenindependent B-cell development in a p53-dependent manner. Blood, 2015, 126: 620-628.
[8] Daniels LB, Maisel AS. Natriuretic peptides. J Am Coll Cardiol, 2007, 50: 2357-2368.
[9] Weber KS, Nelson PJ, Gröne HJ, et al. Expression of CCR2 by endothelial cells : implications for MCP-1 mediated wound injury repair and In vivo inflammatory activation of endothelium. Arterioscler Thromb Vasc Biol, 1999, 19: 2085-2093.
[10] Sakai N, Wada T, Furuichi K, et al. MCP-1/CCR2-dependent loop for fibrogenesis in human peripheral CD14-positive monocytes. J Leukoc Biol, 2006, 79: 555-563.
[11] Dewald O, Zymek P, Winkelmann K, et al. CCL2/Monocyte Chemoattractant Protein-1 regulates inflammatory responses critical to healing myocardial infarcts. Cir Res, 2005, 96: 881-889.
[12] Liehn EA, Piccinini AM, Koenen RR, et al. A new monocyte chemotactic protein-1/chemokine CC motif ligand-2 competitor limiting neointima formation and myocardial ischemia/reperfusion injury in mice. J Am Coll Cardiol, 2010, 56: 1847-1857.
[13] Suurmeijer AJ, Clément S, Francesconi A, et al. α Actin isoform distribution in normal and failing human heart: a morphological, morphometric, and biochemical study. J Pathol, 2003, 199: 387-397.
[14] Bildyug N, Bozhokina E, Khaitlina S. Contribution of α-smooth muscle actin and extracellular matrix to the in vitro reorganization of cardiomyocyte contractile system. Cell Biol Int, 2016, 40: 472-477.
[15] Maiese K, Chong ZZ, Shang YC, et al. Targeting disease through novel pathways of apoptosis and autophagy. Expert Opin Ther Targets. 2012, 16: 1203-1214.
[16] Ola MS, Nawaz M, Ahsan H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis. Mol Cell Biochem, 2011, 351: 41-58.
[17] Siddiqui WA, Ahad A, Ahsan H. The mystery of Bcl2 family: Bcl-2 proteins and apoptosis: an update. Arch Toxicol, 2015, 89: 289-317.
[18] Lowe J, Cha H, Lee MO, et al. Regulation of the Wip1 phosphatase and its effects on the stress response. Front Biosci (Landmark Ed), 2012, 17: 1480-1498.
(编辑:许菁)
Impact of Wildtype p53 Induced Phosphatase 1 Gene Lacking on Heart Function in Experimental Mice
LIU Ke-mei, LIU Chen, ZHOU Peng, LIU Juan, TAN Yu, LI Jian-nan, ZHANG Lian-feng, ZHANG Hong-bing, YAN Hong-bing.
State Key Laboratory of Cardiovascular Disease, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
YAN Hong-bing, Email: hbyanfuwai@aliyun.com
Objective: To explore the impact of knocking out wildtype p53 phosphatase 1 gene on heart function with the changes of cardiac tissue mRNA and protein expressions in experimental mice.
Methods: Our research included in 2 groups: Wildtype (WT) mice group and Wip1 knockout (Wip1-KO) mice group. n=10 in each group. The heart function, ratio of heart weight to body weight (HW/BW) were examined and compared between 2 groups; cardiac tissue morphology was observed by HE staining; mRNA expressions of ANP, BNP, MCP-1 and α-SMA were determined by RT-PCR and protein expressions of Bcl-2, Bax and c-caspase3 were measured by Western blot analysis.
Results: Compared with WT mice group, Wip1-KO mice group showed decreased Wip1 mRNA expression, P<0.05, decreased LVEF, LV fraction shortening and increased left ventricular end systolic diameter (LVESD), all P<0.05; Wip1-KO mice group had reduced BW and elevated ratio of HW/BW, both P<0.05 even the heart weight was similar between 2 groups. There was no difference in cardiac tissue morphology between 2 groups; mRNA expressions of ANP, BNP, MCP-1 and α-SMA
Conclusion: Wip1 gene knockout may impair the heart function in experimental mice, while the relevant mechanism should be further investigated.
Mice, Gene knockout; Heart function test; Apoptosis
book=792,ebook=68
国家自然科学基金(81270288 , 81541095)
100037 北京市,北京协和医学院 中国医学科学院 国家心血管病中心 阜外医院(刘可美、刘臣、周鹏、刘娟、谭宇、李健楠、颜红兵);中国医学科学院医学实验动物研究所 北京协和医学院比较医学中心(张连峰);中国医学科学院基础医学研究所 北京协和医学院基础学院(张宏冰)
刘可美 硕士研究生 主要从事心血管病学基础与临床研究 Email:liukemei@aliyun.com 通讯作者:颜红兵 Email: hbyanfuwai@aliyun.com
R54
A
1000-3614(2017)08-0792-05
10.3969/j.issn.1000-3614.2017.08.015were similar between 2 groups, P>0.05; apoptosis related protein expressions of Bax/Bcl-2 and c-caspase3 were similar between 2 groups, P>0.05.
2017-02-19)

