血清钠水平对急性ST段抬高型心肌梗死患者近期预后的预测价值
张涛,杨艳敏,朱俊,刘力生,梁岩,谭慧琼,李建冬
血清钠水平对急性ST段抬高型心肌梗死患者近期预后的预测价值
张涛,杨艳敏,朱俊,刘力生,梁岩,谭慧琼,李建冬
目的:探讨血清钠(Na+)水平与急性ST段抬高型心肌梗死(STEMI)患者近期预后的关系。
方法:回顾性分析符合欧洲心脏病学会和美国心脏病学会诊断标准,发病12 h内的STEMI患者7 461例,根据患者入院24 h内血清Na+水平最低值将患者分为≥135 mmol/L组、130~134 mmol/L组、<130 mmol/L组,比较各组间基线信息、30天死亡等主要不良事件发生率以及神经内分泌抑制治疗效果的差异并分析其与血清Na+水平的关系。
结果:<130 mmol/L组7天和30天死亡率较其他两组高(P均<0.001);<130 mmol/L组与≥135 mmol/L组相比,30天心原性休克、心力衰竭和危及生命的心律失常发生率也显著升高(P<0.001)。校正了年龄、利尿剂治疗及再灌注治疗等其他影响因素后,血清Na+<130 mmol/L依然与7天及30天死亡显著相关(OR分别为1.69及1.57)。单变量和多变量分析均显示出血清Na+<130 mmol/L与心原性休克(OR分别为1.75及1.64)、心力衰竭(OR分别为1.42及1.30)和危及生命的心律失常( OR分别为1.53及1.34)等次要终点事件显著相关。三组患者中,无论单独应用血管紧张素转换酶抑制剂或β受体阻滞剂,还是联合应用两种药物治疗,与未使用这类药物的患者相比30天死亡率均明显降低(P均<0.001);<130 mmol/L组患者下降幅度较其他两组更为显著,差异有统计学意义(P<0.001)。
结论:入院24 h内的血清Na+<130mmol/L是STEMI患者近期死亡、心原性休克、心力衰竭和危及生命的心律失常等主要不良事件的危险因素。
心肌梗塞;低钠血症;预后
(Chinese Circulation Journal, 2017,32:742.)
低钠血症通常定义为血清钠(Na+)<135 mmol/L,是临床常见的一种电解质紊乱。低钠血症早已确认为心力衰竭(心衰)患者病情严重及预后不良的强力预测因子[1-3]。已公布的针对急性和慢性心衰患者的风险预测模型中,血清Na+水平都是一个重要的组成部分[4,5]。心衰患者中低钠血症的发生、发展可能与肾素-血管紧张素-醛固酮系统的激活、精氨酸血管加压素的分泌增多以及交感神经系统激活等作用相关[6-9]。在急性心肌梗死(AMI)的早期阶段,也存在类似的神经内分泌激活[10,11],一些研究表明,对于AMI来说,低钠血症可能也是一个风险预测因子[12-15]。但是在这些观察研究中,血清Na+水平与AMI患者预后的关系仍未充分阐明。基于此情况,本研究回顾分析2001-06至2004-07期间国内CREATE-ECLA研究中建立的数据资料,评价血清Na+水平对急性ST段抬高型心肌梗死(STEMI)患者近期预后的预测价值,同期观察神经内分泌抑制治疗对不同血清Na+水平患者预后改善方面的差异。
1 资料与方法
研究对象:2001-06至2004-07 CREATEECLA研究中入选的7 461例符合欧洲心脏病学会和美国心脏病学会诊断标准[16]、发病在12 h内的STEMI患者的临床资料,男性5 357例(71.8%),平均年龄(62.6±11.9)岁。根据患者血清Na+水平(24 h内多次测量者取最低值)将7 461例患者分为三组:≥135mmol/L组(n=4 047)、130~134mmol/L组(n=2 605);<130 mmol/L组(n=809)。观察终点:主要终点为发病7天和30天内的全因死亡率。次要研究终点为发病30天内的其他不良事件,包括心原性休克、心衰、危及生命的心律失常和再梗死。
统计学方法:(1)使用SPSS13.0软件进行分析。连续数据以平均值±标准差表示,分类数据以百分比表示。(2)三组患者的基本信息、基线病情、治疗情况间的差异以Pearson χ2检验进行比较,并使用通用线性模型比较平均值(F检验)。(3)血清Na+浓度与终点事件之间的关系使用单变量及多变量逻辑回归分析检验,血清Na+水平作为分类变量,以≥135mmol/L组作为参考组。包括血清Na+水平在内的多种因素对30天死亡率的预测作用也采用多变量回归分析加以评估。多变量分析模型参考GUSTO-I试验[17]模型,包含年龄、体重、收缩压、Killip分级、心率、心肌梗死部位、既往心肌梗死病史、年龄/Killip分级比值、糖尿病、高血压和卒中病史、溶栓或经皮冠状动脉腔内成形术(PTCA)等变量,并添加了入院时血糖。此外,是否使用利尿剂也作为一个变量被加入分析以校正利尿治疗的影响。(4)不同血清Na+水平组间神经内分泌抑制治疗[单独使用血管紧张素转换酶抑制剂(ACEI)、单独使用β受体阻滞剂以及联合使用两种药物]对患者30天死亡率影响的差异采用多变量逻辑回归分析。(5) P<0.05为差异有统计学意义,所有P值均为双侧检验值。
2 结果
三组患者临床资料的比较(表1):<130mmol/L组与其他两组比较,年龄偏大(P<0.001),女性占比较高(P<0.001),收缩压较低(P=0.016),心率较快(P<0.001),Killip分级Ⅱ~Ⅳ级的患者的比例较高(P<0.001),入院时血糖水平较高(P<0.001),使用胰岛素的患者的比例较高(P<0.001),使用利尿剂的患者比例亦较高(P=0.005);接受溶栓治疗和再灌注治疗患者比例(P<0.001)、接受ACEI治疗患者的比例较低(P=0.003),差异均有统计学意义(P<0.05)。
三组患者终点事件发生率的比较(图1): 7 461例患者 7天内死亡612例(8.2%),30天内死亡799例(10.7%)。(1) 7天和30天死亡率: <130 mmol/L组较其他两组均高(P均<0.001); 130~134 mmol/L组(P=0.505)与 ≥135mmol/L组(P=0.522)间无显著性差异。(2) <130 mmol/L组与 ≥135 mmol/L组相比,30天内心原性休克、心衰和危及生命的心律失常发生率显著升高(P<0.001);≥135 mmol/L组与 130~134 mmol/L组比较差异无统计学意义(5.9% vs 6.2%,P=0.599; 19.0% vs 18.0%,P=0.315;8.5% vs 9.0%,P=0.535)。(3) 三组间再梗死的发生率差异无统计学意义(P=0.675)。
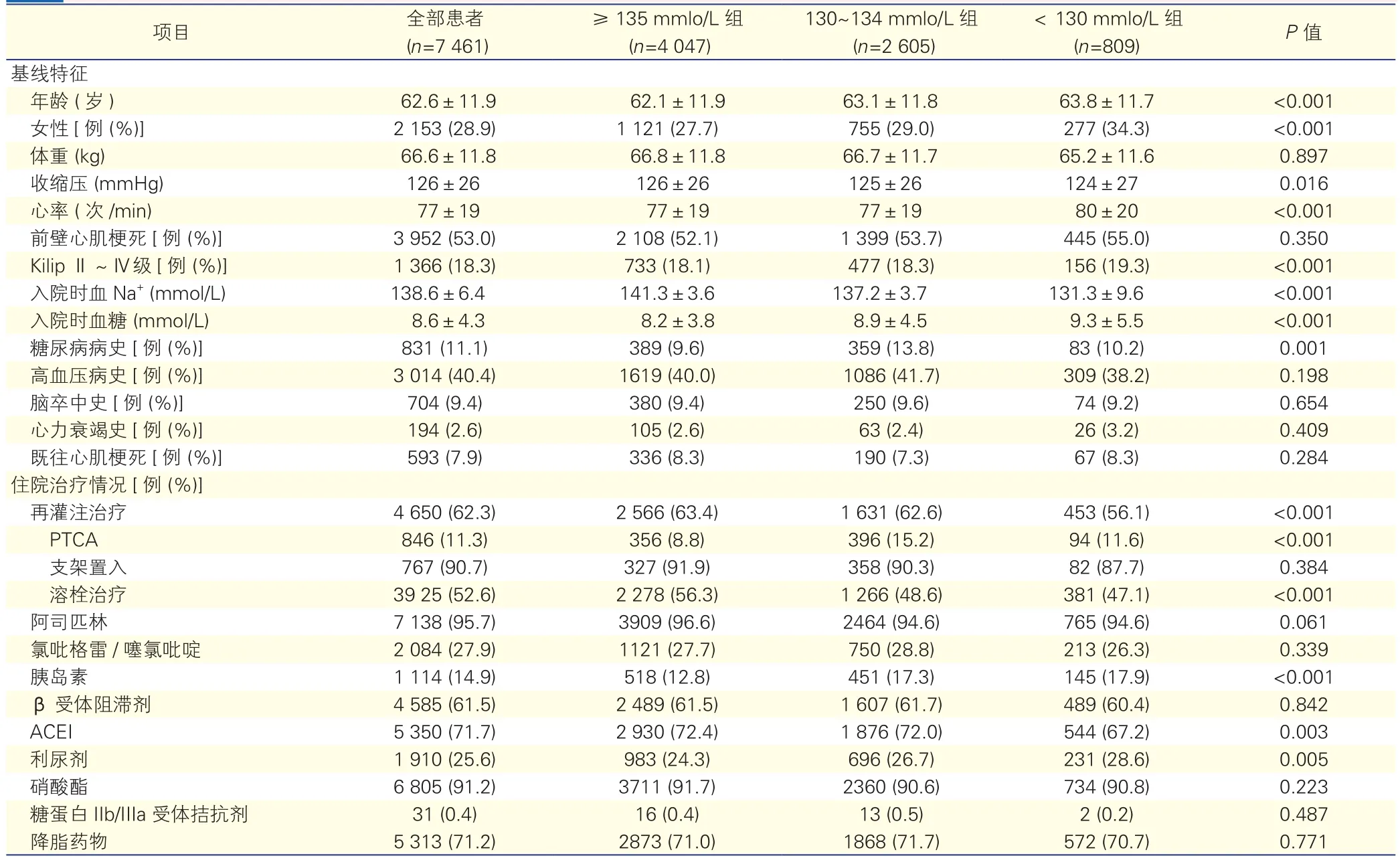
表1 7 461例患者及各组的基线临床特征及住院治疗情况比较(±s)
血清Na+水平与终点事件的相关性(表2):血清Na+<130 mmol/L与7天及30天死亡率升高均呈现出明显的相关性,校正了年龄、利尿剂治疗及再灌注治疗等其他影响因素后,血清Na+<130 mmol/L依然与7天及30天死亡显著相关(OR分别为1.69及1.57)。此外,单变量和多变量分析均显示出血清Na+<130 mmol/L也与心原性休克、心衰和危及生命的心律失常等次要终点事件显著相关。
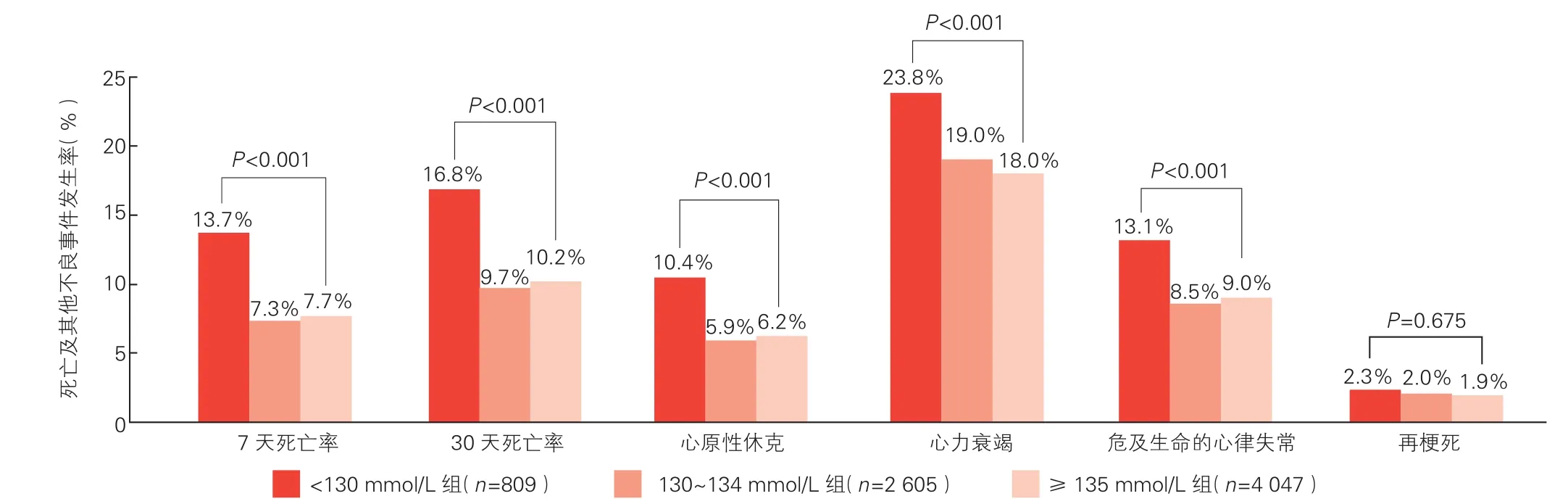
图1 三组患者死亡率及其他不良事件发生率
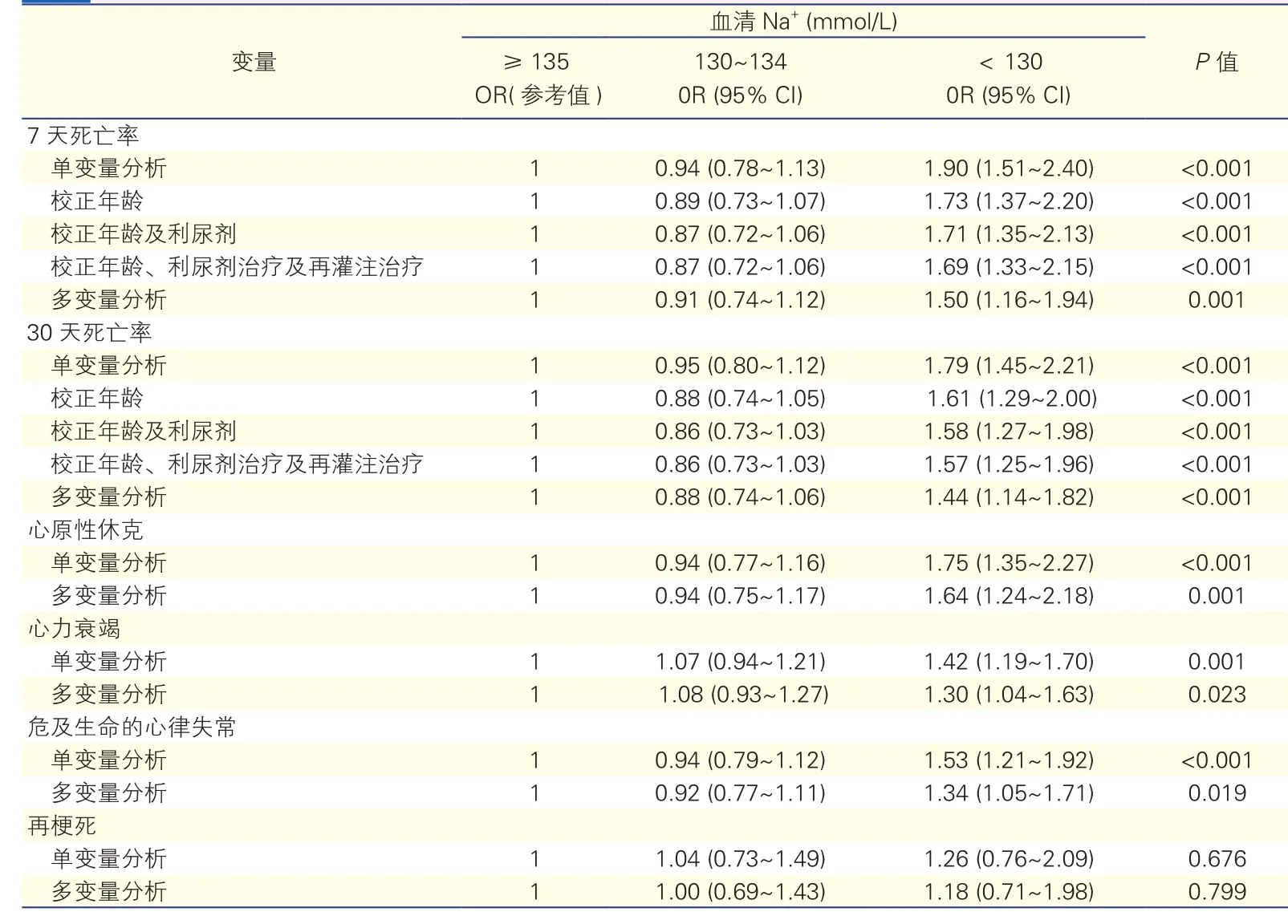
表2 血清Na+水平与终点事件的相关性关系
30天死亡率预测因素的多变量回归分析(表3):参考GUSTO-I试验模型,建立针对7 461例患者30天死亡率的预测模型,包含年龄、性别、心率、收缩压、Killip分级、年龄/Killip分级比值、心肌梗死部位、卒中史、PTCA等因素,并添加了入院时血糖、血清Na+水平以及是否使用利尿剂等因素。经过校正的模型显示,血清Na+<130 mmol/L是30天死亡的预测因子(OR=1.44,95%CI:1.14~1.82,P<0.001),而血清Na+130~134 mmol/L与30天死亡的相关性并不显著(OR=0.88,95%CI:0.74~1.06,P=0. 090)。
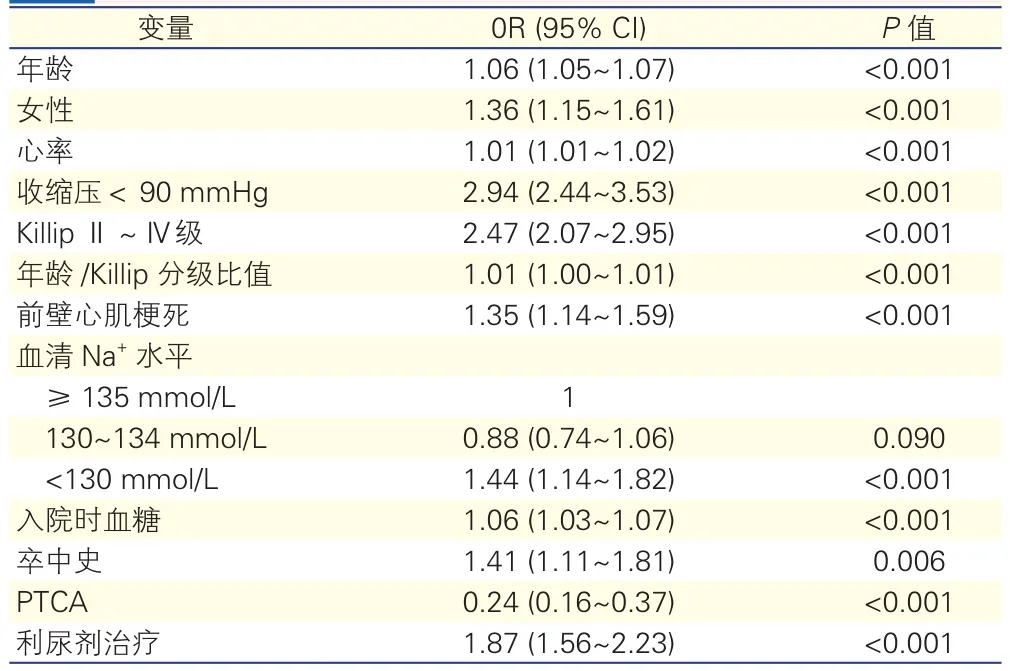
表3 30天死亡率预测因素的多变量回归分析
神经内分泌抑制治疗对三组患者30天死亡率影响的比较(图2):无论单独应用ACEI或β受体阻滞剂还是联合应用两种药物,三组患者30天死亡率较未使用者均降低(P均<0.001);130~134 mmol/L组和≥135 mmol/L组间30天死亡率降低幅度差异无统计学意义(P=0.784),<130 mmol/L组患者较其他两组降幅均更为显著,差异有统计学意义(P<0.001)。
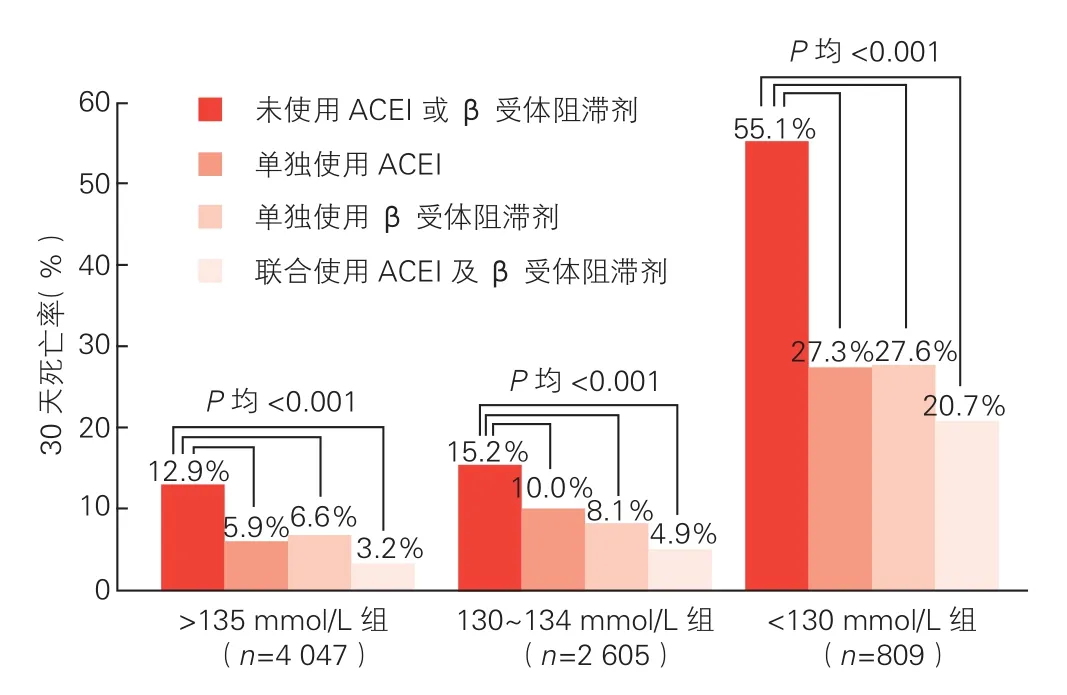
图2 神经内分泌抑制治疗对三组患者30天死亡率的影响
3 讨论
本研究评估入院后24 h内血清Na+水平对STEMI患者预后的预测价值。低钠血症在STEMI患者急性期相当常见,其与许多提示患者预后不良的其他基线特征相关,尤其是血清Na+<130 mmol/L。血清Na+<130 mmol/L患者的近期死亡率以及心原性休克、心衰、危及生命的心律失常的发生率均显著升高。校正了其他已知的危险因素后,Na+<130 mmol/L依然是上述不良事件的独立预测因子。而神经内分泌抑制治疗(ACEI和β受体阻滞剂)降低患者死亡率的作用在血清Na+<130 mmol/L的患者更加明显。
低钠血症是住院患者常见的电解质紊乱类型[18],此前亦有许多研究提示低钠血症与AMI患者的不良预后之间存在联系,但具体机制尚不明确[12-15,19,20]。已知低钠血症是心衰患者预后的预测因素[1-5]。血清Na+水平偏低的心衰患者神经内分泌激素水平较血清Na+正常患者的为高[6-9]。心衰患者的血清Na+水平降低是反映神经内分泌激活和疾病进展的一个标志[21]。实际上,在AMI患者的急性期也存在类似的神经内分泌激活,包括肾素-血管紧张素-醛固酮系统或交感神经系统的激活和(或)或血管加压素释放[10,11]。血管紧张素Ⅱ和醛固酮水平的升高引起肾小管对Na+、水的排泄减少。交感系统的激活引起肾血管收缩导致肾血流量下降、激活肾素-血管紧张素-醛固酮系统并可以直接作用于近曲小管系统[22]。最后,AMI导致的非渗透性刺激,如左心室功能不全、疼痛、恶心呕吐以及镇痛和利尿治疗等,引起血管加压素释放增加,导致肾集合管水通道蛋白数量上调、自由水潴留增加从而进一步加重低钠血症[23]。因此,AMI患者的低钠血症可能是显著的神经内分泌激活的结果,因而与疾病的严重程度相关。另外,本研究结果显示低钠血症也与其他一些已知的、提示AMI患者预后不良的高危因素存在相关性,包括高龄、女性、糖尿病病史、低血压和Killip分级偏高等[17,24],尤其是血清Na+<130 mmol/L者。这可能是低钠血症患者预后不良的另一个原因。
关于利尿治疗对研究的影响,本研究发现低钠血症患者中利尿剂的使用更多。一方面,利尿治疗可以导致钠排泄增多从而导致低钠血症,但另一方面,更多的利尿治疗很可能也是该组患者病情更重的提示。尽管利尿治疗对研究和分析存在一定干扰作用,但在校正了利尿治疗及其他并存的已知危险因素的影响后,血清Na+<130 mmol/L仍然是患者近期死亡及其他不良事件的独立预测因子。
本研究还显示β受体阻滞剂和ACEI类药物的治疗效果在不同血清Na+水平患者间存在差异,血清Na+<130 mmol/L的患者无论使用两种药物中的任一种或联合应用两种药物,30天死亡率的降低均更为显著。正如前文所述,AMI患者的低钠血症可能是显著的神经内分泌激活的结果,因而与疾病的严重程度相关,不难理解神经内分泌抑制治疗对严重低钠血症患者的效果更为显著。与此类似的,既往研究提示血清Na+偏低的心衰患者较血清Na+正常的患者接受ACEI治疗后生存率的改善更为明显[25];β受体阻滞剂降低死亡率的效果与心率下降的幅度有关,对初始心率较快的患者更为明显[26,27]。而本研究中,血清Na+<130mmol/L的患者较另两组患者心率也正是更快。这些结果提示应全力确保所有具备适应症的患者、尤其是存在低钠血症的患者均接受现有指南推荐的ACEI和β受体阻滞剂治疗。
本研究为回顾性研究,存在一定的局限性。首先,对于AMI患者而言,入院24 h内低钠血症是患者预后不良的标志,但未能对低钠血症的发生机制进行深入探讨,但该现象的揭示仍具有重要临床意义。其次,资料所限,本研究仅能回顾分析患者入院后24 h内血清Na+水平与患者预后的联系,并不清楚患者在整个住院治疗期间血清Na+浓度的连续变化情况,无法评估持续性低钠血症对患者预后的预测价值。
综上所述,入院24 h内的血清Na+水平<130 mmol/L是STEMI患者近期死亡和包括心原性休克、心衰和危及生命的心律失常等主要不良事件的危险因素。低钠血症可能是神经内分泌系统过度激活的一个标志,神经内分泌抑制治疗对血清Na+<130 mmol/L的患者降低死亡率的作用更为显著。因此应全力确保所有具备适应证的患者,尤其是存在低钠血症的患者均接受现有指南推荐的ACEI和β受体阻滞剂治疗。持续性低钠血症对STEMI患者预后的预测价值以及纠正低钠血症是否可以改善患者的预后尚需进一步研究。
[1] Klein L, O’Connor CM, Leimberger JD, et al. Lower serum sodium is associated with increased short-term mortality in hospitalized patients with worsening heart failure: results from the Outcomes of a Prospective Trial of Intravenous Milrinone for Exacerbations of Chronic Heart Failure (OPTIME-CHF) study. Circulation, 2005 , 111: 2454-2460.
[2] Gheorghiade M, Abraham WT, Albert NM, et al. Relationship between admission serum sodium concentration and clinical outcomes in patients hospitalized for heart failure: an analysis from the OPTIMIZEHF registry. Eur Heart J, 2007, 28: 980-988.
[3] 巫雪飞, 邹长虹, 黄燕, 等. 住院扩张型心肌病患者低钠血症的发生率及其对预后的判断价值. 中国循环杂志, 2015, 30: 529-533.
[4] Fonarow GC, Adams KF Jr, Abraham WT, et al. Risk stratification for in-hospital mortality in acutely decompensated heart failure: classification and regression tree analysis. JAMA, 2005, 293: 572-580.
[5] Gheorghiade M, Abraham WT, Albert NM, et al. Systolic blood pressure at admission, clinical characteristics, and outcomes in patients hospitalized with acute heart failure. JAMA, 2006, 296: 2217-2226.
[6] Goldsmith SR, Gheorghiade M. Vasopressin antagonism in heart failure. J Am Coll Cardiol, 2005, 46: 1785-1791.
[7] Dzau VJ, Colucci WS, Hollenberg NK, et al. Relation of the reninangiotensin-aldosterone system to clinical state in congestive heart failure. Circulation, 1981, 63: 645-651.
[8] Chidsey CA, Braunwald E, Morrow AG. Catecholamine excretion and cardiac stores of norepinephrine in congestive heart failure. Am J Med, 1965, 39: 442-451.
[9] 贺桦, 许顶立, 刘彦波. 慢性心力衰竭伴低钠血症患者血浆血管加压素和脑钠肽水平的变化. 中国循环杂志, 2004, 19: 529-533.
[10] Sigurdsson A, Held P, Swedberg K. Short- and long-term neurohormonal activation following acute myocardial infarction. Am Heart J, 1993, 126: 1068-1076.
[11] Foy SG, Crozier IG, Richards AM, et al. Neurohormonal changes after acute myocardial infarction: relationships with haemodynamic indices and effects of ACE inhibition. Eur Heart J, 1995, 16 : 770-778.
[12] Goldberg A, Hammerman H, Petcherski S, et al. Prognostic importance of hyponatremia in acute ST-elevation myocardial infarction. Am J Med, 2004, 117 : 242-248.
[13] Goldberg A, Hammerman H, Petcherski S, et al. Hyponatremia and long-term mortality in survivors of acute ST-elevation myocardial infarction. Arch Intern Med, 2006 , 166: 781-786.
[14] Bae MH, Kim JH, Jang SY, et al. Hyponatremia at discharge as a predictor of 12-month clinical outcomes in hospital survivors after acute myocardial infarction. Heart Vessels, 2017, 32: 126-133.
[15] Burkhardt K, Kirchberger I, Heier M, et al. Hyponatraemia on admission to hospital is associated with increased long-term risk of mortality in survivors of myocardial infarction. Eur J Prev Cardiol, 2015, 22: 1419-1426.
[16] Alpert JS, Thygesen K, Antman E, et al. Myocardial infarction redefined: a consensus document of the Joint European Society of Cardiology/American College of Cardiology Committee for the Redefinition of Myocardial Infarction. J Am Coll Cardiol, 2000 , 36: 959-969.
[17] Lee KL, Woodlief LH, Topol EJ, et al. Predictors of 30-day mortality in the era of reperfusion for acute myocardial infarction. Results from an international trial of 41, 021 patients. GUSTO-I Investigators. Circulation, 1995, 91: 1659-1668.
[18] Anderson RJ, Chung HM, Kluge R, et al. Hyponatremia: a prospective analysis of its epidemiology and the pathogenetic role of vasopressin. Ann Intern Med, 1985, 102: 164-168.
[19] Flear CT, Hilton P. Hyponatraemia and severity and outcome of myocardial infarction. Br Med J, 1979, 1: 1242-1246.
[20] Singla I, Zahid M, Good CB, et al. Effect of hyponatremia (<135 mmol/L) on outcome in patients with non-ST-elevation acute coronary syndrome. Am J Cardiol, 2007, 100: 406-408.
[21] Lilly LS, Dzau VJ, Williams GH, et al. Hyponatremia in congestive heart failure: implications for neurohumoral activation and responses to orthostasis. J Clin Endocrinol Metab, 1984, 59: 924-930.
[22] Schrier RW, Berl T. Mechanism of effect of alpha-adrenergic stimulation with norepinephrine on renal water excretion. J Clin Invest, 1973, 52: 502-511.
[23] Schrier RW, Berl T, Anderson RJ. Osmotic and nonosmotic control of vasopressin release. Am J Physiol, 1979, 236: F321-332.
[24] Boersma E, Pieper KS, Steyerberg EW, et al. Predictors of outcome in patients with acute coronary syndromes without persistent ST-segment elevation. Results from an international trial of 9461 patients. The PURSUIT Investigators. Circulation, 2000, 101: 2557-2567.
[25] Lee WH, Packer M. Prognostic importance of serum sodium concentration and its modification by converting-enzyme inhibition in patients with severe chronic heart failure. Circulation, 1986, 73: 257-267.
[26] Kjekshus J. Heart rate reduction-a mechanism of benefit? Eur Heart J, 1987, 8 (Suppl )L: 115-122.
[27] Beta-Blocker Heart Attack Research Group. A randomized trial of propranolol in patients with acute myocardial infarction. I. Mortality results. JAMA, 1982, 247: 1707-1714.
The Early Prognostic Value of Serum Sodium Level in Patients With Acute ST-elevation Myocardial Infarction
ZHANG Tao, YANG Yan-min, ZHU Jun, LIU Li-sheng, LIANG Yan, TAN Hui-qiong, LI Jian-dong.
Department of Emergency, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
YANG Yan-min, Email: yymfuwai@163.com
Objective: To explore the relationship between serum sodium level and early prognosis in patients with acute ST-elevation myocardial infarction (STEMI).
Methods: A total of 7461 STEMI patients within 12h of onset who matched the diagnostic standard of European society of cardiology and American college of cardiology were retrospectively studied. According to serum sodium levels within 24h of admission, the patients were categorized into 3 groups: Serum sodium≥135 mmol/L group, Serum sodium 130-134 mmol/L group and Serum sodium<130 mmol/L group. The baseline condition, 30-day mortality with other adverse events and the effect of neuroendocriology inhibitor treatment were compared among 3 groups; their relationships to serum sodium level were analyzed.
Results: Serum sodium<130 mmol/L group had the higher 7-day and 30-day mortality than the other 2 groups, both P<0.001; compared with Serum sodium≥135 mmol/L group, Serum sodium<130 mmol/L group presented the higher occurrence rates of 30-day cardiac shock, heart failure (HF) and life-threatening arrhythmia, P<0.001. With adjusted affecting factors of age, diuretic and reperfusion treatments, serum sodium<130 mmol/L was still related to 7-day and 30-day mortality (OR=1.69 and OR=1.57). Both single and multivariable analysis indicated that serum sodium<130 mmol/L was related to cardiac shock (OR=1.75 and OR=1.64), HF (OR=1.42 and OR=1.30) and life-threatening arrhythmia (OR=1.53 andOR=1.34). In all 3 groups, the patients using ACE inhibitor, β-blocker or both medications had reduced 30-day mortality than those without such medication, all P<0.001; the reduction was more obvious in Serum sodium<130 mmol/L group than the other 2 groups, P<0.001.
Conclusion: Serum sodium level<130 mmol/L within 24h of admission was the risk factor for the early stage main adverse events as mortality, cardiac shock, HF and life-threatening arrhythmia in acute STEMI patients.
Myocardial Infarction; Hyponatremia; Prognosis
book=742,ebook=18
2016-11-04)
(编辑: 曹洪红)
100037 北京市,北京协和医学院 中国医学科学院 国家心血管病中心 阜外医院 急重症中心
张涛 主治医师 硕士研究生 主要从事心血管急重症研究 Email: Renascence2012@163.com 通讯作者:杨艳敏 Email: yymfuwai@163.com
R541
A
1000-3614(2017)08-0742-06
10.3969/j.issn.1000-3614.2017. 08.004

