尼可地尔对离体大鼠心肌缺血再灌注损伤的影响
张云盛,王清,滕天明,张文娟
尼可地尔对离体大鼠心肌缺血再灌注损伤的影响
张云盛,王清,滕天明,张文娟
目的:探讨钾通道开放剂尼可地尔对离体大鼠心肌缺血再灌注损伤(MIRI)的影响。
方法:建立Langendorff离体心脏灌流系统,44只大鼠随机分为4 组:正常组、缺血再灌注组(I-R 组)、腺苷(100 μmol/L)缺血再灌注组(A/I-R组)、尼可地尔(200μmol/L)缺血再灌注组(N/I-R组),每组11只。分别记录并分析各组左心室发展压(LVDP)、左心室内压力最大上升/下降速率(±dp/dtmax)、再灌注心律失常(RA)、心肌梗死面积以及左心室心肌组织的乙醛脱氢酶2(ALDH2)、抗凋亡基因B淋巴细胞瘤-2(Bcl-2)以及促凋亡基因B淋巴细胞瘤-2相关x蛋白(Bax)的表达水平。
结果:(1)N/I-R组再灌注30 min与再灌注45 min 的LVDP均高于I-R组与A/I-R组(P均<0.05)。(2)I-R组再灌注30 min及45 min 的±dp/dtmax均低于N/I-R组和A/I-R组(P均<0.05)。N/I-R组再灌注30 min及45 min的±dp/dtmax均高于A/I-R组(P均<0.05)。(3)与I-R 组比较,N/I-R组和A/I-R组的 RA 评分均降低(P均<0.01)。N/I-R组与A/I-R组差异无统计学意义(P=0.771)。(4)N/I-R组和A/I-R组心肌梗死面积均低于I-R组(P均<0.01),N/I-R组心肌梗死面积最小(P<0.05)。(5)与正常组比较, I-R组线粒体ALDH2表达明显减少,Bcl-2、Bax的表达增加;N/I-R组线粒体ALDH2表达增加,A/I-R组表达减少,N/I-R组和A/I-R组的Bcl-2、Bax的表达均增加。与I-R组比较,N/I-R组以及A/I-R组Bcl-2/Bax的比值均增大(P均<0.05);在抗凋亡方面N/I-R组与 A/I-R组差异无统计学意义(P>0.05)。
结论:尼可地尔可以减少MIRI,对心肌起到保护作用,其总体作用效果优于腺苷。尼可地尔可上调线粒体ALDH2、Bcl-2表达以及下调Bax的基因蛋白的表达。
心肌再灌注损伤;尼可地尔;线粒体,心脏
(Chinese Circulation Journal, 2017,32:797.)
尼可地尔是一种硝酸酯样作用的钾通道开放剂,既可以开放钾离子通道,也可以发挥类硝酸酯样扩张冠状动脉的作用,有可能通过线粒体的缺血预处理对心肌起到一定保护作用[1]。乙醛脱氢酶2(ALDH2)是一种位于12号染色体的编码基因,呈基因多态性的四联体线粒体蛋白。目前,尼可地尔是否通过调节线粒体ALDH2表达发挥心肌保护作用鲜少研究。本研究旨在探讨尼可地尔对离体大鼠缺血再灌注损伤(MIRI)的作用,为其在心肌MIRI线粒体机制方面提供新的思路。
1 材料与方法
实验动物:健康雄性Wistar大鼠44只,体重260~280 g,由中国医学科学院放射医学研究所实验动物中心提供。随机分为4 组:正常组、缺血再灌注组(I-R 组)、腺苷(100 μmol/L)[2]缺血再灌注组(A/I-R组)、尼可地尔(200 μmol/L)[3]缺血再灌注组(N/I-R组),每组11只。
仪器:Langendorff离体心脏灌流实验系统(上海奥尔科特生物科技有限公司);BL-420S生物机能实验系统(成都泰盟生物技术有限公司)。试剂:1%伊文氏蓝(Evans-blue,北京Solarbio公司);1% 2,3,5-三苯基氯化四氮唑(TTC,北京Solarbio公司);Krebs-Henseleit( K-H )液(国产分析纯试剂配制);尼可地尔(上海梯希爱公司);腺苷(美国Sigma公司)。ALDH2多克隆抗体(美国ImmunoWay公司);GAPDH、Bcl-2、Bax抗体(万类生物公司);BCA蛋白定量试剂盒(美国Thermo scientific公司);Opti-Protein Marker(加拿大abm技术公司);TRIzol RNA提取试剂盒 (100 ml/瓶,美国Thermo scientific 公司);逆转录cDNA合成试剂盒(美国Thermo scientific 公司);SG Excel Fast SYBR Mixture(Plus)(上海生工生物工程股份有限公司);引物均由北京奥科鼎盛生物技术有限公司合成(表1)。

表1 目的基因引物序列
模型复制:全部大鼠均给予肝素5000 U/kg、水合氯醛40 mg/kg腹腔注射,麻醉完全后开胸迅速取出心脏置于4℃ K-H液中,快速挤出心腔内残留血液,然后将其迅速套扎于Langendorff离体心脏灌流系统,保持灌注压力为90 cmH2O(1 cmH2O=0.098 kPa),37℃ K-H液持续灌流。连接BL-420S系统,待心脏稳定片刻后将压力球囊从左心耳插入左心室内,向球囊内注入80~100 μl水调节压力前负荷为5~10 mmHg(1 mmHg=0.133 kPa)。记录心电图、左心室压力各项参数等指标。正常组穿线但不进行结扎,其他3组结扎前降支。正常组持续灌流 K-H液150 min;I-R组K-H液稳定灌流30 min后,结扎前降支30 min,继以K-H液再灌注90 min;N/I-R组与A/I-R组分别给予尼可地尔(200 μmol/L)与腺苷(100 μmol/L)再灌注15 min,继以K-H液再灌流75 min。待灌流结束后,部分心脏行1% Evans-blue和1% TTC双染色,进行心肌梗死面积测定。
血流动力学参数:根据左心室压力曲线,分析记录稳定灌流 30 min 时(结扎前基础状态值)、缺血15 min、缺血30 min以及再灌注后 30 min、45 min左心室发展压(LVDP)、左心室内压上升/下降最大速率(±dp/dtmax)。LVDP=左心室压力曲线最高值-左心室压力曲线最低值。取十个连续心动周期的平均值为基准。
再灌注心律失常:观察各组离体大鼠心脏再灌注期间室性心律失常(VA)出现的时间和持续时间,统计室性早搏的个数,室性心动过速(VT)、心室颤动(VF)发生率和时程。以在VT或VF后出现 3个及以上的正常窦性心律作为VT或VF终止的指标。心律失常的评分(RA评分)依据 CURTIS 评分方案[4]:0分:<50个室性早搏;1分:50~499个室性早搏;2分:>499个室性早搏或1阵可恢复性VT或VF;3分:大于1阵可自行恢复性VT和(或)VF,两者时间相加小于60 s;4分:可自行恢复性VT和(或)VF,两者时间相加 60~119 s;5分:可自行恢复性VT和(或)VF,两者时间相加大于119 s;6分:不可自行恢复性VF。
心肌1% Evans-blue和1%TTC双染色:灌流结束后进行再灌注组大鼠的前降支重新结扎,1% Evans -blue、1%TTC分别进行染色,区分正常区(深蓝色)、缺血未梗死区(红色)及梗死区域(灰白色)。用高清数码相机抓取图像后利用 Image Pro plus 7.0图像分析软件计算心肌梗死区及缺血区域,以心肌梗死区/缺血区域(%)表示心肌梗死百分比。
实时荧光定量逆转录-聚合酶链反应(qRTPCR)方法检测线粒体ALDH2 、抗凋亡基因Bcl-2以及促凋亡基因Bax 信使核糖核酸(mRNA)的表达:液氮中取出标本,每100 mg心肌组织加入1 ml Trizol试剂,在冰浴上充分匀浆。高速离心10 min后取上清液,每1 ml Trizol加入200 μl氯仿,剧烈震荡15~20 s后高速离心15 min,取无色水相每1 ml Trizol加入0.5 ml异丙醇,颠倒混匀后室温静置20~30 min。高速离心后用乙醇冲洗烘干后溶解沉淀,浓度测定后进行反转录。应用SYBR GreenⅠ法,qRT-PCR扩增程序设置为95℃ 30 min, 95℃ 30 s,退火温度为62℃,72℃ 15 s,72℃ 2 min。读取扩增曲线上各组的CT值(每个反应管内的荧光信号到达设定的域值时所经历的循环数)。最终结果采用2-△CT表示相对表达量,以甘油醛-3-磷酸脱氢酶(GAPDH)内参基因进行标准对照。
蛋白免疫印迹(Western blot)检测线粒体ALDH2蛋白、抗凋亡Bcl-2以及促凋亡Bax蛋白的表达:-80℃冰箱中取出标本,每100 mg心肌组织加入1 ml RIPA高效裂解液以及蛋白酶抑制剂,在冰浴上充分匀浆,提取并测定蛋白浓度,在垂直电泳仪中进行电泳分离蛋白。电泳结束后取出凝胶,转膜、封闭及孵育一抗4℃脱色摇床过夜。一抗孵育结束后常温下孵育二抗2 h,最后加入Chemilum -inescent 辣根过氧化物酶底物(1:1混匀)在化学发光成像系统中进行曝光与摄像。
统计学分析:应用 SPSS 22.0统计软件对数据进行统计学分析。数据分析绘图采用GraphPad Prism 5.0与Image J。正态分布计量资料以均数±标准差(±s)表示,LVDP、±dp/dtmax采用重复测量方差分析,其余组间比较采用单因素方差分析 LSD法检验。非正态分布计量资料用中位数和四分位数间距表示,组间比较采用Kruskal-Wallis-H秩和检验两两比较,不校正α水准[5]。计数资料比较采用卡方检验或者Fisher确切概率法。P<0.05 表示差异有统计学意义。
2 结果
2.1 各组大鼠心肌再灌注后LVDP及±dp/dtmax的比较(表2)
对LVDP的影响:随着时间的推移,正常组的LVDP呈逐步下降趋势(P=0.000)。其余各组缺血及再灌注后LVDP,均低于同时间段正常组压力(P均<0.05)。N/I-R组再灌注30 min与再灌注45 min的LVDP均高于同时间段I-R组与A/I-R组(P均<0.05)。对±dp/dtmax的影响:I-R组再灌注30 min及45 min 的±dp/dtmax均低于A/I-R组和N/I-R组(P均<0.05)。N/I-R组再灌注30 min及45 min的±dp/dtmax均高于A/I-R组,差异均有统计学意义(P 均<0.05)。
2.2 各组大鼠再灌注室性心律失常发生率、时程及再灌注RA评分的比较(表3)
正常组仅有室性早搏,无VT、VF发生,N/I-R组和A/I-R组出现室性早搏个数较正常组均增加(P均=0.000),但均少于I-R组(P=0.03,P=0.02)。N/I-R组和A/I-R组与I-R组相比VT、VF 发生率降低(VT:P=0.013, P=0.005;VF:P=0.009,P=0.034)、时程缩短(VT:P=0.000,P=0.000;VF:P=0.011,P=0.005)。与 I-R 组比较,N/I-R组和A/I-R组的 RA 评分降低(P=0.000,P=0.000)。N/I-R组与A/I-R组差异无统计学意义(P=0.771)。
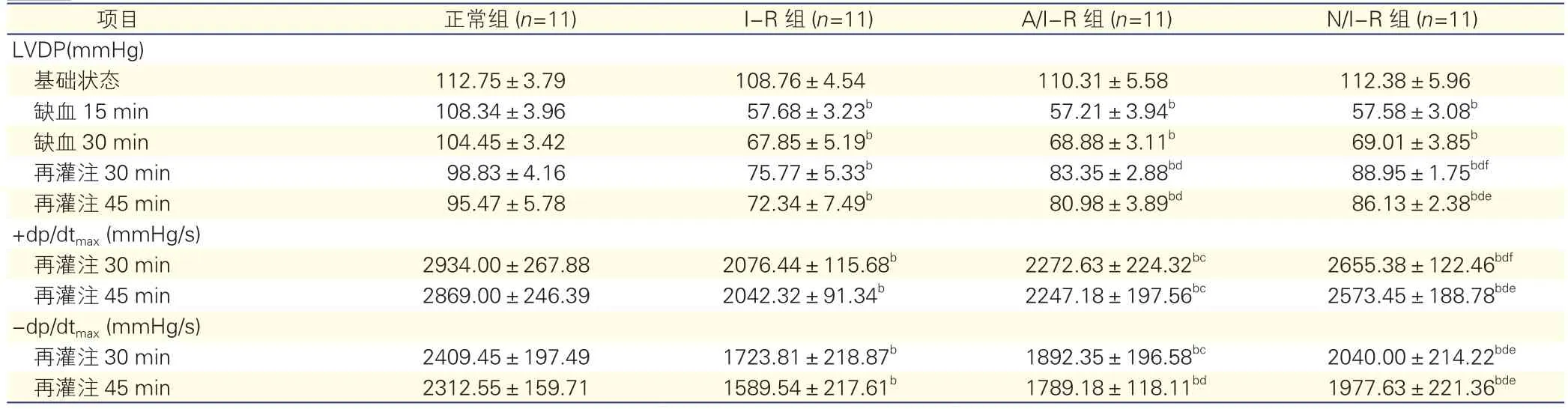
表2 各组大鼠心肌再灌注后LVDP及±dp/dtmax的比较(±s)
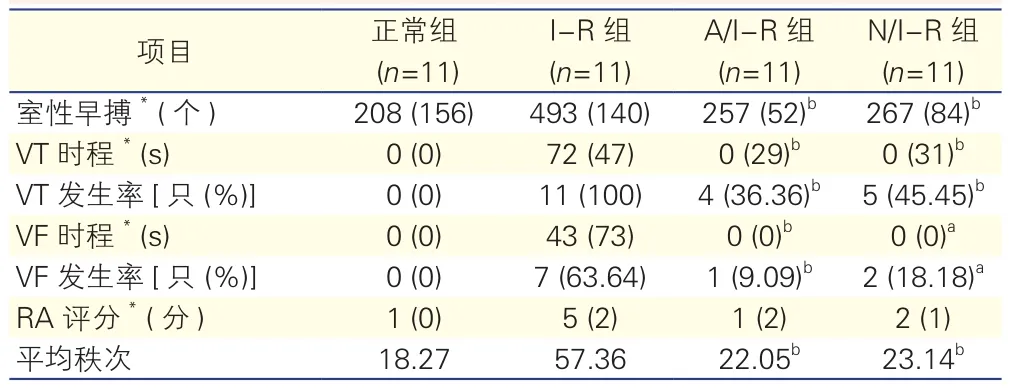
表3 各组大鼠再灌注室性心律失常发生率、时程及再灌注RA评分的比较
2.3 各组大鼠心肌梗死面积比较(图1)
N/I-R组梗死面积(34.95±1.25)%、A/I-R组梗死面积(47.97±1.22)%,均低于I-R组(55.51±1.43)%,差异有统计学意义(P均<0.01),N/I-R组梗死面积最小(P<0.05)。
2.4 各组心肌组织线粒体ALDH2以及Bcl-2、Bax表达结果(表4、图2)
与正常组比较, I-R组线粒体ALDH2表达明显减少,Bcl-2、Bax的表达增加; N/I-R组线粒体ALDH2表达增加,A/I-R组表达减少,N/I-R组和A/I-R组的Bcl-2、Bax的表达均增加。与I-R组比较,N/I-R组以及 A/I-R组Bcl-2/Bax的比值均增大(P均<0.05)。在抗凋亡方面N/I-R组与 A/I-R组差异无统计学意义(P>0.05)。
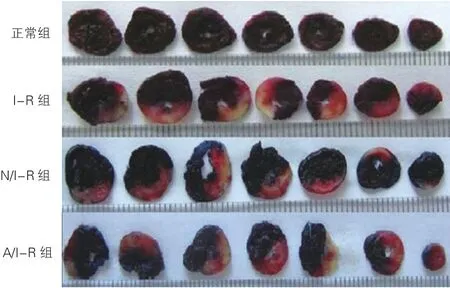
图1 各组大鼠心肌1%伊文氏蓝和1%三苯基氯化四氮唑双染色切片
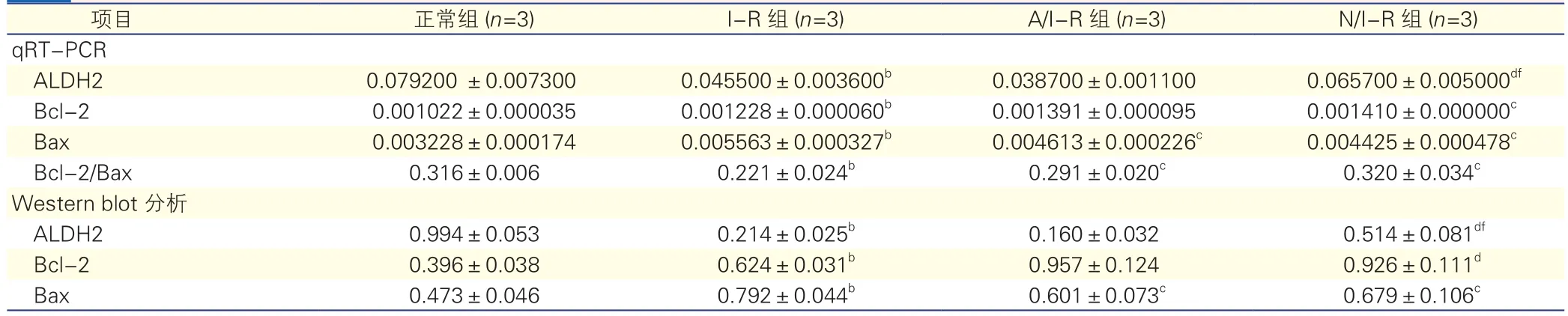
表4 各组大鼠心肌组织线粒体ALDH2以及Bcl-2、Bax表达结果(±s)
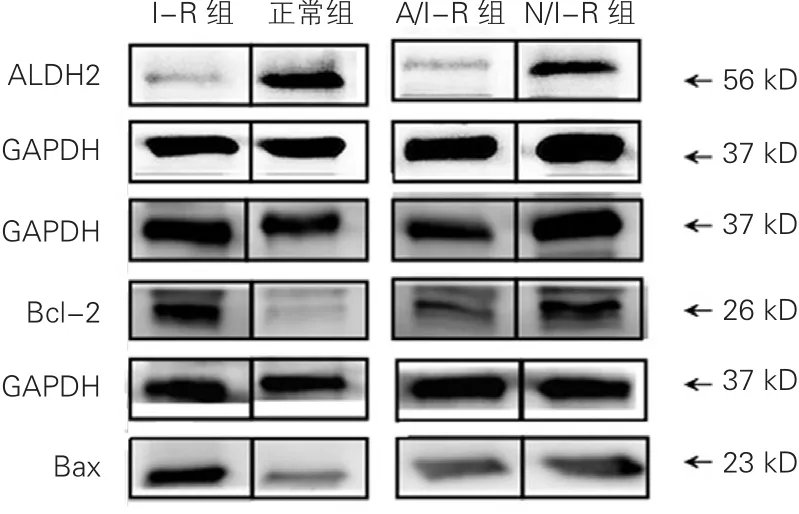
图2 各组大鼠心肌蛋白免疫印迹图
3 讨论
心血管疾病是全球首要致死原因,而急性心肌梗死又是冠心病死亡的重要原因[6,7],及时的介入手术或溶栓治疗能够挽救部分急性心肌梗死时的缺血心肌,降低心功能损伤程度。但在血运重建血流恢复的同时,伴随着MIRI的发生。尼可地尔的代谢产物可以生成一氧化氮(NO),活化鸟苷酸环化酶,使心肌细胞内第二信使环磷酸鸟苷(cGMP)生成增加[8],从而使血管舒张,降低心脏前负荷,降低心肌耗氧量。尼可地尔(200 μmo/L)[2]是细胞膜以及线粒体三磷酸腺苷(ATP)敏感性钾通道(KATP)开放剂,细胞膜KATP通道开放引起K+外流、加速复极,使动作电位时程(APD)缩短, Ca2+内流减少,从而减少细胞内钙超载[9],清除过多的氧自由基,扩张末梢血管降低后负荷,增加微循环冠状动脉的灌注从而产生心脏保护作用。线粒体KATP通道开放参与了缺血预适应以及抗心肌细胞凋亡的作用,Sato等[10]发现低浓度(100 μmo/L)尼可地尔仅能开放线粒体KATP通道的情况下能够明显降低心肌细胞的死亡率,减少心肌细胞的凋亡。研究表明[11],线粒体KATP通道开放剂对缺血再灌注损伤的心肌具有保护作用。另有研究也证实[12],线粒体KATP通道的开放参与了缺血再灌注损伤即刻以及早期缺血后处理的心肌保护机制,而晚期缺血后处理依赖不同的机制。
ALDH2在心肌细胞线粒体中活性高于其他类型醛脱氢酶,其主要机制是通过抑制4-羟壬烯(4-HNE)以及活性氧自由基系统减少心肌细胞的损伤[13]。2002年,Chen等[14]首次全面阐述了ALDH2在机体内硝酸甘油生物转化过程中起着重要的作用。线粒体ALDH2表达的减少也是目前发现硝酸脂类耐药的重要原因之一[15]。激活线粒体ALDH2在MIRI方面起到了保护作用,ALDH2的表达增加,心肌再灌注损伤会减少。同时,ALDH2在抗凋亡以及抗炎症反应方面也具有重要的作用[16]。
本实验采用后处理的方式,同时与细胞膜KATP通道开放剂腺苷(100 μmo/L)在同一实验条件下进行比较。N/I-R组再灌注时与I-R组相比LVDP、±dp/dtmax明显升高(P均<0.05),心肌梗死面积减少(P均<0.05),RA评分降低(P均<0.05),N/I-R组其总体作用效果优于A/I-R组。研究表明,尼可地尔不仅是NO供体和KATP通道开放剂[17],还是很好的抗氧化剂,它通过增加超氧化物歧化酶2的活性和减少黄嘌呤氧化酶活性参与体内抗氧化过程[18,19]。通过这些多种途径与机制,激活NO-cGMP途径,降低氧化应激,保持线粒体功能,减少心肌缺血再灌注的损伤的作用。
在正常心肌与血管内皮组织中,线粒体ALDH2处于高表达状态[20,21],Bcl-2不表达或低表达[22]。在心肌细胞受到缺血再灌注损伤时,Bcl-2表达上调,其基因产物的表达可抑制或逆转细胞凋亡的发生。Bax是Bcl-2 的同源基因蛋白,可通过与 Bcl-2 形成异源二聚体,从而抑制 Bcl-2 的作用,促进凋亡。因此,BCL-2 / Bax的表达比值决定细胞的生存与凋亡[23,24]。本实验结果显示,N/I-R组线粒体ALDH2表达增加,初步探讨了尼可地尔可能通过调节线粒体ALDH2的表达起到对MIRI的保护作用相关联。有关机制有待于进一步验证,线粒体ALDH2有望成为心脏保护新的治疗靶点[25]。本实验室将通过相关抑制剂与激活剂以及KATP通道特异性抑制剂对尼可地尔以及线粒体ALDH2进一步研究与探讨。另外,在心肌抗凋亡方面,尼可地尔与腺苷一样,药物后处理均可以明显减少心肌细胞的凋亡,说明尼可地尔可能通过抑制细胞凋亡对缺血再灌注的心肌起到保护作用。有研究表明,线粒体ALDH2可能通过下调腺苷酸活化蛋白激酶增加FOXO3a转录因子的磷酸化,减少高糖诱导的心肌细胞的凋亡[26]。另外,线粒体ALDH2可以减轻乙醛的衍生物4-HNE以及丙二醛毒性从而到抗心肌细胞凋亡的作用[27]。
关于尼可地尔抗凋亡我们认为有以下两种可能机制:(1)尼可地尔可能通过激活NO-cGMP途径、激活KATP通道等途径减少心肌细胞的凋亡。(2)尼可地尔可能通过上调线粒体ALDH2共同参与抑制心肌细胞抗凋亡途径,其相互之间联系密切。
总之,尼可地尔可减少缺血再灌注时心律失常的发生、改善心脏泵功能、减少心肌梗死的面积,最终有效减少MIRI。而关于尼可地尔发挥再灌注保护作用的信号通路、调节机制等一系列问题有待进一步研究。
[1] Tarkin JM, Kaski JC. Vasodilator Therapy: Nitrates and Nicorandil. Cardiovasc Drugs Ther, 2016, 30: 367-378.
[2] Sun L, Li DL, Zhao M, et al. The role of muscarinic receptors in the beneficial effects of adenosine against myocardial reperfusion injury in rats. PLoS One, 2011, 6: e25618.
[3] Mitani A, Kinoshita K, Fukamachi K, et al. Effects of glibenclamide and nicorandil on cardiac function during ischemia and reperfusion in isolated perfused rat hearts. Am J Physiol, 1991, 261: H1864-H1871.
[4] Curtis MJ, Walker MJ. Quantification of arrhythmias using scoring systems: an examination of seven scores in an in vivo model of regional myocardial ischaemia. Cardiovasc Res, 1988, 22: 656-665.
[5] 张文彤, 闫洁, 邝春伟, 等. SPSS统计分析基础教程. 北京: 高等教育出版社, 2004: 289-292.
[6] 高润霖. 冠心病疾病负担——中国出路. 中国循环杂志, 2017, 32: 1-4.
[7] 陈伟伟, 高润霖, 胡盛寿, 等. 《中国心血管病报告2015》概要. 中国循环杂志, 2016, 31: 521-528.
[8] IONA Study Group. Effect of nicorandil on coronary events in patients with stable angina: the Impact Of Nicorandil in Angina (IONA) randomised trial. Lancet, 2002, 359: 1269-1275.
[9] Zhao F, Chaugai S, Chen P, et al. Effect of nicorandil in patients with heart failure: a systematic review and meta-analysis. Cardiovasc Ther, 2014, 32: 283-296.
[10] Sato T, Sasaki N, O'Rourke B, et al. Nicorandil, a potent cardioprotective agent, acts by opening mitochondrial ATP-dependent potassium channels. J Am Coll Cardiol, 2000, 35: 514-518.
[11] Rajesh KG, Sasaguri S, Suzuki R, et al. Ischemic preconditioning prevents reperfusion heart injury in cardiac hypertrophy by activation of mitochondrial KATPchannels. Int J Cardiol, 2004, 96: 41-49.
[12] Barsukevich V, Basalay M, Sanchez J, et al. Distinct cardioprotective mechanisms of immediate, early and delayed ischaemic postconditioning. Basic Res Cardiol, 2015, 110: 452.
[13] Sun A, Cheng Y, Zhang Y, et al. Aldehyde dehydrogenase 2 ameliorates doxorubicin-induced myocardial dysfunction through detoxification of 4-HNE and suppression of autophagy. J Mol Cell Cardiol, 2014, 71: 92-104.
[14] Chen Z, Stamler JS. Bioactivation of nitroglycerin by the mitochondrial aldehyde dehydrogenase. Trends Cardiovasc Med, 2006, 16: 259-265.
[15] Mackenzie IS, Maki-Petaja KM, Mceniery CM, et al. Aldehyde dehydrogenase 2 plays a role in the bioactivation of nitroglycerin in humans. Arterioscler Thromb Vasc Biol, 2005, 25: 1891-1895.
[16] Chen CH, Budas GR, Churchill EN, et al. Activation of aldehyde dehydrogenase-2 reduces ischemic damage to the heart. Science, 2008, 321: 1493-1495.
[17] Serizawa K, Yogo K, Aizawa K, et al. Nicorandil prevents endothelial dysfunction due to antioxidative effects via normalisation of NADPH oxidase and nitric oxide synthase in streptozotocin diabetic rats. Cardiovasc Diabetol, 2011, 10: 105.
[18] Tamura Y, Tanabe K, Kitagawa W, et al. Nicorandil, a K(ATP) channel opener, alleviates chronic renal injury by targeting podocytes and macrophages. Am J Physiol Renal Physiol, 2012, 303: F339-F349.
[19] 裴玮娜, 谢瑞芹, 崔炜, 等. 曲美他嗪与尼可地尔对经皮冠状动脉介入治疗相关心肌损伤干预作用的比较. 中国循环杂志, 2014, 29: 256-260.
[20] Kato N, Takeuchi F, Tabara Y, et al. Meta-analysis of genome-wide association studies identifies common variants associated with blood pressure variation in east Asians. Nat Genet, 2011, 43: 531-538.
[21] Xia G, Fan F, Liu M, et al. Aldehyde dehydrogenase 2 deficiency blunts compensatory cardiac hypertrophy through modulating Akt phosphorylation early after transverse aorta constriction in mice. Biochim Biophys Acta, 2016, 1862: 1587-1593.
[22] Habibi P, Alihemmati A, Nourazar A, et al. Expression of the Mir-133 and Bcl-2 could be affected by swimming training in the heart of ovariectomized rats. Iran J Basic Med Sci, 2016, 19: 381-387.
[23] Ma LN, Li LD, Li SC, et al. Allicin improves the cardiac function by protecting against apoptosis in rat model of myocardial infarction. Chin J Integr Med, 2016, [Epub ahead of print].
[24] Verma YK, Raghav PK, Raj HG, et al. Enhanced heterodimerization of Bax by Bcl-2 mutants improves irradiated cell survival. Apoptosis, 2013, 18: 212-225.
[25] Budas GR, Disatnik MH, Mochly-Rosen D. Aldehyde dehydrogenase 2 in cardiac protection: a new therapeutic target?. Trends Cardiovasc Med, 2009, 19: 158-164.
[26] 郭钰丽, 闫浩, 张荣庆, 等. 线粒体乙醛脱氢酶2(ALDH2)通过AMPK/FOXO3a通路改善高糖导致的心肌细胞凋亡. 现代生物医学进展, 2014, 11: 2024-2028.
[27] Guo JM, Liu AJ, Zang P, et al. ALDH2 protects against stroke by clearing 4-HNE. Cell Res, 2013, 23: 915-930.
Effect of Nicorandil on Myocardial Ischemia-reperfusion Injury in Isolated Rat’s Heart
ZHANG Yun-sheng, WANG Qing, TENG Tian-ming, ZHANG Wen-juan.
Department of Cardiology, Tianjin Medical University General Hospital, Tianjin (300052), China
ZHANG Wen-juan, Email:zwjzyy2013@163.com
Objective: To investigate the effect of potassium channel opener nicorandil on myocardial ischemia-reperfusion injury (MIRI) in isolated rat’s heart.
Methods: Langendorff system was established for isolated heart reperfusion. A total of 44 rats were randomly divided into 4 groups: Normal control group, Ischemia-reperfusion (I-R) group, Adenosine/I-R (A/I-R) group, the I-R heart was treated by adenosine 100 μmo/L and Nicorandil/I-R (N/I-R) group, the I-R heart was treated by nicorandil 200 μmo/L. n=11 in each group. Left ventricular developed pressure (LVDP), the maximal rise/fall rate of left ventricular pressure (±dp/dtmax), reperfusion arrhythmia (RA) and myocardial infarction (MI) size were recorded; the expressions of left ventricular tissue acetaldehyde dehydrogenase 2 (ALDH2), Bcl-2 and Bax were examined and compared among different groups.
Results:①Compared with I-R and A/I-R groups, N/I-R group had increased LVDP at 30 min and 45 min reperfusion, all P<0.05.②Compared with N/I-R and A/I-R groups, I-R group showed reduced ±dp/dtmax at 30 min and 45 min reperfusion, all P<0.05; while ±dp/dtmax in N/I-R group was higher than A/I-R group at 30 min and 45 min reperfusion, all P<0.05.③Compared with I-R group, both N/I-R and A/I-R groups presented reduced RA score, all P<0.01, RA score wassimilar between N/I-R group and A/I-R group, P=0.771. ④compared with I-R group, both N/I-R and A/I-R groups had the smaller MI size, P<0.01 and N/I-R group showed the smaller MI size, P<0.05. ⑤Compared with Normal control group, I-R group had decreased mitochondrial ALDH2 expression and increased Bcl-2, Bax expression; ALDH2 level was elevated in N/ I-R group had reduced in A/I-R group; Bcl-2 and Bax levels were increased in both N/I-R and A/I-R groups. Compared with I-R group, both N/I-R and A/I-R groups had increased ratio of Bcl-2/Bax, P<0.05; the anti-apoptosis effect was similar between N/I-R group and A/I-R group, P>0.05.
Conclusion: Nicorandil may reduce MIRI and protect myocardium in isolated rat’s heart, the overall effect is better than adenosine. Nicorandil can up-regulate the expressions of mitochondrial ALDH2, Bcl-2 and down-regulate the expression of Bax.
Myocardial Reperfusion Injury; Nicorandil; Mitochondria, Heart
book=797,ebook=73
2016-11-25)
(编辑: 王宝茹)
天津市高等科技发展基金计划项目(20110151);天津市科技计划项目(15YFYZSY00020)
300052 天津市,天津医科大学总医院 心血管内科
张云盛 硕士研究生 主要从事心血管疾病临床和科研工作 Email: zys3722976@163.com 通讯作者:张文娟 Email:zwjzyy2013@163.com
R54
A
1000-3614(2017)08-0797-06
10.3969/j.issn.1000-3614.2017.08.016

