猪繁殖与呼吸综合征LAMP检测方法建立
赵相鹏汪琳*尹羿蒲静任彤高志强张伟刘凤华史雅然
(1.北京出入境检验检疫局 北京 100026;2.北京农学院)
猪繁殖与呼吸综合征LAMP检测方法建立
赵相鹏1汪琳1*尹羿1蒲静1任彤1高志强1张伟1刘凤华2史雅然2
(1.北京出入境检验检疫局 北京 100026;2.北京农学院)
以猪繁殖与呼吸综合征病毒(PRRSV)ORF6基因为靶基因,设计2对引物,建立PRRSV RT-LAMP检测方法。该检测方法的灵敏度与荧光RT-PCR检测方法相近,高于普通RT-PCR检测方法,约2 h即可得出结果,不需要昂贵的仪器设备,适于猪场PRRSV的监测。
猪繁殖与呼吸综合征病毒;RT-LAMP
1 前言
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS),曾称“猪蓝耳病”“猪瘟疫”“猪流行性流产和呼吸综合征”等,由猪繁殖和呼吸综合征病毒(PRRSV)引起,其以妊娠母猪流产、早产、产死胎、弱胎、木乃伊胎以及仔猪和肥育猪的呼吸道症状为特征[1,2],我国将其列为二类传染病。PRRS病毒(PRRSV)是一种单股正链的RNA病毒,基因组长约15 kb,具有9个开放阅读框架(ORFs)。常用的分子生物学检测方法为普通RTPCR和荧光RT-PCR,其中荧光RT-PCR是国际上公认的快速准确技术之一,但设备昂贵[3-7],很多基层养猪场无法购买。环介导等温扩增技术(LAMP)不需要模板热变性[8,9],仅需普通水浴锅就能完成[10]。本项目针对美洲型PRRSV建立了RT-LAMP检测技术,通过特异性、灵敏度实验和临床样本检测,表明RT-LAMP检测方法的灵敏度与荧光RT-PCR方法相当,扩增效率高,特异性强,结果判定简单,适合基层现场快速检测。
2 材料与方法
2.1 材料
2.1.1 试剂
TRIZOL:购自Invitrogen公司;AMV反转录酶、dNTP:购自Promega公司;Bst DNA 聚合酶:购自NEB公司;Betaine:购自Sigma公司;SYBR Green I: 购自 Invitrogen 公司;HNB(Hydroxynaphthol blue):分子式 C20H11N2Na3O11S3,M=620.47 g/Mol,购自Fluka公司;Taq DNA聚合酶和PCR相关试剂:购自Promega公司;PRRS病毒美洲型荧光RT-PCR检测试剂盒:实验室研制;RNA酶抑制剂:购自Promega公司;Trizol裂解液:购自Ambion公司;氯仿、无水乙醇:均为分析纯,购自国药集团;75%乙醇,用新开启的分析纯无水乙醇和DEPC水(符合GB 6682-92要求)配制,-20℃预冷。
2.1.2 主要仪器
台式冷冻高速离心机:Eppendorf 5417R,离心速度可达12 000 r/min;台式电子天平:IKA RCT basic;常规PCR仪:ABI 9700;荧光PCR检测仪:ABI 7900HT,Roche 1.1。
2.1.3 灭活病毒及核酸
研究过程中应用到的病毒株有灭活的美洲型PRRSV VR2332、灭活美洲型PRRSV 07-45株、灭活高致病性PRRSV 07-14株、灭活高致病性PRRSV 07-14株、灭活欧洲型PRRSV LV、猪伪狂犬病病毒、猪瘟病毒C株核酸和猪链球菌2型ZY株核酸:均由本实验室保存。
2.2 方法
2.2.1 病毒RNA的提取
向加有600 μL裂解液的灭菌离心管中加入待测样本200μL,用吸头反复吸打混匀;再加入200 μL氯仿,混匀器上振荡混匀5 s(不宜过于强烈,以免产生乳化层),离心(12 000 g,15 min);另取灭菌离心管,加入 600 μL 异丙醇(-20℃预冷),并加入上述离心后的上层液相(注意不要吸出中间层,该层富含DNA和蛋白质),颠倒混匀,离心(12 000 g,15 min);轻轻倒去上清液,倒置于吸水纸上,吸干液体;加入600 μL 75%乙醇(-20℃预冷),颠倒洗涤,离心(12 000 g,10 min);轻轻倒去上清液,倒置于吸水纸上,尽量吸干液体;10 000 g离心5 s,将管底部少量液体用微量加样器吸干,室温干燥5 min;于干燥后的沉淀中加入11 μL DEPC水,轻轻混匀,溶解管壁上的RNA(即为所需 RNA)。
2.2.2 引物的设计
为确保探针的保守性和特异性,针对目前已知的3个不同亚群的PRRSV核酸[11],选取ORF6基因编码区特定序列作为靶区域,应用DNA MAN在多重序列比对的基础上,进行引物设计(见图1)。引物FIP和BIP针对的2个扩增区域之间用TTTT进行连接,以便于扩增时成环。

图1 PRRSV美洲型3个不同亚群的的序列比对和引物设计
2.2.3 引物的筛选
对引物进行筛选试验。RT-PCR引物为P1和P2,扩增片段为236 bp;LAMP引物为:PRRS1-F3、PRRS1-B3、PRRS1-FIP、PRRS1-BIP、PRRS2-F3、PRRS2-B3、PRRS2-FIP、PRRS2-BIP。
2.2.4 RT-LAMP反应体系的建立与优化
MgSO4、betaine、dNTP 的浓度以及反应时间和温度对LAMP反应效率有一定影响,通过逐一优化,确定反应体系和条件(表1),以期达到最佳扩增效率。
PRRSV美洲型07-14提取RNA后,将RNA 1∶104稀释后,进行RT-LAMP检测,反应参数为60℃/60 min,80℃/15 min。
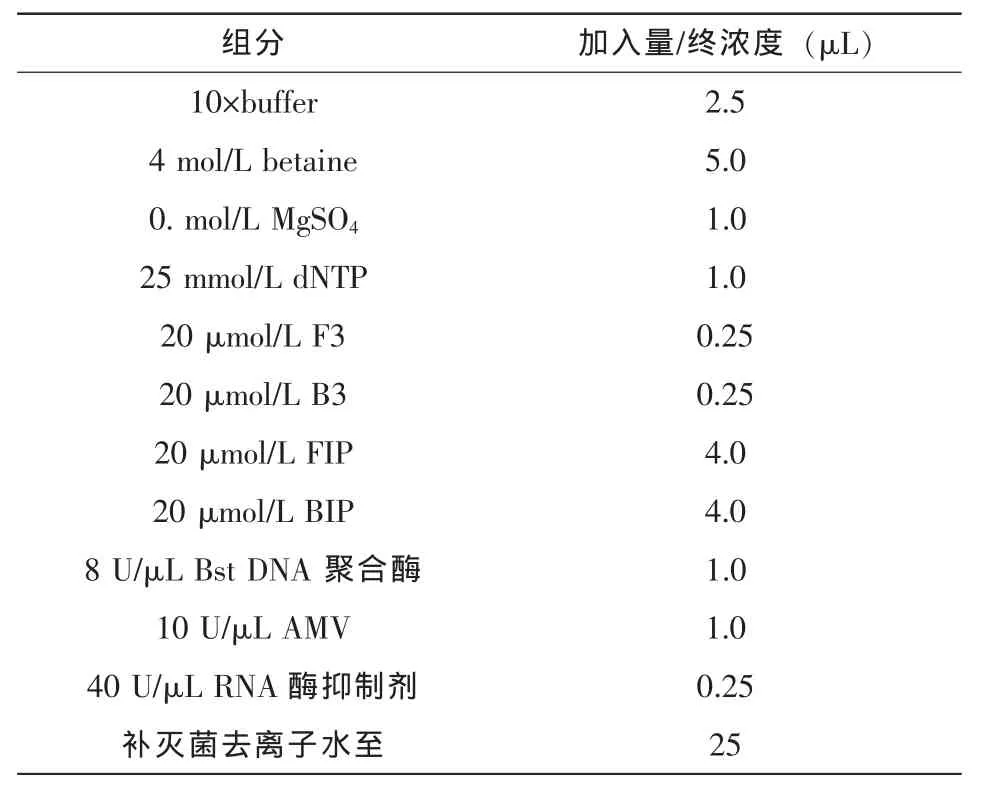
表1 RT-LAMP反应体系
2.2.5 灵敏度试验
将PRRSV 07-14核酸作10-1-10-8倍稀释,分别用RT-LAMP、普通RT-PCR和荧光RT-PCR检测,比较方法的灵敏度。
2.2.6 特异性试验
用所建立的RT-LAMP方法对欧洲型PRRSV LV核酸、猪伪狂犬病病毒核酸、猪瘟病毒C株核酸、猪链球菌2型ZY株核酸分别进行检测,以验证方法的特异性。
2.2.7 重复性试验
连续3次分别用建立的RT-LAMP方法对病毒07-14核酸的 10-5、10-6、10-7稀释液进行重复性试验,以验证方法的可重复性和稳定性。
2.2.8 快速显色研究
在建立RT-LAMP检测方法的基础上,分别将SYBR Green I和HNB两种染色液加入反应体系,比较显色情况。SYBR Green I购买后直接使用;HNB为粉末,称量0.946 g,用DEPC水定容于50 mL离心管中。取6支1.5 mL离心管,每管加入900 μL DEPC水,再分别加入100 μL 30 mmol/L HNB,配成3 mmol/L HNB溶液。
2.2.9 对临床样品的检测
某地区数个规模化猪场采集的病料 (各种内脏和肌肉组织)49份,用建立的RT-LAMP方法进行检测,并与荧光RT-PCR和常规RT-PCR检测方法进行比较。
3 结果
3.1 引物筛选结果
采用上述条件,筛选出能检出所用3株美洲型病毒核酸,且扩增稳定的引物对,即PRRS2-F3、PRRS2-B3、PRRS2-FIP、PRRS2-BIP(图 2)。
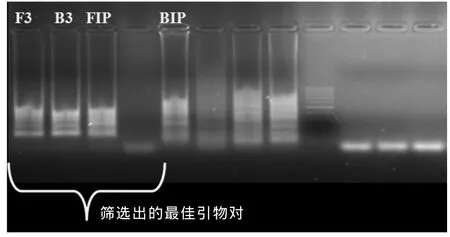
图2 引物筛选试验结果
3.2 灵敏度试验结果
用建立的RT-LAMP检测PRRSV 07-14核酸10-1-10-8稀释液,结果显示该方法的灵敏度达到10-8(图3-图4)。用建立的方法与荧光定量RT-PCR方法和常规RT-PCR方法进行比较,结果见图5。

图3RT-LAMP对PRRSV 07-14核酸检测灵敏度

图4 加入SYBR Green I进行染色的结果

图5 RT-LAMP与荧光定量RT-PCR和常规RT-PCR的比较
图5显示,建立的方法灵敏度与荧光定量RTPCR方法相近,但明显高于常规RT-PCR检测方法。
3.3 特异性试验结果
试验结果显示特异性良好,无交叉反应(图6)。
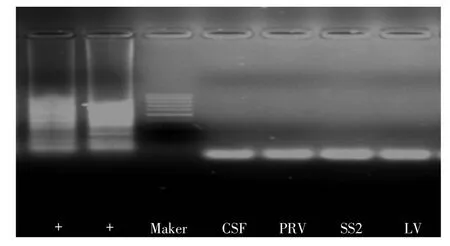
图6 RT-LAMP的特异性试验结果
3.4 重复性试验结果
试验结果显示,3个稀释度的病毒核酸均为阳性,重复性好。
3.5 快速显色研究
结果显示,SYBR Green I在反应前加入反应体系会影响扩增结果,且显色明显程度不如HNB;而HNB在反应前加入反应体系不影响扩增效果(图7)。

图7 HNB染色结果
3.6 临床样品检测结果
49份病料用建立的RT-LAMP方法进行检测,并与荧光RT-PCR和常规RT-PCR检测方法进行比较,结果见表2。结果显示RT-LAMP与荧光RTPCR结果完全一致,符合率100%,阳性检出率高于普通RT-PCR。
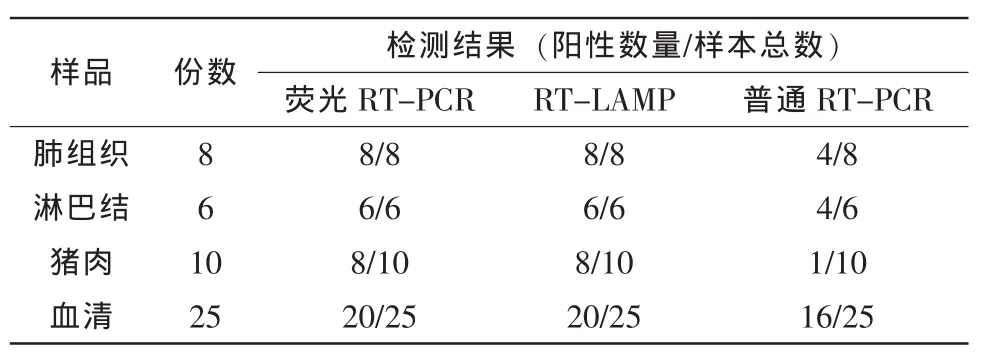
表2 49份临床样品的检测结果
4 结论
本项目建立的LAMP检测方法特异性良好,与猪瘟病毒核酸、猪伪狂犬病毒核酸以及猪链球菌2型核酸无交叉反应。临床样本检测显示RT-LAMP检测方法的灵敏度与荧光RT-PCR一致,完全可用于养殖场现场快速检测、诊断PRRSV。实验中还发现LAMP由于产物量大,开盖检测很容易发生气溶胶污染,因此在反应前加入显色剂,反应结束后不开盖就能判读结果,有利于检测质量控制。
[1]Albina E.Epidemiology of porcine reproductive and respiratory syndrome (PRRS):an overview[J].Vet Microbiol,1997,55(1-4):309-16.
[2]Allende R,Kutish G F,Laegreid W,et al.Mutations in the genome of porcine reproductive and respiratory syndrome virus responsible for the attenuation phenotype[J].Arch Virol,2000,145(6):1149-61.
[3]Allende R,Lewis T L,Lu Z,et al.North American and European porcine reproductive and respiratory syndrome viruses differ in non-structural protein coding regions[J].J Gen Virol,1999,80:307-15.
[4]Andreyev V G,Wesley R D,Mengeling W L,et al.Genetic variation and phylogenetic relationships of 22 porcine reproductive and respiratory syndrome virus (PRRSV) field strains based on sequence analysis of open reading frame 5[J].Arch Virol,1997,142(5):993-1001.
[5]Asagoe T,Inaba Y,Jusa E R,et al.Effect of heparin on infection of cells by equine arteritis virus[J].J Vet Med Sci,1997,59(8):727-728.
[6]Bautista E M,FaabergK S,Mickelson D,etal.Functional properties of the predicted helicase of porcine reproductive and respiratory syndrome virus[J].Virology,2002,298(2):258-270.
[7]Bautista E M,Goyal S M,Collins J E.Serologic survey for Lelystad and VR-2332 strains of porcine respiratory and reproductive syndrome (PRRS) virus in US swine herds[J].J Vet Diagn Invest,1993,5(4):612-614.
[8]Chang C C,Yoon K J,Zimmerman J J,et al.Evolution of porcine reproductive and respiratory syndrome virus during sequential passages in pigs[J].J Virol,2002,76(10):4750-4763.
[9]Cheon D S,Chae C.Antigenic variation and genotype of isolates of porcine reproductive and respiratory syndrome virus in Korea[J].Vet Rec,2000,147(8):215-218.
[10]Cheon D S,Chae C.Restriction fragment length polymorphism analysis of open reading frame 5 gene of porcine reproductive and respiratory syndrome virus isolates in Korea[J].Arch Virol,2000,145(7):1481-1488.
LAMP Detection Method for PRRSV
ZHAO Xiangpeng1, WANG Lin1*, YIN Yi1, PU Jing1, REN Tong1, GAO Zhiqiang1,ZHANG Wei1, LIU Fenghua2, SHI Yaran2
(1.Beijing Entry-Exit Inspection and Quarantine Bureau, Beijing, 100026;2.Beijing Agricultural College)
The porcine reproductive and respiratory syndrome virus (PRRSV) RT-LAMP detection method was built.ORF6 gene of PRRSV is as the target gene,and 2 pairs of primers were designed.The sensitivity is equal as fluorescent RT-PCR detection method,more sensitivity than the common RT-PCR method.The result can be get in about 2 hours,and the expensive instrument isn't necessary.The LAMP detection method is suitable for the PRRS virus in farm.
Porcine Reproductive and Respiratory Syndrome;LAMP
S851.34;Q789
E-mail:zhaoxp@bjciq.gov.cn;*通讯作者E-mail:wanglin@bjciq.gov.cn
北京市科技计划课题 (D171100002117002)
2017-01-21

