miR⁃646抑制骨肉瘤细胞的增殖和迁移的机制初探
裴祎,牟帅,薛峰,滕松龄,王广斌
(1.中国医科大学肿瘤医院,辽宁省肿瘤医院骨与软组织肿瘤科,沈阳 110042;2.中国医科大学附属盛京医院骨科,沈阳 110004;3.沈阳医学院附属中心医院手外科,沈阳 110024)
miR⁃646抑制骨肉瘤细胞的增殖和迁移的机制初探
裴祎1,牟帅2,薛峰2,滕松龄3,王广斌2
(1.中国医科大学肿瘤医院,辽宁省肿瘤医院骨与软组织肿瘤科,沈阳 110042;2.中国医科大学附属盛京医院骨科,沈阳 110004;3.沈阳医学院附属中心医院手外科,沈阳 110024)
目的探讨miR-646对骨肉瘤细胞增殖和迁移的抑制作用。方法通过MTT实验检测miR-646过表达或受到抑制后对U2OS细胞增殖的影响。Transwell实验分析miR-646过表达或受到抑制后对U2OS细胞迁移的影响。MIRDB预测miR-646与表皮生长因子受体(EGFR)的位点结合后,利用荧光素酶报告及实验检测miR-646对EGFR的靶向作用,并通过Western blotting检测miR-646对EGFR通路的作用。结果MTT结果表明,转染miR-646后U2OS细胞的增殖受到了显著地抑制,24 h时抑制率为21.76%±1.05%,相反,当miR-646受到抑制后U2OS细胞的增殖得到了促进,24 h时促进的比率为18.89%±0.81%。Transwell实验发现miR-646可以抑制骨肉瘤细胞系U2OS的迁移能力。随后MIRDB预测发现miR-646与EGFR的3’UTR区域具有结合位点,荧光素酶报告基因实验证明了miR-646可以直接作用于EGFR。Western blotting结果证明miR-646对U2OS细胞增殖迁移能力的抑制在一定程度上是通过miR-646对EGFR通路的抑制实现的。结论miR-646可以通过抑制EGFR通路的活性,进而抑制骨肉瘤细胞的增殖和迁移功能。
miR-646;骨肉瘤;表皮生长因子;迁移;增殖
骨肉瘤是最常见的一种儿童原发性恶性肿瘤,骨肉瘤患者的5年生存率约为68%,但是一旦发生转移,其5年生存率则锐减至20%左右[1-2]。
表皮生长因子受体(epidermal growth factor receptor,EGFR)的异常扩增或突变是恶性骨肉瘤中很常见的表现[3]。EGFR可以通过调节cyclin D1等蛋白的表达来影响细胞的增殖情况,也可以通过作用于Akt等通路影响细胞的多种生物学功能,EGFR对基质金属蛋白酶2(matrix metalloproteinase-2,MMP2)的调节也会参与细胞的侵袭转移[4]。微小RNA(miRNA)可以在很多生物学过程中发挥重要的调节作用。在肿瘤中经常会发现异常表达的miRNA,这些miRNA可以作为抑癌基因或者癌基因发挥作用[5]。
本研究通过体外实验证实了miR-646具有通过调节EGFR通路影响骨肉瘤细胞的增殖和迁移能力。
1 材料与方法
1.1 主要试剂
U2OS细胞由沈阳军区总医院中心实验室冻存,使用DMEM(Dulbecc’s modified eagle media)培养基(美国Gibco公司)加10%胎牛血清(天津市灏洋生物制品科技有限责任公司)培养。EGFR(sc-377229),cyclin d1(sc-8396),MMP2(sc-13594),gapdh(sc-365062)抗体及相关二抗购自美国Santa Cruz公司。EGFR WT,EGFR MUT(突变与miR-646结合位点的序列)引物均合成于上海生工生物工程公司。荧光素酶报告基因试剂盒购自上海英拜生物科技有限公司。miR-646过表达/对照、miR-646抑制剂/对照及miR-646反义链(AS)购自于广州锐博生物公司。
1.2 方法
1.2.1 MTT实验:分别在U2OS细胞中转染miR-646过表达/对照或者miR-646抑制剂/对照,24 h后取培养至对数生长期的U2OS细胞消化,以1×104/孔接种于96孔培养板中。于0、12、24、36和48 h分别通过MTT检测细胞增殖情况。每个时间点加入5 mg/mL MTT 10 μL,培养4 h后弃上清,加入DMSO 200 μL溶解结晶,溶解后在490 nm处记录吸光值。
1.2.2 荧光素酶报告基因实验:分别将miR-646过表达质粒/miR-646反义链及EGFR野生型/突变型转染到处于对数生长期的U2OS细胞中,使用双荧光素酶报告实验测得荧光值并计算统计结果。
1.2.3 Transwell实验:U2OS细胞转染不同处理因素24 h后,将无血清培养基中的U2OS细胞以1×105/孔接种于Transwell小室上室中,下室添加600 μL含10%胎牛血清的培养基。培养24 h后,95%乙醇固定,0.4%台盼蓝染色。
1.2.4 Western blotting:使用RIPA裂解细胞提取蛋白。每个样本取等量蛋白在10%的SDS-PAGE胶内电泳,电泳结束后4℃100 V转膜1 h后洗膜,并通过5%脱脂奶粉室温封闭1 h。对应一抗4℃孵育过夜,二抗室温孵育1 h。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析,采用非配对t检验分析差异,P<0.05为差异有统计学意义。
2 结果
2.1 miR-646对U2OS细胞增殖的影响
分别将miR-646模拟物和对照转染到U2OS细胞,得到miR-646过表达的细胞系。利用MTT方法,于0、12、24、36和48 h分别检测细胞增殖情况,结果显示,miR-646对U2OS细胞的增殖具有一定抑制作用。见图1。
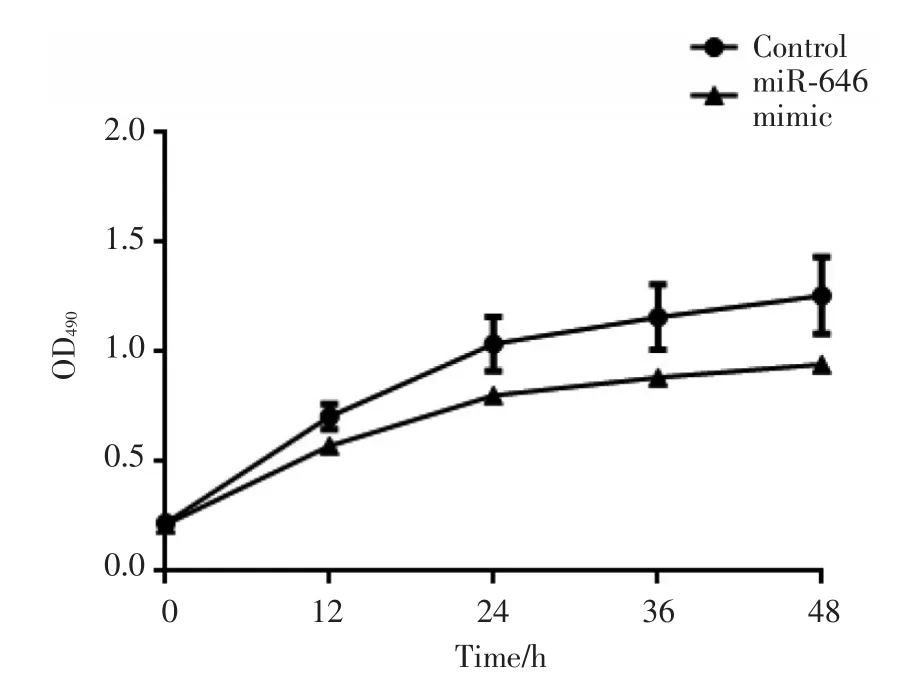
图1 miR⁃646模拟物作用下细胞的增殖情况Fig.1 Proliferation of cells treated with miR⁃646
分别将miR-646抑制物和对照转染到U2OS细胞后,得到miR-646低表达的细胞系。利用MTT的方法,于0、12、24、36和48 h分别检测细胞增殖情况,结果显示,miR-646对U2OS细胞的增殖具有显著的促进作用。见图2。
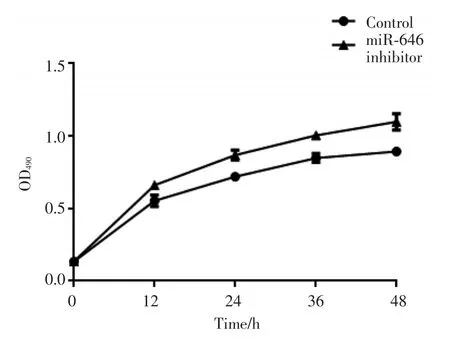
图2 miR⁃646抑制物作用下细胞的增殖情况Fig.2 Proliferation of cells treated with miR⁃646 inhibitor
2.2 miR-646对骨肉瘤细胞迁移能力的调节
骨肉瘤的迁移能力极强,这直接导致了其预后效果不佳,并且一旦发生远隔转移,患者的生存期通常较短。目前已经发现miR-646可能对骨肉瘤有一定的负向调节作用,为了进一步了解其是否可以影响骨肉瘤细胞的迁移能力,本研究在U2OS细胞中过表达了miR-646,并且通过Transwell实验发现miR-646可以抑制U2OS细胞的迁移,见图3。随后,利用U2OS细胞构建miR-646低表达的细胞系,通过Transwell实验发现miR-646表达下调可以促进U2OS细胞的迁移能力,见图4。
2.3 miR-646和EGFR的关系
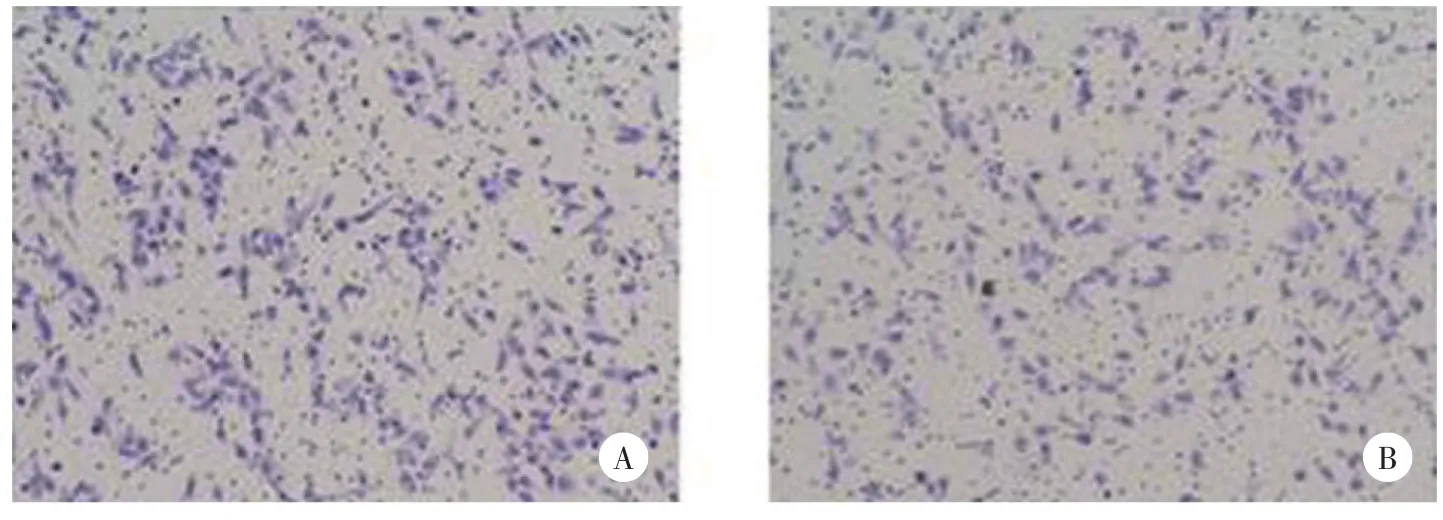
图3 miR⁃646模拟物对U2OS迁移能力的影响 ×200Fig.3 Effect of miR⁃646 mimic on migration of U2OS cells×200
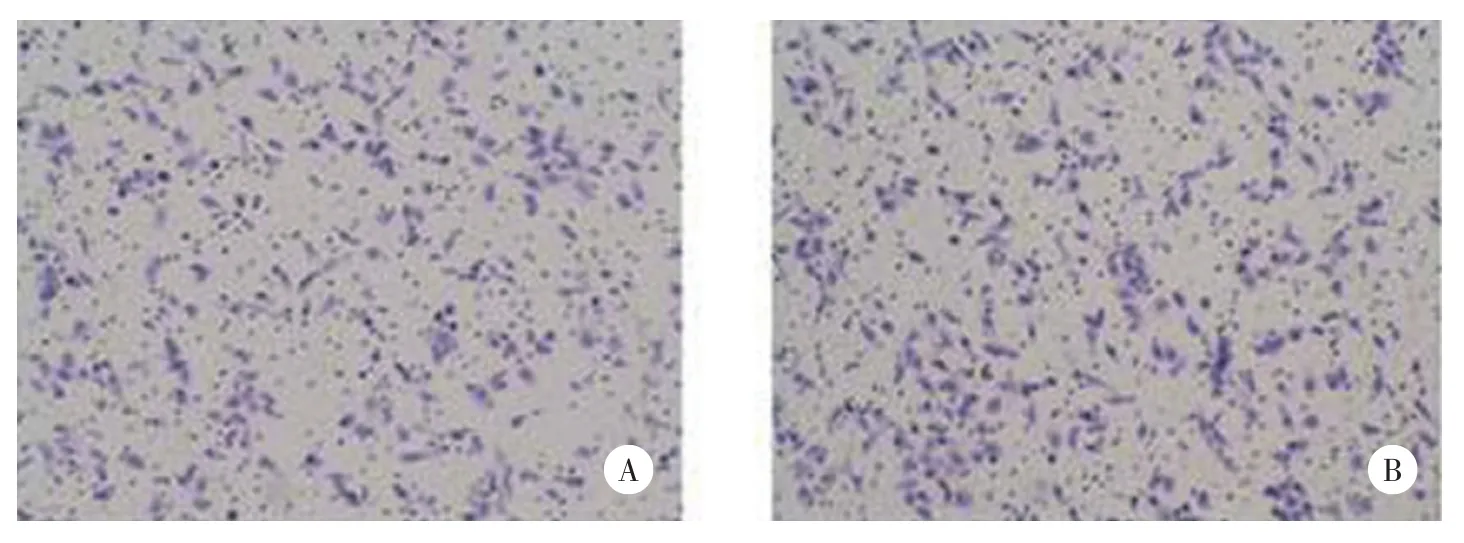
图4 miR⁃646抑制物对U2OS迁移能力的影响 ×200Fig.4 Effect of miR⁃646 inhibitor on migration of U2OS cells×200
通过MTT和Transwell的实验结果发现,miR-646对于U2OS细胞的增殖和迁移能力均有一定的抑制作用,为了探索miR-646对U2OS细胞生物学功能抑制作用的机制,通过生物学软件(MIRDB)预测寻找miR-646可能打靶的位点,结果发现miR-646与EGFR的3’UTR区域具有结合位点,见图5。
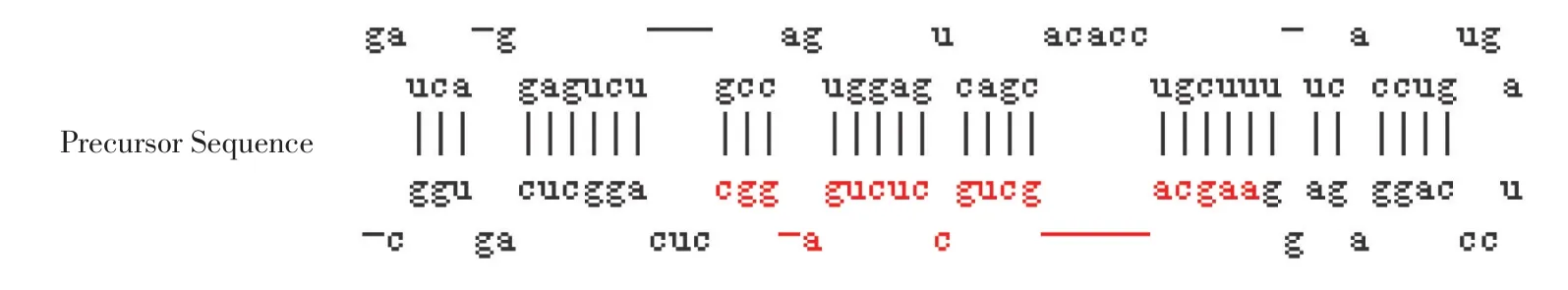
图5 miR⁃646与EGFR的结合位点预测Fig.5 Prediction of binding sites between miR⁃646 and EGFR
为了进一步了解miR-646是否可以直接调控EGFR的表达,本研究进行荧光素酶报告基因实验,结果发现,当miR-646与EGFR共同转染时,EGFR的活性显著下调,但是转入miR-646的反义链后此作用消失,而且当miR-646与EGFR MUT共同转染时,不会影响EGFR的活性,说明miR-646可以直接作用于EGFR,见图6。
2.4 miR-646对EGFR通路的调节
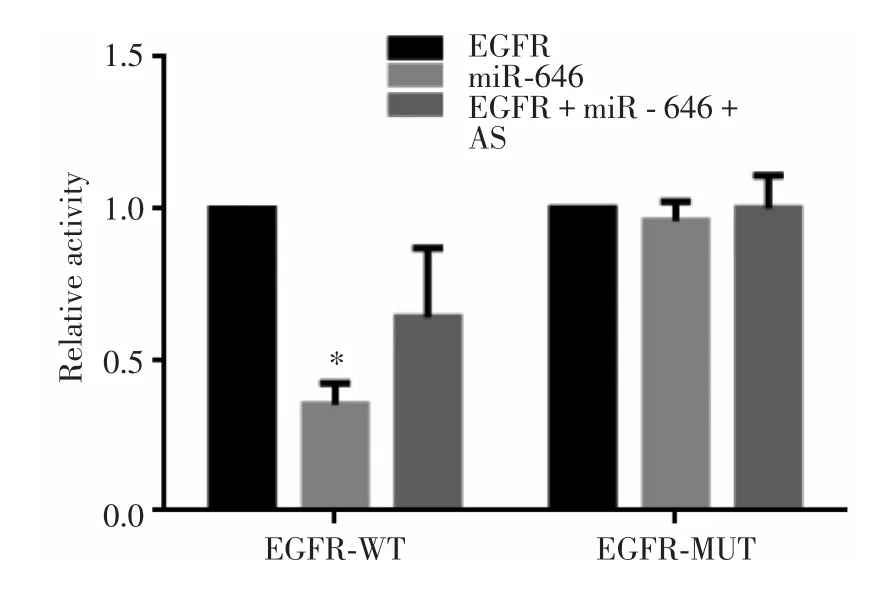
图6 miR⁃646可以直接打靶EGFRFig.6 miR⁃646 targeted EGFR
构建miR-646过表达的U2OS细胞系,结果发现miR-646对EGFR、cyclin D1和MMP2蛋白均有一定的抑制作用,见图7。随后构建了miR-646稳定低表达的U2OS细胞系,结果发现miR-646表达下调之后,EGFR、cyclin D1和MMP2蛋白的表达均有所上调,见图8。
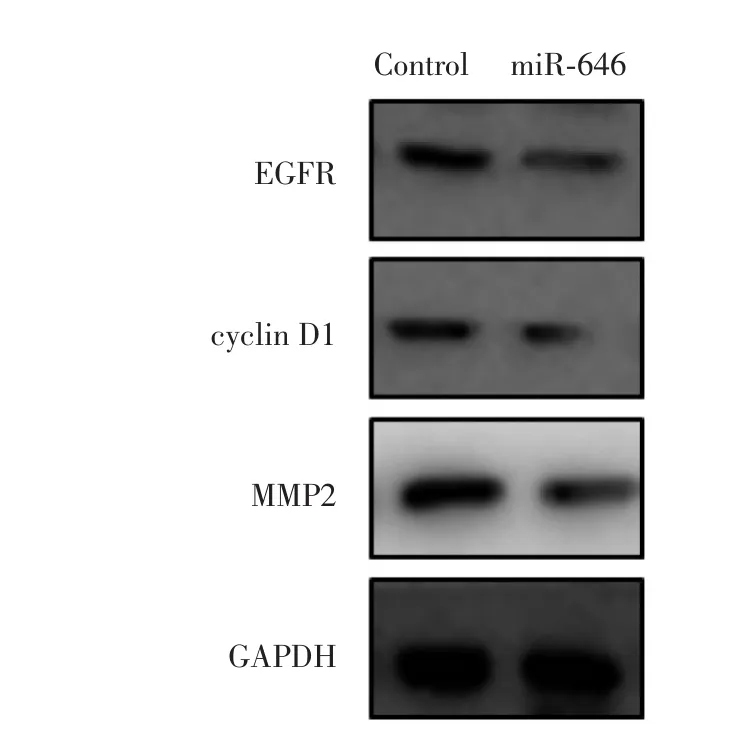
图7 miR⁃646对EGFR通路蛋白的影响Fig.7 Effect of miR⁃646 on EGFR pathway
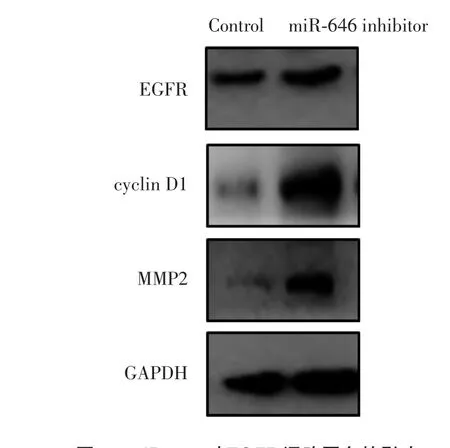
图8 miR⁃646对EGFR通路蛋白的影响Fig.8 Effect of miR⁃646 on EGFR pathway
3 讨论
骨肉瘤是儿童及青少年时期发病率较高的恶性肿瘤,也是最常见的原发性恶性骨肿瘤。骨肉瘤生长极为快速,很容易发生远隔器官转移[6]。
EGFR在多种肿瘤中被报道存在异常表达或者异常激活的现象,它可以通过调节多种信号通路来发挥重要作用。在细胞的增殖、凋亡、侵袭转移和分化等多种生命过程中均有EGFR的参与。目前很多EGFR的靶向治疗药物(单克隆抗体或者小分子抑制剂)均已投入临床应用,在治疗结肠癌、非小细胞肺癌和胰腺癌等多种肿瘤方面起到了重要作用。在骨肉瘤中,EGFR也被证明存在过度表达的现象,很多研究[7-10]指出,EGFR可以促进骨肉瘤的发生发展。
miRNA可作为癌基因或抑癌基因介导肿瘤的生长、发展和进展。目前为止,很多研究报道已经指出miRNA在骨肉瘤的发生发展中起到重要的作用。miR-1,miR-133和miR-378均被证明在骨肉瘤组织中低表达,并且可以通过抑制骨肉瘤细胞的增殖、促进其凋亡以及抑制其侵袭转移来起到抑制骨肉瘤发生发展的目的。
miR-646已经被证明在肺癌、骨肉瘤、肝细胞癌和肾细胞癌中具有低表达的现象。miR-646可以通过抑制FGF2的表达来抑制骨肉瘤细胞的侵袭转移。miR-646可以负调控NOB1进而抑制肾癌细胞的增殖和迁移。miR-646与肝癌的易感性也密切相关[11-15]。
miR-646与肿瘤的发生发展密切相关,为了深入探讨miR-646在骨肉瘤中是如何发挥作用的,本研究进行了一系列分析实验。在构建miR-646过表达与沉默的细胞系后,分别通过MTT实验和Transwell实验检测了miR-646对于骨肉瘤细胞系U2OS增殖和迁移能力的影响。结果发现,miR-646过表达后可以显著抑制U2OS细胞的增殖。肿瘤细胞的增殖功能大大增强,促进了肿瘤的快速生长,对机体构成了压迫性损伤,因此推断miR-646对于骨肉瘤有一定的治疗效果。Transwell实验结果表明,miR-646可以显著抑制U2OS细胞的迁移。
MIRDB预测指出miR-646可以与EGFR有一定的结合位点,通过报告基因实验发现miR-646可以直接作用于EGFR,这证明了miR-646可以通过影响EGFR的活性影响骨肉瘤的发生发展。接下来通过对EGFR通路蛋白表达的检测发现,miR-646过表达可以抑制EGFR、cyclin D1和MMP2的表达,这说明miR-646可以通过影响EGFR通路来调节U2OS细胞的增殖和迁移能力。
综上所述,miR-646可以通过抑制EGFR通路来抑制骨肉瘤细胞的增殖和迁移,为骨肉瘤的治疗提供了新的理论基础。
[1]HE M,JIANG L,REN Z,et al.Noscapine targets EGFR p-Tyr1068 to suppress the proliferation and invasion of MG63 cells[J].Sci Rep,2016,10(6):37062.DOI:10.1038/srep37062.
[2]ARETZ I,HARDT C,WITTIG I,et al.An impaired respiratory electron chain triggers down-regulation of the energy metabolism and deubiquitination of solute carrier amino acid transporters[J].Mol Cell Proteomics,2016,15(5):1526-1538.DOI:10.1074/mcp. M115.053181.
[3]SEVELDA F,MAYR L,KUBISTA B,et al.EGFR is not a major driver for osteosarcoma cell growth in vitro but contributes to starvation and chemotherapy resistance[J].J Exp Clin Cancer Res,2015,2(34):134.DOI:10.1186/s13046-015-0251-5.
[4]WANG Q,CAI J,WANG J,et al.MiR-143 inhibits EGFR-signalingdependent osteosarcoma invasion[J].Tumour Biol,2014,35(12):12743-12748.DOI:10.1007/s13277-014-2600-y.
[5]SARVER AL,THAYANITHY V,SCOTT MC,et al.MicroRNAs at the human 14q32 locus have prognostic significance in osteosarcoma[J].Orphanet J Rare Dis,2013,11(8):7.DOI:10.1186/1750-1172-8-7.
[6]MORTUS JR,ZHANG Y,HUGHES DP.Developmental pathways hijacked by osteosarcoma[J].Adv Exp Med Biol,2014,804:93-118.DOI:10.1007/978-3-319-04843-7_5.
[7]XIAO Q,ZHANG X,WU Y,et al.Inhibition of macrophage polarization prohibits growth of human osteosarcoma[J].Tumour Biol,2014,35(8):7611-7616.DOI:10.1007/s13277-014-2005-y.
[8]HOU CH,LIN FL,TONG KB,et al.Transforming growth factor alpha promotes osteosarcoma metastasis by ICAM-1 and PI3K/Akt signaling pathway[J].Biochem Pharmacol,2014,89(4):453-463. DOI:10.1016/j.bcp.2014.03.010.
[9]LEE JA,KO Y,KIM DH,et al.Epidermal growth factor receptor:is it a feasible target for the treatment of osteosarcoma[J].Cancer Res Treat,2012,44(3):202-209.DOI:10.4143/crt.2012.44.3.202.
[10]MCCLEESE JK,BEAR MD,KULP SK,et a1.Met interacts with EGFR and Ron in canine osteosarcoma[J].Vet Comp Oncol,2013,11(2):124-139.DOI:10.1111/j.1476-5829.2011.00309.x.
[11]PAN Y,CHEN Y,MA D,et al.miR-646 is a key negative regulator of EGFR pathway in lung cancer[J].Exp Lung Res,2016,42(6):286-295.DOI:10.1080/01902148.2016.1207726.
[12]AZAM AT,BAHADOR R,HESARIKIA H,et al.Downregulation of microRNA-217 and microRNA-646 acts as potential predictor biomarkers in progression,metastasis,and unfavorable prognosis of human osteosarcoma[J].Tumour Biol,2016,37(5):5769-5773.DOI:10.1007/s13277-015-3821-4.
[13]SUN XH,GENG XL,ZHANG J,et al.Downregulation of microRNA-217 and microRNA-646 acts as potential predictor biomarkers in progression,metastasis,and unfavorable prognosis of human osteosarcoma[J].Tumour Biol,2015,36(3):2127-2134.DOI:10.1007/s13277-014-2822-z.
[14]FINNERTY JR,WANG WX,HEBERT SS,et al.The miR-15/107 group of microRNA genes:evolutionary biology,cellular functions,and roles in human diseases[J].J Mol Biol,2010,402(3):491-509.DOI:10.1016/j.jmb.2010.07.051.
[15]LI W,LIU M,FENG Y,et al.Downregulation of microRNA-217 and microRNA-646 acts as potential predictor biomarkers in progression,metastasis,and unfavorable prognosis of human osteosarcoma[J].Br J Cancer,2014,111(6):1188-1200.DOI:10.1038/ bjc.2014.382.
(编辑 于 溪)
Mechanism of Inhibition of Proliferation and Migration of Osteosarcoma Cells by miR⁃646
PEI Yi1,MU Shuai2,XUE Feng2,TENG Songling3,WANG Guangbin2
(1.Department of Bone and Soft Tissue Surgery,Cancer Hospital of China Medical University,Liaoning Cancer Hospital&Institute,Shenyang 110042,China;2.Department of Orthopaedics,Shengjing Hospital,China Medical University,Shenyang 110004,China;3.Department of Hand Surgery,Central Hospital Affiliated to Shenyang Medical Collage,Shenyang 110024,China)
ObjectiveThe mechanism of inhibition of the proliferation and migration of osteosarcoma cells by miR-646 was investigated.Meth⁃odsThe effects of miR-646 on the proliferation of U2OS cells were detected by MTT assay.The effects of miR-646 on U2OS cell migration were analyzed by Transwell assay.MIRDB was used to predict the binding sites of miR-646 and epidermal growth factor receptor(EGFR),which were confirmed in a luciferase reporter assay.Western blotting was conducted to detect the effect of miR-646 on the EGFR pathway.ResultsThe MTT test showed that transfection of miR-646 significantly inhibited U2OS cell proliferation;the 24 h inhibition rate was 21.76%±1.05%.In contrast,the 24 h promotion was 18.89%±0.81%.Transwell experiments showed that miR-646 inhibited the migration of osteosarcoma U2OS cells.MIRDB predicted that miR-646 bound in the 3’-untranslated region of EGFR,and luciferase reporter gene experiments showed that miR-646 directly acted on EGFR.Western blotting experiments demonstrated that miR-646 inhibited the proliferation and migration of U2OS cells to some extent by inhibiting the EGFR pathway.ConclusionmiR-646 can inhibit the proliferation and migration of osteosarcoma cells by inhibiting the EGFR pathway.
miR-646;osteosarcoma;epidermal growth factor receptor;migration;proliferation
R738.1
A
0258-4646(2017)08-0729-05
10.12007/j.issn.0258-4646.2017.08.013
裴祎(1984-),男,主治医师,硕士.
王广斌,E-mail:wanggb@sj-hospital.org
2016-12-27
网络出版时间:

