甲炎康泰对自身免疫性甲状腺炎模型大鼠Th1/Th2细胞平衡偏移的影响*
张程斐,侯毅,刘铜华,孙文,吴丽丽,秦灵灵
甲炎康泰对自身免疫性甲状腺炎模型大鼠Th1/Th2细胞平衡偏移的影响*
张程斐1,侯毅1,刘铜华2**,孙文3,吴丽丽4,秦灵灵5
(1.北京中医药大学东方医院北京100078;2.北京中医药大学研究生院北京100029;3.北京中医药大学教育部中医养生学重点实验室北京100029;4.北京中医药大学中医养生学研究所北京100029;5.北京中医药大学科技处北京100029)
目的:探讨甲炎康泰对自身免疫性甲状腺炎(AIT)大鼠Th1/Th2细胞平衡偏移作用机制。方法:采用Lewis大鼠建立AIT大鼠40只,6周后随机分为模型组、甲炎康泰低、中、高剂量组,每组10只,每天分别按去离子水、0.708、1.417、2.834 g·kg-1剂量连续灌胃8周。检测血清TgAb、TPOAb;Th1、Th2细胞分布比例及Th1/ Th2比率;检测血浆中IL-4、IL-5、IFN-γ、TNF-α和IL-1α含量;HE染色观察甲状腺组织的病理;免疫组织化学检测甲状腺IFN-γ、IL-4蛋白表达。结果:甲炎康泰高剂量组能够下降AIT大鼠TPOAb、TGAb水平,降低甲状腺炎发生率、Th1与Th2细胞分布比例以及Th1/Th2比率;降低血浆IFN-γ、TNF-α、IL-1α、IL-4、IL-5含量;降低甲状腺IFN-γ、IL-4蛋白表达。结论:甲炎康泰具有降低AIT大鼠甲状腺自身抗体的作用,可能与通过调节细胞因子水平和Th1/Th2细胞平衡偏移有关。
甲炎康泰自身免疫性甲状腺炎大鼠Th1/Th2细胞平衡偏移
自身免疫性甲状腺疾病(Autoimmune Thyroid Dis⁃ease,AITD)是由自身免疫功能紊乱,引起特异性甲状腺自身抗体的产生和甲状腺内淋巴细胞的浸润,以甲状腺结构破坏和功能减退为主要特征的器官特异性自身免疫疾病。在AITD发病的作用机制中,细胞因子发挥了非常重要的作用[1]。正常状态下Th1与Th2型细胞所分泌的细胞因子保持动态平衡,若其中任何一个因子处于劣势或优势状态,此平衡将偏移而导致自身免疫性疾病的产生。研究显示在AITD的发病机制中,Th1/Th2细胞平衡偏移显现了十分关键的作用[2]。本研究将建立自身免疫性甲状腺炎大鼠为模型,观察中药复方甲炎康泰对Th1/Th2细胞平衡偏移的作用机制。
1 实验材料
1.1 主要仪器试药
CM1900恒冷冰冻切片机(北京普瑞赛司仪器有限公司);Thermo labsystem MK3酶标仪(美国Thermo公司);Avantij-25I型低温真空高速离心机(美国Beck⁃man公司);M1600扫描仪(深圳清华紫光公司);激光共聚焦显微镜(德国GmbH公司);OLYMPUS BH-2光镜(日本奥林巴斯公司);PL202-S电子天平(瑞士梅特勒-托利多仪器有限公司);蒸汽消毒箱(上海申安器械厂);FD53型高温干燥箱(德国Binder公司);BD FACS CantoTMⅡ流式细胞仪(美国BD公司);其他手术相关器械。
碘化钠溶液(玛雅试剂有限公司产品,批号:MA⁃YA-CR-2831),猪甲状腺球蛋白(美国Sigma公司,批号:018K7012V),弗氏不完全佐剂(美国Sigma公司,批号:SLBL9742V),弗氏完全佐剂(美国Sigma公司,批号:SLBM2184V),TPO-Ab Elisa kit(武汉华美生物工程有限公司,批号:C3968470338),TGAb Elisa kit(EX⁃PANDBIO,批号:201605);二甲苯、无水乙醇(北京化工厂);伊红(美国Sigma公司),免疫组化一抗IFN-r(美国Sigma公司,批号:R02332);免疫组化一抗IL-4(美国Sigma公司,批号:ab9811),Mayer'苏木素染液(北京索莱宝科技有限公司,批号:20161213),羊血清工作液(北京中杉金桥生物技术有限公司,批号:WK161525),柠檬酸(北京化工厂,批号:20130123),柠檬酸钠(上海麦克林生化科技有限公司,批号:C10046927),DAB显色试剂盒(北京中杉金桥生物技术有限公司,批号:K162418A),超敏二步免疫组化检测试剂(北京中杉金桥生物技术有限公司,批号:K166616J),大鼠外周淋巴细胞分离液(北京索莱宝科技有限公司,批号:20151017),4%多聚甲醛溶液(北京索莱宝科技有限公司,批号:SL26171504),红细胞裂解液(德国Miltenyi Biotec,批号:130-094-183),Antirat CD3 FITC(美国eBioscience公司,批号:11-0030-82),Rat IFN-GMA PE(批号:559499)、Rat IL-4 PE(批号:555082)及MS IgG1 KPA ITCL PE(批号:554680),均购自美国BD公司。Rat IFN-γ(批号:A311101)、TNF-α(批号:A311129)、IL-1α(批号:A311105)、IL-4(批号:A311121)及IL-5(批号:B311185)均购自北京旷博生物技术股份有限公司。
碘化钠溶液:将64 mg碘化钠溶于100 mL水溶液中,配制出含量为0.064%的溶液。现用现配,注意避光。乳化剂的配制:首先用PBS配制浓度为0.1%的猪甲状腺球蛋白(Porcine Throglobulin,PTg),然后按等容积比例与弗氏完全佐剂(Complete Freund's Adjuvant,CFA)混合,研磨成乳剂。Tg终浓度为0.05%,即100 ug Tg/0.2 mL乳化剂。弗氏不完全佐剂(Incomplete Freund's Adjuvant,IFA)配制方法同CFA。
1.2 实验药物
甲炎康泰复方颗粒剂(购于北京中医药大学东方医院)水溶液:柴胡、郁金、浙贝母、玄参、夏枯草、穿山龙、乌梅、山慈菇、黄芪颗粒剂,加入双蒸水制备成100 mL水溶液,置4℃冰箱备用。甲炎康泰已申请专利(专利号:CN106421633A)。
1.3 实验动物
SPF级Lewis大鼠50只,4周龄,体重80±10 g,雌性。购于北京维通利华实验动物技术有限公司,许可证号:SYXK(京)2015-0015。
2 实验方法
2.1 分组与造模
按文献方法[3]制作AIT模型:随机抽取10只大鼠为正常对照组,其余均造模。自实验第1周起,造模鼠自由饮用0.064%NaI,非造模鼠自由饮用双蒸水。第3周除非造模鼠外,各组造模鼠初次免疫:弗氏完全佐剂甲状腺球蛋白乳剂在大鼠足垫、背部皮下、颈部皮下分别多点注射0.2 mL/只/次,共注射2次,中间间隔2天。加强免疫:第4-8周分别在大鼠足垫、背部皮下、颈部皮下分别多点注射0.2 mL/只/次。造模是否成功验证方法:眶静脉取血,酶联免疫吸附法(Elisa)检测外周血清中TPOAb、TGAb抗体水平。
2.2 给药方法
造模成功后,各组给药量参照人与动物之间体表面积比例(剂量换算用)表折算[4],甲炎康泰低、中、高剂量组每天分别给予大鼠甲炎康泰颗粒剂0.708、1.417、2.834 g·kg-1灌胃,正常组与模型组大鼠予每天以同体积去离子水1 mL·100 g-1。连续给药8周。
2.3 指标及检测方法
2.3.1 流式样本处理及实验方法
流式细胞术检测Th1细胞、Th2细胞的分布比例及Th1/Th2比率。治疗结束后,1%戊巴比妥钠麻醉,腹主动脉取血5 mL,置于肝素钠采血管中,分离血浆待测,在采血管中加入红细胞裂解液,涡旋孵育、洗涤、重悬细胞,调至每个样本包含5×105单个核细胞/mL。
检测Th1、Th2细胞时,每组细胞样品中加入配好的刺激剂(含佛波酯、离子酶素、高尔基体阻断剂、布雷菲德菌素A的1640培养液),37℃恒温箱内培养刺激5 h,加入anti-rat CD3 FITC、anti-rat CD4 FITC进行细胞表面染色,破膜固定后加入Rat IFN-GMA PE、Rat IL-4 PE或同型对照MS IgG1 KPA ITCL PE进行胞内染色,37℃孵育30 min。利用流式细胞仪进行检测。
2.3.2 Th1、Th2细胞相关细胞因子的检测
采用流式高通量多因子检测技术检测血浆中Th1和Th2细胞相关细胞因子表达。参考Fan[5]报道的方法,运用Aimplex大鼠单因子检测试剂盒Rat IFN-γ、TNF-α、IL-1α、IL-4及IL-5均购自北京旷博生物技术股份有限公司检测血浆中Th1和Th2细胞相关细胞因子表达情况,用流式细胞仪进行检测。
2.3.3 大鼠甲状腺病理观察
使用半定量形态学分析大鼠发生AIT的阳性率。采用奥林巴斯DP2-BSW显微照相系统,400倍光镜下每张HE染色切片随机照取5个视野,应用Image-Pro Plus 6.0软件测量整个截面与截面内炎细胞的面积。自身免疫性甲状腺炎的病理诊断标准:甲状腺组织内炎细胞与整个组织的面积比值>2%[6]即为阳性,之后计算各组大鼠发生AIT的阳性率。
2.3.4 免疫组织化学分析
染色强度分析:每例切片随机取10个视野,400倍光镜下采集图像。运用Image-Pro Plus 6.0,Media Cy⁃bernetics系统进行吸光度检测,分别分析IL-4、IFN-γ的积分光密度(IOD)平均值,进行统计学处理。
2.4 统计学方法
采用SPSS 20.0统计软件处理数据,数据以均数±标准差(xˉ±s)表示,组间比较采用方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 外周血中TPOAb、TGAb浓度测定
由表1可知:与正常组比较,模型组大鼠TPOAb、TGAb浓度显著升高(P<0.01);与模型组比较,甲炎康泰高剂量组大鼠TPOAb明显下降(P<0.05)。与模型组比较,甲炎康泰高剂量组大鼠TGAb显著下降(P<0.01)。
3.2 各组大鼠甲状腺组织的病理变化
正常组可见大量完整甲状腺滤泡,大小适中,腔内红色胶质充盈均匀,滤泡上皮细胞完整;模型组间质和滤泡壁呈炎性细胞浸润,大量滤泡腔变小以及被破坏,腔内胶质不均或减少,滤胞壁变薄、破坏;治疗组间质内淋巴细胞浸润较模型组明显减少,滤泡上皮细胞较为完整,胶质含量略减少,但较模型组轻微,滤泡结构完整。高剂量组略好于中、低剂量组(图1)。

表1 各组大鼠血清中TPOAb、TGAb含量比较(xˉ±s,n=10)
正常组、模型组、甲炎康泰低、中、高剂量组大鼠自身免疫性甲状腺炎的发生率分别为0,100%,20%,20%,10%。与正常组比较,模型组甲状腺炎的发生率明显升高(P<0.01);与模型组比较,治疗组甲状腺炎的发生率明显降低(P<0.01),但三组间比较无统计学差异(表2)。
3.3 Th1细胞、Th2细胞的分布比例及Th1/Th2比率变化
由表3可知,与正常组比较,模型组Th1和Th2细胞分布比例以及Th1/Th2比率显著上升(P<0.01);与模型组比较,甲炎康泰高剂量组Th1细胞分布比例显著降低(P<0.01),甲炎康泰高剂量组Th2细胞分布比例降低(P<0.05),甲炎康泰高剂量组Th1/Th2比率降低(P<0.05)。
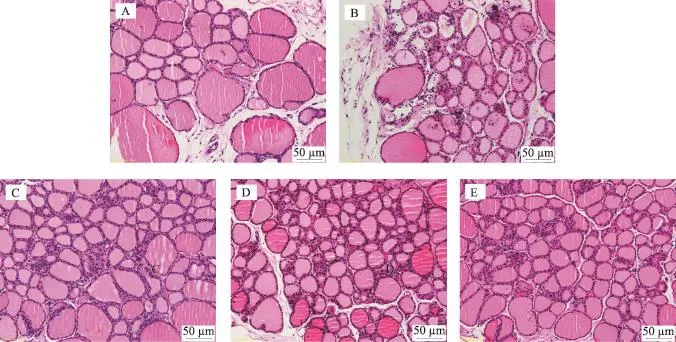
图1 大鼠甲状腺石蜡切片HE染色光镜观察结果(×200)

表2 各组大鼠甲状腺炎发生率情况(xˉ±s,n=10)
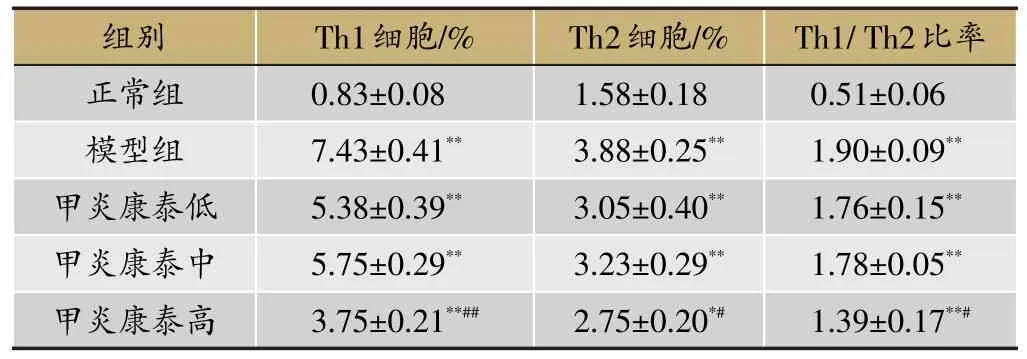
表3 各组大鼠外周血中Th1和Th2细胞的分布比例变化的比较(xˉ±s,n=4)
3.4 Th1、Th2细胞相关细胞因子的表达情况
由表4可知,与正常组比较,模型组IFN-γ、TNF-α、IL-1α均显著升高(P<0.01);与模型组比较,甲炎康泰高剂量组IFN-γ降低且有统计学意义(P<0.05);与模型组比较,甲炎康泰低、高剂量组TNF-α降低且有统计学意义(P<0.05);与模型组比较,甲炎康泰低、高剂量组IL-1α降低且有统计学意义(P<0.05),高剂量组IL-1α极显著降低(P<0.01)。
由表5可知,与正常组比较,模型组IL-4显著升高(P<0.05),IL-5极显著升高(P<0.01);与模型组比较,甲炎康泰低、中、高剂量组IL-4显著降低(P<0.05);与模型组比较,甲炎康泰低剂量组IL-5显著降低(P<0.05),高剂量组IL-5极显著降低(P<0.01)。
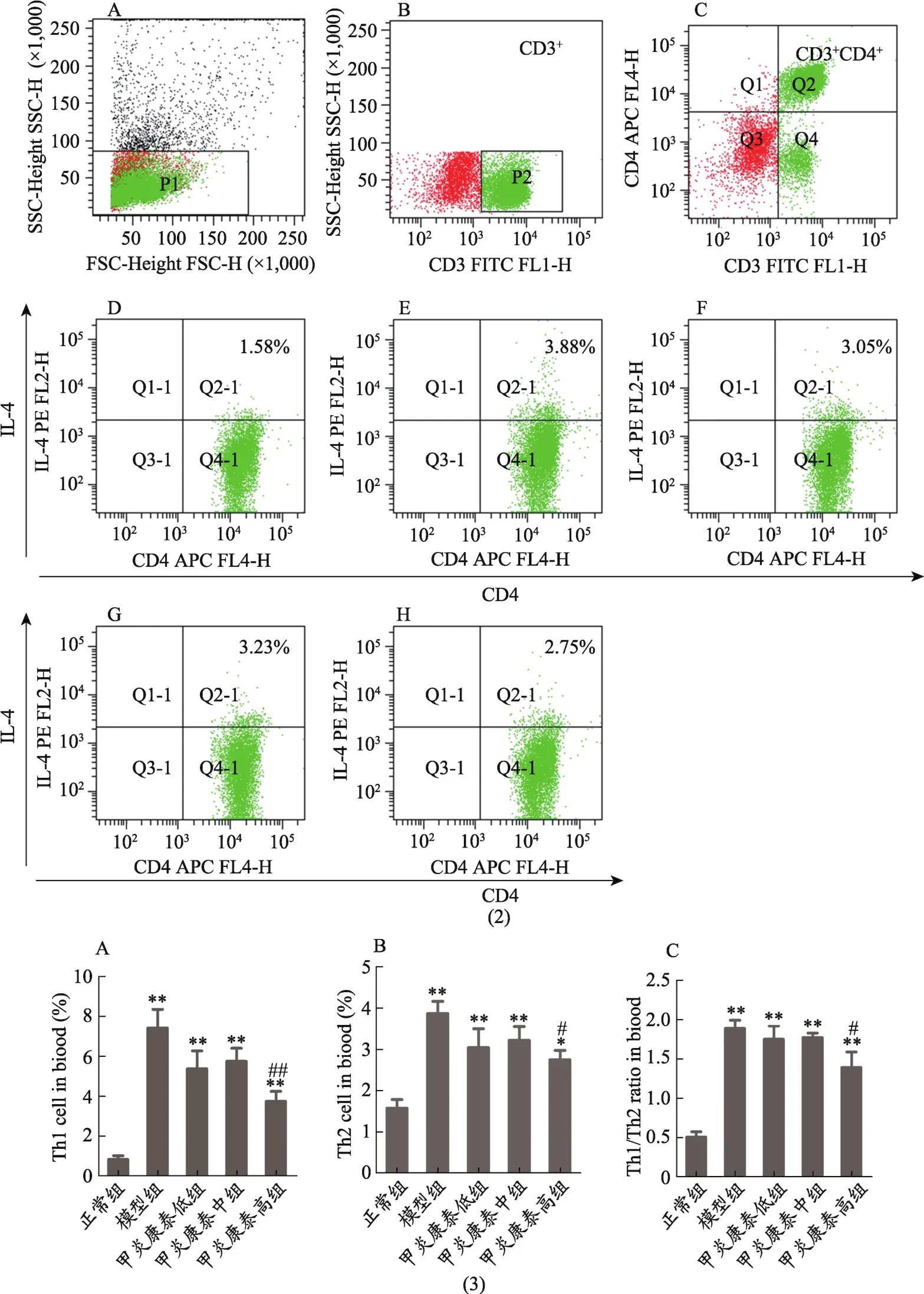
图2 各组大鼠外周血中Th1、Th2细胞分布比例及Th1/Th2比率变化的比较
3.5 各组大鼠甲状腺IFN-γ、IL-4蛋白表达变化
镜下可见甲状腺组织IFN-γ免疫阳性物呈棕色位于甲状腺上皮细胞核中,提示IFN-γ蛋白表达在甲状腺上皮细胞核中,见图3和表6;IL-4免疫阳性物呈棕色位于甲状腺滤泡质中,提示IL-4蛋白表达在甲状腺滤泡质中,见图4和表7。比较各组平均光密度值,正
常组大鼠甲状腺组织内有较少IFN-γ、IL-4蛋白表达,模型组大鼠IFN-γ、IL-4蛋白表达均呈现阳性。与模型组比较,甲炎康泰低、中、高剂量组IFN-γ、IL-4蛋白表达显著减少(P<0.01)。
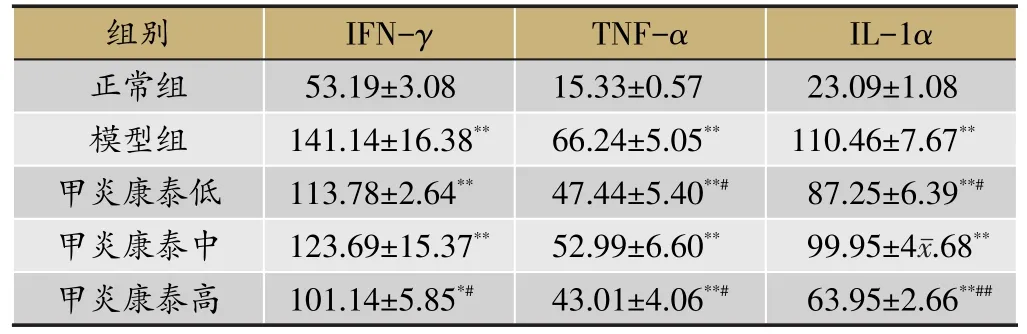
表4 甲炎康泰对大鼠血清中Th1相关细胞因子表达的影响(xˉ±s,n=4)

表5 甲炎康泰对大鼠血清中Th2相关细胞因子表达的影响(xˉ±s,n=4)

图3 各组大鼠甲状腺组织IFN-γ染色(×400)
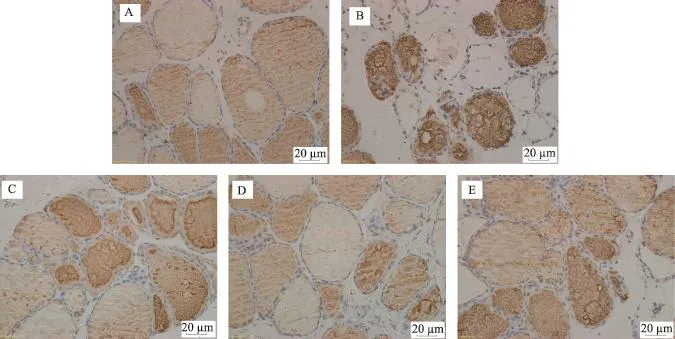
图4 各组大鼠甲状腺组织IL-4染色(×400)
4 讨论
AITD以特异性甲状腺自身抗体的产生和甲状腺组织内炎性细胞浸润为主要特征。近年其发病率持续增长,约占世界人口12%,女性患病率是男性10倍多,尤其绝经后妇女更频繁[7]。西医目前无特异性治疗药物及方法。AITD可归属于中医“瘿病”的范畴,病机在于气滞、血瘀、痰凝。甲炎康泰是多年临床治疗自身免疫性甲状腺疾病的经验方,具有疏肝化瘀、软坚散结之功效。前期研究疗效结果显示经甲炎康泰治疗6个月后,TgAb与TPOAb总有效率分别为97.22%、94.44%[8],其治疗AITD的临床疗效确切。本研究进一步对其作用机制进行探讨,病理结果显示,与模型组比较,甲炎康泰治疗组甲状腺炎的发生率显著降低(P<0.01),主要表现为淋巴细胞浸润程度的降低。甲状腺自身抗体检测结果显示,甲炎康泰低、中、高剂量组大鼠TGAb、TPOAb表达水平均下降,高剂量组TPOAb浓度下降有统计学意义(P<0.05),TGAb显著下降(P<0.01)。提示甲炎康泰具有减轻特异性甲状腺自身抗体的产生以及降低甲状腺内淋巴细胞浸润的作用。
甲状腺组织内Ts细胞数量下降或功能减退,减弱了对B淋巴细胞和Th细胞的抑制作用。B淋巴细胞在辅助性T细胞(Th细胞)的作用下增生并大量分泌抗甲状腺自身抗体,从而导致AITD的发生。因此,Th细胞活化及Th1/Th2细胞平衡偏移是本疾病一条核心的共同通路[9]。因分泌细胞因子的功能差异,Th细胞可分为Th1和Th2两个细胞亚群,Th1型细胞主要产生TNF-α,IFN-γ和IL-1α等细胞因子,介导细胞免疫;Th2细胞可分泌IL-4、IL-5等细胞因子,介导I型超敏反应与体液免疫[10]。正常状态下Th1与Th2型细胞所分泌的细胞因子保持动态平衡,若其中任何一个因子处于劣势或优势状态,此平衡将偏移而导致自身免疫性疾病的产生。因此在AITD的发病机制中,Th1/Th2细胞平衡偏移显现了十分关键的作用。故本实验采用流式细胞术检测大鼠外周血中Th1和Th2细胞的分布比例变化,研究显示,模型组小鼠Th1和Th2细胞比例高于正常组小鼠Thl和Th2细胞比例,说明细胞免疫和体液免疫共同参与了AITD的发病[11,12]。且模型组Th1/Th2比率(较正常组Th1/Th2比率而言,提示AITD的发生与Th细胞活化向Th1细胞偏移有关。甲炎康泰低、中、高剂量组均能降低Th1、Th2与Th1/Th2比例,且高剂量组疗效显著。
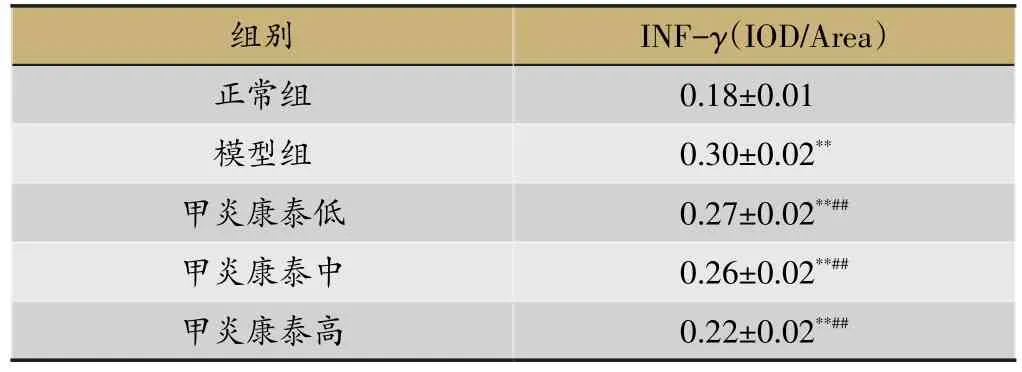
表6 各组大鼠甲状腺IFN-γ蛋白表达(xˉ±s,n=10)
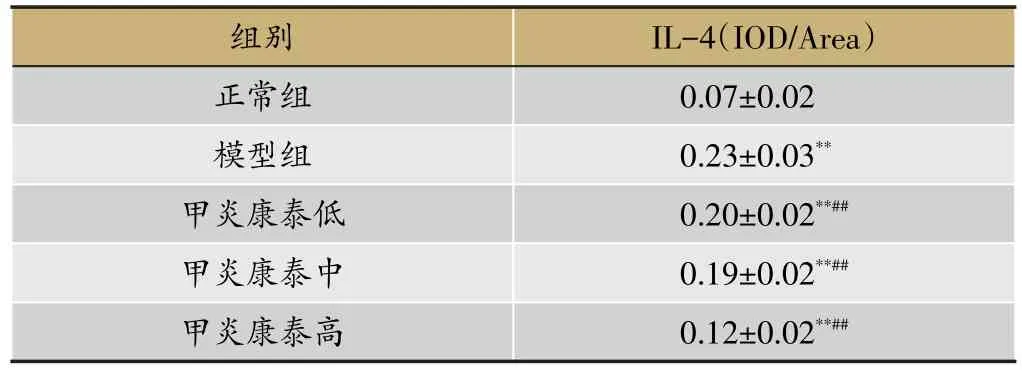
表7 各组大鼠甲状腺IL-4蛋白表达(xˉ±s,n=10)
TNF-α、IFN-γ、IL-1α和IL-4、IL-5分别是Th1和Th2型细胞因子的代表,在功能上互相拮抗保持平衡,常作为Thl/Th2型细胞因子动态平衡的指标。TNF-α可加强异常免疫反应,引起甲状腺组织内的炎性破坏[13];IFN-γ可促进B细胞与T细胞分化,增强NK细胞杀伤活性,激活单核巨噬细胞,且注射IFN-γ于EAT高易感品系小鼠甲状腺中可诱导EAT[14];IL-1α是重要的致炎细胞因子,几乎影响各种类型的细胞[15,16]。甲炎康泰治疗组与模型组相比较TNF-α、IFN-γ、IL-1α水平均明显下降,高剂量组最为显著。提示甲炎康泰具有抑制Th1型细胞因子和减缓Th细胞活化向Th1细胞偏移作用。IL-4可通过抑低Th1型细胞产生的细胞因子,而降低Th1型细胞异常应答所引起的组织损伤[17];IL-5可引起B淋巴细胞的增殖、分化和成熟,加快甲状腺自身抗体的大量分泌,激发了甲状腺滤泡细胞的生长及其功能的提高,导致甲状腺功能亢进症。本研究显示模型组和治疗组IL-5均高于对照组,与Gopalakrishnan S等研究结果一致[18]。对比模型组,甲炎康泰低、中、高剂量组IL-4、IL-5水平均明显下降,提示甲炎康泰有促使Th2型细胞因子回归正常趋势的作用,可防止Th2型细胞因子因拮抗Th1型细胞因子而过亢。
综上所述,由此推测甲炎康泰治疗自身免疫性甲状腺疾病,可能与显著降低细胞因子水平、调节Th1/ Th2细胞平衡偏移有关。甲炎康泰治疗作用的具体细胞因子作用机制有待于进一步研究。
1Caturegli P,Kimura H,Rocchi R,et al.Autoimmune Thyroid Diseases. Curr Opin Rheumatol,2007,19(1):44-48.
2Karanikas G,Schuetz M,Wahl K,et al.Relation of anti-TPO autoanti⁃body titre and T-lymphocyte cytokine production patterns in Hashimoto' s thyroiditis.Clin Endocrinol(Oxf),2005,63(2):191-196.
3Verginis P,Stanford M M,Carayanniotis G.Delineation of Five Thyro⁃globulin T Cell Epitopes with Pathogenic Potential in Experimental Au⁃toimmune Thyroiditis.J Immunol,2002,169(9):5332-5337.
4熊远珍.实验动物与人用药量的新换算.江西医学院学报,1997,04:41.
5Fan X,Wang J,Hou J,et al.Berberine alleviates ox-LDL induced in⁃flammatory factors by up-regulation of autophagy via AMPK/mTOR sig⁃naling pathway.J Transl Med,2015,13(1):1-11.
6Bagchi N,Brown T R,Sundick R S.Thyroid cell injury is an initial event in the induction of autoimmune thyroiditis by iodine in obese strain chickens.Endocrinology,1995,136(11):5054-5060.
7Duntas L H.The Role of Iodine and Selenium in Autoimmune Thyroid⁃itis.Horm Metab Res,2015,47(10):721-726.
8邓莉.甲炎康泰治疗桥本氏甲状腺炎的临床疗效观察及药效研究.西安:陕西中医药大学硕士学位论文,2016.
9Weetman A P.Autoimmune Thyroid Disease.Autoimmunity,2004,37 (4):337-340.
10 Elenkov I J.Glucocorticoids and Th1/Th2 balance.Ann N Y Acad Sci, 2004,1024(10):138-146.
11 Roura-Mir C,Catalfamo M,Sospedra M,et al.Single-cell analysis of in⁃trathyroidal lymphcytes shows differential cytokine expression in Hashi⁃moto's and Graves'disease.Eur J Immunol,1997,27(12):3290-3320.
12 Tang H,Sharp G C,Chen K,et al.The kinetics of cytokine gene expres⁃sion in the thyroids of mice developing granulomatous experimental au⁃toimmune thyroidtis.Autoimmun,1998,11(6):581-589.
13 Yamada T,Sato A,Komiya I,et al.An elevation of serum immunoglobu⁃lin E provides a new aspect of hyperthyroid Graves'disease.J Clin En⁃docrinol Metab,2000,85(8):2775-2778.
14 Tang H,Mignon-Godefroy K,Meroni P L.The effects of a monoclonal antibody to interferon-gamma on experimental autoimmune thyroiditis (EAT):prevention of disease and decrease of EAT-specific T cells.Eur J Immunol,1993,23(1):275-278.
15 Dinarello C A.Immunological and inflammatory functions of the inter⁃leukin-1 family.Annu Rev Immunol,2009,27:519-550.
16 Dinarello C A.Blocking interleukin-1beta in acute and chronic autoin⁃flammatory diseases.J Intern Med,2011,269(1):16-28.
17 Phenekos C,Vryonidou A,Gritzapis A D,et al.Th1 and Th2 serum cyto⁃kine profiles characterize patients with Hashimoto's thyroiditis(Th1)and Graves'disease(Th2).Neuroimmunomodulation,2004,11(4):209-213.
18 Gopalakrishnan S,Sen S,Adhikari J S,et al.The role of T-lymphocyte subsets and interleukin-5 blood levels among Indian subjects with auto⁃immune thyroid disease.Hormones(Athens),2010,9(1):76-81.
Effect of Jia-Yan-Kang-Tai on Th1/Th2 Immune Cell Imbalance in Rats withAutoimmune Thyroiditis
Zhang Chengfei1,Hou Yi1,Liu Tonghua2,Sun Wen3,Wu Lili4,Qin Lingling5
(1.Dongfang Hospital of Beijing University of Chinese Medicine,Beijing 100078,China; 2.Graduate School,Beijing University of Chinese Medicine,Beijing 100029,China; 3.Key Laboratory on Traditional Chinese Medicine Health Cultivation of the Ministry of Education,Beijing 100029,China; 4.Institute of Health Cultivation,Beijing University of Chinese Medicine,Beijing 100029,China; 5.Department of Science and Technology,Beijing University of Chinese Medicine,Beijing 100029,China)
This study was aimed to explore the mechanism of Jia-Yan-Kang-Tai(JYKT)on Th1/Th2 immune cell imbalance in rats with autoimmune thyroiditis(AIT).A total of 40 Lewis rats were made into AIT rat model.Six week later,AIT rats were randomly divided into the model group,low-dose,middle-dose and high-dose JYKT group,with 10 rats in each group.Intragastric administration of deionized water,0.708 g·kg-1,1.417 g·kg-1and 2.834 g·kg-1JYKT was given to rats in each group,respectively for 8 consecutive weeks.Serum TgAb and TPOAb were detected.The ratio ofTh1 cell,Th2 cell and Th1/Th2 was measured.Contents of IL-4,IL-5,IFN-γ,TNF-α and IL-1α in plasma were detected.The pathology of thyroid tissues was observed by HE dyeing.The protein expressions of IFN-γ and IL-4 in thyroid tissues were observed under immunohistochemical staining.The results showed that high-dose JYKT group can reduce the level of TPOAb and TGAb,the incidence of thyroiditis,the ratio of Th1 cell,Th2 cell and Th1/Th2;decrease contents of IFN-γ,TNF-α,IL-1α,IL-4 and IL-5 in plasma;reduce the protein expression of IFN-γ and IL-4 in thyroid tissues.It was concluded that JYKT was able to suppress thyroid autoantibodies of AIT rats,which may be related to the regulation of cytokine level and Th1/Th2 immune cell imbalance.
Jia-Yan-Kang-Tai,autoimmune thyroiditis,rat,Th1/Th2 immune cell imbalance
10.11842/wst.2017.05.009
R96
A
(责任编辑:陈宁,责任译审:王晶)
2017-05-10
修回日期:2017-05-20
*科学技术部国家国际科技合作专项项目(2015DFA30910):中药干预桥本氏甲状腺炎活性筛选技术与组方优化研究,负责人:刘铜华。
**通讯作者:刘铜华,本刊编委,教授,博士生导师,主要研究方向:中医药防治糖尿病及并发症临床及作用机制研究。

