尖叶假龙胆乙酸乙酯部位对胰岛素抵抗HepG2细胞IRS-1、Akt的影响*
高佳琪,魏颖,屈玲霞,刘永巧,刘一冰,徐暾海**,刘铜华
尖叶假龙胆乙酸乙酯部位对胰岛素抵抗HepG2细胞IRS-1、Akt的影响*
高佳琪1,2,3,魏颖1,2,3,屈玲霞1,2,3,刘永巧1,2,3,刘一冰1,徐暾海1,2,3**,刘铜华2,3
(1.北京中医药大学中药学院北京100029;2.北京中医药大学中医养生学北京市重点实验室北京100029;3.北京中医药大学中医养生学教育部重点实验室北京100029)
目的:研究尖叶假龙胆乙酸乙酯部位对胰岛素抵抗HepG2细胞胰岛素关键信号IRS-1、Akt的基因、蛋白的影响。方法:以CCK-8法检测HepG2细胞活性;采用人肝癌HepG2细胞,并用高浓度胰岛素(10-6mol·L-1)培养HepG2细胞36 h,建立胰岛素抵抗细胞模型。根据CCK-8法结果分为正常组(Control组)、模型组(IR组)、尖叶假龙胆乙酸乙酯部位IR+50 μg·mL-1组、IR+500 μg·mL-1组及二甲双胍组,以葡萄糖试剂盒检测葡萄糖消耗量。尖叶假龙胆乙酸乙酯部位给药6 h后RT-PCR检测胰岛素抵抗HepG2细胞IRS-1、Akt基因表达;尖叶假龙胆乙酸乙酯部位给药6 h后,利用Western blot法检测IRS-1、Akt的蛋白表达。结果:尖叶假龙胆乙酸乙酯部位浓度为500 μg·mL-1时,存活率达到95%。浓度高于500 μg·mL-1时,存活率下降;与IR组比较,IR+50 μg·mL-1组与IR+500 μg·mL-1组促进胰岛素抵抗HepG2细胞葡萄糖的消耗量,但其作用不及盐酸二甲双胍组。给药6 h后与IR组比较,IR+50 μg·mL-1组与IR+500 μg·mL-1组的RT-PCR检测胰岛素抵抗HepG2细胞IRS-1、Akt的基因表达显著升高,P<0.01。给药6 h后与IR组比较,IR+50 μg·mL-1组与IR+500 μg·mL-1组的Western blot法检测IRS-1、Akt的蛋白表达显著升高,P<0.01。结论:尖叶假龙胆乙酸乙酯部位上调HepG2细胞胰岛素信号通路关键靶点IRS-1、Akt基因表达,以及IRS-1、Akt蛋白表达从而可能是其改善胰岛素抵抗作用的机制。
尖叶假龙胆乙酸乙酯部位HepG2细胞胰岛素抵抗胰岛素信号
胰岛素抵抗(Insulin Resistence,IR)是一种先于多种疾病状态的病理状态,包括高血压、肥胖病、高血脂和2型糖尿病[1,2]。胰岛素抵抗是2型糖尿病发病的主要因素,在2型糖尿病发病中起重要作用。2型糖尿病严重威胁人类健康,为了人类健康与发扬民族用药我们做了本次研究。胰岛素抵抗的特点是营养失调和葡萄糖摄取不足,存在于许多组织和器官;在分子水平表现为胰岛素与胰岛素受体结合后信号传导丢失,可以发生在肝脏、脂肪及骨骼肌组织中[3-5]。胰岛素信号传导障碍导致葡萄糖利用率降低,被认为是胰岛素抵抗发病机制中的关键因素[6]。HepG2细胞被广泛用于葡萄糖代谢、脂类代谢、胰岛素抵抗等[7,8]。因此,本研究针对胰岛素抵抗的关键病理环节选取HepG2细胞(人肝癌细胞)作为模型细胞。
尖叶假龙胆Gentianella acuta为龙胆科Gentiananceae假龙胆Gentianella草本植物。全草入蒙药,性凉、味苦。广泛分布于中国内蒙古、新疆、河北、山东、山西等省。具有清热利湿的功效,常用于治疗黄疸、头痛、发热等症状。民间多用于治疗心脏病[9]。现在药理研究表明,尖叶假龙胆主要含有三萜、口山酮类化合物[10,11],其中口山酮类化合物具有很好的抗糖尿病活性[12]。本研究以人肝癌HepG2细胞为模型,研究尖叶假龙胆乙酸乙酯部位对其胰岛素信号传导通路关键靶点基因、蛋白的影响,探讨尖叶假龙胆乙酸乙酯部位改善胰岛素抵抗的机制。
1 仪器和材料
1.1 仪器
HDL型超净工作台(北京东联哈尔仪器制造有限公司);HERA cell 150i CO2孵育箱(美国Thermo scientific公司);IX71倒置显微镜(日本Olympus公司);Sigma台式高速低温冷冻离心机(美国Sigma-Aldrich公司);Glomax multi酶标仪(美国Promega公司);R200D型分析天平(德国赛多利斯集团);电泳仪、转膜槽(美国BIO-RAD公司);ABI Prism 7500PCR扩增仪(美国应用生物系统公司);凝胶成像仪(美国BIORAD公司;ChemiDocTM XRS+with Image LabTM Software);旋转蒸发仪(瑞士Buchi公司)。
1.2 实验材料
DMEM高糖培养基(美国Gibco公司);胎牛血清(美国Corning公司);青霉素-链霉素混合液(深圳市康杰尔生物科技有限公司,批号:151116);胰蛋白酶-EDTA溶液(深圳市康杰尔生物科技有限公司,批号20161012);磷酸盐缓冲液(PBS)(深圳市康杰尔生物科技有限公司,批号:150413);胰岛素(丹麦诺和诺德制药股份有限公司,批号:J201000117);盐酸二甲双胍(中国中美上海施贵宝制药有限公司,批号:AAA2857);CCK-8(日本同仁化学研究所);葡萄糖检测试剂盒(上海Robio公司);细胞培养瓶(美国Corning公司);96孔板(美国Corning公司);GoScriptTMReverse Transcription System试剂盒(美国Promega公司);BCA蛋白定量试剂盒(美国Biomiga公司);IRS-1、Akt抗体(美国Cell Signaling Technology公司);β-actin抗体(北京普利莱基因技术有限公司、);Blocking one(日本Nacalai Tesque公司);Solution1(日本TOYOBO公司);Solution2(日本TOYOBO公司);10×TBST封闭洗涤缓冲溶液(北京普利莱基因技术有限公司);10×TBS封闭洗涤缓冲溶液(北京普利莱基因技术有限公司);分离胶缓冲液(北京普利莱基因技术有限公司);浓缩胶缓冲液(北京普利莱基因技术有限公司);葡萄糖检测试剂盒(上海Robio公司);RNA引物(上海生工生物工程股份有限公司合成)。
1.3 药材与细胞
尖叶假龙胆:产于内蒙古呼伦贝尔海拉尔为龙胆科假龙胆属植物尖叶假龙胆(Gentianella acuta Hulten)的干燥全草(北京中医药大学中药学院刘春生教授鉴定)。HepG2细胞人肝癌细胞株:北京中医药大学教育部中医养生学重点实验室保存。
2 实验方法
2.1 尖叶假龙胆乙酸乙酯部位提取物制备
尖叶假龙胆3.5 kg全草。粉碎后,室温下,加95%乙醇浸渍提取。至提取液呈微黄色,提取液用旋转蒸发器浓缩至没有醇味,得到95%乙醇浓缩液;药材残渣加70%乙醇浸渍提取,至提取液呈微黄色;回收乙醇,浓缩至没有醇味,得到70%乙醇浓缩液。将95%和70%乙醇浓缩液,分别加水悬浮,用乙酸乙酯萃取。合并,浓缩,冻干,得到乙酸乙酯部位提取物。
2.2 HepG2细胞的培养
将放于液氮中的HepG2细胞,快速在置于37℃水浴中5 min内复苏。马上移入到含有10%胎牛血清、1%青霉素-链霉素混合液的DMEM高糖培养基的细胞瓶中。置于孵育箱培养24 h。待细胞融合到80%以上时,用PBS轻轻洗涤3次;加1 mL 0.25%胰蛋白酶进行消化,再加3 mL培养基停止消化。4℃,1 000 r·min-1,离心5 min;弃去原来的培养基加新培养基进行吹打,形成细胞混悬液;移入至新的细胞培养瓶。每2天传代一次,取对数生长期的细胞进行实验。
2.3 CCK-8法细胞活性检测
取对数生长期的HepG2细胞,按每孔8 000个/mL密度接种于96孔板中,每孔100µL,每组6个复孔。待细胞贴壁以后,设置空白对照组与药物干预组。药物干预组加无血清含药DMEM高糖培养基的尖叶假龙胆乙酸乙酯部位,药物终浓度分别为1 500、1 000、500、150、100、50 μg·mL-1。每个浓度设6个复孔,加药24 h后,每孔加10 μL CCK-8,置于培养箱中反应1 h后;取出置于酶标仪中检测,波长为450 nm,读取吸光度值。计算细胞存活率:
存活率=给药组OD值/对照组OD值×100%
2.4 造模与分组给药
取对数生长期的细胞以8 000个/mL的密度接种于96孔板中,每孔100µL,每组6个复孔,置于细胞培养箱培养24 h。待细胞达到80%融合度时,移除旧培养基,用PBS轻轻洗涤3次。设置Control组与IR组、IR+50 μg·mL-1与IR+500 μg·mL-1,IR组、IR+50 μg·mL-1与IR+500 μg·mL-1加含有10-6mol·L-1胰岛素的DMEM高糖培养基(含10%胎牛血清),Control组无胰岛素,置于细胞培养箱继续培养36 h[12]。即为胰岛素抵抗HepG2细胞模型。移除旧培养基,用PBS轻轻洗涤3次;加入无血清DMEM高糖培养基后,置于细胞培养箱培养12 h。
2.5 测定葡萄糖消耗量
按“2.4”项方法,取对数生长期的细胞以8 000个/mL的密度接种于96孔板中,每孔100µL,每组6个复孔。分组给药24 h后,用PBS轻轻洗涤3次;加入无血清DMEM高糖培养基后,置于细胞培养箱培养6 h。利用葡萄糖试剂盒进行糖消耗量检测。
2.6 RT-PCR基因检测
取对数生长期的细胞以1×105个/mL的密度接种于6孔板中,每孔2 mL,每组3个复孔。分组给药6 h后,HepG2细胞用PBS轻轻洗涤3次。依照RNA提取试剂盒提取RNA;测纯度。然后进行反转录,摇匀,室温静置5 min。退火25℃5 min,延伸42℃1 h,70℃灭活15 min,得到cDNA。每管20µL反应体系:2µL cDNA稀释液(1∶45)、10µL Mix反应液、7.92µL无核酸水和0.08µL引物混合物(表1),置于PCR仪中进行反应,反应条件:95℃10 min;95℃15 s,60℃1 min(共40次循环);95℃15 s,60℃15 s溶解。
2.7 Western Blot蛋白表达
取对数生长期的细胞以1×105个/mL的密度接种于6孔板中,每孔2 mL,每组3个复孔。分组给药6 h后,用Homoginized Buffer提取总蛋白,加2×蛋白上样缓冲液100µL,100℃煮沸5 min后蛋白变性。用BCA蛋白定量试剂盒测定蛋白量。每孔20µg上样量,预电泳90 V 5 min,电泳100 V 1.5 h,预先用转膜液处理PVDF膜及滤纸45 min,再半干法凝胶转膜0.2 A 50 min,膜在1×TBS中室温摇床中清洗2次,每次10 min;Blocking one封闭2 h。分别以IRS-1、Akt、β-actin抗体(1∶1 000稀释),4℃孵育过夜。回收一抗,膜用1× TBST室温摇床中清洗3次,每次10 min;洗膜后加羊抗兔二抗(1∶20 000)室温孵育1 h。回收二抗,膜用1× TBST室温摇床中清洗3次,每次10 min;洗膜后加ECL发光液,避光反应1 min,凝胶成像系统对目的蛋白进行成像。用Image J软件进行分析蛋白灰度。
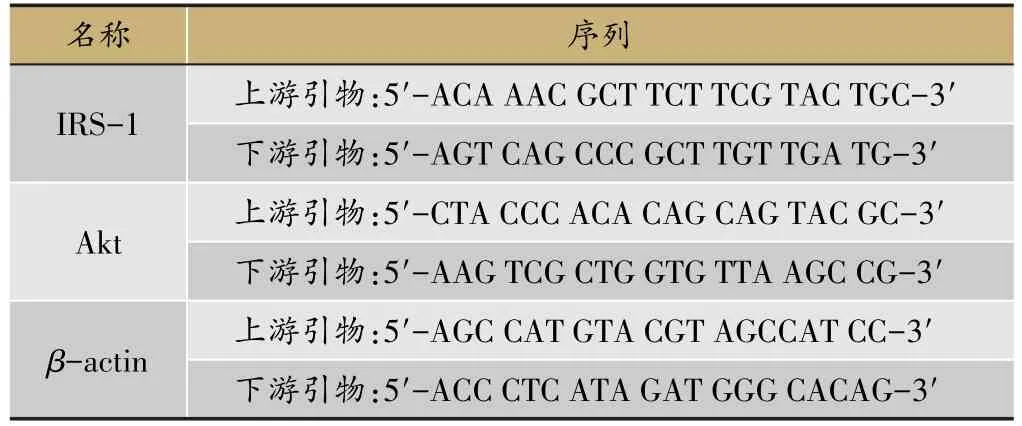
表1 IRS-1、Akt、β-actin引物合成序列
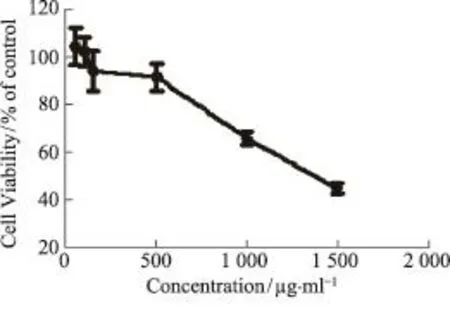
图1 尖叶假龙胆乙酸乙酯粗提物对HepG2细胞活性的影响
2.8 数据分析方法
数据处理采用SAS 8.2统计学软件进行分析,实验数据以(xˉ±s)表示。多组比较采用单因素方差分析,两组间比较采用LSD检验;P<0.05有统计学差异,P<0.01有极显著差异。
3 实验结果
3.1 尖叶假龙胆乙酸乙酯部位对HepG2细胞活性的影响
CCK-8(图1)结果显示:尖叶假龙胆乙酸乙酯部位浓度为500 μg·mL-1时,存活率达到95%;浓度低于500 μg·mL-1时,细胞存活率趋近于100%;浓度超过500 μg·mL-1时,对HepG2细胞的生长具有明显的抑制作用。且浓度越大,抑制作用越明显。所以本实验选取500和50 μg·mL-1用来进行改善胰岛素抵抗HepG2细胞的研究。
3.2 尖叶假龙胆乙酸乙酯部位对HepG2细胞葡萄糖消耗量的影响
由表2可知,与Control组比较,IR组的葡萄糖消耗量明显降低(P<0.05),说明IR组的HepG2细胞产生了胰岛素抵抗作用。与IR组比较,盐酸二甲双胍组与IR+ 500 μg·mL-1组葡萄糖消耗量极显著增大(P<0.01),细胞葡萄糖消耗量分别增加了55.4%与22.9%,IR+50 μg·mL-1组葡萄糖消耗量明显增大(P<0.05)细胞葡萄糖消耗量增加了16.4%。
3.3 尖叶假龙胆乙酸乙酯部位对HepG2细胞IRS-1、Akt mRNA表达的影响
由表3可知,与IR组比较,Control组mRNA表达显著上调(P<0.05);IR+50 μg·mL-1组与IR+500 μg·mL-1组表达也显著上调(P<0.05)。给药浓度越大,mRNA表达越显著,并呈现剂量依赖性上升。表明尖叶假龙胆乙酸乙酯部位能上调胰岛素抵抗中信号传导通路关键基因IRS-1、Akt的表达。
3.4 尖叶假龙胆乙酸乙酯部位对HepG2细胞IRS-1、Akt蛋白表达的影响
调节糖代谢的重要途径之一是胰岛素信号传导通路。其通路的关键蛋白IRS-1、Akt是其发挥作用的重要体现。由表4和图2可知,与IR组比较,Control组IRS-1、Akt蛋白表达显著上调(P<0.01);IR+50 μg·mL-1组与IR+500 μg·mL-1组IRS-1、Akt蛋白表达也显著上调(P<0.05)。给药浓度越大,蛋白表达越显著,并呈现剂量依赖性上升。表明尖叶假龙胆乙酸乙酯部位能上调胰岛素信号传导通路关键蛋白IRS-1、Akt。
4 讨论
尖叶假龙胆乙酸乙酯部位中富集了大量的口山酮类化合物[14]。现代药理研究表明,口山酮类化合物具有抗糖尿病作用。Bellidifolin给药后可以上调胰岛素受体InsRα,IRS1,PI3K蛋白,表明Bellidifolin可能通过上调胰岛素信号来改善胰岛素抵抗来发挥作用[12]。Yan Liu等[15]研究表明口山酮类化合物过氢键和π-π共轭与α-葡萄糖苷酶发生作用,来抑制α-葡萄糖苷酶活性来发挥降糖作用。现代药理研究表明对尖叶假龙胆改善胰岛素抵抗作用,其具体机理还尚不明确,需要进一步对其机理进行探究。胰岛素抵抗细胞模型的建立,为尖叶假龙胆改善胰岛素抵抗作用提供有利的保障。因为肝脏是糖代谢的主要是靶器官之一,所以选用人肝癌HepG2细胞作为细胞模型;采用高浓度胰岛素(10-6mol·L-1)诱导培养HepG2细胞36 h产生胰岛素抵抗模型,以葡萄糖试剂盒检测其对葡萄糖消耗量的影响,结果表明尖叶假龙胆乙酸乙酯部位促进葡糖糖的消耗量。但其作用不及盐酸二甲双胍。本实验CCK-8法用来筛选安全有效的药物浓度,结果提示500 μg·mL-1以下的浓度对细胞无毒性作用并且细胞存活率大于95%,这为研究关键胰岛素信号提供理论依据。
胰岛素信号传导通路中的信号分子受到阻碍或者减弱,就会导致胰岛素抵抗(IR)。IR是指外周组织和靶器官对内和(或)外源性胰岛素的反应性和敏感性降低的一种代谢状态,是2型糖尿病最主要的病理机制之一[16]。胰岛素首先与胰岛素受体(InsR)结合。InsR受体家族包括RS1、IRS2、IRS3等许多亚型,研究显示,IRS1上Ser/Thr磷酸化活性的变化是其中重要环节之一;IRS1上Ser位点磷酸化主要作为一种生理的负反馈调节抑制IRS1的活性,与IR的发生有密切关系。Akt是PI3K信号通路下游的重要靶蛋白,也与胰岛素抵抗有着密切的联系[17]。在尖叶假龙胆乙酸乙酯部位干预胰岛素抵抗HepG2细胞6 h后检测IRS1、Akt的基因表达与蛋白水平。发现尖叶假龙胆乙酸乙酯部位IR+50 μg·mL-1组与IR+500 μg·mL-1组都能上调IRS1、Akt的基因与蛋白水平,并且呈现剂量依赖性上调。表明尖叶假龙胆乙酸乙酯部位可能调节胰岛素信号通路关键因子,从而改善胰岛素抵抗的作用。

表2 尖叶假龙胆乙酸乙酯部位对HepG2细胞葡萄糖消耗量的影响(xˉ±s,n=6)
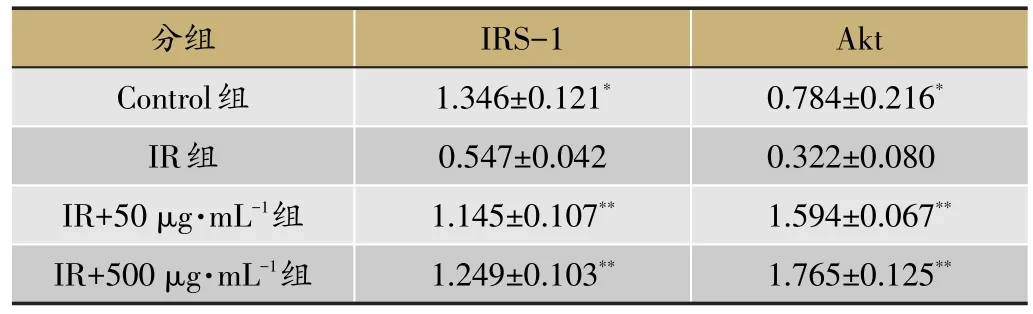
表3 尖叶假龙胆乙酸乙酯部位对HepG2细胞IRS-1、Akt mRNA表达的影响(xˉ±s,n=3)
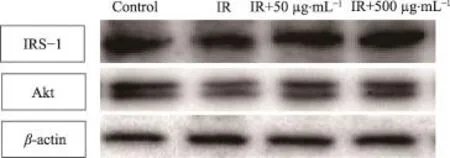
图2 尖叶假龙胆乙酸乙酯部位对胰岛素抵抗HepG2细胞IRS-1、Akt蛋白表达的影响
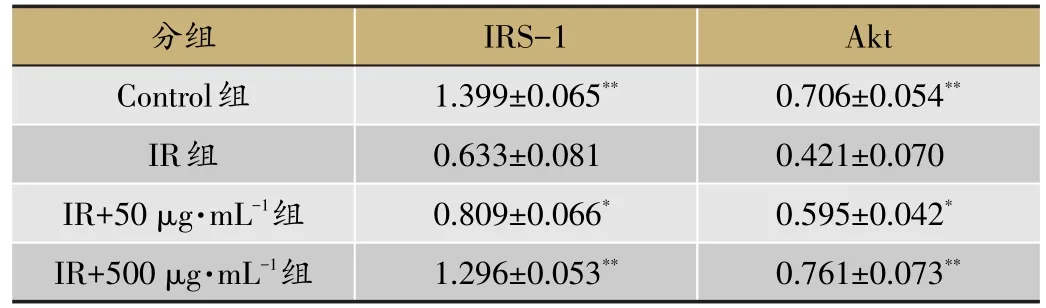
表4 尖叶假龙胆乙酸乙酯部位对HepG2细胞IRS-1、Akt蛋白表达的影响(xˉ±s,n=3)
综上所述,尖叶假龙胆乙酸乙酯部位对胰岛素抵抗HepG2细胞胰岛素信号有显著影响,上调IRS-1、Akt信号因子可能改善胰岛素作用。本研究为尖叶假龙胆在抗糖尿病领域提供一定的理论基础,为追踪分离尖叶假龙胆中的主要活性成分提供科学依据,深入的研究机理仍然缺乏,尖叶假龙胆改善胰岛素抵抗作用的机理研究有待于进一步探究。
1Cordain L,Eades M R,Eades M D,et al.Hyperinsulinemic diseases of civilization:More than just Syndrome X.Comp Biochem Physiol A Mol Integr Physiol,2003,136(1):95112.
2Xie W,Wang W,Su H,et al.Effect of ethanolic extracts of Ananas comosus L.leaves on insulin sensitivity in rats and HepG2.Comp Biochem Physiol C Toxicol Pharmacol.2006,143(4):429435.
3Mu J,Brozinick J T Jr,Valladares O,et al.Arole for AMP-activated protein kinase incontraction and hyproxia-regulated glucose transport in skeletal muscle.Mol Cell,2001,7(5):1085-1094.
4Ryder J W,Chibalin A V,Zierath J R.Intracellular mechanisms underlying increases in glucose uptakeinresponsetoinsulin orexercrises in skeletal muscle.Acta physicol scand,2001,171(3):249-257.
5Bouzakri K,Koistinen HA,Zierath JR.Molecular mechanisms of skeletal muscle insulin resistance in type 2 diabetes.Curr Diabetes Rev, 2005,1(2):167-174.
6Onoue T,Goto M,Tominaga T,et al.Reactive oxygen species mediate insulin signaltransduction in mouse hypothalamus.Neurosci Lett,2016, 619(4):1-7.
7Kahn S E,Hull R L,Utzschneider K M.Mechanisms linking obesity to insulin resistance and type 2 diabetes.Nature,2006,444(7121):840-846.
8Samuel V T,Shulman G I.Mechanisms for insulin resistance:Common threads and missing links.Cell,2012,148(5):852-871.
9乌尼尔,春亮,哈斯巴根.内蒙古呼伦贝尔地区鄂温克族民间药用植物调查.中国野生植物资源,2008,27(06):27-29+43.
10李旻辉,靳敏,张海涛,等.尖叶假龙胆化学成分研究.包头医学院学报,2011,27(02):13-14.
11 Lv L J,Li M H.Terpenoids,flavonoids and xanthones from Gentianella acuta(Gentianaceae).Biochem Syst Ecol,2009,37(4):497-500.
12Tian L Y,Bai X,Chen X H,et al.Anti-diabetic effect of methylswertianin and bellidifolin from Swertia punicea Hemsl.and its potential mechanism.Phytomedicine,2010,17(7):533-539.
13张汝学,贾正平,李茂星,等.体外胰岛素抵抗细胞模型的建立及在药物筛选中的应用.中国药理学通报,2008,24(7):971-976.
14刘洋洋.尖叶假龙胆乙酸乙酯部位化学成分研究及含量测定.北京:北京中医药大学硕士学位论文,2015.
15 Liu Y,Ma L,Chen W H,et al.Bing Mechanism and Synergetic Effects of Xanthone Derivatives as Noncompetiitive α-Glucosidase Inhibitors: A Theorertical and Experimental Study.J Phys Chem B,2013,117(43): 13464-13471.
16 Pessin J E,Saltiel A R.Signaling pathways insulin action:molecular targets of insulin resistance.J Clin Invest,2000,106(2):165-169.
17 Saltiel A R,Pessin J E.Insulin signaling pathways in time and space. Trends Cell Biol,2002,12(2):65-71.
Effects of EthylAcetate Extracts of Gentianella acuta on IRS-1 andAkt in Insulin Resistance HepG2 Cells
Gao Jiaqi1,2,3,Wei Ying1,2,3,Qu Lingxia1,2,3,Liu Yongqiao1,2,3,Liu Yibing1,Xu Tunhai1,2,3,Liu Tonghua2,3
(1.School of Chinese materia Medica,Beijing University of Chinese Medicine,Beijing 100029,China;2.Beijing Key Laboratory on Traditional Chinese Medicine Health Cultivation,Beijing University of Chinese Medicine,Beijing 100029,China; 3.Key Laboratory on Traditional Chinese Medicine Health Cultivation of the Ministry of Education,Beijing 100029,China)
This paper was aimed to study the effect of ethyl acetate extracts of Gentianella acuta on the gene and protein of insulin significant signal IRS-1 and Akt in insulin resistance(IR)HepG2 cells.The CCK-8 method was used to detect the HepG2 cell activity.HepG2 cells of human liver cancer were cultured with high concentration insulin(10-6mol·L-1)for 36 hours to establish IR cell model.According to the results of CCK-8,the control group,model(IR)group,ethyl acetate extracts of Gentianella acuta IR+50 μg·mL-1,IR+500 μg·mL-1group,and the metformin group were divided. Glucose consumption was measured with a glucose assay kit.The expressions of IRS-1 and Akt gene in IR HepG2 cells were detected by RT-PCR after 6-hour using of ethyl acetate extracts of Gentianella acuta.Western blot was used to detect the expression of IRS-1 and Akt protein after 6-hour using of ethyl acetate extracts of Gentianella acuta.The results showed that when the concentration of ethyl acetate extracts of Gentianella acuta was 500 μg·mL-1,the survival rate reached 95%.When the concentration was higher than 500 μg·mL-1,the survival rate decreased.Compared with the IR group,the IR+50 μg·mL-1group and the IR+500 μg·mL-1group promoted glucose consumption of IR HepG2 cells, but its effect was less than that of the metformin hydrochloride group.The expression of IRS-1 and Akt in IR HepG2 cells was significantly increased by using RT-PCR in the group of IR+50 μg·mL-1and IR+500 μg·mL-1compared with the IR group after 6-hour using of ethyl acetate extracts of Gentianella acuta.The expression of IRS-1 and Akt protein in the group of IR+50 μg·mL-1and IR+500 μg·mL-1was significantly higher than that in the IR group after 6-hour medication detected by western blot.It was concluded that the ethyl acetate extracts of Gentianella acuta can increase the expression of IRS-1,Akt gene,the expression of IRS-1 and Akt protein in HepG2 cells,which may be the mechanism of IR improvement.
Ethyl acetate extracts of Gentianella acuta,HepG2 cells,insulin resistance,insulin signal
10.11842/wst.2017.05.011
R96
A
(责任编辑:陈宁,责任译审:王晶)
2017-04-19
修回日期:2017-05-18
*科学技术部国际科技合作项目(2010DFB33260):中医药干预治胰岛素抵抗创新中药研究,负责人:徐暾海;北京中医药大学创新团队-中医药干预糖尿病及其并发症研究团队(2011-CXTD-19),负责人:刘铜华。
**通讯作者:通讯作者:徐暾海,教授,博士生导师,研究方向:中药活性成分及质量控制研究。

