微生物发酵技术在中药苷类生物转化中的应用进展*
马宗敏,段绪红,秦梦,黄璐琦,裴林**
微生物发酵技术在中药苷类生物转化中的应用进展*
马宗敏1,段绪红1,秦梦1,黄璐琦2**,裴林1**
(1.河北省中医药科学院浊毒证重点实验室石家庄050031;2.中国中医科学院中药研究所北京100700)
苷类是诸多中药的主要活性成分之一。近年来,因其抗炎、抗病毒、增强免疫、抗癌等药理活性的发现,苷类中药成分越来越受到研究者的重视。绝大多数苷类经肠道微生物发酵转化为苷元或低糖苷等成分发挥药效,为了提高苷类成分的生物利用度,在体外将苷类物质转化为相应活性成分,就成为十分有意义的研究课题。微生物发酵技术因其反应特异性强、副产物少、反应条件温和、清洁环保等优点在中药转化领域具有独特优势,利用微生物对苷类中药进行转化的研究大量涌现。本文对近年来微生物发酵转化中药苷类活性成分的研究进展进行展望。
苷苷元中药微生物转化
苷类成分广泛分布于众多植物体内,是人参、三七、栀子、黄芩、甘草、薯蓣、牛蒡子、桔梗、柴胡等常用中药材的主要有效成分。中药中的苷类成分有抗炎、解毒、增强免疫、保护血管等诸多功效,近年被报道有抗癌作用[1,2]。因苷类成分具有诸多重要的药理活性,越来越受到研究者的重视,但天然苷类化合物因含有糖基,分子极性大、脂溶性小、不易通过肠壁黏膜吸收,因此并不是药理活性最佳的分子结构,需要经过肠道菌群代谢转化为相应苷元、低糖苷或其他产物,使分子极性降低,脂溶性增强,才能更好地穿透肠壁进入血液循环,进而发挥药效[2]。比如,芍药苷具有抗炎、镇痛、免疫调节及抗原发性肝癌等作用[3,4],但药物直接口服后,并不能得到有效吸收,口服的芍药苷在肠道内经过肠道菌群转化成为苷元后才能更好的穿透肠壁入血,发挥药效[5]。Liu[6]等的研究发现,芍药苷在Caco-2细胞上的转运比其苷元低40倍,提示体外转化芍药苷为苷元后,其生物利用度将大大提高。杨秀伟等[7-10]以肠道菌为转化系统,研究了一系列苷类物质的肠道菌群转化,包括山柰苷、七叶树皂苷-Ia、紫花前胡苷、升麻苷等,证实了这些苷类经过肠道菌群代谢转化产生的低糖苷、甘元和其他一些产物才是真正的药效成分。
生物发酵法模拟体内微生物转化过程,在体外把药物转化为人体能迅速吸收的有效成分。在发酵转化过程中,植物组织内大多数有效成分也得到了充分地溶出和转化,大幅度提高了药物有效成分含量,进而使药效得到增强。此外,将转化后单一和几种已知有效成分直接作用于人体,有利于阐明药物在体内的吸收、运输、分布、存储、代谢等药代动力学问题,使用药机制更加明确,有利于中药的推广。
1 微生物发酵转化是中药转化的理想途径
中药的微生物转化研究开始于20世纪80年代,经过多年的发展,利用微生物发酵技术转化中药已成为中药生物技术中发展最迅速的分支之一。微生物因其易于培养、菌种资源丰富、产生的酶系强大,在中药生物转化领域备受关注[11,12]。
中药的微生物发酵转化相比化学转化具有反应特异性强(位置/立体特异性)、反应条件温和、副产物少和清洁环保等优点[13,14]。同时,微生物具有生长周期短、繁殖速度快、适应能力强、含有丰富的各类酶系等优点。因此,微生物转化技术与化学转化相比无论在转化速度还是转化质量等方面均表现出了显著优势,被广泛应用于天然药物成分的合成转化和代谢机理研究[15]。目前,中药成分的微生物发酵转化技术是人类获得结构新颖、独特、低成本、低毒性和高活性药物的重要途径之一。
2 微生物发酵转化苷类中药的机理阐述
微生物可以利用中药中的蛋白、多糖、微量元素、维生素等多种营养成分,将降解苷类物质产生的糖类作为碳源,为其发酵生长提供能量。由于微生物本身的生理特征,如若以苷类的糖作为其碳源,就相适应地被驯化诱导产生出用于代谢该种苷类的特定的酶。微生物进行自身生长繁殖等生理活动会产生的丰富而强大的酶系,这些生物酶正是微生物发酵中药过程中中药发生结构改变的物质基础,通过酶催化反应中药成分被分解转化形成新成分。通过微生物发酵技术转化中药,与一般的物理或化学方法相比可以更大幅度地改变药性,减毒增效,扩大药物适用范围,明确药物作用机理。这就是微生物可以用来发酵苷类中药的理论根据[16]。
3 苷类中药成分的微生物转化研究进展
近年来,稀有人参皂苷各种生理活性不断被发现,因其在天然植物中含量极少,使得这类成分的生物合成方法备受关注。目前,苷类中药的微生物转化主要集中在人参皂苷的转化上,其次是虎杖中白藜芦醇苷、黄芩中黄芩苷的微生物转化,甘草、栀子、薯蓣、绞股蓝、葛根中苷类有效成分的转化也有较多研究(图1)。随着研究的不断深入,研究者们的眼光也开始向其他苷类中药转移,而不仅仅是集中在人参皂苷上,芦荟苷[17]、苦杏仁苷[18]、黄芪甲苷[19]、白头翁皂苷[20,21]、洋地黄毒苷[22]等的微生物发酵转化研究也纷纷涌现。将
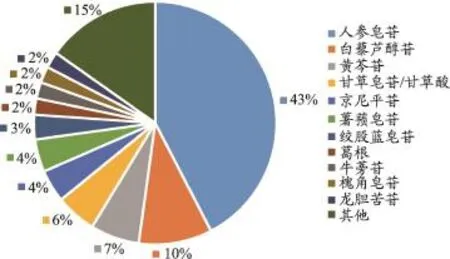
图1 2012-2016年中国知网苷类中药微生物转化研究统计
来,越来越多的领域将会被拓展,会有更多新的有效成分在生物转化领域被发现,推动天然药物中新药的开发。
用于发酵转化苷类的微生物经历了混合菌群模拟人体转化、单一已知产酶菌种转化和筛选菌种转化三个阶段,混合菌群发酵主要利用肠道菌群模拟人体环境进行转化,单一微生物绝大多数为真菌,以霉菌为主,最多使用的是黑曲霉,细菌主要是从肠道中筛选的乳杆菌等肠道菌。近年来,越来越多的研究者们开始将注意力集中到植株生境菌株或植株内生菌的选育上,药用植物内生菌在长期进化过程中与植株共存共生,在植物活性成分的代谢转化上可能具有其他来源微生物无可比拟的优势。本文将对微生物转化报道较多的中药苷类研究现状分别进行阐述并提出一些看法。
3.1 人参皂苷
人参皂苷作为人参、三七、西洋参的主要有效成分,具有广泛的药理作用。有些人参皂苷在人参中的含量很低,被称为稀有人参皂苷,如人参皂苷CK、Rg3、Rh1、Rh2等,这些稀有人参皂苷均具有独特的药理活性。
稀有人参皂苷CK是二醇型人参皂苷在人体肠道内经肠道菌的去糖基化后的主要代谢产物和吸收形式之一,它在许多方面都体现了良好的生物活性,包括抗肿瘤、抗炎、保肝和抗过敏,而且在神经系统及免疫系统方面也具有很好的调节作用[23]。人参皂苷的转化研究目标产物大都是人参皂苷CK。
高娟等[24]利用从土壤中筛选的黑曲霉Aspergillus uiger sp.J7转化人参皂苷Rb1为CK,在实验最优化的发酵转化条件下将体系放大为200 mL,选育的黑曲霉能将200 mg人参皂苷Rb1全部转化为人参皂苷CK,且不会继续水解人参皂苷为苷元,这一研究对利用单一底物转化合成人参皂苷CK很有意义。武伦鹏等[25]从人参根部土壤分离出一株真菌GH26,能有效地将人参主要皂苷Rb1转化为人参皂苷CK,在最佳转化条件下人参皂苷CK的最大转化率为76.6%。郭从亮等[26]从强入侵性植物紫茎泽兰Ageratirca adercophora中分离出一株特异性活性真菌Corciochaeta sp.,该菌株可特异性地转化三七总皂苷中的人参皂苷Rb1,获得人参皂苷Rd和稀有人参皂苷CK,发酵12天后人参皂苷的转化率高达11.62%。Zhou等[27]以提取的三七叶总皂苷为底物,利用Paecilomyces bainier发酵将其转化为人参皂苷CK,培养基和培养条件优化后,人参皂苷CK的含量由21.2%提高到72.7%。Yoo等[28]利用转基因技术对人参皂苷发酵转化进行了研究,将火球菌属菌株Pyroeo⁃ceus furiosus中的β-糖苷酶的基因转入大肠杆菌中,这种β-糖苷酶热稳定性很高,90℃都不会失活。转基因大肠杆菌经过12 h的培养后,经过简单热处理即可得到高纯度的蛋白;在实验优化的条件下,3.9 mM人参皂苷Rd转化成为人参皂苷CK的时间为1 h,转化率为82.5%,5 h之后人参皂苷Rd和CK又完全地转化为苷元APPD(原人参二醇),苷元的产量达364 mg·L-1·h-1。该研究转化率很高,具有非常重要的意义,转基因技术将会成为以后人参稀有皂苷转化研究的重要方向。
稀有人参皂苷Rh2具有明显的抗癌细胞转移作用,术后服用可加快伤口愈合和体力恢复。佟心等[29]用德式乳杆菌保加利亚亚种对人参总皂苷进行发酵转化后,得到人参皂苷Rh2。
人参皂苷F2对胃癌和肺癌细胞有抑制作用,可作为潜在开发药物[26]。许文迪等[30]利用冬虫夏草菌特异性的将人参皂苷Rb1转化为稀有皂苷F2,转化途径为Rb1→Rd→F2,转化率约为70.16%,转化效率较高,过程稳定。
3.2 白藜芦醇苷/虎杖苷
白藜芦醇是天然的多酚类抗氧化物质,最早在红葡萄酒中发现,也是虎杖药材中的活性成分,又称“虎杖苷元”。因其抗氧化、抗肿瘤、抗动脉粥样硬化等多种生物学活性,白藜芦醇被认为是治疗心血管疾病和癌症最有潜力的药物之一,是堪比紫杉醇的又一种绿色抗癌物质[31]。但是,虎杖中白藜芦醇多以苷的形式存在,需要转化为苷元才能发挥药效。张文婷等[32]利用大鼠肠内厌氧细菌对虎杖中主要单体虎杖苷进行生物转化研究,采用LC-MS/MS检测代谢产物后发现虎杖苷易被肠道内细菌所代谢,主要代谢产物为白黎芦醇,推测虎杖苷在体内被转化为白藜芦醇后发挥作用。因此,采用体外发酵法将白藜芦醇苷转化为白藜芦醇对白藜芦醇的开发利用具有重要意义。游松等[33]采用多个菌株对白藜芦醇苷进行发酵转化研究,筛选后获得一株丝状真菌Syncephalastrum racemosum 3.264,该菌能将白藜芦醇苷高效转化为白藜芦醇,纯化后白藜芦醇纯度高达98%。
近年来,很多学者对虎杖内生菌转化白藜芦醇苷生成白藜芦醇进行了研究。刘华金等[31]以虎杖煎煮水提液为底物,从虎杖根、茎中筛选出6株能转化白藜芦醇苷的内生真菌,转化率最高的一株被鉴定为草酸青霉,来自虎杖植株茎中,转化后发酵液中白藜芦醇含量达14.067 5 μg·mL-1,是为未发酵前的2.65倍。肖苏尧等[34]从虎杖新鲜植株中筛选得到一株白藜芦醇苷转化菌,该菌与卡门培尔青霉(Ehicillium camemberti)同源性高达99%,卡门培尔青霉在欧洲许多国家用于奶酪的发酵等工艺,具有很高的安全性。
韩萍萍等[35]从虎杖苷粗提物中分离得到一株产β-葡萄糖苷酶活力较高的曲霉,通过实验条件优化,白藜芦醇苷的含量提高了34.16%。许南儿等[36]从虎杖的微生物富集物中分离筛选到一株霉菌XW-2,鉴定为黑曲霉(Aspergillus niger),用其发酵粗酶液处理虎杖后白藜芦醇含量达到了9.24 mg·g-1,是未经处理虎杖中的4.1倍。
3.3 黄芩苷
常用中药黄芩主要成分是黄芩苷、其次是黄芩素、汉黄芩苷、汉黄芩素[37]。黄芩具有抗菌、抗病毒、抗氧化、免疫调节等多种作用,近年来的研究还发现黄芩具有抑制癌细胞增殖的作用[38-40]。实验表明,黄芩苷经肠道细菌代谢去糖基化成为甘元黄芩素后能够更好地吸收和发挥药效[37,38]。
刘伶文等[41,42]建立了人体肠道菌转化黄芩苷为苷元黄芩素的体外模型,并探索了转化条件,证实转化过程中起转化作用的是β-D-葡萄糖醛酸苷酶,对黄芩苷发酵液进行超声波破碎处理可促进黄芩苷转化并利于提取黄芩素。之后该课题组又采用白腐真菌对黄芩苷进行了生长细胞和静态细胞转化研究,发现生长细胞转化法可以诱导菌种表达特定的代谢酶,有利于生物转化反应的进行,并优化了生长细胞转化条件[43]。
龙厚宁等[44]利用纳豆菌液体发酵转化黄芩中的黄芩苷和汉黄芩苷成为相应甘元,在实验室优化条件下,发酵6天,黄芩中黄芩苷和汉黄芩苷的转化率分别为97.6%和97.0%。曹江叶等[45]通过研究证实蓝藻PCC7002可以对黄芩苷进行生物转化,转化后有新的产物生成,但进一步研究还未见报道。
3.4 甘草皂苷/甘草酸
甘草酸又称甘草皂苷,是甘草中最主要的活性成分,具有消炎、抗病毒、抗氧化、抗肿瘤等药理作用[46]。甘草皂苷因结构中含有两个葡萄糖醛酸基,极性较高不易吸收,如若分子中的糖醛酸基水解去除一个就可以减少它的极性,增强分子穿透性,提高在血液中的浓度以更好地发挥药效[47]。全艳玲等[47,48]从甘草切片中选育出甘草生物转化菌黑曲霉IS254,能够将甘草酸转化成甘草次酸;之后张丽娜[46]等又以黑曲霉IS254为初始菌株,通过紫外诱变筛选出β-葡萄糖醛酸苷酶高产的黑曲霉菌株,定向作用于甘草皂苷,使其脱去一分子葡萄糖醛酸基,转化率达22.44%,为原始黑曲霉菌株的6.5倍。
张琴等[49]从甘草中筛选出高产β-葡萄糖苷酶的菌株GF10和GF19,能够将甘草皂苷水解成苷元,转化后其抗氧化活性和对DPPH自由基的清除率都得到了显著提高。
3.5 京尼平苷
栀子是中医临床治疗黄疸肝炎的首选药,京尼平是栀子中起主要作用的药效成分,具有泻火除烦、清热利尿、凉血解毒等功效,栀子中京尼平的含量很低,仅为为5-10 g·kg-1,而其前体京尼平苷在栀子中含量高达30-50 g·kg-1[50]。近年来的研究证实京尼平具有抗肿瘤、治疗肝硬化等多种功效[51],具有良好的开发前景。将栀子中京尼平苷转化为甘元京尼平将大大提高栀子的药用价值。
董悦生等[52]利用哈茨木霉CGMCC2979直接转化药材,将栀子中的京尼平苷转化为京尼平,无需糖苷酶和京尼平苷的制备,48 h京尼平苷的转化率为97.8%。转化后的京尼平通过XAD-16N大孔树脂偶联硅胶柱色谱,制备得到纯度大于95.0%的京尼平,收率为62.3%。该研究提供了一种简便、高效制备京尼平的方法。
赵平等[53]利用产β-葡萄糖苷酶的邬衣黑曲霉发酵京尼平苷生产京尼平,在自然pH下,通过优化实验条件,京尼平苷的转化率可达99%以上,转化产物京尼平纯度可达98%以上,该研究具有一定的工业化应用潜力。
赵东等[54]从土壤中筛选出一株产β-葡萄糖苷酶黑曲霉,直接以栀子粉为发酵转化底物,栀子粉含量10%条件下发酵96 h,京尼平的微生物转化率达到22%。这种直接用微生物转化中药原粉的方法简化了京尼平的生产工艺,可大大降低生产成本。
3.6 薯蓣皂苷
薯蓣皂苷是两分子鼠李糖基通过一分子吡喃葡萄糖基与薯蓣皂苷元连接形成的,薯蓣皂苷口服后经肠道菌群转化成为薯蓣皂苷元发挥药理作用[55]。薯蓣皂苷元也是合成甾体激素类药物的重要原料,应用前景广阔。但薯预皂苷元的平均含量很低,用微生物转化薯蓣皂苷为苷元是近年来开发薯蓣皂苷元的新途径。
张佳佳等[56]首次报道了赤霉菌Gibberellainterme⁃dia WX12(层出镰孢菌Fusarium proliferatum的有性阶段)转化黄姜中的皂苷为薯蓣皂苷元,该菌筛选自作者实验室保藏的菌种,经过条件优化后赤霉菌WX12转化薯蓣皂苷元的得率提高到(31±0.3)mg·g-1干黄姜。雷晶等[57]从自来水中筛选得到能水解黄姜皂苷产生薯蓣皂苷元的烟曲霉,该报道中的烟曲霉粗酶热稳定性高于其他耐热性β-糖苷酶,具有明显优势。
巧克力火锅的食用方法与奶酪火锅类似。传统做法是将巧克力掰成小块,再加入一些甜酒(如樱桃酒、橘子酒等)、淡奶油,用小火慢慢加热,直至巧克力融化,然后就可用叉子插着切成块的水果蘸着巧克力酱食用了。这样的吃法十分有趣,巧克力酱在水果表面凝固后变得清脆可口,有些像中国的糖葫芦,既甜蜜又爽口。对于爱吃甜食的女孩子来说,这道巧克力火锅简直是大爱。
李长田等[58]从穿龙薯蓣D.hippohica中分离获得少根根霉原变种R.arrhizus var.arrhizus发酵穿龙薯蓣生产薯蓣皂苷元,工艺简单,总薯蓣皂苷元得率较高。陈宇[59]从盾叶薯蓣干燥根茎中筛选出3株菌,均能够发酵转化甾体总皂苷生成薯蓣皂苷元,混合菌发酵实验结果显示以泡盛曲霉和No.2.20140425为混合发酵菌种转化甾体总皂苷的转化率效率最高,在实验优化条件下,甾体总皂苷的转化率达到71.57%。
3.7 其他苷类
陈良华等[60,61]先后研究了黑曲霉、构巢曲霉和灰绿曲霉对福建绞股蓝皂苷的发酵转化,转化后产物抗癌效果增强,对蘑菇酪氨酸酶抑制作用和DNA氧化损伤保护作用减弱,该研究为利用微生物转化法筛选抗癌绞股蓝皂苷奠定了基础。
葛根素是葛根的主要有效成分,但其水溶性差,很难注射给药。首尔国立大学Li等[62]利用能够产生麦芽糖淀粉酶的嗜热脂肪芽孢杆菌(Bacillusstearo ther⁃mophilus)对葛根素进行微生物转化,得到α-D-葡萄糖基-(l→6)-葛根素和α-D-麦芽糖基-(l→6)-葛根素两种主要产物,溶解度分别是葛根素的14倍和168倍,大大提高了水溶性。宋艳秋等[63]从红曲米中选育出一株能够转化葛根的丝状真菌YM3207并鉴定为紫色红曲霉Monascus purpureus,转化产物中染料木素和葛根素含量提高,抑菌活性增强。后期研究[64]将产物鉴定为染料木素,β-胡萝卜苷和葛根素。
龙胆苦苷是条叶龙胆、龙胆、秦芜等龙胆科植物的主要活性成分,具有促进胃排空和肠蠕动、保肝、抗氧化、抗炎等药理活性作用。龙胆苦苷在植物内生真菌和人体肠内菌作用下可以转化成龙胆碱,龙胆碱的某些药理作用强于龙胆苦苷[65]。目前对龙胆碱的生物转化主要目的是发现新的药效成分。黄元元等[66]采用非恒定温度的培养方法,研究5种真菌对底物龙胆苦苷的生物转化。结果证明,黑曲霉、米根霉、少根根霉、酿酒酵母YS58和毕赤酵母GS115均能转化龙胆苦苷。通过GC-MS定性分析,黑曲霉、米根霉、少根根霉以及毕赤酵母GS115的转化产物之一确定为龙胆酸。与龙胆苦苷相比,转化产物龙胆酸同样具有抗炎药理作用,并且无毒副作用。许丹[67]从北极高纬地区土壤及海洋沉积物中筛选到一株产β-葡萄糖苷酶的青霉属真菌Penicillium sp.C-5,利用该菌对龙胆苦苷进行发酵转化,通过LC-MS和NMR等对分离得到的转化产物进行分析,得到一种天然产物并获得了一种新化合物。
近年来研究发现,牛蒡甘元具有抗炎、抗病毒、抗肿瘤、调节免疫等多种功效[68-70]。牛蒡苷是中药牛蒡子主要药效成分,研究发现牛蒡子苷经肠道微生物代谢为苷元后被人体吸收,发挥药效[71]。欧志敏等[72]采用黑曲霉CGMCC No.2594发酵产生的β-葡萄糖苷酶酶液水解牛蒡子苷制备牛蒡子苷元,牛蒡子苷元的最高产率可以达到94.7%。陆征[73]以筛选得到的两株霉菌(泡盛曲霉变种和里氏木霉)联合对牛蒡子粉进行发酵炮制,将牛蒡子粉中的牛蒡苷成功转化为牛蒡苷元,在实验最佳发酵工艺条件下,转化率达97.8%,纯化得到牛蒡苷元晶体纯度高于99%。他们还对牛蒡甘元的抗肿瘤机制进行了研究,发现其主要通过诱导肿瘤细胞凋亡来抑制肿瘤细胞的增殖,该研究认为牛蒡苷元是一种极具开发潜力的抗肿瘤化合物。
4 总结与展望
近年来,微生物转化中药成为了一个较热的研究领域,苷类中药的微生物转化主要集中在将苷转化为低糖苷或苷元,以更利于人体吸收并发挥药效,也有部分研究将苷类代谢为其他物质,目的在于发现新的药效化合物。虽然研究者们更多地将目光投向这一领域,但是由于交叉学科需要在两个研究领域都有较深造诣,深入研究取得成果还有很远的路要走。现阶段的研究主要停留在实验室阶段,以菌种的选育最为常见,但多数研究者选育出菌种,在实验室做了一定的转化条件优化后,都没有进一步的研究报道。微生物发酵的小试、中试、放大培养,产物的分离纯化等向工业化迈进的实质性研究进展鲜见报道。关于微生物发酵转化在苷类中药活性成分转化中的应用需要着力解决的问题主要在以下几方面:
菌种的选育是目前主要的研究报道内容,也是苷类中药转化的基础所在。选育出优良的菌种才能够在后期的研究中事半功倍。苷类转化的菌种目前主要有3个来源:①从已知产糖苷酶的菌种中针对特定苷类选育优良转化菌种;②从药用植物生长环境或药材粉末霉变物中选育转化菌种;③近年来研究报道较多的从植株有机体内筛选分离内生菌,内生菌作为植株的一个不可分离的部分,与植株共同进化生长,在药用植物有效成分的转化上具有其他微生物无法比拟的优势。此外,随着生物技术的发展,转基因菌株的构建、诱导突变菌株等都将助推高效转化菌株的选育。
苷类中药发酵转化的转化体系稳定性是扩大生产的关键一步,只有稳定的转化体系才有利于放大培养,保持较高转化率。当前实验条件下转化的体系多在游离状态下进行,缺乏稳定性,开发固定化的培养转化体系,将有利于解决这一难题。
转化产物的高效、快速、廉价分离是整个发酵转化技术的又一关键,有了高效的菌种,稳定的转化体系,产物的分离手段是降低生产成本的主要技术所在,针对特定产物结构开发合理的低成本分离手段,将会推进微生物发酵转化中药走向工业化进程。
1吴立军.天然药物化学(第6版).北京:人民卫生出版社,2011.
2柯仲成,杨楠,侯雪峰,等.大鼠肠道菌群对芍药苷体外代谢转化的研究.中国中药杂志,2016,41(20):3839-3845.
3刘陶世,赵新慧,段金廒,等.芍药甘草汤总苷抗炎镇痛作用的配伍研究.中药新药与临床药理,2007,18(6):427-430.
4晏雪生,李瀚曼,彭亚琴,等.芍药苷对人肝癌细胞HepG-2调亡及其调控基因的影响.中华中医药学刊,2007,25(7):1346-1347.
5He J X,Goto E,Akao T,et al.Interaction between Shaoyao-Gancao-Tang and a laxative with respect to alteration of paeoniflorin metabolism by intestinal bacteria in rats.Phytomedicine,2007,14(7-8):452-459.
6Liu Z Q,Jiang Z H,Liu L,et al.Mechanisms responsible for poor oral bioavailability of paeoniflorin:Role of intestinal disposition and interac⁃tions with sinomenine.Pharm Res,2006,23(12):2768-2780.
7杨秀伟,张建业,徐嵬,等.山柰苷的人肠内细菌生物转化研究.药学学报,2005,40(8):717-721.
8杨秀伟,赵静,崔景荣,等.七叶树皂苷-Ia的人肠内细菌生物转化产物及其抗肿瘤活性研究.北京大学学报(医学版),2004,36(1):31-35.
9Zhang P,Yang X W.Biotransformation of nodakenin and simultaneous quantification of nodakenin and its aglycone in incubated system of hu⁃man intestinal bacteria by HPLC.J Asian Nat Prod Res,2009,11(4): 371-379.
10 Zhao B,Yang X B,Yang X W,et al.Biotransformation of prim-O-gluco⁃sylcimifugin by human intestinal flora and its inhibition on NO produc⁃tion and DPPH free radical.J Asian Nat Prod Res,2012,14(9):886-896.
11 Demain A L,Adrio J L.Contributions of microorganisms to industrial bi⁃ology.Mol Biotechnol,2008,38(1):41-55.
12杨红亚,吴少华,王兴红,等.开展中药生物转化研究意义深远.中草药,2004,35(12):1321-1324.
13 Dordick J S,Clark D S.Biocatalysis and biotransformation.Curr Opin Chem Biol,2002,6(2):123-124.
14郑丽娜,张明春.中药有效成分的酶法生物转化.时珍国医国药, 2010,21(10):2556-2558.
15 Li M X,Zhu H Y,Yang D H,et al.Production of secoisolariciresinol from defatted flaxseed by bacterial biotransformation.J Appl Microbio, 2012,113(6):1352-1361.
16徐萌萌,王建芳,徐春,等.微生物转化苷类中药的机理及应用.世界科学技术-中医药现代化,2006,8(2):24-27.
17牛艳丰.代谢芦荟苷微生物的筛选及其酶的反应条件研究与纯化.上海:华东理工大学硕士学位论文,2013.
18常军.黑曲霉粗酶液对苦杏仁苷的生物转化研究.湖北农业科学, 2012,51(2):377-379.
19陈丽艳,李月,王昶,等.黄芪经侧耳菌发酵后黄芪甲苷和毛蕊异黄酮葡萄糖苷的转化.中华中医药学刊,2013,31(10):2194-2197.
20周成,时维静,肖新,等.一株生物转化白头翁皂苷真菌的筛选与鉴定.安徽科技学院学报,2016,50(2):22-26.
21曹体爽,刘廷强,王东明,等.生物转化法制备白头翁皂苷A3.大连工业大学学报,2014,33(1):18-20.
22骆健美,宋霆,朱凤芝,等.赭曲霉转化洋地黄毒苷的工艺优化和产物活性分析.天然产物研究与开发,2015,27:398-403.
23张阳,林毅.酶法转化二醇型人参皂甙Rd及制备稀有人参皂甙CK.华侨大学学报(自然科学版),2011,32(6):668-671.
24高娟,周安东,原野,等.黑曲霉降解人参皂苷Rb1制备稀有皂苷Compound K.生物技术进展,2016,6(2):98-104.
25武伦鹏,白龙律,韩春峰,等.微生物转化人参主要皂苷Rb1为C-K的研究.人参研究,2016,28(2):7-11.
26郭从亮,杨晓艳,陈子明,等.一株植物内生菌Conzochaeta sp.对三七总皂苷中人参皂苷Rb1的特异性转化含量测定.中药材,2016,39 (5):1075-1078.
27 Zhou W,Yan Q,Li J Y,et al.Biotransformation of Panax notoginseng saponins into ginsenoside compound K production by Paecilomyces bain⁃ier sp.229.J Appl Microbiol,2008,104(3):699-706.
28 Yoo M H,Yeom S J,Park C S,et al.Production of aglycon protopanaxa⁃diol via compound K by a thermostable β-glycosidase from Pyrococcus furiosus.Appl Microbiol Biotechnol,2011,89(4):1019-1028.
29佟心.一种人参皂苷Rh2的制备方法.中国:CN 102154428 A,2011-08-17.
30许文迪,闫炳雄,邱智东,等.冬虫夏草菌生物转化人参皂苷Rb1的研究.科学技术与工程,2015,15(31):12-17.
31刘华金,易有金,杨建奎,等.转化白藜芦醇苷虎杖内生真菌的分离和鉴定.食品科学,2012,33(11):172-176.
32张文婷,黄琴伟,向智敏,等.大鼠肠道菌对虎杖苷的生物转化研究.中国药学杂志,2012,47(8):631-634.
33游松,尤凯,王旭,等.白藜芦醇苷的提取纯化及其生物转化.沈阳药科大学学报,2009,26(4):312-315.
34肖苏尧,彭维,李赟,等.虎杖中白藜芦醇生物转化菌的筛选及鉴定.现代食品科技,2012,28(7):749-752.
35韩萍萍,祝旭君,陈虹.微生物转化虎杖苷生成白藜芦醇的研究.浙江树人大学学报(自然科学版),2012,12(1):25-28.
36许南儿,罗榴彬,梅建凤,等.生物转化法提高虎杖中白藜芦醇的含量.药物生物技术,2012,19(5):411-413,426.
37刘伶文,司磊,任树勇,等.人肠道菌对黄芩苷的生物转化.天然产物研究与开发,2012,24:1437-1440,1392.
38徐君.黄芩-黄连药对与肠道菌群的相互作用研究.南京:南京中医药大学硕士学位论文,2014.
39 Shinichi I,Kaiunobu S,Naomasa Y,et al.Antitumor effects of scutellari⁃ae radix and its components baicalein,baicalin,and wogonin on bladder cancer cell lines.Urology,2000,55(6):951-955.
40孙吉平.黄芩苷抑制大鼠胰岛细胞瘤细胞株增殖的分子机制研究.中国中西医结合杂志,2006,26(4):337-340.
41 Mortia M,Takahashi I,Kanai M,et al.Baicalein 5,6,7-trimethyl ether, a flavonoid derivative,stimulates fatty acid beta-oxidation in skin fibro⁃blasts of X-linked adrenoleukodystrophy.FEBS Lett,2005,579(2):409-414.
42刘伶文,司磊.超声波对黄芩苷生物转化的影响.西安工程大学学报,2012,26(1):36-40.
43杨希,刘伶文,王璐倩,等.白腐真菌转化黄芩苷生成黄芩素的研究.西安工程大学学报,2015,29(1):57-61.
44龙厚宁,张硕,姚磊,等.纳豆菌液体发酵转化黄芩苷和汉黄芩苷的工艺研究.中国中药杂志,2015,40(23):4623-4628.
45曹江叶,陈斌,刘永刚,等.蓝藻PCC7002对黄芩苷的生物转化研究.药物生物技术,2016,23(5):393-396.
46张丽娜,明有山,肖艺,等.紫外诱变黑曲霉微生物转化甘草皂苷.辽宁科技大学学报,2016,39(2):126-129.
47刘贻胜.单葡萄糖醛酸甘草次酸的微生物转化及分离纯化.鞍山:辽宁科技大学硕士学位论文,2014.
48全艳玲,刘贻胜,徐云剑,等.甘草生物转化菌种选育.中国酿造, 2013,32(4):123-125.
49张琴,李艳宾,李华.产β-葡萄糖苷酶甘草内生菌的筛选及对甘草黄酮转化的研究.食品科学,2013,34(1):194-198.
50付小梅,周光雄,葛菲,等.栀子类药材的研究概况及展望.中国野生植物资源,2001,20(2):24-26,30.
51 Inao M,Mochida S,Matsui A,et al.Japanese herbal medicine inchinko-to as a therapeutic drub for liver fibrosis.J Hepatol,2004,41(4): 584-591.
52董悦生,刘乐平,包永明,等.哈茨木霉CGMCC2979生物转化栀子中的京尼平苷制备京尼平.催化学报,2014,35(9):1534-1546.
53赵平,杨光,邹积宏.京尼平苷微生物转化生产京尼平的研究.安徽农业科学,2016,44(26):98-101.
54赵东,荆玮,姚盟成,等.京尼平的微生物转化及其交联特性的测定分析.生物技术通报,2012,7:146-151.
55马海英,赵志涛,王丽娟,等.薯蓣皂苷元和黄山药总皂苷抗高脂血症作用比较.中国中药杂志,2002,27(7):528-530.
56张佳佳,李会,李恒,等.高效转化黄姜皂苷为薯蓣皂苷元菌株的筛选及转化条件优化.生物工程学报,2013,29(6):848-852.
57雷晶,黄文,李天宏.黄姜皂苷水解烟曲霉的分离及其β-糖苷酶性质初探.北京大学学报(自然科学版),2011,47(5):929-934.
58李长田,田凤华,李江楠,等.少根根霉原变种发酵生产薯蓣皂苷元.菌物学报,2012,31(5):754-761.
59陈宇.薯蓣皂苷元的微生物发酵法制备及其体外抗氧化活性的研究.广州:华南理工大学硕士学位论文,2015.
60陈良华,郑志忠,明艳林,等.福建绞股蓝真菌转化及其产物抗癌活性研究.亚热带植物科学,2014,43(3):192-196.
61陈良华,翁梦婷,秦江,等.灰绿曲霉对绞股蓝皂苷的微生物转化及其生物活性.厦门大学学报(自然科学版),2016,55(5):775-780.
62 Li D,Park S H,Shim J H,et al.In vitro enzymatic modification of puera⁃rin to puerarin glycosides by maltogenic amylase.Carbohydr Res,2004, 339(17):2789-2797.
63宋艳秋,陈有为.中药葛根微生物转化菌株的鉴定及转化特性的研究.大理学院学报,2015,14(12):64-68.
64宋艳秋,陈有为.葛根的红曲霉转化产物化学成分分析.天然产物研究与开发,2013,25(11):1525-1528.
65匡海学,吴高松,刘华,等.龙胆苦苷和龙胆碱的生物转化和药理活性研究进展.天津中医药,2016,33(7):385-389.
66黄元元,陈光,皮新梅,等.真菌对龙胆苦苷的生物转化研究.长治医学院学报,2013,27(2):90-93.
67许丹.高纬北极真菌应用于龙胆苦苷转化的筛选及其转化产物研究.上海:华东理工大学,2012.
68 Tsai W J,Chang C T,Wang G J,et al.Arctigenin from Arctium Lappa inhibits interleukin-2 and interferon gene expression in primary human T lymphocytes.Chin Med,2011,6(1):12-15.
69黄栋栋,孟易禹,孙栋勋,等.牛蒡子苷元诱导人鼻咽癌CNE-1细胞凋亡及其作用机制.中国病理生理杂志,2016,32(1):101-105.
70李晓梅,苏勤勇,关永霞,等.牛蒡子苷元对实验性胃溃疡的保护作用及其机制探讨.中药药理与临床,2015,31(5):47-50.
71姜洪帅,窦德强.肠道微生物对牛蒡苷的转化及转化酶的初步研究.中国现代中药,2014,16(1):9-11.
72欧志敏,严琴英,杨根生.生物转化法水解牛蒡子苷制备苷元.浙江工业大学学报,2009,37(6):629-633.
73陆征.牛蒡苷元的制备及其抗肿瘤作用机制.武汉:华中农业大学博士学位论文,2015.
Microbial Transformation of Glycosides in Chinese Herbal Medicine
Ma Zongmin1,Duan Xuhong1,Qin Meng1,Huang Luqi2,Pei Lin1
(1.Key Laboratory of Zhuo-Du Syndrome,Hebei Provincial Academy of Traditional Chinese Medicine,Shijiazhuang 050031,China; 2.Institute of Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China)
Glycosides are the active ingredients(AIs)of many Chinese herbs and have become hot spots along with the findings of their new functions,such as anti-inflammatory,antivirus,enhanced immunity and anti-cancer.It has been found that glycosides exert their effects by converting to aglycons or other AIs in vivo.Therefore,the transformation of glycosides to the corresponding AIs in vitro becomes very important to enhance their bioavailabilities.The microbial transformation has an unparalleled advantage in the transformation of Chinese herbs in vitro for its reaction specificity, less by-products,mild reaction conditions and environmental protection.This paper summarized and prospected researches of glycosides'microbial transformation.
Glycoside,aglycon,Chinese herbal medicine,microbial transformation
10.11842/wst.2017.05.025
R932
A
(责任编辑:马雅静,责任译审:王晶)
2017-03-10
修回日期:2017-04-28
*中央本级重大增减支项目(2060302):名贵中药资源可持续利用能力建设,负责人:黄璐琦、裴林;河北省中医药管理局科研计划项目(2015087):黄芩内生菌的分离及其对黄芩生物转化研究,负责人:马宗敏。
**通讯作者:黄璐琦,本刊编委,中国工程院院士,研究员,博士生导师,主要研究方向:分子生药学,中药资源学;裴林,教授,博士生导师,主要研究方向:中医内科学,中药学。

