HDAC1在调控乳腺癌MCF-7细胞p21WAF1/CIP1转录过程中与ERα的协同作用
邹 丹, 冯秀艳,周伟强
(沈阳医学院1.病理生理学教研室、2.辽宁省环境污染与微生态重点实验室,辽宁 沈阳 110034)
HDAC1在调控乳腺癌MCF-7细胞p21WAF1/CIP1转录过程中与ERα的协同作用
邹 丹1, 冯秀艳2,周伟强2
(沈阳医学院1.病理生理学教研室、2.辽宁省环境污染与微生态重点实验室,辽宁 沈阳 110034)
目的研究乳腺癌MCF-7细胞中组蛋白去乙酰化酶1(histone deacetylases 1,HDAC1)、雌激素受体α(estrogen receptor α,ERα)共同募集于p21WAF1/CIP1启动子特定区域,调控其转录活性的具体作用位点,同时明确辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)及瘦素(Leptin)在调节p21WAF1/CIP1启动子功能中的作用机制。方法将处于对数生长期的乳腺癌MCF-7细胞在无血清培养基中饥饿24 h后,分别用20 μmol·L-10.88 μL SAHA (SAHA组)、0.625 nmol·L-110 μL Leptin(Leptin组)处理24 h,对照组(Basal组)细胞培养在完全型RPMI 1640培养基中。各组细胞裂解液先后与HDAC1抗体及ERα抗体进行染色质免疫共沉淀(chromatin-immunoprecipitation, ChIP)孵育,收集纯化结合HDAC1及ERα抗体的DNA片段,应用Real-time PCR法检测p21WAF1/CIP1启动子区从转录起始位点(transcription start site, TSS)到其上游(+2~-4 000 bp) f1~f10片段的DNA相对表达量,并用2-△△CT法分析。结果Basal组中,HDAC1、ERα抗体在p21WAF1/CIP1启动子区f1、f8片段有高亲和力。SAHA 组中,HDAC1、ERα抗体与p21WAF1/CIP1启动子区f1、f8片段结合量明显低于对照组,而在Leptin组两片段与HDAC1、ERα抗体结合量明显高于对照组。结论乳腺癌MCF-7细胞增殖过程中,细胞增殖信号可招募HDAC1、ERα至p21WAF1/CIP1启动子区。该启动子区上游0~-400 bp,-2 800~-3 200 bp DNA片段是与HDAC1、ERα共同作用的靶功能区。
乳腺癌; MCF-7细胞;p21WAF1/CIP1;组蛋白去乙酰化酶1;雌激素受体α;辛二酰苯胺异羟肟酸;瘦素
乳腺癌是常见女性恶性肿瘤,其中70%的患者为雌激素受体α(estrogen receptor α,ERα)阳性。ERα阳性的乳腺癌MCF-7细胞,其生长与增殖主要受ER信号系统驱动,此信号系统亦可被瘦素(Leptin)信号系统所激活[1]。女性体内瘦素水平增加,其患高恶性、低分化且预后不良的乳腺癌几率大大增加[2]。p21WAF1/CIP1是细胞周期依赖性蛋白激酶抑制剂,可使细胞周期停滞、促进细胞凋亡并抑制癌细胞的转移和侵袭。本研究的前期工作证实,瘦素处理后的小鼠乳腺癌4T1细胞p21WAF1/CIP1mRNA及蛋白表达水平远远低于瘦素未处理组细胞[3]。组蛋白去乙酰化酶1 (histone deacetylases 1,HDAC1)使组蛋白去乙酰化,可与一些调控肿瘤发生发展的基因启动子区结合,抑制这些基因的转录。辛二酰苯胺异羟肟酸 (suberoylanilide hydroxamic acid,SAHA)是目前已知最经典的HDAC抑制剂(histone deacetylase inhibitor, HDACi)之一, 可抑制组蛋白去乙酰化酶活性,通过上调p21WAF1/CIP1引起细胞周期阻滞于G1期而抑制细胞增殖[4]。本实验旨在寻找HDAC1及ERα共同募集于p21WAF1/CIP1启动子区,调控其转录活性的具体作用位点,明确SAHA及瘦素在调节p21WAF1/CIP1启动子功能过程中的分子机制。
1 材料与方法
1.1材料人乳腺癌细胞株MCF-7(美国ATCC细胞库),SAHA(Sigma), Leptin(Sigma), 完全型RPMI 1640培养液(Thermo), 改良型RPMI 1640培养液(Thermo), 磷酸盐缓冲液1×(Thermo), 0.25%胰酶-EDTA(Gibco), 89890 ZebaTM脱盐离心柱(Thermo),PierceTMAgarose ChIP试剂盒(Thermo), HDAC1及ERα抗体(Abcam), Power SYBR®Green PCR Master Mix(Life technologies), p21WAF1/CIP1f1~f10引物(上海生工生物工程有限公司)。 超净工作台(Thermo)、CO2恒温细胞培养箱(Thermo), Biofuge 28RS低温高速离心机(Heraeus), 倒置显微镜(Olympus), SK-D1807-E 摇床(Scilogex), 恒温混匀器(Eppendorf), 7500 Real-time PCR仪(Life technologies)。
1.2方法
1.2.1细胞培养 将MCF-7细胞接种在完全型RPMI 1640培养液(10%胎牛血清,青霉素、链霉素100 kU·L-1)中,37℃、5% CO2孵箱饱和湿度条件下贴壁传代培养,每2~3 d换液并传代1次。0.25%胰酶-EDTA消化。经2~3次传代,取对数生长期的细胞等量分成3组,分别接种于完全型RPMI 1640培养液中,24 h后,再将细胞置于改良型RPMI 1640培养液中进行同步化处理24 h。此后,将3组细胞分别定义为SAHA组(完全型RPMI 1640培养液10 mL+20 μmol·L-1SAHA 0.88 μL)、Leptin组(完全型RPMI 1640培养液10 mL+0.625 nmol·L-1Leptin 10 μL)、Basal对照组(等量完全型RPMI 1640培养液)。
1.2.2先后使用HDAC1及Eα抗体经两次ChIP(即ChIP-on-ChIP)方法处理样品 MCF-7细胞的甲醛交联及细胞团的分离;细胞溶解及MNase 消化,每组样品各得到50 μL的MNase 消化产物,留取5 μL -20℃保存作为内对照,45 μL进行下一步的免疫沉淀处理,免疫沉淀过程中需向每个ChIP样品加入HDAC1抗体10 μg;HDAC1抗体-组蛋白-DNA免疫沉淀洗脱:向免疫沉淀物中加入150 μL 1×IP洗脱液,室温振荡孵育30 min,再加入150 μL 1×IP洗脱液,室温振荡孵育10 min。3 000×g2 min离心收集洗脱下来的免疫沉淀物,将洗脱复合物置于到经1×IP稀释液预处理的Zeba脱盐洗脱柱上(参见操作手册),1 000×g离心2 min收集样品。向各组样品中加入1×IP稀释液至500 μL,加入Eα抗体7.5 μg,进行再次免疫沉淀(参见操作手册),最终3组MCF-7细胞均获得使用HDAC1及Eα抗体进行2次ChIP得到的DNA及各自的内对照。
1.2.3Real-time PCR 检测各组p21WAF1/CIP1f1~f10片段的DNA相对表达 PCR反应体系为25 μL:DNA 1.5 μL,上、下游引物各0.75 μL,PCR Master Mix 12.5 μL, ddH2O 9.5 μL。反应条件为: 50℃ 2 min ,95℃ 10 min预变性, 95℃ 15 s, 60℃ 1 min, 共40个循环。每个样品3个复孔,采用2-△△CT法计算各组DNA的相对表达量。p21WAF1/CIP1启动子区的10个片段的引物序列为:f1:Forward 5′-TCCTCCTGGAGAGTGCCAAC-3′,Reverse 5′-TTGGTGCGCTGGACACATTT-3′;f2:Forward 5′-TTCCCGGAAGCATGTGACAA-3′,Reverse 5′-GCACCTGGAGCACCTAG ACACC-3′;f3:Forward 5′-CCCGTTTCCCCAGCAGTGTA-3′,Reverse 5′-GCCAGGAAGGGGAGGATTTG-3′;f4:Forward 5′-AGGCCAAGGGGGTCTGCTAC-3′,Reverse 5′-CGGGGAGGACAGGCTTCTTT-3′;f5:Forward 5′-TGAAAGCAGAGGGGCTTCAA-3′,Reverse 5′-ACCATCCAAAGGGCTGGTTG-3′;f6:Forward 5′-TGTCCTTGGGCTGCCTGTTT-3′,Reverse 5′-AGCCCTGTCG CAAGGATCTG-3′;f7:Forward 5′-TTCTGCAGCCACCACTGAGC-3′,Reverse 5′-GTGGAGCAGCATGGGGTAGG-3′;f8:Forward5′-CCCACCTCAGCCACCTGAA T-3′,Reverse 5′-GGGCAGATCACAGGGTCAGG-3′;f9:Forward 5′-AGTGGGCACATTTAGACATAGCAGG T-3′,Reverse 5′-CCTCCCGGTCATGCCTTT C-3′;f10:Forward 5′-GTCAGGTGCCACTGGGGTCT-3′,Reverse 5′-CGGTCCCCTGTTTCAATGCT-3′。p21WAF1/CIP1启动子区+2~ -4000 bp 10个选定区域f1~f10(Fig 1)。

Fig 1 Schematic diagram of HDAC1 and ERα response elementfor regulating transcriptional function of p21WAF1/CIP1 promoter

2 结果
2.1Basal组MCF-7细胞p21WAF1/CIP1启动子区f1~f10片段HDAC1及ERα高功能结合位点筛选Basal组MCF-7细胞经HDAC1及ERα抗体2次ChIP处理后,45 μL样品与5 μL内对照的DNA分别与f1~f10引物作用进行Real-time PCR扩增,所得CT值之差为该样品在p21WAF1/CIP1启动子区各自片段的ΔCT值,再以f4片段为对照,其他片段的△CT值与其相减,得到Basal组样品在p21WAF1/CIP1启动子区f1~f10片段各自△△CT值,采用2-△△CT法计算各片段DNA的相对表达量。Basal组f1~f3、f5~f10片段DNA的相对表达量为(1.93±0.13)、(1.31±0.07)、(1.44±0.09)、(1.77±0.08)、(1.32±0.09)、(1.75±0.15)、(2.81±0.36)、(1.76±0.07)、(2.48±0.18),较f4片段相对表达量(1±0)明显升高(P<0.01),f8片段达最高值(Fig 2)。
2.2SAHA作用下MCF-7细胞p21WAF1/CIP1启动子区f1~f10片段HDAC1及ERα高功能结合位点筛选将SAHA处理后的MCF-7细胞的DNA组分,经HDAC1及ERα抗体2次ChIP处理后,进行Real-time PCR检测。结果表明,SAHA组MCF-7细胞的p21WAF1/CIP1启动子f1及f8片段结合HDAC1及 ERα抗体的 DNA相对表达量为(0.51±0.04)、(0.41±0.04),较Basal组对应片段相对表达量(1±0)均明显降低(P<0.01),见Fig 3。

Fig 2 Screening of high function bindsite of HDAC1 and ERα among f1~f10 fragmentsof p21WAF1/CIP1 promoter region in basal group MCF-7 cells
**P<0.01vsf4 fragment

Fig 3 Screening of high function bindsite of HDAC1 and ERα among f1~f10 fragments ofp21WAF1/CIP1 promoter region in SAHA group MCF-7 cells
**P<0.01vsbasal group
2.3Leptin作用下MCF-7细胞p21WAF1/CIP1启动子区f1~f10片段HDAC1及ERα高功能结合位点筛选将Leptin处理后的MCF-7细胞的DNA组分,经HDAC1及ERα抗体2次ChIP处理后,进行Real-time PCR 检测。结果表明,Leptin组细胞p21WAF1/CIP1启动子区f1~f3、f6~f10片段结合HDAC1及ERα抗体的DNA相对表达量为(1.28±0.06)、(1.12±0.07)、(1.32±0.08)、(1.66±0.17)、(1.66±0.15)、(1.80±0.22)、(1.48±0.14)、(1.32±0.25),较Basal组对应片段相对表达量(1±0)均明显升高(P<0.01),f8片段达最高值(Fig 4)。

Fig 4 Screening of high function bind siteof HDAC1 and ERα among f1~f10 fragments ofp21WAF1/CIP1 promoter region in Leptin group MCF-7 cells
**P<0.01vsbasal group
2.4SAHA、Leptin分别作用下MCF-7细胞p21WAF1/CIP1启动子区f1片段结合HDAC1及ERα抗体的相对表达量比较SAHA、Leptin组MCF-7细胞p21WAF1/CIP1启动子区f1片段结合HDAC1及ERα抗体的DNA相对表达量为(0.51±0.04)、(1.28±0.06),与Basal组对应片段相对表达量(1±0)相比,差异均有统计学意义(P<0.01),见Fig 5。
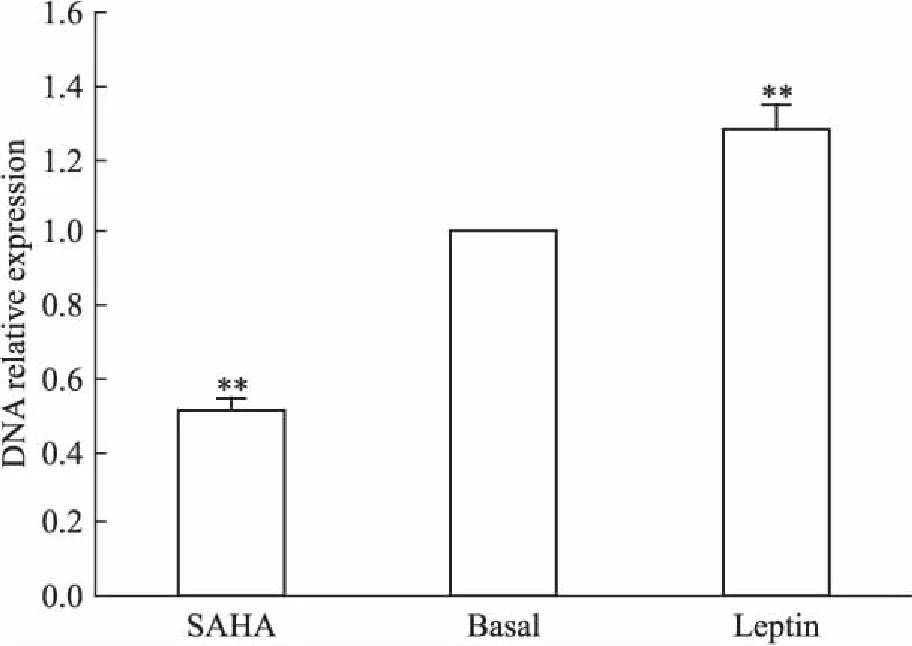
Fig 5 Comparison of high function bind of HDAC1and ERα in f1 fragment of p21WAF1/CIP1 promoter regionin MCF-7 cells among SAHA, Basal and Leptin group
**P<0.01vsbasal group
2.5SAHA、Leptin分别作用下MCF-7细胞p21WAF1/CIP1启动子区f8片段结合HDAC1及ERα抗体的相对表达量比较SAHA、Leptin组MCF-7细胞p21WAF1/CIP1启动子区f8片段结合HDAC1及ERα抗体的DNA相对表达量为(0.41±0.06)、(1.80±0.22),与Basal组对应片段相对表达量(1±0)相比,差异均有统计学意义(P<0.01),见Fig 6。

Fig 6 Comparison of high function bindof HDAC1 and ERα in f8 fragment of p21WAF1/CIP1 promoterregion in MCF-7 cells among SAHA, Basal and Leptin group
**P<0.01vsbasal group
3 讨论
乳腺癌 MCF-7 细胞为ER阳性的乳腺癌经典细胞系,其ERα位于细胞核内,是雌激素激活的转录因子,通过调节特异性靶基因的转录而发挥基因型调节效应。雌激素应答成分(estrogen response element, EREs)位于雌激素应答靶基因的启动子区,ERα可直接结合到EREs或通过与AP1、SP1、MTA1、HDAC1等其他转录因子结合,调控靶基因的转录,促进乳腺癌细胞的增生[5]。乳腺癌 MCF-7 细胞引起癌前病变及癌肿中ERα的表达均增高[6]。ERα是乳腺癌细胞增殖过程中的重要调控因素, ERα基因的表达及其转录活性的调控都离不开HDACs的参与[7],尤其是 HDAC1 和 HDAC7[8]。
本实验利用ChIP-on-ChIP方法研究发现,Basal组MCF-7细胞p21WAF1/CIP1基因TSS近端启动子调节区f1~f3和远端调节区f5~f10片段结合HDAC1及ERα抗体的DNA相对表达量较f4片段明显升高。这表明在细胞增殖过程中,HDAC1及ERα可被招募至p21WAF1/CIP1启动子区,其中f1及f8片段均与之有较高能力的结合。
在乳腺癌细胞增殖过程中,细胞增殖信号在p21WAF1/CIP1的启动子区可招募HDAC1转录因子,通过组蛋白去乙酰化表观遗传修饰影响p21WAF1/CIP1表达。前期研究证实,SAHA可降低HDAC1在p21WAF1/CIP1启动子区的结合[9]。此外,HDACi也显示出对ERα 基因表达的下调作用[10]。SAHA可以从转录水平抑制ERα合成,同时可以通过增强Hsp90乙酰化修饰,促进ERα经泛素-蛋白酶体通路降解[11]。本研究发现,SAHA作用下的MCF-7细胞, p21WAF1/CIP1启动子区f1及f8片段结合HDAC1及ERα抗体的DNA相对表达量明显低于对照组,这表明f1及f8片段可能是SAHA发挥作用的功能敏感区。
Leptin可通过调控细胞周期、凋亡、影响细胞外环境等多重机制,促进雌激素受体阳性的MCF-7乳腺癌细胞增殖与转移[12]。Leptin可提高HDAC1的活性,使核心组蛋白去乙酰化,从而抑制p21WAF1/CIP1的表达,最终促进细胞周期从G1期到S期的进程[13]。另有报道,Leptin可通过促进芳香酶的表达,导致雌激素生成增多[14],也可上调乳腺癌MCF-7细胞中ERα的表达水平[15]。本实验中,Leptin作用下的MCF-7细胞, p21WAF1/CIP1启动子区f1~f3及f6~f10片段结合HDAC1及ERα抗体的DNA相对表达量较对照组增多,但根据SAHA组细胞p21WAF1/CIP1启动子区各片段结合HDAC1及ERα抗体情况的筛选结果,可以推断在乳腺癌发生、发展过程中, f1及f8片段可能是Leptin与SAHA均发挥作用的功能敏感区。
综上所述,本研究通过ChIP on ChIP实验技术筛选出Basal组乳腺癌MCF-7细胞p21WAF1/CIP1启动子区的HDAC1及ERα高功能结合位点,进而利用SAHA 及Leptin的药理学特征,使用SAHA 及Leptin对MCF-7细胞进行分组处理,ChIP on ChIP 2次抗体结合后DNA检测,进一步明确p21WAF1/CIP1启动子区0~400 bp、-2 800~-3 200 bp两区域可能是与HDAC1和ERα高度结合的功能活跃区。此研究发现丰富了SAHA和Leptin在调节p21WAF1/CIP1启动子功能过程中的分子机制,更为抗乳腺癌的药物研发及靶向治疗奠定了理论和实验基础。
[1] Xue R Q, Gu J C, Du S T, et al. Lentivirus-mediated RNA interference targeting the ObR gene in human breast cancer MCF-7 cells in a nude mouse xenograft model[J].ChinMedJ(Engl), 2012,125(9):1563-70.
[2] Hancke K, Grubeck D, Hauser N, et al. Adipocyte fatty acid-binding protein as a novel prognostic factor in obese breast cancer patients[J].BreastCancerResTreat, 2010,119(2): 367-77.
[3] Zhou W, Guo S, Gonzalez-Perez R R. Leptin pro-angiogenic signature in breast cancer is linked to IL-1 signalling[J].BrJCancer, 2011,104(1):128-37.
[4] 韩 翰,王 敏. SAHA和TRAIL联合使用对乳腺癌雌激素受体阳性细胞MCF-7生长的影响[J].中国药理学通报, 2016,32(2): 223-8.
[4] Han H, Wang M. Effects of combination treatment with SAHA and TRAIL on ER positive breast cancer cell MCF-7[J].ChinPharmacolBull, 2016,32(2): 223-8.
[5] Liao X H, Lu D L, Wang N, et al. Estrogen receptor α mediates proliferation of breast cancer MCF-7 cells via a p21/PCNA/E2F1-dependent pathway[J].FEBSJ, 2014,281(3):927-42.
[6] 张佳娜, 汪庆余, 曾 磊,等. 乳腺癌细胞中p73α与ERα的相互关系[J].实验与检验医学, 2013,31(1):4-6.
[6] Zhang J N, Wang Q Y, Zeng L,et al. Co-relation between ERα and p73α in breast cancer cells[J].ExpLabMed, 2013,31(1): 4-6.
[7] Margueron R, Duong V, Castet A, et al. Histone deacetylase inhibition and estrogen signalling in human breast cancer cells[J].BiochemPharmacol, 2004,68(4): 1239-46.
[8] Kurtev V, Margueron R, Kroboth K,et al. Transcriptional regulation by the repressor of estrogen receptor activity via recruitment of histonedeacetylases[J].JBiolChem, 2004,279(23):24834-43.
[9] 邹 丹, 周伟强. 乳腺癌MCF-7细胞p21WAF1/CIP1启动子区HDAC1高功能结合位点的研究[J]. 中国药理学通报, 2017,33(3): 317-21.
[9] Zou D, Zhou W Q. A study on high function binding site of HDAC1 in p21WAF1/CIP1promoter region in breast cancer MCF-7 cells[J].ChinPharmacolBull, 2017,33(3): 317-21.
[10]Margueron R, Duong V, Bonnet S, et al. Histone deacetylase inhibition and estrogen receptor alpha levels modulate the transcriptional activity of partial antiestrogens[J].JMolEndocrinol, 2004,32(2):583-94.
[11]Yi X, Wei W, Wang S Y, et al. Histone deacetylase inhibitor SAHA induces ERalpha degradation in breast cancer MCF-7 cells by CHIP-mediated ubiquitin pathway and inhibits survival signaling[J].BiochemPharmacol, 2008,75(9):1697-705.
[12]Feng X, Han H, Zou D,et al. Suberoylanilide hydroxamic acid-induced specific epigenetic regulation controls Leptin-induced proliferation of breast cancer cell lines[J].Oncotarget, 2017,8(2):3364-79.
[13]Gonzalez-Perez R R, Xu Y, Guo S, et al. Leptin upregulates VEGF in breast cancer via canonic and non-canonical signalling pathways and NF-kappaB/HIF-1alpha activation[J].CellSignal, 2010,22(9):1350-62.
[14]Liu E, Samad F, Mueller B M. Local adipocytes enable estrogen-dependent breast cancer growth: role of leptin and aromatase[J].Adipocyte, 2013,2(3):165-9.
[15]Yu W, Gu J C, Liu J Z, et al. Regulation of estrogen receptors alpha and beta in human breast carcinoma by exogenous leptin in nude mouse xenograft model[J] .ChinMedJ(Engl), 2010,123(3):337-43.
SynergisticeffectofERαonHDAC1regulatingtranscriptionofp21WAF1/CIP1inbreastcancerMCF-7cells
ZOU Dan1,FENG Xiu-yan2, ZHOU Wei-qiang2
(1.DeptofPathophysiology, 2.KeyLabofEnvironmentalPollutionandMicroecologyofLiaoningProvince,ShenyangMedicalCollege,Shenyang110034,China)
AimTo investigate the specific binding sites that histone deacetylases 1(HDAC1) and estrogen receptor α(ERα)can be recruited to regulate the transcriptional activity of p21WAF1/CIP1promoter in the breast cancer MCF-7 cells, and to clarify the molecular mechanism of suberoylanilide hydroxamic acid(SAHA) and leptin regulating p21WAF1/CIP1promoter function.MethodsThe breast cancer MCF-7 cells in logarithmic growth phase were starved with FBS free medium for 24 hours, and treated with 20 μmol·L-1SAHA(SAHA group) or 0.625 nmol·L-1leptin(Leptin group) for 24 hours. The cells that were cultured in complete RPMI 1640 medium without any treatment were assigned as control group(Basal group). The cell lysis was prepared and incubated respectively with anti-HDAC1 and anti-ERα antibody by chromatin-immunoprecipitation(ChIP) method overnight at 4℃. The DNA-ChIP was followed the manufacturer′s protocol for the assay. DNA fragments binding anti-HDAC1 and anti-ERα antibody were gathered and purified. The relative expression level of DNA fragments from TSS to the upstream of the p21WAF1/CIP1promoter region(+2~-4 000 bp) binding with antibody was detected by real-time PCR and analyzed by 2-△△CTmethod.ResultsIn basal group, HDAC1 and ERα had high affinity with the f1 and f8 fragments of p21WAF1/CIP1promoter compared to the f4 fragment. In SAHA group, the binding ability of HDAC1 and ERα to the f1 and f8 fragments of p21WAF1/CIP1promoter was significantly lower than that of the control, while reversing to reach the peak after leptin treatment.ConclusionsHDAC1 and ERα can be recruited to p21WAF1/CIP1promoter by the cell proliferation signal during the proliferation of breast cancer MCF-7 cells. The DNA f1(from 0 to -400 bp) and f8(from -2 800 to -3 200 bp) fragment in the upstream of p21WAF1/CIP1promoter are the target functional region for the binding with HDAC1and ERα.
breast cancer; MCF-7 cell; p21WAF1/CIP1; HDAC1; ERα; suberoylanilide hydroxamic acid; leptin
时间:2017-8-20 16:47 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170820.1647.024.html
2017-06-05,
2017-07-11
国家自然科学基金资助项目(No 81172509);辽宁省自然科学基金资助项目(No 201602735);沈阳市科技计划项目(No F15-199-1-28)
邹 丹(1971-),女,博士,副教授,研究方向:肿瘤调控,E-mail: 2306344641@qq.com; 周伟强(1970-),男,博士,教授,研究方向:肿瘤调控,通讯作者,E-mail: zhouwq@hotmail.com
10.3969/j.issn.1001-1978.2017.09.012
A
:1001-1978(2017)09-1243-06
R329.2;R392.11;R394.2;R737.902.2;R977.1;R977.3

