雷丸蛋白pPeOp诱导胃癌细胞SGC-7901凋亡机制研究
赵肖涯,陆仲夏,杜丽君,梁浩威,陈宜涛
(浙江中医药大学生命科学学院,浙江 杭州 310053)
雷丸蛋白pPeOp诱导胃癌细胞SGC-7901凋亡机制研究
赵肖涯,陆仲夏,杜丽君,梁浩威,陈宜涛
(浙江中医药大学生命科学学院,浙江 杭州 310053)
目的探究雷丸蛋白pPeOp诱导人胃癌细胞SGC-7901的凋亡机制。方法采用CCK-8法和流式细胞术检测不同浓度的pPeOp(30、60、90 mg·L-1)对人胃癌细胞SGC-7901的活性抑制和凋亡诱导作用;qRT-PCR和Western blot检测死亡受体通路和线粒体通路TNF-R1、Fas/FasL、Bcl-2、caspase-3、caspase-8的mRNA和蛋白表达情况。结果CCK-8结果显示,与Control组相比,阴性对照聚乙烯吡咯烷酮(PVP)组细胞存活率差异无显著性;阳性对照5-氟尿嘧啶(5-Fu)组细胞存活率为(53.71±7.34)%,存活率明显下降(P<0.05);30、60、90 mg·L-1的 pPeOp组细胞存活率分别为(80.95±6.25)%、(53.48±5.70)%、(44.61±6.50)%,存活率降低且与浓度呈负相关(r=0.984,P=0.016)。流式细胞术结果显示,PVP组与Control组相比差异无显著性,5-Fu组细胞凋亡率为(39.30±3.34)%(P<0.05),30、60、90 mg·L-1pPeOp组细胞凋亡率分别为(10.90±1.25)%、(28.80±2.70)%、(32.00±3.50)%,差异存在显著性(P<0.05)。TNF-R1、Fas/FasL、caspase-3及caspase-8的mRNA和蛋白表达水平均上调,差异存在显著性(P<0.05);Bcl-2的mRNA和蛋白表达水平下调,差异存在显著性(P<0.05)。结论pPeOp能明显抑制人胃癌细胞SGC-7901的增殖并诱导其凋亡,死亡受体通路和线粒体通路与pPeOp诱导人胃癌细胞SGC-7901凋亡有关。
凋亡;caspases;胃癌;SGC-7901;线粒体通路;死亡受体通路;雷丸
胃癌是一种常见的恶性肿瘤,每年全球10万人中有13 860人患胃癌,发病率居恶性肿瘤第4位,死亡率居第2位[1]。目前,胃癌的治疗主要以手术及放化疗为主,但其复发率高。细胞凋亡异常、过度增殖是胃癌发生的机制之一[2]。因此,诱导胃癌细胞凋亡是胃癌治疗的重要方向。细胞凋亡是由多种癌基因、抑癌基因及细胞因子共同调控的结果[3]。研究药物靶向调控相关分子表达,诱导细胞凋亡,对肿瘤治疗具有重要的临床意义。
中医药具有数千年的临床实践经验,其在抗肿瘤、减毒增效、预防复发和转移等方面具有明显的效果[4-6],可有效改善患者的生存质量。雷丸(OmphalialapidescensSchroet)是我国常用传统驱虫中药,主要用于驱除蛔虫、绦虫和钩虫等[7]。尚有研究报道,雷丸还具备较好的抗肿瘤作用[8-9],中国食品药品监督管理总局(CFDA)已经批准了雷丸片和雷丸胶囊作为治疗肿瘤的辅助用药[10-11]。
本实验室前期从雷丸中分离纯化得到了一种含量丰富的小分子抗肿瘤蛋白pPeOp(purified PVP-extractedOmphalialapideacensprotein),研究证明其对人胃癌细胞有较好的凋亡诱导作用和直接杀伤作用,而对正常胃黏膜细胞无毒副作用[9,12]。本文将通过研究pPeOp对死亡受体通路和线粒体通路的影响,探究其诱导人胃癌细胞SGC-7901凋亡的分子机制。
1 材料
1.1细胞与药物人胃癌细胞SGC-7901细胞株,浙江省疾病控制预防中心提供;雷丸购自方回春堂;聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)购自Biosharp;5-氟尿嘧啶(5-fluorouracil,5-Fu)购自Sigma。
1.2试剂与仪器Cell Counting Kit-8(CCK-8试剂盒)、细胞凋亡检测试剂盒、细胞裂解液、GAPDH抗体(鼠抗人)、辣根过氧化物酶标记山羊抗小鼠IgG、ECL反应液,均购自碧云天;兔抗人Bcl-2、TNF-R1、Fas/FasL、caspase-3和caspase-8抗体,均购自Cell Signaling Technology;辣根过氧化物酶标记山羊抗兔IgG购自联科生物;BCA蛋白检测试剂盒购自凯基生物;逆转录试剂盒购自Thermo;相关基因引物均购自生工生物工程股份有限公司;SYBR Green®Premix Ex TaqTM购自TaKaRa。流式细胞仪(Beckman FC500);荧光定量PCR仪(型号:Eppendorf Realplex 4);冷冻离心机(型号:5417R,Eppendorf)。
2 方法
2.1雷丸蛋白pPeOp的分离纯化按Chen等[9]方法分离纯化雷丸蛋白pPeOp。以小牛血清体积分数为0.05的RPMI 1640培养液配制30、60、90 mg·L-13个终浓度备用。以90 mg·L-1PVP提取液为阴性对照组,100 mg·L-15-Fu为阳性对照组。
2.2CCK-8法检测细胞活性取对数生长期的人胃癌细胞SGC-7901,以1×104个接种于96孔板,培养24 h;设置6个复孔,加药培养24 h;每孔中加入10 μL CCK-8溶液,37℃孵育1 h,于450 nm波长检测吸光度。
2.3流式细胞术检测细胞凋亡取对数生长期的胃癌细胞SGC-7901,以1×106个接种于6孔板,培养24 h;加药培养24 h,收集细胞悬液,离心弃上清,加2 mL冷的PBS洗涤,加1 mL 1×Binding buffer重悬,吸取100 μL上述液于离心管中,每管加5 μL FITC Annexin V和5 μL PI;微离心,25℃避光孵育15 min;每管加400 μL 1×Binding buffer,1 h内流式细胞术检测。
2.4qRT-PCR检测死亡受体通路和线粒体通路相关基因表达取对数生长期的胃癌细胞SGC-7901,以1×106个接种于6孔板,培养24 h;加药培养24 h,用TRIzol法提取细胞总RNA;用逆转录试剂盒将mRNA逆转录合成cDNA,逆转录产物进行荧光定量PCR反应,以GAPDH为内参,半定量分析基因mRNA表达水平。通过CT值比较反映相应基因mRNA表达量的高低。引物序列见Tab 1。
2.5Westernblot检测蛋白表达取对数生长期的胃癌细胞SGC-7901,以1×106个接种于6孔板,培养24 h;加药培养24 h,收集细胞悬液,离心弃上清;2 mL PBS清洗细胞,加200 μL含PMSF的裂解液,冰上裂解10 min;将细胞转移至离心管,继续裂解25 min,每10 min弹1次;4℃ 12 000 r·min-1离心15 min,取上清,BCA法测定蛋白浓度。经SDS-PAGE电泳、转膜后移入封闭液,室温封闭2 h;TBST洗涤3次,4℃一抗孵育过夜,用TBST洗膜3次;室温二抗孵育2 h,用TBST再次洗膜3次。用ECL发光后,在暗室中进行胶片显影。

Tab 1 qRT-PCR primer sequence

3 结果
3.1SGC-7901细胞的形态学变化给药培养24 h后,在倒置显微镜下观察,各组细胞形态学特征表现为:Control组与PVP组细胞形态正常,呈梭形,排列紧密;5-Fu组细胞形态异常,排列疏松,少数细胞悬浮。pPeOp作用于细胞后,细胞贴壁情况下降、增殖受抑、数目减少、形态变圆甚至破裂,且随着药物浓度的增加,圆形细胞数逐渐增多(Fig 1)。

Fig 1 Effect of pPeOp on morphology of SGC-7901 cells
3.2pPeOp对人胃癌细胞SGC-7901活性的抑制作用CCK-8检测各组细胞存活率。结果显示,与Control组相比,不同浓度pPeOp(30、60、90 mg·L-1)作用于SGC-7901细胞后,细胞存活率明显降低,分别为(80.95±6.25)%(P<0.05)、(53.48±5.70)%(P<0.01)、(44.61±6.50)%(P<0.01),PVP组和5-Fu组分别为(99.72±6.48)%、(53.71±7.34)%(P<0.01)。实验结果表明,pPeOp对SGC-7901细胞的活性具有明显的抑制作用,并与浓度呈正相关性(r=0.984,P=0.016)。见Fig 2。
3.3pPeOp对人胃癌细胞SGC-7901凋亡的影响Fig 3流式细胞仪检测结果显示, pPeOp作用于SGC-7901细胞24 h后,30、60、90 mg·L-1组总凋亡率分别为(10.90±1.25)%、(28.80±2.70)%、(32.00±3.50)%,相比Control组均明显上升(P<0.01)。PVP组则无明显变化,5-Fu组总凋亡率为(39.30±3.34)%,与Control组差异存在显著性(P<0.01)。结果提示,pPeOp对胃癌细胞SGC-7901具有明显的促凋亡作用。
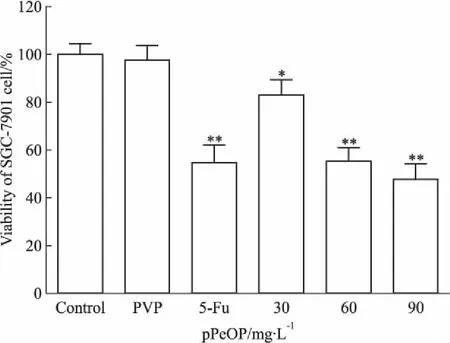
Fig 2 Effect of pPeOp on cell viability of SGC-7901 cells
3.4pPeOp对人胃癌细胞SGC-7901死亡受体通路的影响Fig 4A结果显示,药物处理组Fas/FasL和TNF-R1 mRNA表达水平较Control组明显上调,并与浓度呈正相关性(FasL:r=0.986,P=0.014;TNF-R1:r=0.928,P=0.032);蛋白表达水平较Control组也明显上调,并与浓度呈正相关性(FasL:r=0.917,P=0.043;TNF-R1:r=0.957,P=0.041),见Fig 4B。结果提示,pPeOp对细胞死亡受体通路信号传导具有一定的调控作用。
3.5pPeOp对人胃癌细胞SGC-7901线粒体通路的影响Fig 5的qRT-PCR和Western blot结果显示,30 mg·L-1pPeOp组Bcl-2 mRNA表达水平较Control组表达无变化,60、90 mg·L-1pPeOP组Bcl-2 mRNA表达水平较Control组表达下调,且与药物浓度呈负相关(r=0.935,P=0.034);蛋白表达水平较Control组也明显下调。结果表明,pPeOp通过下调促癌蛋白Bcl-2的表达,参与了线粒体通路信号传导。
3.6pPeOp对caspase蛋白表达的影响Fig 6结果显示,与Control组相比,pPeOp组caspase-3的mRNA表达水平明显上调,caspase-8的mRNA表达在30、60 mg·L-1组无变化,在90 mg·L-1组表达上调;caspase-3及caspase-8的蛋白表达水平也明显上调,且caspase-8的蛋白表达水平呈剂量依赖性(r=0.993,P=0.02)。
4 讨论
细胞凋亡是一种ATP依赖性的并由细胞严格调控的细胞程序性死亡[13]。在正常情况下,机体通过细胞凋亡来消除体内过量、冗余和其它不健康细胞以维持机体的平衡和稳定。而在胃癌细胞中,这一平衡被打破,抗凋亡基因明显上调,促凋亡基因明显下调,细胞凋亡被抑制,细胞过度增殖[14]。因此,研究肿瘤细胞凋亡的基本机制,寻找特异性药物靶向抑制或杀伤肿瘤细胞已成为肿瘤治疗的研究热点。
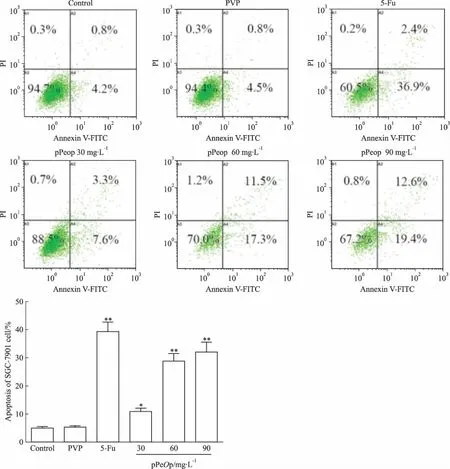
Fig 3 Effect of pPeOp on apoptosis rate of SGC-7901 cells
根据凋亡信号的来源可将凋亡途径分为两条[15]:死亡受体途径(即外源性途径)和线粒体途径(即内源性途径)。死亡受体途径由TNF超家族成员与其相对应的TNFR超家族成员特异结合[16],活化胞质中衔接分子(adapter molecule),如FADD、TRADD等,招募活化caspase-8等蛋白质形成死亡复合体,导致细胞凋亡。TNF超家族成员包括Fas、TNF-α、TRAIL等配基;TNFR超家族成员包括FasL、TNFRI、TRID等。线粒体途径中最重要的调控因子是Bcl-2家族蛋白[17-18],其中包括抗凋亡因子(Bcl-2、Bcl-X、Mcl-1等)、促凋亡因子(Bax、Bak等)和只含BH3结构域的蛋白(Bim、Bid等)。促凋亡蛋白与线粒体外膜结合,细胞色素C释放进入胞质,细胞色素C与Apaf-1、caspase-9前体、ATP / dATP形成凋亡体(alxzome),招募并激活caspase-3、caspase-7,进而引发caspase级联反应[19],导致细胞凋亡。除细胞色素C 外,线粒体还可通过释放Smac/DIABLO、Omi/HtrA2、凋亡诱导因子(apoptosis inducing factor,AIF)和EndoG等,诱导非caspase依赖的DNA断裂。活化的caspase-8还可以通过切割胞质内Bid,产生tBid,移位至线粒体,使Bak和Bax寡聚体化形成孔隙,以利于细胞色素C从线粒体释放,并级联放大caspase激活后的下游信号。Bcl-2和Bcl-XL通过抑制细胞色素C的释放和阻止Bak、Bax蛋白的移位,从而发挥其抗凋亡作用。虽然两条凋亡途径上游事件不同,但是他们最终激活的凋亡效应物相同,即caspase[20]。
本研究结果显示,pPeOp蛋白可明显抑制人胃癌细胞SGC-7901的生长活性并诱导其凋亡。主要表现为:与Control组相比,pPeOp蛋白作用后,细胞出现排列疏松,呈圆形或团块状,贴壁数目明显减少等细胞形态学特征;细胞的凋亡率检测结果也呈现较高水平。结合qRT-PCR和Western blot检测结果分析, TNF-R1、Fas/FasL、caspase-3、caspase-8 mRNA和蛋白表达均明显增加;Bcl-2 mRNA和蛋白表达明显降低,与细胞的凋亡有关,并且与药物呈剂量依赖性。以上结果表明,pPeOp可能通过激活死亡受体通路和线粒体通路中相关基因及蛋白的表达,而发挥诱导细胞凋亡的作用。pPeOp对死亡受体通路和线粒体通路其它相关蛋白的调控,有待进一步研究。
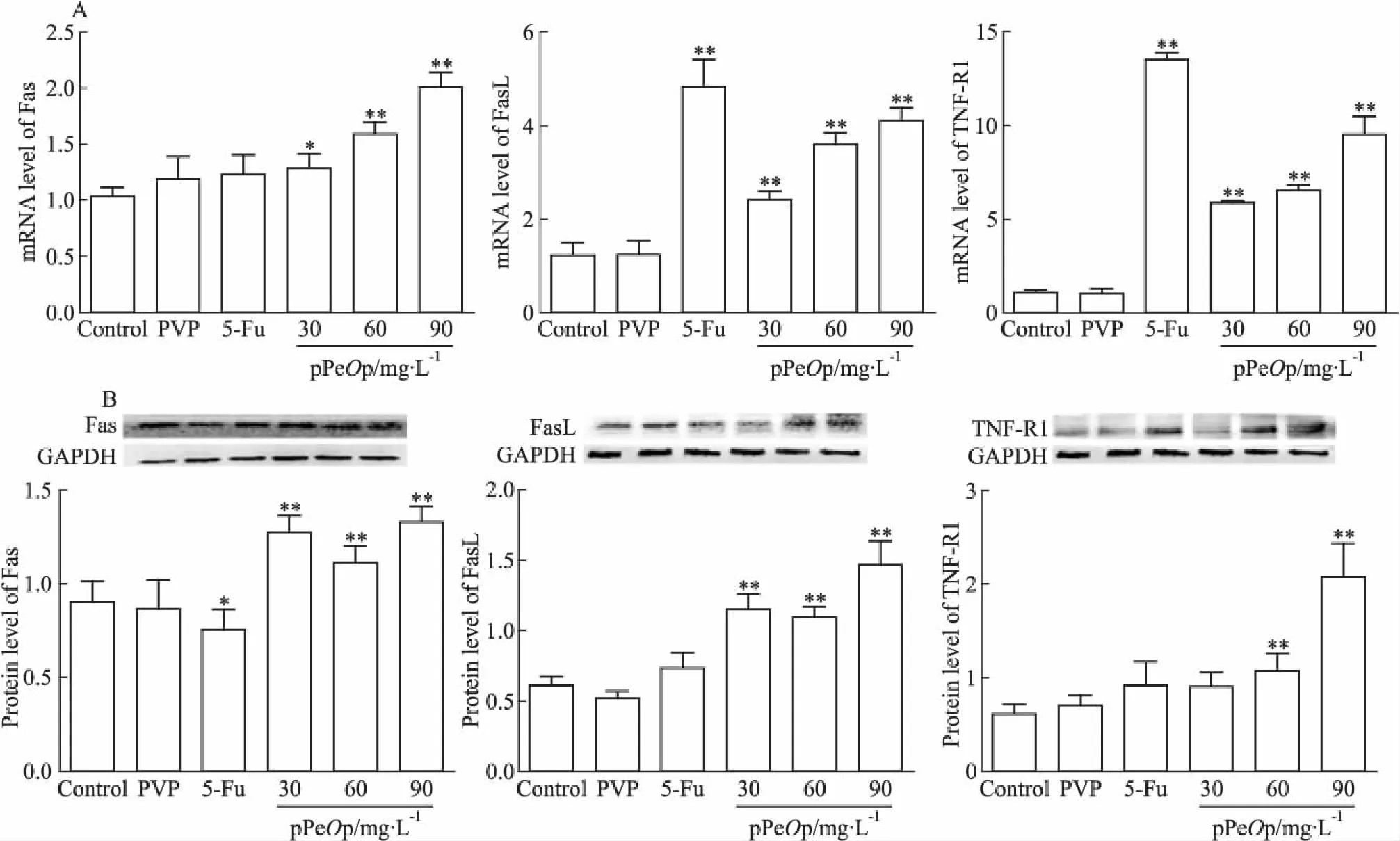
Fig 4 Effect of pPeOp on expression levels of Fas/FasL and TNF-R1
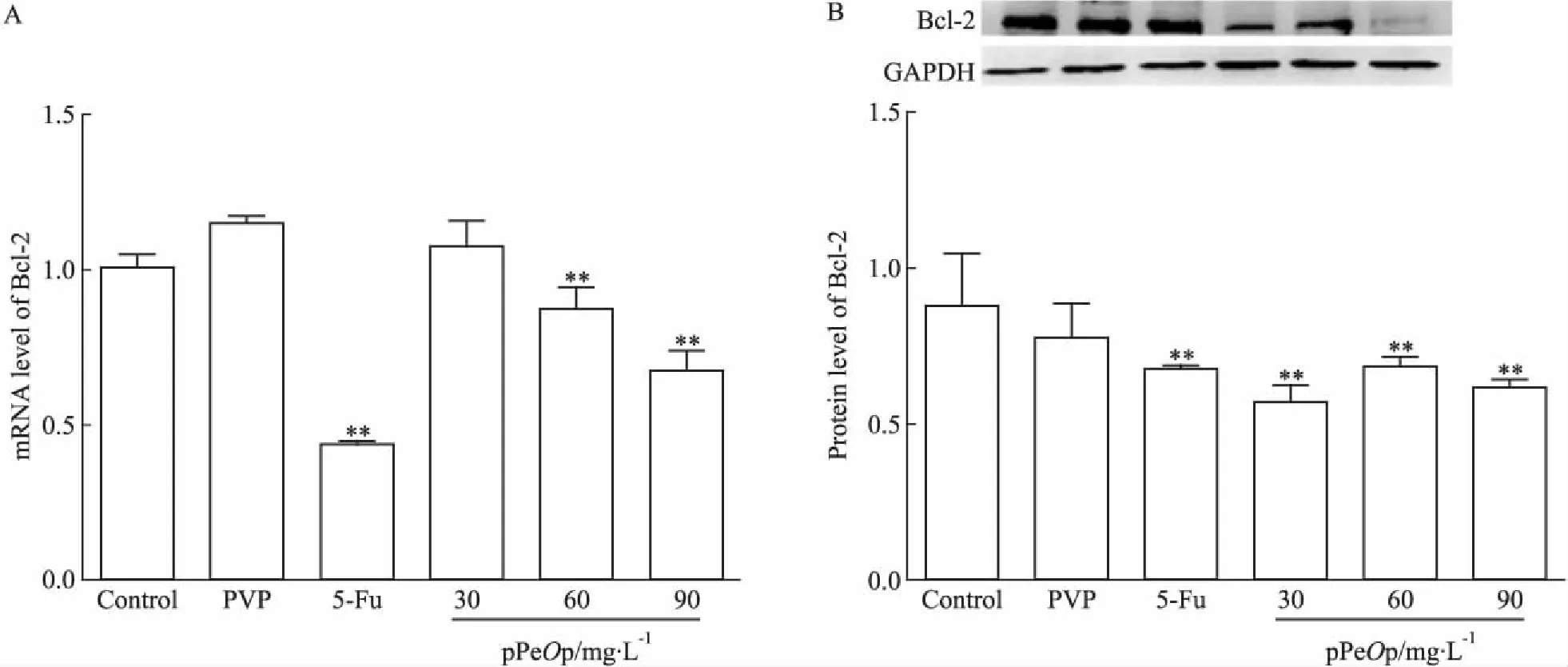
Fig 5 Effect of pPeOp on expression levels of Bcl-2

Fig 6 Effect of pPeOp on expression levels of caspase-3 and caspase-8
[1] Chen X, Wang Y, Zang W, et al. miR-194 targets RBX1 gene to modulate proliferation and migration of gastric cancer cells[J].TumorBiol, 2015,36(4): 2393-401.
[2] Zhang T, Zou P, Wang T, et al. Down-regulation of miR-320 associated with cancer progression and cell apoptosis via targeting Mcl-1 in cervical cancer[J].TumorBiol, 2016,37(7): 8931-40.
[3] Gumulec J, Balvan J, Sztalmachova M, et al. Cisplatin-resistant prostate cancer model: Differences in antioxidant system, apoptosis and cell cycle[J].IntJOncol, 2014,44(3): 923-33.
[4] 赵素华, 杨秀勤, 朱 伟, 等. 水溶性紫杉醇前药的制备及抗肿瘤活性的研究[J]. 中国药理学通报, 2016,32(12): 1711-7.
[4] Zhao S H, Yang X Q, Zhu W, et al. Preparation of anti-cancer water-soluble paclitaxel prodrug and its anti-cancer effect[J].ChinPharmacolBull, 2016,32(12): 1711-7.
[5] Li X, Yang G, Li X, et al. Traditional Chinese medicine in cancer care: a review of controlled clinical studies published in Chinese[J].PLoSOne, 2013,8(4): e60338.
[6] Liu J, Wang S, Zhang Y, et al. Traditional Chinese medicine and cancer: History, present situation, and development[J].ThoracCancer, 2015,6(5): 561-9.
[7] Wang B, Yu W, Guo J, et al. The antiparasitic drug, potassium antimony tartrate, inhibits tumor angiogenesis and tumor growth in nonsmall-cell lung cancer[J].JPharmacolExpTher, 2015,352(1): 129-38.
[8] 陈非飞, 杨永乐, 龚维瑶, 等. 雷丸pPeOp蛋白抑制胃癌细胞MC-4增殖和迁移的作用研究[J]. 浙江中医药大学学报, 2015,39(1): 9-14.
[8] Chen F F, Yang Y L, Gong W Y, et al. Inhibited migration of gastric tumor cells MC-4 by protein pPeOp from Omphalia lapidescens[J].JZhejiangChinMedUniv, 2015,39(1): 9-14.
[9] Chen Y T, Lu Q Y, Lin M A, et al. A PVP-extract fungal protein of Omphalia lapideacens and its antitumor activity on human gastric tumors and normal cells[J].OncolRep, 2011,26(6): 1519-26.
[10]梁荣祥. 雷丸胶囊联合化疗治疗广泛期小细胞肺癌35例[J]. 中医杂志, 2012,53(9): 782.
[10]Liang R X. Treatment of 35 cases of extensive small cell lung cancer with Omphalia lapideacens capsule combined with chemotherapy[J].JTraditChinMed, 2012,53(9): 782.
[11]许明峰, 沈莲清, 王奎武. 雷丸化学成分的研究[J]. 中草药杂志, 2011,42(2): 251-4.
[11]Xu M F, Shen L Q, Wang K W. Research on chemical constituents of Omphalia lapideacens[J].ChinHerbMedJ, 2011,42(2): 251-4.
[12]陈宜涛, 陆群英, 林美爱, 等. PVP荷载雷丸蛋白诱导人胃癌细胞MC-4的凋亡作用[J]. 中华中医药学刊, 2011,29(6): 1296-8.
[12]Chen Y T, Lu Q Y, Lin M A, et al. Apoptosis induced by proteins in Omphalia lapideacens conjugation to polyvinyl pyrrolidone in human gastric epithelial MC-4 cell[J].ChinArchTraditChinMed, 2011,29(6): 1296-8.
[13]Eto S, Yoshikawa K, Nishi M, et al. Programmed cell death protein 1 expression is an independent prognostic factor in gastric cancer after curative resection[J].GastricCancer, 2016,19(2): 466-71.
[14]赵 林, 吴 鹏, 章平贵, 等. 雷公藤甲素对人结肠癌HCT116细胞增殖、自噬和凋亡的影响[J]. 中国药理学通报, 2016,32(10): 1399-404.
[14]Zhao L, Wu P, Zhang P G, et al. Effect of triptolide on human colorectal cancer HCT116 cell proliferation, autophagy and apoptosis[J].ChinPharmacolBull, 2016,32(10): 1399-404.
[15]Ashkenazi A. Targeting the extrinsic apoptotic pathway in cancer: lessons learned and future directions[J].JClinInvest, 2015,125(2): 487-9.
[16]Hirsova P, Gores G J. Death receptor-mediated cell death and proinflammatory signaling in nonalcoholic steatohepatitis[J].CellMolGastroenterolHepatol, 2015,1(1): 17-27.
[17]Lu H F, Chie Y J, Yang M S, et al. Apigenin induces caspase-dependent apoptosis in human lung cancer A549 cells through Bax- and Bcl-2-triggered mitochondrial pathway[J].IntJOncol, 2010,36(6): 1477-84.
[18]Yang J, Yao S. JNK-Bcl-2/Bcl-xL-Bax/Bak pathway mediates the crosstalk between matrine-induced autophagy and apoptosis via interplay with beclin 1[J].IntJMolSci, 2015,16(10): 25744-58.
[19]Mitupatum T, Aree K, Kittisenachai S, et al. Hep88 mAb-mediated paraptosis-like apoptosis in HepG2 cells via downstream upregulation and activation of caspase-3, caspase-8 and caspase-9[J].AsianPacJCancerPrev, 2015,16(5): 1771-9.
[20]Huang F, Huang M, Zhang H, et al. Changes in apoptotic factors and caspase activation pathways during the postmortem aging of beef muscle[J].FoodChem, 2016,190: 110-4.
ApoptosismechanismofgastriccancercellSGC-7901inducedbyOmphalialapidescensproteinpPeOp
ZHAO Xiao-ya, LU Zhong-xia, DU Li-jun, LIANG Hao-wei, CHEN Yi-tao
(CollegeofLifeScience,ZhejiangChineseMedicineUniversity,Hangzhou310053,China)
AimTo investigate the apoptosis mechanism of human gastric cancer cell SGC-7901 induced byOmphalialapidescensprotein pPeOp.MethodsCCK-8 and flow cytometry were used to detect the inhibitory effect of different concentrations of pPeOp(30, 60, 90 mg·L-1) on SGC-7901. The mRNA and protein expression of TNF-R1, Fas/FasL, Bcl-2, caspase-3 and caspase-8 were detected by qRT-PCR and Western blot.ResultsSGC-7901 cells were treated with different concentrations of pPeOp(30, 60, 90 mg·L-1) for 24 h. CCK-8 test showed that there was no significant difference between PVP group and the control group. The survival rate of the 5-Fu group was(53.71±7.34)% (P<0.05). The survival rates of pPeOp group(30, 60, 90 mg·L-1) were(80.95±6.25)%, (53.48±5.70)% and(44.61±6.50)%(r=0.984,P=0.016),respectively. Flow cytometry showed that the apoptosis rate of PVP group had no significant difference with control group, and the apoptosis rate of 5-Fu group was about(39.30±3.34)%(P<0.05). The apoptotic rates of pPeOp group(30, 60, 90 mg·L-1) were(10.90±1.25)%, (28.80±2.70)% and (32.00±3.50)%,respectively(P<0.05). The mRNA and protein expression levels of Bcl-2 were down-regulated,whereas the expression of TNF-R1, Fas/FasL, caspase-3 and caspase-8 were significantly up-regulated(P<0.05).ConclusionspPeOp can significantly inhibit the proliferation of gastric cancer cell line SGC-7901 and induce apoptosis in a dose-dependent manner. Death receptor pathway and mitochondrial pathway may be related to pPeOp-induced apoptosis of gastric cancer SGC-7901.
apoptosis; caspases; gastric cancer; SGC-7901; mitochondrial apoptosis pathway; death receptor apoptosis pathway;Omphalialapidescens
时间:2017-8-20 16:47 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170820.1647.034.html
2017-06-10,
2017-07-18
国家自然科学基金资助项目(No 81374023);浙江省自然科学基金资助项目(No Y207765);浙江省大学生科技创新活动计划暨新苗人才计划项目(No 2016R410039)
赵肖涯(1995-),女,研究方向:抗肿瘤药用真菌,E-mail: 17826865936@163.com; 陈宜涛(1977-),男,博士,副教授,硕士生导师,研究方向:抗肿瘤药用真菌,通讯作者,E-mail: cytworld@163.com
10.3969/j.issn.1001-1978.2017.09.017
A
:1001-1978(2017)09-1271-07
R282.71;R329.25;R392.11;R735.202.2;R977.6;R979.1

