活血解毒中药下调8-OhdG表达抑制梗阻性肾病大鼠细胞凋亡
王 筝,常 奕,熊云昭,王 萱, 王聪慧,王 淼,王香婷,孙东云,梁丽娟,许庆友
(1.河北中医学院中西医结合学院,2. 河北省中西医结合肝肾病证重点实验室,河北 石家庄 050200,3. 河北医科大学研究生学院,河北 石家庄 050091)
◇复方药物药理学◇
活血解毒中药下调8-OhdG表达抑制梗阻性肾病大鼠细胞凋亡
王 筝1,2,常 奕1,2,熊云昭1,3,王 萱1,3, 王聪慧1,王 淼1,王香婷1,2,孙东云1,梁丽娟1,许庆友1,2
(1.河北中医学院中西医结合学院,2. 河北省中西医结合肝肾病证重点实验室,河北 石家庄 050200,3. 河北医科大学研究生学院,河北 石家庄 050091)
目的观察依普利酮及活血解毒中药对梗阻性肾病大鼠肾小管上皮细胞凋亡的影响及作用机制。方法将60只清洁级♂ Wistar大鼠随机分为假手术组、模型组、依普利酮组、中药组,每组15只。除假手术组外,其余大鼠结扎单侧输尿管复制肾间质纤维化动物模型。依普利酮组给予依普利酮100 mg·kg-1·d-1加入饲料喂养,中药组给予活血解毒中药方煎剂13.7 g·kg-1·d-1灌胃。14 d后摘取梗阻侧肾脏,TUNEL法检测肾脏细胞凋亡,放射免疫分析法检测血清醛固酮含量,ELISA检测血清及尿液8-OhdG含量,免疫组化、Western blot检测caspase-12、caspase-9、Bax以及Bcl-2蛋白表达。结果UUO大鼠血清醛固酮、血清及尿液8-OhdG含量及肾脏阳性凋亡细胞明显升高,caspase-9、caspase-12、Bax蛋白表达明显增强,Bcl-2表达下降(P<0.01);依普利酮及中药可降低血尿8-OhdG水平(P<0.01),下调caspase-9、caspase-12、Bax蛋白水平的表达(P<0.01)。结论依普利酮及活血解毒中药可以通过抑制氧化损伤,阻断caspase和(或)Bax信号通路,减少输尿管梗阻后肾小管上皮细胞凋亡。
8-羟基脱氧鸟苷;细胞凋亡;氧化损伤;依普利酮;醛固酮;肾脏纤维化;caspase-12;caspase-9;Bax;Bcl-2
梗阻性肾病是急慢性肾功能衰竭的重要原因,其病理特征是肾间质纤维化。造成泌尿系梗阻的机制非常复杂,其中包括血液动力学改变、炎性损伤、氧化应激和细胞凋亡等因素的共同参与。梗阻导致肾脏血流动力学改变,激活肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system, RAAS),进而激活RAAS下游的醛固酮,导致氧化应激,并且这一过程在细胞凋亡中起着重要的作用[1]。已有大量研究表明,氧化应激可导致肾小管上皮细胞凋亡,促进肾脏疾病的进展[2]。本研究采用单侧输尿管结扎(unilateral ureteral obstruction, UUO)造模,给予醛固酮受体阻断剂依普利酮及活血解毒中药治疗,观察醛固酮、8-羟基脱氧鸟苷(8-hydroxy-2'-deoxyguanosine, 8-OhdG)等指标变化,以及含半胱氨酸的天冬氨酸蛋白水解酶9(cysteinyl aspartate specific proteinase, caspase-9)、caspase-12、B淋巴细胞瘤-2(B cell lymphoma leukemia-2, Bcl-2)、Bcl-2相关蛋白x(Bcl-2 associated protein x, Bax)等凋亡相关因子的表达,探讨梗阻性肾病中关于氧化应激介导的细胞凋亡信号通路以及中药的保护机制。
1 材料与方法
1.1动物及分组清洁级♂ Wistar大鼠60只,体质量(200±20)g,购于河北医科大学动物实验中心,动物合格证号:SCXK(冀)1205069。按照体重编号,根据随机数字表随机分为假手术组、模型组、依普利酮组和中药组,每组15只,于河北省中西医结合肝肾病证重点实验室饲养7 d后进行实验。
1.2药物与试剂依普利酮饲料,美国Pfizer公司产品,辉瑞公司提供原粉,由日本Research Diets.Inc公司按1.25 g·kg-1加入饲料中,折合成大鼠药物用量为100 mg·kg-1·d-1。活血解毒中药方采用广东一方制药公司免煎颗粒(僵蚕10 g、地龙10 g、蝉蜕10 g、乌蛇10 g、丹参10 g、鳖甲10 g、赤芍10 g、金银花10 g、大黄6 g、野菊花10 g、蒲公英10 g、黄芪15 g、当归10 g),按比例混匀煎煮15 min,水煎液含生药4 kg·L-1,参照徐叔云《药理实验方法学》折合大鼠用量为13.7 g·kg-1·d-1给药。醛固酮放射免疫分析试剂盒购自天津九鼎医学生物工程有限公司;8-OhdG试剂盒购自南京建成生物工程研究所;TUNEL法凋亡检测试剂盒购自Roche公司;caspase-9抗体购自Epitomics公司;caspase-12抗体购自Genetex公司;Bcl-2、Bax抗体均购自Santa Cruz公司。
1.3造模方法及给药除假手术组外,其余各组大鼠按照Iwai等[3]方法制备肾间质纤维化实验动物模型。乙醚麻醉后于腹部左侧切开,游离左输尿管,于输尿管上1/3处和中1/3处结扎后切断并缝合,假手术组仅游离左侧输尿管但不结扎离断,轻轻拨动肠管后缝合皮肤。术后1 d开始给药,依普利酮(EPL)组给予依普利酮100 mg·kg-1·d-1加入饲料喂养,中药组(ZY)给予活血解毒中药煎剂13.7 g·kg-1·d-1灌胃,假手术组和模型组给予等量蒸馏水灌胃,共14 d,均每日1次。干预结束后,大鼠断头取血,留取血清标本,-20℃低温保存待检。摘取梗阻侧肾脏,部分组织置于4%多聚甲醛中固定,脱水、石蜡包埋,切片行HE染色及免疫组化染色;其余组织-70℃低温保存用于蛋白检测。
1.4观察指标
1.4.1TUNEL及光镜检测凋亡细胞 按照TUNEL试剂盒说明操作。在200倍光镜下观察,每组选取互不连接的20个视野,以细胞核染成深棕色为阳性表达,统计阳性细胞,以此作为凋亡指数。同时HE染色后,1 000倍油镜下观察肾小管上皮细胞凋亡表达。
1.4.2放射免疫法检测血清醛固酮含量 末次给药后,大鼠禁食12 h,断头取血,留取血液标本3 mL,注入硅化玻璃试管内,4℃、8 000 r·min-1离心10 min,吸取上清液,取血清标本,采用放射免疫分析法检测。按照试剂盒说明书操作。
1.4.3ELISA检测血清、尿液8-OhdG含量 UUO术后,将动物放入代谢笼中,收集24 h尿量,留取尿液标本;大鼠断头取血,留取血清标本,采用双抗体夹心ELISA测定,根据ELISA试剂盒说明书操作。
1.4.4免疫组化及Western blot检测caspase-9、caspase-12、Bcl-2、Bax蛋白表达 免疫组化采用SABC法检测,石蜡切片脱蜡入水,修复抗原后加入一抗,4℃过夜;PBS清洗3次,每次5 min,滴加生物素标记的二抗,37℃孵育30 min,同上清洗3次,滴加辣根过氧化物酶标记链酶卵白素工作液,37℃孵育30 min,同上清洗3次,DAB显色3~5 min,自来水充分冲洗,终止显色;苏木精复染,脱水,透明,封片。显微镜下观察蛋白表达的位置及染色强弱,以镜下出现棕黄色为阳性表达。
冰冻肾组织用裂解液(含蛋白酶抑制剂)提取并测定蛋白含量;取样品,按比例加入loading buffer 95℃煮沸5 min后待电泳;配制SDS-PAGE 胶,上样蛋白20 μg,电泳90 V到底;0.22 μm PVDF膜(甲醛处理),20 V,40 min半干转;5%脱脂牛奶封闭2~4 h,加入一抗(1 ∶1 000),4℃过夜,TBST清洗3次,每次10 min;加入二抗(1 ∶20 000),室温60 min,TBST清洗3次,每次10 min,TBS清洗10 min后,用红外激光成像系统扫描,所得结果以内参较正。

2 结果
2.1凋亡细胞计数由Tab 1、Fig 1可见,TUNEL法标记凋亡细胞,模型组阳性凋亡细胞明显增多(P<0.01),主要表达于远端小管上皮细胞;依普利酮组及中药组阳性细胞数明显减少(P<0.01) 。 HE染色1000倍油镜下观察凋亡细胞,表现为核浓缩、核裂解,结果显示UUO组明显增多(Fig 2)。
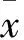
Tab 1 Expression of positive cell apoptosisin UUO rats by TUNEL(±s, n=15)
**P<0.01vssham group;##P<0.01vsUUO group
2.2血清醛固酮、血清及尿液8-OhdG水平比较如Tab 2所示,与假手术组比较,模型组血清醛固酮、血清及尿液8-OHdG的含量含量均明显升高,差异有统计学意义(P<0.01)。经依普利酮及中药治疗后,血清及尿液8-OHdG含量明显减少,差异有统计学意义(P<0.01)。中药组血清醛固酮含量与模型组比较明显降低,差异有统计学意义(P<0.01)。依普利酮组血清醛固酮含量较模型组有所升高,但无统计学意义(P>0.05)。

Fig 1 Expression of positive cellapoptosis in UUO rats by TUNEL(×200)
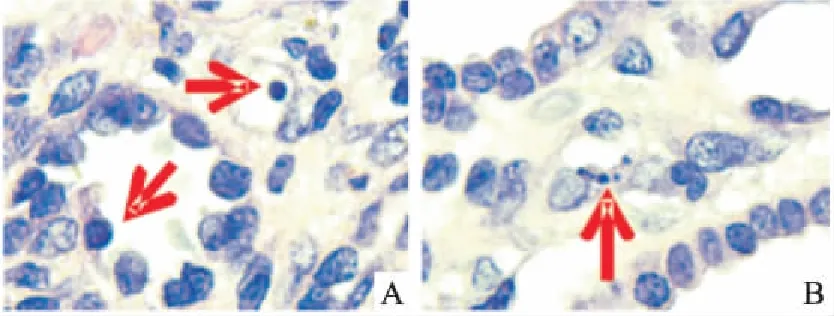
Fig 2 Apoptosis of renal cells in ratswith UUO group by light microscope(×1 000)
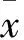
Tab 2 Expression of serum 8-OhdG, urine 8-OhdG andserum aldosterone in rats induced by UUO(±s,n=8)
**P<0.01vssham group;##P<0.01vsUUO group
2.5肾组织caspase-9、caspase-12、Bax、Bcl-2免疫组化表达假手术组caspase-9、caspase-12蛋白呈弱表达;模型组两者表达均明显增强,其中caspase-9在肾小管上皮细胞胞质的表达更明显,caspase-12以肾髓质扩张的肾小管上皮细胞胞质表达最为明显;依普利酮组及中药组两者亦可见到阳性表达,较假手术组为甚,但与模型组比较则明显减轻(Fig 3、4)。Bax蛋白在假手术组呈阳性表达,主要表达于肾小管上皮细胞胞质;与假手术组比较,模型组其表达明显增强;与模型组比较,依普利酮组及中药组Bax表达明显下降(Fig 5)。Bcl-2蛋白在假手术组呈阳性表达,主要表达于肾小管和皮髓交界处,肾间质亦有少量表达;模型组其表达明显下降,主要表达于近曲小管;与模型组比较,依普利酮组及中药组Bcl-2表达明显增强(Fig 6)。
2.6肾组织caspase-9、caspase-12、Bax、Bcl-2蛋白表达由Tab 3、Fig 7可见,与假手术组比较,模型组caspase-9、caspase-12、Bax蛋白表达明显上调,Bcl-2表达下调。与模型组比较,依普利酮组及中药组caspase-9、caspase-12、Bax表达均被下调,Bcl-2表达上调,差异有统计学意义(P<0.01)。
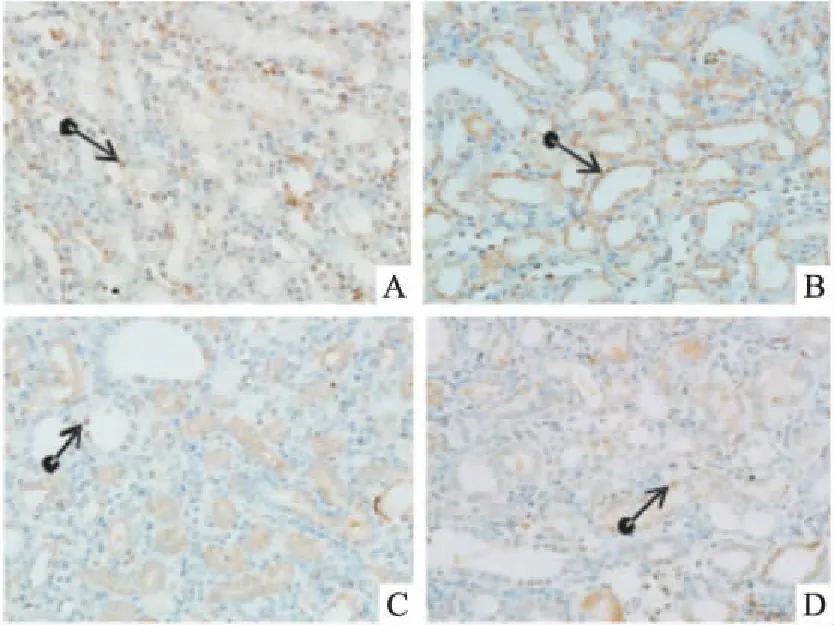
Fig 3 Expression of caspase-9 in UUO ratswith immunohistochemistry(×200)

Fig 4 Expression of caspase-12 in UUOrats with immunohistochemistry(×200)
Tab 3 Expression of caspase-9, caspase-12, Bax and Bcl-2 in rats induced with UUO by Western blot(±s,n=3)
**P<0.01vssham group;##P<0.01vsUUO group

Fig 5 Expression of Bax in UUO rats withimmunohistochemistry(10×20)
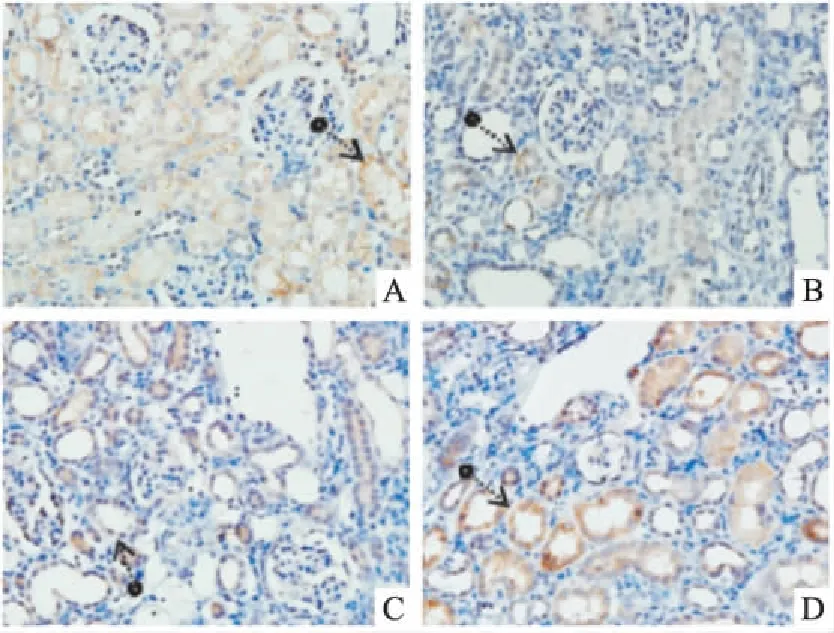
Fig 6 Expression of Bcl-2 in UUO ratswith immunohistochemistry(10×20)
3 讨论
肾小管间质纤维化(renal interstitial fibrosis, RIF)是各种慢性肾脏疾病发展至终末期肾衰竭的共同形态学特点和必然结局。与肾小球硬化相比,梗阻性肾病RIF病变程度与肾功能的关系更加密切,因此RIF程度成为反映肾功能状况和判断预后的重要依据,在慢性肾病转归中起着关键作用[4]。RIF进程是一缓慢的渐进过程,早期表现为炎性细胞浸润、氧化损伤及致纤维化细胞因子释放,继而肾小管上皮细胞表型转化、细胞凋亡或增殖,最终导致细胞外基质(extracellular matrix, ECM)沉积[5]。大量研究表明,梗阻可激活RAAS[6]。以往对血管紧张素Ⅱ(angiotensin Ⅱ, Ang Ⅱ)关注较多,其发挥作用主要在梗阻早期,通过直接或间质刺激细胞因子的产生,诱导肾脏损伤。随着对RAAS的深入研究,发现作为下游效应分子的醛固酮可能发挥着更为重要的介导作用,醛固酮可作为一个独立的致病因素参与RIF进程[7]。

Fig 7 Expression of caspase-9, caspase-12, Baxand Bcl-2 in UUO rats with Western blot
作为人体内作用最强的盐皮质激素,醛固酮能与靶上皮细胞内特定的盐皮质激素受体(mineralocorticoid receptor , MR)结合,形成复合物,转运到细胞核内,进而参与水钠代谢的调控。除了对血流动力学产生影响,醛固酮调节水钠代谢亦可引起氧化损伤。醛固酮能激活NADPH氧化酶,使活性氧簇( reactive oxygen species, ROS)生成明显增多,促进炎症反应,导致ECM集聚[8]。临床报道指出,梗阻性肾病患者超氧阴离子(O2-)、过氧化氢(H2O2)等ROS的成员明显升高[9]。动物实验表明,UUO术后5 d,肾组织NADPH氧化酶活性开始上调,术后14 d达到高峰。另外,UUO术后5 d,抗氧化物如超氧化物歧化酶(superoxide dismutase, SOD)活性下降,持续到术后14 d[10]。可见,梗阻导致肾脏损伤,进而激活醛固酮,其活化后诱导氧化应激,又加重了肾脏损伤,且与Ang Ⅱ相互作用,共同参与RIF进程[11]。因此,阻断醛固酮的氧化损伤作用,对于减缓肾脏病的进展有重要意义。但是由于ROS不稳定性,其难以直接检测,可通过其形成的氧化产物评估氧化应激状态。8-OhdG是敏感的DNA损害生物指标,是最能反映机体内DNA 氧化损伤程度的标志物。本实验中,模型组大鼠血清及尿液8-OhdG含量较假手术组明显升高,且与血清醛固酮的升高相一致,说明醛固酮可能通过氧化应激加重肾脏损伤。
梗阻性肾病与氧化应激和肾小管上皮细胞凋亡均有密切的联系,虽然具体的分子机制尚不明确,但氧化应激确实是介导细胞凋亡的重要环节[12]。目前认为细胞凋亡信号传导通路主要包括3种:线粒体凋亡途径、死亡受体凋亡途径以及内质网反应途径(endoplasmic reticulum stress,ERS)。Caspase-12是ERS 导致凋亡的特异性介质,以无活性的前体形态定位于内质网膜上,只有在ERS发生时,caspase-12 才会被激活。活化的caspase-12 发生移位后,进一步激活下游的caspase-3、caspase-9 等,引发级联反应,参与ERS引起的细胞凋亡[13]。Bcl-2家族在细胞凋亡信号传导过程中亦发挥重要作用,其中Bcl-2和Bax是Bcl-2家族中最具代表性的两个成员。Bcl-2为抑制凋亡因子,而Bax为促进凋亡因子,两者相互作用,共同调控细胞的存亡。Truong等[14]实验表明,结扎单侧输尿管后,上皮细胞的凋亡最早出现在集合管,7 ~ 24 d达到高峰,随后逐渐降低,其中涉及一系列凋亡调控因子,包括抑制凋亡的Bcl-2蛋白。因此,调控细胞凋亡,特别是抑制肾小管上皮细胞凋亡,有助于肾脏修复,尤其是对梗阻解除后肾功能持续恶化的患者更有治疗意义。本实验证实梗阻性肾脏凋亡细胞明显增多,caspase-12、caspase-9、Bax和Bcl-2表达异常,血尿8-OhdG升高,说明氧化损伤参与细胞的凋亡。
血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors, ACEI)或血管紧张素Ⅱ受体阻断剂(angiotensin II receptor blockers, ARB)是治疗肾脏疾病的常用药物,在一定程度上可减缓肾脏损伤,但仍有不少患者出现醛固酮逃逸现象,表现为血浆醛固酮水平升高,其升高程度与尿蛋白排泄和肾功能恶化进程正相关[15]。作为具有高度选择性的醛固酮受体阻断剂,依普利酮通过抑制醛固酮与其受体的结合,从而阻止醛固酮受体复合物的形成,进而抑制其活化,延缓RIF进程[16]。目前,依普利酮在国外作为心脏病、高血压及肾脏病的主要治疗药物,我们之前的实验也证实其可以抑制环孢素诱导的急性肾损伤以及梗阻性肾病导致的细胞增殖[17-19]。本次实验采用UUO造模,复制RIF动物模型,激活RAAS,诱导醛固酮活化,通过氧化应激介导肾小管上皮细胞凋亡。结果证实,依普利酮拮抗了醛固酮与MR的结合,进而阻断醛固酮介导的氧化损伤,下调 8-OhdG表达,抑制肾小管上皮细胞凋亡,从而达到减轻肾间质纤维化的作用,至于血清中醛固酮含量升高,是由于阻断其与受体结合所致。
本实验观察中药对细胞凋亡的影响,结果证实活血解毒中药可以减轻梗阻性肾病细胞凋亡,其机制与抑制醛固酮诱导的氧化损伤相关,为临床治疗提供了实验依据。
(致谢:本实验主要在河北省中西医结合肝肾病重点实验室完成,在此对实验室的各位老师及同学的帮助致以衷心的感谢!)
[1] Patni H, Mathew J T, Luan L, et al . Aldosterone promotes proximal tubular cell apoptosis: role of oxidative stress[J].AmJPhysiolRenalPhysiol, 2007,293(4): F1065-71.
[2] Circu M L, Aw T Y. Reactive oxygen species, cellular redox systems, and apoptosis[J].FreeRadicBiolMed, 2010,331: 749-62.
[3] Iwai T, Kitamoto K, Teramoto K, et al. Cobait protoporphyrin attenuates rat obstructive nephropathy: role of cellular infiltration[J].Urology, 2008,72(2): 432-8.
[4] Eddy A A. Overview of the cellular and molecular basis of kidney fibrosis[J].KidneyIntSuppl, 2014,4(1):2-8.
[5] Siddesha J M, Valente A J, Sakamuri S S, et al. Angiotensin II stimulates cardiac fibroblast migration via the differential regulation of matrixins and RECK[J].JMolCellCardiol, 2013,65: 9-18.
[6] Okabe M,Miyazaki Y,Niimura F, et al. Unilateral ureteral obstruction attenuates intrarenal angiotensin Ⅱ generation induced by podocyte injury[J].AmJPhysiolRenalPhysiol, 2015,308(8): F932-7.
[7] Bai M,Chen Y,Zhao M, et al. NLRP3 inflammasome activation contributes to aldosterone-induced podocyte injury[J].AmJPhysiolRenalPhysiol, 2017,312(4): F556-64.
[8] Ding W,Xu C,Wang B. Rotenone attenuates renal injury in aldosterone-infused rats by inhibiting oxidative stress, mitochondrial dysfunction, and inflammasome Activation[J].MedSciMonit, 2015,21: 3136-43.
[9] Nishiyama A, Kusaka T, Kitajima H. Role of aldosterone in oxidative stress and renal injury[J].YakugakuZasshi, 2007,127(9): 1331-7.
[10]Manucha W, Vallés P G. Cytoprotective role of nitric oxide associated with Hsp70 expression in neonatal obstructive nephropathy[J].NitricOxide, 2008,18(3): 204-15.
[11]Wagman G, Fudim M, Konmas C E, et al. The neurohormonal network in the RAAS can bend before breaking[J].CurrHeartFailRep, 2012,9(2):81-91.
[12]Patni H, Mathew J T, Luan L,et al. Aldosterone promotes proximal tubular cell apoptosis: role of oxidative stress[J].AmJPhysiolRenalPhysiol, 2007,293(4): 1065-71.
[13]Jiménez Fernández D, Lamkanfi M. Inflammatory caspases: key regulators of inflammation and cell death[J].BiolChem, 2015,396:193-203.
[14]Truong L D, Sheikh-Hamad D, Chakraborty S. Cell apoptosis and proliferation in obstructive uropathy[J].SeminNePhrol, 1998,18:641-51.
[15]Hostetter T H, Rosenberg M E, Ibrahim H N, et al. Aldosterone in renal disease[J].CurrOpinNephrolHypertens, 2001,10(1):105-10.
[16]William B L, Eun S K, James M L. Aldosterone antagonism or synthase inhibition reduces end-organ damage induced by treatment with angiotensin and high salt[J].KidneyInt, 2009,75(9): 936-44.
[17]吴丽敏,陈立祥,梁丽娟,等. 依普利酮下调SGK-1表达抑制梗阻性肾病细胞增殖的研究[J].中国药理学通报, 2016,32(1): 69-73.
[17]Wu L M, Chen L X, Liang L J, et al. Inhibitory effects of eplerenone on cell proliferation via down-regulated SGK-1 pathway in rats with unilateral ureteral obstruction[J].ChinPharmacolBull, 2016,32(1): 69-73.
[18]梁丽娟, 王 筝, 王 蕊, 等. 依普利酮下调TNF-α、NF-κB抑制细胞表型转化的研究[J].中国药理学通报, 2013,29(11): 1553-7.
[18]Liang L J, Wang Z, Wang R, et al. Inhibitory effects of eplerenone on epithelial-mesenchymal transformation via down-regulated TNF-α and NF-κB in rats with unilateral ureteral obstruction[J].ChinPharmacolBull, 2013,29(11): 1553-7.
[19]Wang C H, Wang Z, Liang L J, et al. The inhibitory effect of eplerenone on cell proliferation in the contralateral kidneys of rats with unilateral ureteral obstruction[J].Nephron, 2017,136(4):328-38.
InhibitoryeffectsofHuoxueJiedudecoctiononcellapoptosisviadown-regulating8-OhdGinobstructivenephropathyrats
WANG Zheng1,2,CHANG Yi1,2,XIONG Yun-zhao1,3,WANG Xuan1,3,WANG Cong-hui1,WANG Miao1,WANG Xiang-ting1,2,SUN Dong-yun1,LIANG Li-juan1,XU Qing-you1,2
(1.HebeiUniversityofChineseMedicine, 2.HebeiKeyLabofIntegrativeMedicineonLiver-KidneyPatterns,Shijiazhuang050200,China;3.GraduateSchoolofHebeiMedicalUniversityHebeiMedicalUniversity,Shijiazhuang050091,China)
AimTo observe the effect of eplerenone(EPL) and Chinese decoction on cell apoptosis in obstructive nephropathy rats.MethodsSixty male Wistar rats were randomly divided into sham group, UUO group, EPL group and ZY group(n=15). Except sham group, the rats in the other groups were ligated with unilateral ureteral obstruction(UUO) for renal interstitial fibrosis model. The rats were treated with eplerenone at 100 mg·kg-1·d-1added to diet in EPL group, and orally 13.7 g·kg-1·d-1decoction of Chinese medicine in ZY group. The kidneys were harvested on 14th day, the number of renal cell apoptosis were detected by TUNEL, and serum aldosterone and 8-OhdG were detected with radioimmunoassay and ELISA. Caspase-12, caspase-9, Bax and Bcl-2 were examined by immunohistochemistry and Western blot.ResultsThe levels of serum aldosterone, serum and urine 8-OhdG and the number of positive apoptotic cells increased significantly in UUO rats compared with Sham group. The overexpression of caspase-9, caspase-12 and Bax and down-regulated Bcl-2 were obvious in UUO group(P<0.01). The level of 8-OhdG, expression of caspase-9, caspase-12 and Bax were down-regulated, and Bcl-2 expression was up-regulated in eplerenone and Chinese decoction treated rats(P<0.01).ConclusionEplerenone and Chinese decoction could inhibit cell apoptosis induced by oxidative damage after UUO via caspases and(or) Bax pathway.
8-OhdG; apoptosis; oxidative damage; eplerenone; aldosterone; renal fibrosis; caspase-12;caspase-9;Bax;Bcl-2
时间:2017-8-20 16:47 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170820.1647.052.html
2017-06-02,
2017-07-01
国家自然科学基金资助项目(No 81473652);河北省自然科学基金项目(No H2016423059,H2015423009);河北省高等学校科学技术研究项目(No QN2015144)
王 筝(1984-),女,博士,讲师,研究方向:肾脏病中西医结合临床及基础,E-mail:1017425887@qq.com; 许庆友(1958-),男,博士,教授,博士生导师,研究方向:肾脏病中西医结合临床及基础,通讯作者,E-mail:qingyouxu@sohu.com
10.3969/j.issn.1001-1978.2017.09.026
A
:1001-1978(2017)09-1324-06
R-332;R322.61;R329.25;R692.053.1

