一株地衣芽孢杆菌产凝乳酶酶学性质研究
宋 曦,汪 慧,尚 菲,韩 雍,刘圆媛
(1陇东学院农林科技学院,甘肃庆阳 745000;2陇东学院生命科学技术学院,甘肃庆阳 745000)
一株地衣芽孢杆菌产凝乳酶酶学性质研究
宋 曦1,汪 慧1,尚 菲2,韩 雍1,刘圆媛1
(1陇东学院农林科技学院,甘肃庆阳 745000;2陇东学院生命科学技术学院,甘肃庆阳 745000)
目的:对地衣芽孢杆菌所产凝乳酶的酶学特性进行研究。方法:在不同的温度、pH值、底物浓度、不同金属离子等条件下测定地衣芽孢杆菌产凝乳酶相对酶活力。结果:地衣芽孢杆菌所产凝乳酶最适凝乳温度为70℃;40℃以上热处理后凝乳活性有不同程度的损失,75℃热处理10min后凝乳酶活性丧失;pH值为5~8时凝乳活性随乳pH值的降低而增强,pH值为7时凝乳酶最稳定;Ca2+、Fe2+、Fe3+、Mn2+、Mg2+、Al3+对酶活性有一定的促进作用;Li2+、Na+、Cu2+、Zn2+对酶活性有抑制作用;底物浓度最适为250 g/L、Ca2+的最适浓度为0.014 g/L。
地衣芽孢杆菌;凝乳酶
凝乳酶在干酪加工过程中主要作用为专一性地水解乳中κ-酪蛋白第105~106 位苯丙氨酸和甲硫氨酸之间的肽键,形成稳定的副κ-酪蛋白及亲水性的糖巨肽[1-3]。国际市场上凝乳酶中动物性来源的约占70%、微生物性的占30%、植物性的不到1%。微生物产凝乳酶不受自然条件影响,生产成本低,可大规模工业化生产,所以成为国内外的研究重点[2-8]。
本试验从甘肃省天祝藏族自治县牦牛牧区土壤中分离得到高产凝乳酶菌株1株,对其进行分子鉴定表明该菌株与地衣芽孢杆菌BacilluslicheniformisstrainN8 和BacilluslicheniformisstrainYP1A同源性为99%,标记为D3.11。
1 材料与方法
1.1 材料与仪器设备
菌种:实验室筛选菌种,经16sRNA序列分析比对,确定为地衣芽孢杆菌。
试剂:酪蛋白、牛肉膏、磷酸氢二钠、氯化钠、琼脂、蒸馏水、10%脱脂牛乳、硫酸铵等。
仪器与设备:冷冻离心机、电子分析天平、显微镜、摇床、恒温培养箱,超净工作台,试管(若干)、接种针、接种枪、酒精灯、玻璃棒、纱布、棉线、铁架台、移液管、三角瓶(若干)、培养皿等。
1.2 方法
1.2.1 测定方法
(1)硫酸铵盐析用量条件的确定:低温条件下向发酵液中缓慢加入研细的硫酸铵粉末至20 %~30 %饱和度,静置3 h,在12 000 r/min、4 ℃下离心10 min,分别收集上清液。同样条件下,再缓慢向上清液中加入硫酸铵至70%、80%、90%、100%饱和度,沉淀过夜,在12 000 r/min、4 ℃下离心10 min,分别收集沉淀,溶于pH为6.0的磷酸盐缓冲溶液中待测用。
(2)凝乳酶凝乳活性的测定:采用Arima方法[9],取5 mL 100g/L的脱脂乳,在一定温度下保温5 min,加入1 mL酶液,迅速混合均匀,准确记录从加入酶液到乳凝固的时间(s)。把40 min凝固1 mL 100 g/L脱脂乳的酶量定义为一个索氏单位。
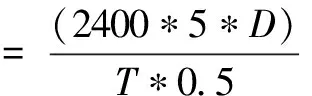
T—凝乳时间;D—稀释倍数

1.2.2 试验方法
(1)酶的最适凝乳温度:将酶液分别在25、30、35、40、45、50、55、60、65、70 ℃下保温5 min 后测定酶活力,以35 ℃时的酶活力为对照。
(2)酶的热稳定性:将酶液分别在40、50、60、70 ℃下保温10、20、30、40、50、60 min后,测定酶活力,以35 ℃时的酶活为力为对照。
(3)脱脂乳的pH值对酶凝乳活性的影响:用0.1 mol/L HCl和0.1 mol/L NaOH将100 g/L的脱脂乳的pH分别调节到5.5、5.8、6.1、6.4、6.7在酶最适宜的凝乳温度下测定酶的凝乳活性,以脱脂乳自然pH值(6.5)下酶活力为对照。
(4)不同pH值下的稳定性:用0.1 mol/L HCl和0.1mol/L NaOH将酶液调节到pH为2、3、4、5、6、7、8、9、10、11、12,在室温下放置过夜后,再将酶液pH调节到酶最适pH值,在酶最适温度下测定酶活力,以酶液pH自然时的酶活作为对照。
(5)Ca2+对酶凝乳活性的影响:脱脂乳中添加CaCl2,使其含量分别为0.004、0.006、0.008、0.012、0.014、0.016、0.018 g/L,35 ℃下测定凝乳酶活,以CaCl2添加量为 0.011 g/L的脱脂乳时的酶活作为对照。
(6)金属离子对酶的凝乳活性的影响:配制KCl,MgSO4、LiSO4、FeCl2、NaCl、MnSO4、Fe(SO4)3、Al(SO4)3、CuSO4、ZnCl含量分别为0.05 mol/L的脱脂乳溶液,在酶的最适作用温度下测定酶活力,以未添加金属离子的10 %脱脂乳时的酶活为对照。
(7)底物浓度对酶的凝乳活性的影响:脱脂奶粉配制成10、50、100、150、200、250 g/L溶液,35 ℃下测定酶活力,以脱脂乳为10 %的酶活为对照。
2 结果与分析
2.1 硫酸铵用量的确定
将收集沉淀溶解于pH 6.8的磷酸缓冲液中,测定凝乳酶活力。表1可知,酶活在初始硫酸铵浓度为20 %时最高,其原因可能是30 %时浓度过大,而使酶蛋白有一定的沉淀。在同样条件下缓慢向上清液中加入硫酸铵至70 %、80 %、90 %、100 %饱和度,沉淀过夜,测得在加入硫酸铵至浓度为70 %时酶活力最高。
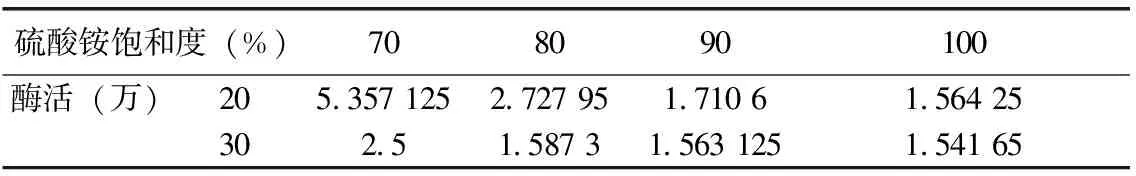
表1 不同硫酸铵饱和度下的酶活
2.2 酶的最适凝乳温度
将已分离纯化好的酶液分别在25~70 ℃范围内保温10 min后测定凝乳酶活力。图1结果表明,D3.11菌株所产凝乳酶在35~70 ℃有较高的凝乳活力,凝乳最适温度为70 ℃,当温度低于30 ℃时凝乳速度缓慢。在温度为35~70 ℃之间凝乳酶活力较高,从30 ℃开始凝乳酶活力与温度成正比,高于70 ℃时,活力迅速下降,升至75 ℃时失活。在酶蛋白的活性范围内,随着温度的升高会加快酶促反应的进行,但高于酶的最适反应温度后,高温会使凝乳酶性质发生改变,甚至使酶失去活力,所以导致相对酶活力迅速降低,当凝乳酶失去活性后,其相对凝乳活力为零。
2.3 酶的热稳定性
将已分离纯化好的酶液分别在40、50、60、70 ℃下保温10、20、30、40、50、60 min,测定其剩余活力,表2结果表明,凝乳酶在40 ℃下处理60 min,凝乳活性比处理前有所增高;在50 ℃下处理10 min时酶活较处理前有所提高,但继续处理20、30、40、50、60 min后酶活力逐渐降低;在60 ℃下处理10、20、30、40、50、60 min后酶活力大幅度降低,处理60 min时活力丧失73.1%;70 ℃下处理10 min后凝乳酶活力即完全丧失。酶的变性不仅取决与温度的高低,还与该温度下保持的时间长短有关,在高于变性温度下,酶在很短时间内出现高凝乳活性,但随时间延长,活性逐渐损失,直至完全失活。
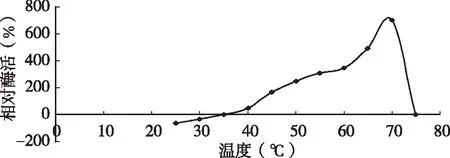
图1 不同温度下凝乳酶的相对酶活
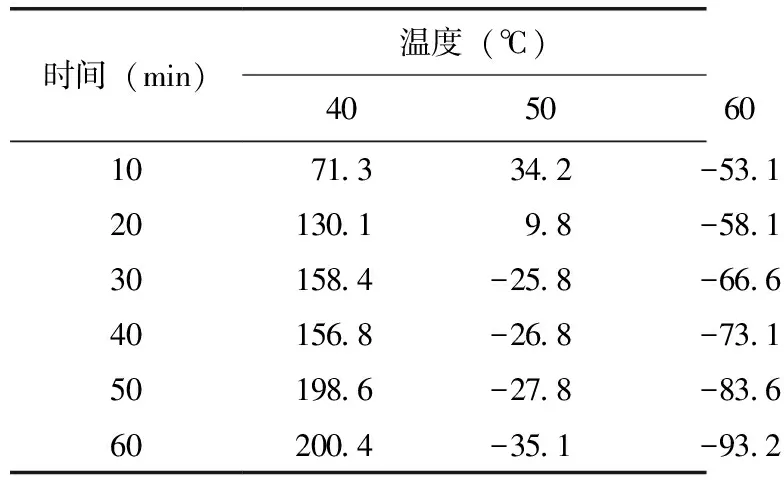
表2 一定温度下保持一定时间后凝乳酶的相对酶活
2.4 底物pH值对凝乳酶活力的影响
将脱脂乳pH值分别调节为pH 5.5、5.8、6.1、6.4、6.7后测定凝乳酶活力。由图2可知,随着pH值的升高,凝乳活力整体呈下降趋势,在酸性条件下酶具有较高的凝乳活力,pH为5.5时凝乳活力最高。当pH为6.7时凝乳活力则下降很快,不到对照试验的20 %。出现以上现象是因为pH值的变化会影响到酶的空间结构,可能导致酶活性部位可基团改变,酶分子活性中心催化基团和结合基团的离解,底物的离解及酶~底物复合物的离解,从而影响反应动力学,影响酶反应速度。
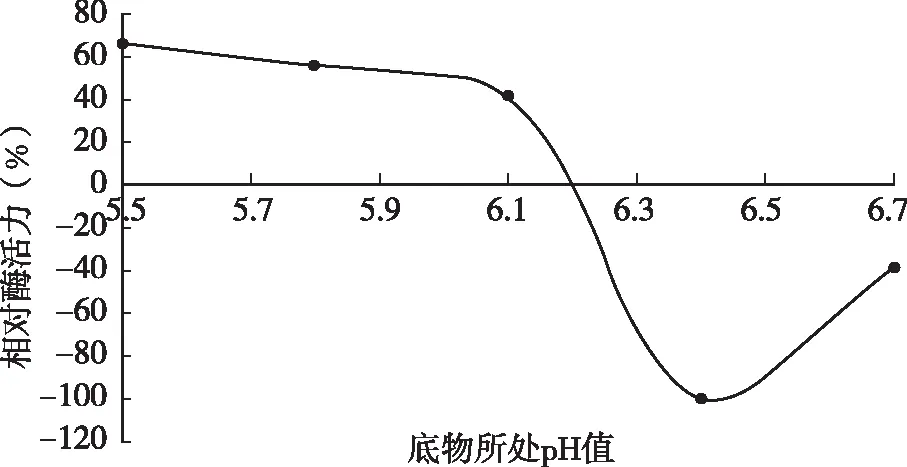
图2 脱脂乳pH值对凝乳酶活性的影响
2.5 酶液在不同pH值时的稳定性
用0.1mol/L的HCl和NaOH将不同酶液调至pH为2、3、4、5、6、7、8、9、10、11、12,室温下放置过夜,然后将pH值调到6.0,测定凝乳酶活力。图3结果表明,D3.11菌株所产凝乳酶在弱酸和中性偏碱的环境中都还保留有一定的凝乳活力,在pH为7时较稳定,超过pH 7值,酶的稳定性下降,活力受影响,甚至完全失活。当pH高于7.0或低于2.0时酶活损失严重,说明该凝乳酶在强酸,强碱条件下都不稳定。过酸或过碱会影响酶蛋白的结构,甚至使酶变性而失活。
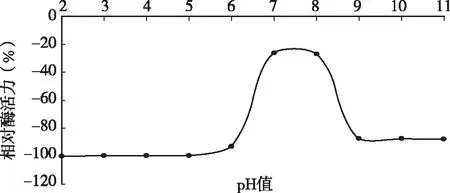
图3 凝乳酶在不同pH值处理后酶活力
2.6 Ca2+对凝乳酶活性的影响
由图4可知,CaCl2质量浓度达到0.014 g/L时凝乳活力呈增加趋势,低浓度的Ca2+对酶的凝乳活力影响较小,到0.018 g/L趋于稳定;从整体上看Ca2+加速了凝乳过程。当CaCl2添加量不足时,凝乳时间延长,而且凝块组织松散;反之,添加过多时,虽然凝乳速度加快,但凝块坚实,所以CaCl2的添加量应该在一个稳定的范围内,此凝乳酶在0.018 g/L趋于稳定。
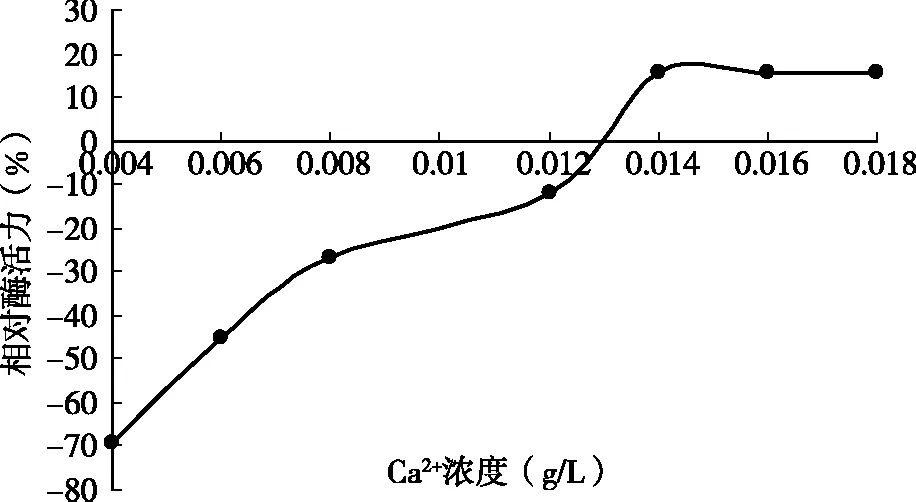
图4 Ca2+对酶凝乳效果的影响
2.7 其他金属离子对酶的凝乳效果的影响
当脱脂乳中不同金属离子的含量为0.05 mol/L时,测定凝乳酶活力。由表3可知,Fe2+、Fe3+、Mn2+、Mg2+、Al3+对凝乳活力有显著的促进作用,其中Fe2+最大可使凝乳活力提高46.3%,Mg2+最小也有1.6 %的促进作用。Li2+、Na+、Cu2+、Zn2+对凝乳活力有抑制作用,Cu2+对凝乳活力抑制能力最大,达到60.8%,而Li2+、Na+抑制作用最小都达到13.1 %。k+对凝乳活力的影响不明显。
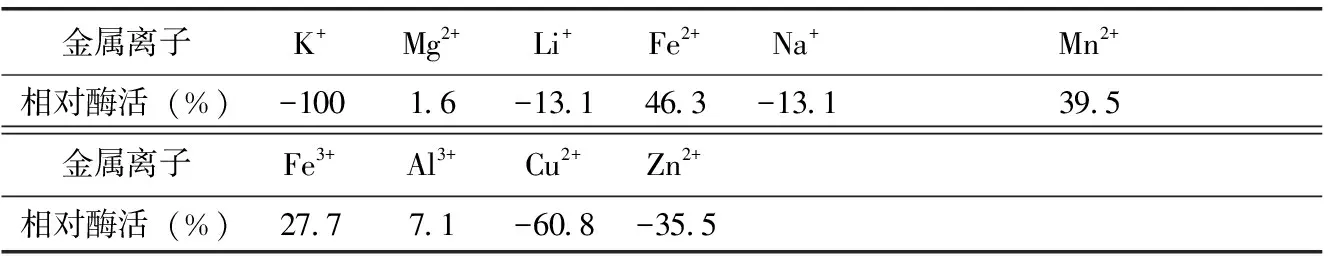
表3 不同金属离子对凝乳酶活力影响
2.8 底物浓度对酶的凝乳效果的影响
由图5可知,脱脂乳浓度分别为10、50、100、150、200、250 g/L时测定凝乳酶活力,结果表明脱脂乳的不同浓度对凝乳酶的酶活力有一定程度的影响,当脱脂乳液的浓度高于一定程度时,酶的活力有所减弱。底物浓度越大,凝乳酶活性越高,当底物浓度小于200 g/L时,随着底物浓度的增大,酶凝乳活性增加较快,当大于200g/L时,酶的凝乳活性趋于稳定,凝乳酶活力最大。
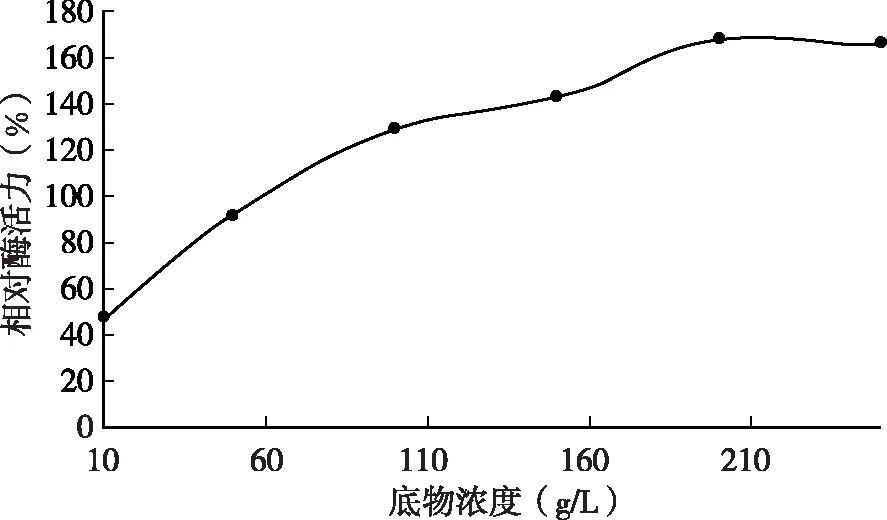
图5 不同脱脂乳浓度时的凝乳酶相对酶活
3 结论与讨论
(1)菌株D3.11产凝乳酶分离时采用硫酸铵为初始饱和度为20 %,加入硫酸铵到饱和度为70 %时效果最佳。(2)菌株D3.11产凝乳酶的最适凝乳温度为70℃。在40 ℃下处理60 min,酶的活力较稳定,凝乳活性比处理前有所增高;在50 ℃下处理10 min酶活较处理前有所提高,但继续处理20、30、40、50、60 min酶活力逐渐降低;70℃下处理10 min后酶活力丧失。说明该菌株产凝乳酶耐高温,适合于工业生产。国内薛璐等人对江米酒凝乳酶酶学特性的研究表明,其温度在65℃后酶活力丧失[10]。高维东等[11]对微小毛霉凝乳酶酶学性质的研究表明,其最适温度为60、70℃后酶活力丧失。王博达等[12]将解淀粉芽孢杆菌所产凝乳酶进行克隆、重组表达后发现重组后的凝乳酶在70℃时酶活力最高,说明D3.11所产凝乳酶耐高温性能较好。(3)pH为5.5时凝乳活力最高。菌株D3.11产凝乳酶,强碱条件下都不稳。所以在该凝乳酶的应用过程中,必须将酶的反应环境pH值控制在弱酸性条件下。CARIAS J R等[13]对黄色粘球菌产凝乳酶研究表明,该菌在pH 6.0时酶活力最高。CAVALCANTI M T H等[14-15]对诺卡氏菌所产凝乳酶研究表明,其最适pH值为11.0和7.5,即在碱性条件下较稳定,可见不同细菌所产凝乳酶最适pH值相差较大。(4)Fe2+、Fe3+、Mn2+、Mg2+、Al3+对菌株D3.11产凝乳酶凝乳活力有显著的促进作用。Li2+、Na+、Cu2+、Zn2+对菌株D3.11产凝乳酶凝乳活力有抑制作用。K+对菌株D3.11产凝乳酶的凝乳活力的影响不明显。Ca2+最适浓度为0.014 g/L,Ca2+参与乳的凝固过程,当酶作用于酪蛋白形成福κ-酪蛋白时,Ca2+可加速副κ-酪蛋白的进一步聚集而凝固。同时副κ-酪蛋白对凝乳酶本身也有一定的影响[3,16]。脱脂乳浓度为200g/L时,酶活力最大。◇
[1]刘显庭,张昊,郭慧媛,等.凝乳酶在干酪生产中的应用[J].中国乳业,2013(133):54-57.
[2]郭本恒.乳品化学[M].北京:中国轻工业出版社,2001:7.
[3]BRUNO M A,et al.Milk cloting and proteolytic activity of an enzyme preparation from Bromelia hieromymi fruits[J].LWT-Food Science and Technology,2010,43(4):697-701.
[4]高维东,甘伯中,丁福军,等.微生物凝乳酶的研究进展[J].中国乳品工业,2009,37(5):34-36.
[5]张卫兵,宋曦,贺晓玲,等.Bacillus licheniformis产凝乳酶培养基的优化[J].中国酿造,2011,30(2):70-73.
[6]Prados,PINO A,Fernandez-salguero J.Effect of a powdered begetable coagulant from Cynara cardunculus in the accelerated ripening of Mznchego cheese[J].Int J Food Sci Technol,2007,42(5):556-561.
[7]杜琨,张亚宁.干酪的营养价值及研究动态[J].中国食物与营养,2005(10):45-46.
[8]杭锋,洪青,王钦博,等.凝乳酶的研究进展[J].食品科学,2016,30(3):273-279.
[9]K Arima,I Shinjiro,T Gakuzo.Milk-clltting enzymes from microorganinism,Part InScreening test and identification of potent fungus[J].Agric Biol Chem,1967,31(5):540-545.
[10]薛璐,陈历俊,姜铁民,等.江米酒凝乳酶酶学特性的研究[J].食品科学,2008,29(4):259-262.
[11]高维东,甘伯中,丁福军,等.微小毛霉凝乳酶的酶学性质研究[J].食品科学,2010,31(3):185-188.
[12]王博达,丁重阳,张梁,等.解淀粉芽孢杆菌凝乳酶的克隆、重组表达及酶学性质[J].工业微生物,2016,45(6):9-15.
[13]CARIAS J R,RAUBGEAUD J,MAZAUD C,et al.A chymosin-like extracellular acidic endoprotease from Myxococcus xanthus[J].J Bacteriol,1992,174(15):5136-5140.
[14]CAVALCANTI M T H,et al.Partial purification of new milk-clotting enzyme produced by Nocardiopsis sp.[J].Bioresource Technol,2004,93(1):29-35.
[15]CAVALCANTI M T H,et al.Milk clotting protease production by Nocardiopsis sp.in an inexpensive medium[J].World J Microb Biot,2005,21(2):151-154.
[16]FOLTMANN B,et al.The primary sructure of calf chymosin[J].J Biol Chem,1979(254):8447-8456.
(责任编辑 李婷婷)
The Properties of Chymosin fromBacilluslicheniformis
SONG Xi1,WANG Hui1,SHANG Fei2,HAN Yong1, LIU Yuan-yuan1
(1College of Agriculture and Forestry;2College of life Science and Technology,Longdong University,Qingyang 745000,China)

Bacilluslicheniformis;chymosin
宋曦(1984— ),女,硕士研究生,讲师,研究方向:食品营养与卫生。

