瓦松总黄酮的提取及其抑菌效果
孙森凤,张颖颖
(1山东中医药大学药学院,济南 250355; 2山东中医药大学中医学院,济南 250355)
瓦松总黄酮的提取及其抑菌效果
孙森凤1,张颖颖2
(1山东中医药大学药学院,济南 250355;2山东中医药大学中医学院,济南 250355)
目的:提取瓦松总黄酮并对其总黄酮含量进行测定,进一步观察总黄酮的抑菌效果。方法:采用超声法提取瓦松总黄酮,以芦丁为标准品,用紫外分光光度法测总黄酮的含量;并参照NCCLS规范,用微量稀释法来测定总黄酮最小抑菌浓度(MIC)和最小杀菌浓度(MBC)。结果:测定标准曲线线性相关性良好,R2=0.999 2,线性范围在0.02~0.6 mg/mL。瓦松总黄酮对福氏志贺菌标准株抑菌效果最好,对部分临床分离金黄色葡萄球菌耐甲氧西林株(MRSA)、表皮葡萄球菌标准株、大肠埃希菌及其临床分离株、肺炎克雷伯菌标准株及其临床分离株抑菌效果较好,对金黄色葡萄球菌的抑菌效果最弱。瓦松水提物抑菌趋势与总黄酮一致性较差,总黄酮及水提物均无明显的MBC。结论:瓦松总黄酮及其水提物对本试验选取的菌株均有一定的抑制作用,且抑制作用较好。黄酮好于水提物,作用机制以抑制为主,而非直接杀菌。瓦松总黄酮具有较好的抑菌效果,在食品开发上有较高研究价值。
瓦松总黄酮;抑菌活性;MIC;MBC
瓦松为景天科植物瓦松或晚红瓦松的全草,《新修本草》描述,瓦松气微、味酸,具有清热解毒、止血收敛、利湿消肿以及养心安神等功效,用于吐血、鼻衄、血痢、疟疾、痔疮、湿疹、痈毒和疔疮等症的治疗[1]。相关文献报道[2],瓦松有一定的食用价值,食用口感较好,可作为酱菜的生产原料,并可提取叶蛋白,在食品生产中有深入开发价值。在药理作用价值方面,现代临床研究发现瓦松具有抗肿瘤、抗癌、强心、抗病毒及免疫调节等方面均有较好的作用。Yoon Y等人[3]研究表明,日本瓦松粗提物对革兰氏阳性菌和革兰氏阴性菌共10个菌种216株菌均有一定的抑制效果,具有明显的广谱抗菌效应[3]。
瓦松的主要药效成分包括多糖、黄酮等物质,课题组前期已经对瓦松多糖的抑菌效果做了初步研究,发现瓦松多糖具有一定的抑菌活性,且其抑菌活性高于水提物。但目前国内外对瓦松黄酮抑菌的研究较少,为进一步研究瓦松抑菌的主要成分,深入揭示瓦松抑菌机制,课题组提取了瓦松总黄酮,对其抑菌活性开展初步研究。本实验中选用了部分常见可致食品污染细菌,包括金黄色葡萄球菌ATCC25923标准株及临床分离MRSA(金黄色葡萄球菌耐甲氧西林株)、大肠埃希菌ATCC25922标准株及部分临床分离株、变形杆菌标准株ATCC49027、表皮葡萄球菌ATCC12228标准株及其它部分临床分离菌株、肺炎克雷伯菌标准株ATCC13883及临床菌株等共计16株细菌,以不同浓度的瓦松黄酮和水提取物进行了对比实验,研究瓦松的抑菌效果,以期深入揭示瓦松抑菌机制,扩展瓦松在食品研发中的应用提供更多依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料 瓦松,粉碎后过40目筛,于密封袋中低温保存,备用;石油醚(批号:2014070,天津市精细化有限公司);无水乙醇(批号201602253,天津市精细化有限公司);营养琼脂(批号:20160508,北京奥博星);MH肉汤(批号:20140708,北京奥博星)。
1.1.2 仪器 UV9100B型紫外可见分光光度计(北京莱伯泰科仪器有限公司)、旋转蒸发仪(RE-52A上海亚荣生化仪器厂,上海)、KQ-500E型超声波清洗器(昆山市超声仪器有限公司)、离心机(TD5A-W湖南湘仪,湖南湘潭)、SHB-III循环水式多用真空泵(郑州长城科工贸有限公司)、FA1004N 电子天平(上海精密科学仪器有限公司)、SK-1快速混匀漩涡器(中国深圳)、远红外辐射干燥箱(上海阳光实验仪器有限公司)、梅特勒-托利多分析天平(上海先悦机电有限公司)、单通道及12道微量移液器(Dragon)、DHP-9162电热恒温培养箱(上海一恒)、96孔培养板(新星实验器材公司,江苏南通)、普朗DNM-9602酶标仪(北京普朗公司)、一次性无菌培养皿(直径90 mm,新星实验器材公司,江苏南通)、苏净安泰BSC-1300IIA生物洁净安全柜(苏净集团,江苏苏州)和麦氏比浊管(自制)。
1.1.3 菌株 标准菌株:金黄色葡萄球菌ATCC25923大肠埃希菌ATCC25922表皮葡萄球菌ATCC12228福氏志贺菌ATCC12022、变形杆菌ATCC49027;临床分离菌株:大肠埃希菌3株、MRSA(耐甲氧西林金黄色葡萄球菌)5株,总计12株。上述标准菌株及临床分离菌株均由山东中医药大学微生物教研室提供,各菌株以营养琼脂进行接种,37 ℃24 h培养后挑取菌苔以生理盐水配成1×106cfu/mL的对应菌液备用。
1.1.4 试剂及其配制
(1)试剂:标准品芦丁(10080-200707 中国药品生物制品检定所)、乙醇、亚硝酸钠、硝酸铝和氢氧化钠均为分析纯。
(2)试剂的配制:70%乙醇溶液;准确量取70 mL无水乙醇,加双蒸水30 mL,混匀;5%亚硝酸钠溶液;精确称取2.500 g亚硝酸钠溶于双蒸水中,在50 mL容量瓶中定容;10%硝酸铝溶液;精确称取5.000 g硝酸铝溶于双蒸水中,在50 mL容量瓶中定容;4%氢氧化钠溶液;精确称取10.000 g氢氧化钠溶于双蒸水中,在250 mL容量瓶中定容。
1.2 方法
1.2.1 标准溶液的制备 用电子天平精密称取120 ℃恒温干燥至恒重的芦丁标准品10 mg于50 mL容量瓶中,用50%乙醇溶解后定容至刻度,摇匀,即为浓度为0.2 mg/mL的标准溶液,置于4 ℃冰箱保存备用。
1.2.2 瓦松总黄酮提取及水提物制备
(1)瓦松总黄酮提取:参照相关文献进行瓦松总黄酮的提取[4]。精确称取瓦松30g,加入600mL 70%浓度的乙醇溶液,先超声波震荡处理40min,固液比1∶20,超声频率47.6Hz,提取温度40℃。之后于100℃的温度下回流2.5h。将总黄酮粗提液抽滤,弃去残渣,收集滤液。然后将滤液于4℃下8 000r/min离心20min,收集上清液入烧杯中。将所得样品溶液于旋蒸仪上旋蒸至近干,用尽量少的甲醇将其中样品洗至蒸发皿中,减压浓缩,水浴蒸干,得样品浸膏77.5mg/g,根据实验要求配成所需浓度。
(2)瓦松水提物:称取瓦松50 g,加入1 000 mL的蒸馏水,文火煎1h,除去药渣,浓缩水提液至50 mL,即得瓦松水煎液。最终浓度相当于原药1 g/mL。将浓缩液稀释至0.2 g/mL,以0.22 μm一次性无菌滤器过滤备用。
1.2.3 测定波长的选择 取标准溶液各2.0 mL置于10 mL容量瓶中,加5%亚硝酸钠溶液0.5 mL,摇匀,放置5min,再加10%硝酸铝溶液0.5 mL,摇匀,放置5min,然后加氢氧化钠试液4 mL,最后加50%乙醇定容,摇匀,放置15 min。以加0.00 mL标准品为空白对照,进行分光扫描。结果表明,芦丁在510 nm处有最大吸收峰。
1.2.4 标准曲线的绘制 分别量取标准液0、1.0、1.5、2、2.5、3于10 mL容量瓶,加5%的亚硝酸钠溶液0.5 mL,摇匀后静置5 min;然后加10%的硝酸铝0.5 mL,摇匀后静置5 min,最后加入4%的氢氧化钠溶液4 mL,并用50 %乙醇稀释至刻度。然后在波长510 nm处测定吸光度,以芦丁浓度(Y)对吸光度(X)进行回归分析,制作标准曲线,其回归方程为:Y=10X+0.018,R2=0.999 2。结果表明,芦丁(黄酮类化合物)浓度与对应的吸光度呈现良好的线性关系,符合Lambert-Beer定律。
1.2.5 培养基制备 营养琼脂,购自北京奥博星生物公司,按说明书配制后121 ℃高压灭菌20 min,分装于无菌培养皿制成平板,4 ℃保存备用。MH(B)肉汤购自北京奥博星生物公司,按说明书配制分装后于121 ℃高压灭菌20 min,4℃保存备用。
1.2.6 细菌培养 制备营养琼脂平板,分别取上述各菌密集划线接种于培养基表面,37 ℃培养24 h,以生理盐水洗脱菌苔制备菌液。
1.2.7 MIC测定 实验菌液的制备:采用比浊法,将菌液浓度调整为1×106CFU/mL。抑菌实验步骤参照NCCLS标准,采用微量稀释法进行[5]。在96孔板中每孔加入培养基100 μL,然后在第1行中加入100μL药液,从第1行中吸取100 μL混合液加入第2行,依次类推至第6行,得到2、4、8、16、32、64倍稀释药物梯度。第7行每孔加入庆大霉素注射液10 μL为阳性对照,第8行直接加入菌液做为阴性对照。以上药液和对照加样完毕后,每孔加入1×106CFU/mL的对应菌液10 μL,每个药物做3次平行试验,37 ℃培养24 h,以酶标仪对培养板在600 nm波长下测定 OD值,结合细菌生长情况判断结果。
1.2.8 MBC测定 从2.8中判定为MIC的孔中,吸取培养物取10μL,以涂布棒无菌操作均匀涂布于营养琼脂平板上,以37 ℃培养24 h后无明显生长现象的浓度作为最低杀菌浓度(MBC)[6]。
2 结果与分析
由表1可见,瓦松总黄酮对各菌均有较好抑制效果。对福氏志贺菌标准株的抑菌效果最好,MIC为0.625 mg/mL;对部分临床分离MRSA、表皮葡萄球菌标准株、大肠埃希菌及其临床分离株、肺炎克雷伯菌标准株及其临床分离株的抑菌效果次之,MIC是1.25 mg/mL;对金黄色葡萄球菌、变形杆菌及部分MRSA的抑菌效果较弱,MIC为2.5 mg/mL。瓦松水提物抑菌趋势与黄酮一致性较差,对金黄色葡萄球菌标准株、表皮葡萄球菌标准株及1株MRSA的MIC相同,均为12.5 mg/mL,对福氏志贺菌标准株和3株MRSA的MIC为50 mg/mL,对其余菌株的MIC均为100 mg/mL。从MIC结果看,瓦松总黄酮的抑菌活性要显著高于瓦松水提物。
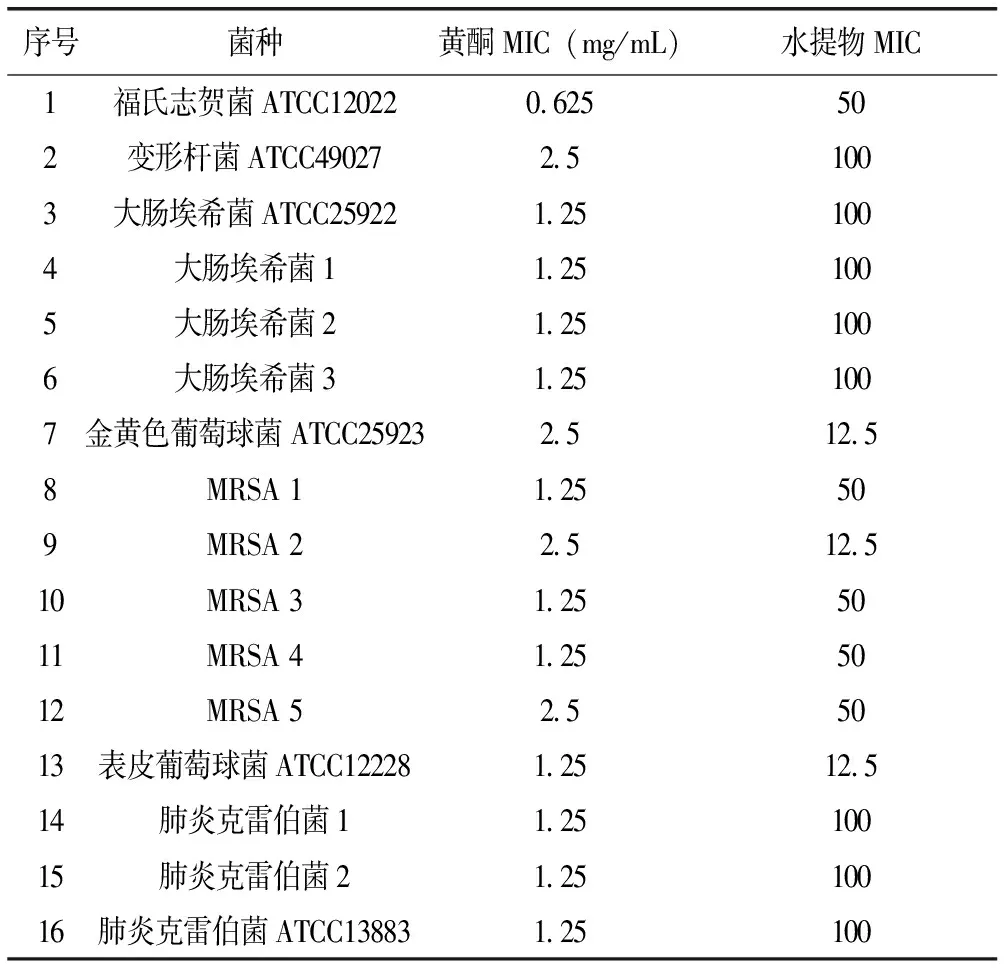
表1 瓦松总黄酮及水提物MIC结果
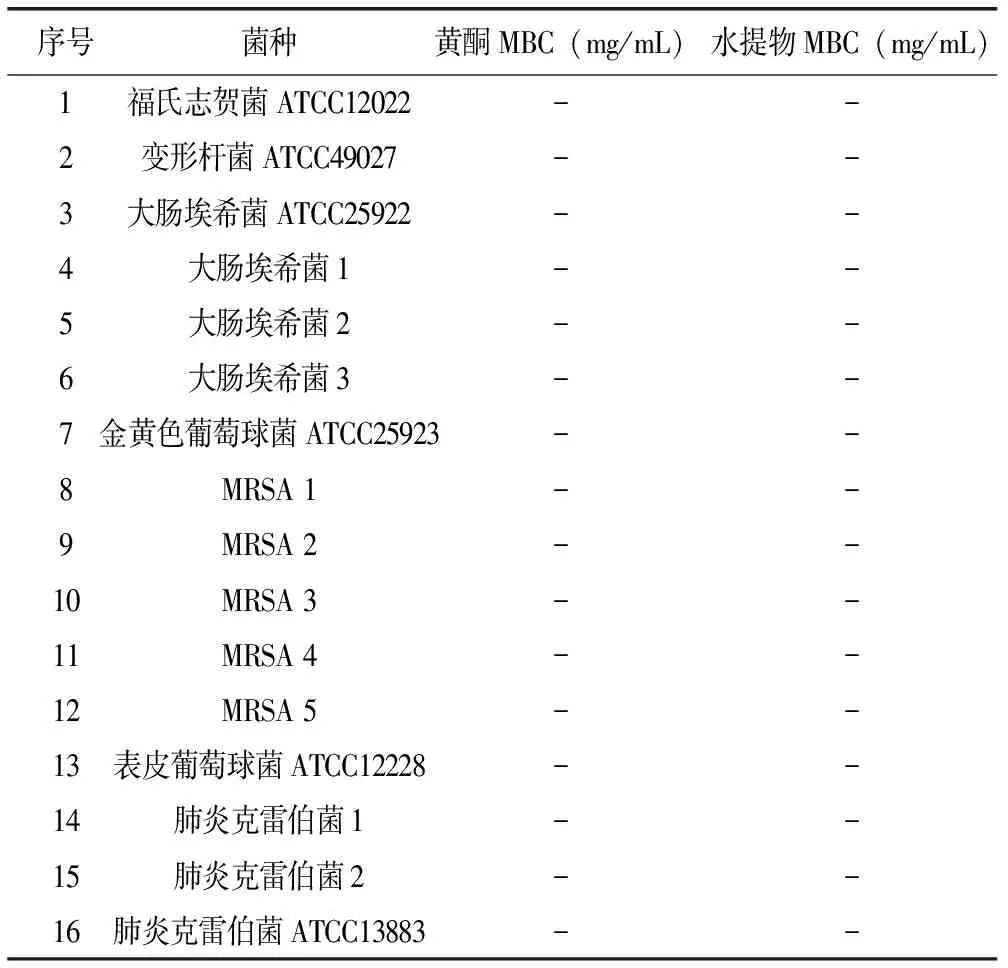
表2 瓦松总黄酮及水提物对各菌株的MBC结果
注:“-”表示无明显MBC。
由表2可见,瓦松总黄酮及水提物对各菌株均无明显的MBC,说明其作用机制主要为抑菌而非杀菌。
3 讨论
瓦松具有较高食用和药用价值。食用方面,瓦松新鲜植株肉质多汁,适口性较好,除可供人类食用外,在畜牧业上也有一定应用价值[7];药用方面,瓦松是民间应用较早的中药之一,具有多种药理活性[8]。文献报道,瓦松可用于吐血、鼻衄、血痢、疟疾、痔疮、湿疹、痈毒、疔疮以及肛周脓肿等症的治疗[1]。研究表明,瓦松对金黄色葡萄球菌等革兰阳性菌的抑菌效果较好;对大肠杆菌、变形杆菌等革兰氏阴性抑菌效果次之[9]。研究显示,瓦松的主要成分有黄酮类、有机酸类、甾醇类和强心苷等[10],其中黄酮类化合物是其重要药效成分。黄酮类化合物广泛存在于多种中药中,有抗微生物、抗氧化、降血糖和抗肿瘤等多种药理作用,特别是在抗微生物方面,对革兰阳性菌、阴性菌及部分真菌均有一定的抑菌效果[11]。目前,国外对瓦松属黄酮的研究主要集中于OrostachysjaponicusA. Berger上,以高效液相色谱—质谱联用对其黄酮成分进行了初步分析[12],发现其黄酮具有一定的抗氧化作用[13];在抗肿瘤方面,其黄酮可通过抑制Bcl-2和X-IAP来对MMP进行调节,进而诱导人淋巴细胞发生caspase依赖的细胞凋亡以抑制肿瘤[14];还可通过灭活Akt及调节紧密连接来抑制前列腺癌LNCaP细胞的侵袭[15];在其总黄酮中发现了7种具有较好钙蛋白酶抑制活性的成分[16],提示其有一定的抗溃疡作用;此外,该植物甲醇提取物对过氧化氢诱导所致 GT1-1小鼠下丘脑神经细胞的凋亡具有一定保护作用[17]。国内方面,王亚红等[18-20]对瓦松属总黄酮的提取及纯化方法做了初步研究;张桂芳等[21]发现瓦松黄酮粗提物对糖尿病大鼠的高脂血症和脏器损伤有明显的治疗和修复作用;王翔飞等[22]以黄花瓦松乙醇提取物和石油醚提取物作用于金黄色葡萄球菌,发现有一定抑菌效果。综合上述国内外研究,瓦松是一种既有食用价值又有药用价值的植物资源,可作为开发药食同源相关产品的重要原材料。为了深入研究瓦松的药用及食用价值,在前期研究的基础上,我们对瓦松总黄酮进行了初步提取,并对抑菌活性进行了检测。研究中选择了临床上常见引起感染的部分细菌,包括标准株及其部分临床分离株,对瓦松总黄酮的抑菌作用进行了初步研究。通过对比发现,瓦松总黄酮的抑菌效果要显著地好于水提物。
金黄色葡萄球菌是目前临床常见的致病菌之一,该菌容易产生耐药性,可引起皮肤软组织感染、败血症及导管相关性感染及食物中毒等多种疾病,是目前危及临床患者生命的重要致病菌[23],是食品的主要污染菌之一,近年来其典型耐药株耐甲氧西林金黄色葡萄球菌(MRSA)所致感染发生率呈现逐渐增高趋势[24];福氏志贺菌可致细菌性痢疾,在我国,福氏志贺菌导致的病例数占细菌性痢疾的80%以上[25],在夏秋季容易通过消化道传播,亦属消化道感染细菌之一;变形杆菌多为机会致病菌,但亦可能导致肠道感染以及泌尿系统感染,甚至导致腹泻等临床反应[26]。大肠埃希菌是临床上机会性感染的主要病原菌之一,能够引起泌尿系统、生殖系统及消化系统等感染[27],其中某些致病菌株可以污染食物,导致出血性结肠炎甚至尿毒症,严重危害食品安全;表皮葡萄球菌是凝固酶阴性葡萄球菌,一般不会导致疾病,但近年所致医源性感染不断增多[28];肺炎克雷伯菌是医院感染最常见的肠杆菌科细菌之一,主要有肺炎、尿路、胆道、伤口、导管及血流等的感染[29],该菌易产生耐药性变异,故在临床工作中应合理选择抗生素。上述各菌皆为临床常见感染菌,多数均可污染食物造成感染。本研究结果显示,瓦松黄酮对各菌均有一定抑制作用,故其结果对食品研究更具指导价值。
实验结果表明,瓦松总黄酮对其他各标准株和临床分离株均有较好的抑制作用。对福氏志贺菌标准株有最佳抑菌效果,其MIC为0.625 mg/mL;对2株临床分离MRSA、表皮葡萄球菌标准株、大肠埃希菌及其临床分离株、肺炎克雷伯菌标准株及其临床分离株的抑菌效果次之,MIC是1.25 mg/mL;对金黄色葡萄球菌、变形杆菌及2株临床分离MRSA的抑菌效果最差,MIC为2.5 mg/mL。瓦松水提物抑菌对金黄色葡萄球菌标准株、表皮葡萄球菌标准株及1株MRSA的MIC相同,均为12.5 mg/mL;对福氏志贺菌标准株和另外3株MRSA的MIC为50 mg/mL;对其余菌株的MIC均为100 mg/mL。MIC结果显示,瓦松总黄酮有较强的抑菌活性,显著好于瓦松水提取物。另从MIC的趋势来看,无论是多糖还是水提物,对金黄色葡萄球菌标准株和表皮葡萄球菌均有较强抑制效果,对其余菌株则有较大差异;所有检测的菌株均无明显MBC,提示瓦松水提物和瓦松总黄酮对上述细菌仅有抑制作用,无明显的杀灭作用。
MIC结果显示,瓦松总黄酮对临床分离的部分MRSA、大肠埃希菌和肺炎克雷伯菌都有较好抑制作用,且显著好于水提物,也好于课题组前期研究过的瓦松多糖(孙森凤,范华忠,付叶佩,等.瓦松多糖对部分临床感染菌的抑菌活性研究,《食品与药品》杂志已接收),证明瓦松总黄酮可能是瓦松最主要的抑菌成分。后继研究中将对瓦松总黄酮进行深入分析,并对其抗炎、镇痛等活性开展深入研究,进一步明确瓦松的活性物质,为拓展瓦松在食品生产中的应用提供更多依据。◇
[1]赵建国,曲伟红. 瓦松的现代研究进展[J]. 时珍国医国药,2007,18(10):2430-2431.
[2]陈金法. 瓦松的综合利用[J]. 中国林副特产,2009,6(6):99-100.
[3]蔡玉英,张伟韦,兴光,等. 中药瓦松粗提物抗菌效应[J]. 时珍国医国药,1999,10(12):885-886.
[4]祝波,王亚红. 正交优化超声波法提取瓦松总黄酮工艺的研究[J]. 中成药,2012,34(12):2426-2428.
[5]Rex J H. Reference Method for Broth Dilution Antifungal Susceptibility Testing of Yeasts:Third Informational Supplement[M]. Clinical and Laboratory Standards Institute,2008.
[6]陈秀枢,屠湧涛. 微量肉汤稀释法测定MIC的评价[J]. 中华医学检验杂志,1994,17(2):95-98.
[7]赵建国,曲伟红. 瓦松的现代研究进展[J]. 时珍国医国药,2007,18(10):2430-2431.
[8]温学森,任正伟,王子伟,娄红祥. 瓦松药用历史及存在问题[J]. 中药,2008,31(1):158-161.
[9]丁芬,王亚茹. 狼爪瓦松粗提物抑菌效果研究[J]. 黑龙江医药,2013,26(2):227-228.
[10]孙立立. 瓦松属植物的化学及药理研究进展[A]. 药用植物化学与中药有效成分分析研讨会论文集(上)[C].2008:3.
[11]李叶,唐浩国,刘建学. 黄酮类化合物抑菌作用的研究进展[J]. 农产品加工,2008,12(12):53-55.
[12]JH Lee,SJ Lee,S Park,et al. Characterization of flavonoids inOrostachysjaponicusA. Berger using HPLC-MS/MS:Contribution to the overall antioxidant effect[J]. Food Chemistry,2011,128(2):1627-1633.
[13]DH Jin,HS Kim,JH Seong,et al. Comparison of Total Phenol,Flavonoid Contents,and Antioxidant Activities ofOrostachysjaponicusA. Berger Extracts[J]. Journal of Environmental Science International,2016,25(5):695-703.
[14]WS Lee,JW Yun,A Nagappan,et al. Flavonoids fromOrostachysjaponicusA. Berger induces caspase-dependent apoptosis at least partly through activation of p38 MAPK pathway in U937 human leukemic cells[J]. Asian Pacific journal of Cancer Prevention,2015,16(2):465-469.
[15]SD Yeok,L Won Sup,JJ Hyun,et al. Flavonoids fromOrostachysjaponicusA. Berger Inhibit the Invasion of LnCaP Prostate Carcinoma Cells by Inactivating Akt and Modulating Tight Junctions[J]. International Journal of Molecular Sciences,2013,14 (9):18407-18420.
[16]MC Je,WJ Jung,KY Lee,et al. Calpain inhibitory flavonoids isolated fromOrostachysjaponicus[J]. Journal of Enzyme Inhibition and Medicinal Chemistry,2009,24(3):676-679.
[17]Yoon Y,Kim S,Hong S G,et al. Protective effects ofOrostachysjaponicusA. Berger (Crassulaceae)on H2O2-induced apoptosis in GT1-1mouse hypothalamic neuronalcell line[J]. Journal of Ethnopharmacol,2000,69(1):73-78.
[18]王亚红,杨艳俊. 瓦松总黄酮微波辅助提取工艺研究[J]. 北京农业,2015(32):207-208.
[19]王亚红,王亚丽,祝波. 瓦松总黄酮的索氏提取工艺研究[J]. 北方园艺,2014(10):130-132.
[20]王亚红,王亚丽,杨艳俊. 大孔树脂纯化瓦松中总黄酮的工艺[J]. 中国医院药学杂志,2014(10):791-794.
[21]张桂芳,王颖,郭希娟,张东杰. 瓦松黄酮粗提物对糖尿病大鼠血脂的影响[J]. 中国老年学杂志,2014(17):4930-4932.
[22]王翔飞,赵文斌,成玉怀,等. 黄花瓦松提取物抑菌活性部位研究[J]. 安徽农业科学,2010,38(25):13675-13676.
[23]李丽民,吴先华,徐礼锋. 金黄色葡萄球菌的临床分布及耐药性分析[J]. 中华医院感染学杂志,2014,24 (4):787-789.
[24]窦学梅,宋巍,高文旃,等.MRSA医院感染及耐药性研究[J].中华医院感染学杂志,2012,22(9):1943-1945.
[25]罗霞,王建平,孙强正. 福氏志贺菌Xv血清型聚合酶链反应鉴定方法的建立及应用[J]. 疾病监测,2014,29 (10):833-836.
[26]邓群,雷云雪,郑慧妮. 变形杆菌感染特征及药敏分析[J]. 检验医学与临床,2007,4(7):618-619.
[27]廖新华,王辉. 大肠埃希菌感染临床分布及耐药性分析[J]. 实用中医药杂志,2011,27(3):196-197.
[28]Rogers KL,Fey PD,Rupp ME.Coagulase-negative Staphylococcal infections[J].Infect Dis Clin North Am,2009(23):73-98.
[29]王辉,侯万乐,龚志伟. 医院感染革兰阴性杆菌的分布及耐药性分析[J].中华医院感染学杂志,2010,20(3):414-416.
(责任编辑 李婷婷)
Extraction and Antibacterial Effect of Total Flavonoids inOrostachyssp.
SUN Sen-feng1,ZHANG Ying-ying2
(1College of Pharmacy,Shandong University of Traditional Chinese Medicine,Jinan 250355,China;2College of Traditional Chinese Medicine,Shandong University of Traditional Chinese Medicine,Jinan 250355,China)

Orostachyssp.total flavonoids;bacteriostatic activity;MIC;MBC
山东省高校中医药抗病毒协同创新中心课题“中医药抗病毒免疫技术体系构建”(项目编号:XTCX2014B01-04)。
孙森凤(1995— ),女,本科生,研究方向:从事中药提取纯化及药理。
张颖颖(1977— ),男,硕士,讲师,研究方向:中医药抗病原生物。

