MUTYH c.892-2A>G剪切位点突变在家族性乳腺癌中的意义
简文静,邵 康,肖 瑜,曹博洋,谢欣彤,盛海艳,宋淑芬,刘仁斌,王先明
1.中山大学附属第三医院甲状腺乳腺外科,广东 广州 510630;
2.深圳市第二人民医院甲乳外科,广东 深圳 518035;
3.深圳华大基因研究院,广东 深圳 518083
MUTYH c.892-2A>G剪切位点突变在家族性乳腺癌中的意义
简文静1,2,邵 康3,肖 瑜2,曹博洋3,谢欣彤2,盛海艳2,宋淑芬2,刘仁斌1,王先明2
1.中山大学附属第三医院甲状腺乳腺外科,广东 广州 510630;
2.深圳市第二人民医院甲乳外科,广东 深圳 518035;
3.深圳华大基因研究院,广东 深圳 518083
背景与目的:MUTYH基因变异与结直肠癌患癌风险升高有关,但其突变与乳腺癌发生的相关性尚不明确,该研究探讨MUTYH c.892-2A>G剪切位点突变在中国家族性乳腺癌中的意义。方法:采用二代测序(next generation sequencing,NGS)方法检测95个家族性乳腺癌患者及亲属MUTYH基因突变情况,并与BRCA1、BRCA2基因突变情况进行比较。结果:95个家系224名受试者中有4个家系共7名受试者检出MUTYH c.892-2A>G突变,突变率为3.1%,其中只有1例先证者检出MUTYH c.892-2A>G突变。95个家系中也只有1例先证者检出携带BRCA1突变;5个家系中共9名受试者检出携带BRCA2突变,突变率为4.0%。MUTYH c.892-2A>G突变人数分别与BRCA2、BRCA1突变人数相比较,不存在基因共突变现象。结论:MUTYH c.892-2A>G突变虽然在有乳腺癌家族史的高危正常人群中突变率较高,但很可能是低外显的乳腺癌发生相关的致病位点。
MUTYH;家族性乳腺癌;BRCA1;BRCA2
乳腺癌是全球女性最常见的恶性肿瘤。5年流行病学数据表明,全世界约有11%的乳腺癌发生在中国,且发病率在迅速上升[1]。有家族史或携带遗传突变基因是乳腺癌发生的高风险因素。目前已知的乳腺癌易感基因BRCA1及BRCA2,其突变、重排及缺失仅与小于15%的家族性乳腺癌发生有关[2],表明还有很多促进家族性乳腺癌发生的突变基因还未被发现或证实。最近一项大型的协同研究发现,1个多基因风险评分方法低于1%的个体,家族史对其有更大的影响,预示着稀有的基因突变很可能对乳腺癌有重要影响[3]。
MUTYH基因是一个参与DNA损伤后碱基切除修复的基因[2,4],大量研究发现,MUTYH基因变异与结直肠癌患癌风险升高有关[4-7]。但有研究表明,MUTYH基因突变与乳腺癌发生相关性尚不明确[8-11]。且在中国人群中,MUTYH突变与乳腺癌发生相关性的报道较少。因此,本项目旨在研究MUTYH c.892-2A>G剪切位点突变在家族性乳腺癌中的分布频率与特征,并对比BRCA1及BRCA2基因突变,观察它们是否有共突变现象,探讨MUTYH c.892-2A>G剪切位点突变在家族性乳腺癌中的意义,为家族性乳腺癌风险评估提供新依据。
1 材料和方法
1.1 标本来源
选取2014年12月—2016年10月来自深圳地区医院95个乳腺癌家系共224名受试者作为研究对象,其中乳腺癌患者104例,未患乳腺癌的受试者120名。家族性乳腺癌定义为家族成员中有2个以上1级亲属患乳腺癌。所有乳腺癌患者均经病理学确诊。乳腺癌患者年龄为25~80岁,中位年龄为54岁。未患乳腺癌的受试者年龄为11~77岁,中位年龄为36岁。所有受试者参加研究前均知情同意,并签署知情同意书。未患乳腺癌的受试者年龄低于18岁者,均由其监护人代理签署同意书。
1.2 主要试剂
血液DNA提取试剂盒QIAamp® DNA Blood mini kit购自德国QIAGEN公司,PCR扩增试剂KAPA2G™ Robust HotStart ReadyMix购自美国Kapa Biosystems公司,DNA分子量Marker购自宝生物工程(大连)有限公司。引物由生工生物工程(上海)股份有限公司合成,二代测序(next generation sequencing,NGS)和Sanger测序由深圳华大基因研究院完成。
1.3 实验方法
1.3.1 人全血DNA的提取
每个受试者使用EDTA抗凝管收集约5 mL静脉血,经DNA提取试剂盒QIAamp®DNA Blood mini kit提取样本中基因组DNA 200 μL,使用Qubit®2.0检测DNA浓度,每份样本的DNA获得量大于等于2 μg。
1.3.2 样本的文库构建与上机测序
基因组DNA经随机打断、纯化、末端修复加A后,与Hiseq测序所需特殊接头连接,然后经PCR预扩增,乳腺癌易感基因芯片目标区域靶向杂交捕获和PCR再扩增后,得到目标区域DNA的Hiseq上机文库。经质控合格后的文库DNA,按照Hiseq测序平台的操作说明进行上机测序,保证每个文库的原始数据量达到0.6 Gb以上,目标区域的平均测序深度为200X,目标区域覆盖度超过99%。
1.3.3 生物信息分析与突变解读
下机数据由华大基因研究院进行专业解读,首先对原始测序数据进行初步处理和质量控制,然后将所得序列用BWA软件比对到人的参考基因组Hg19上,经Picard和GATK软件去重,校正和突变检测后,找到样本中的点突变和插入或缺失突变;最后,对目标区域的乳腺癌易感基因突变进行解读,找出致病突变。
1.3.4 Sanger验证
为了验证高通量测序所获MUTYH突变位点的准确性,采用金标准Sanger测序技术对突变位点进行测序验证。首先对该突变位点所在的区域设计引物进行PCR扩增,引物序列为MUTYH-892_F:5’-AGAACTGGAA TGGGGCTTCT-3’;MUTYH-892_R:5’-CAGCCCAGGCTAACTCTTTG-3’,然后以提取的基因组DNA为模板,使用设计的引物进行PCR扩增,扩增的条件为:95 ℃预变性3 min;94 ℃变性25 s,57 ℃退火30 s,72 ℃延伸40 s,30个循环;最后72 ℃充分延伸8 min。40 μL扩增的体系为:2X Kapa2G Robust HotStart ReadyMix 20 μL,引物F和R各2 μL(10 μmol/L),DNA模板1 μL(50 ng/μL),最后加双蒸水补至40 μL。
PCR产物经琼脂糖凝胶电泳验证后,进行PCR产物纯化及测序。最后根据测序峰图分析目标位点的突变情况。
1.4 统计学处理
采用SPSS 20.0软件对数据进行分析,MUTYH c.892-2A>G剪切位点突变频率分别与BRCA1、BRCA2基因突变频率的比较采用配对资料的t检验,P<0.05为差异有统计学意义。
2 结 果
2.1MUTYHc.892-2A>G突变的检出及验证
收集95个家系共224名受试者的外周血,分离出白细胞,提取DNA及建库后,用NGS技术对MUTYH基因全外显子及其外显子与内含子连接区域进行检测。在这224名受试者中,7名受试者检出MUTYH c.892-2A>G突变,突变信息见表1。接着我们将检测出的MUTYH c.892-2A>G剪切突变位点进行Sanger测序及PCR电泳以进一步验证(图1、2)。该突变发生在该基因1号染色体,在氨基酸编码区892位上的2个bp碱基A突变为G,是杂合的剪切位点突变。该基因位点在千人数据库正常人群中的突变频率为0.3%,在东亚人群中的突变率为2.77%。其在ClinVar数据库和文献中均有报道[10],被判定为引起遗传性肿瘤发病风险升高的致病突变。
7名受试者分别来自4个有乳腺癌家族史的家系。家系图谱见图3。在家系1中,我们只检测了先证者及其女儿,先证者未检出该突变,而其未患病的女儿携带该突变。在家系2中,我们检测了先证者、先证者姐姐及其4个外甥女,发现先证者亦未携带该突变,而其4个外甥女中有3个携带该突变。在家系3中,我们检测了先证者、先证者姐姐及其女儿,只发现先证者及其女儿都携带MUTYH基因突变,未检出携带其它基因突变;而先证者的姐姐未发现携带该基因突变(图1)。在家系4中,我们检测了先证者、先证者姐姐及先证者女儿,发现其姐姐携带该突变,而先证者及其女儿不携带该突变。即4个家族的先证者中只有1个先证者发现MUTYH c.892-2A>G剪切位点突变,其余6个均为不同家系先证者的未患病亲属。

表 1 MUTYH c.892-2A>G突变位点在千人数据库及东亚人群中的突变频率Tab. 1 Mutation frequencies of MUTYH c.892-2A>G in 1 000 genomes project and East Asians
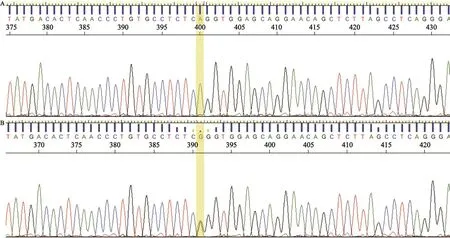
图 1 Sanger测序验证MUTYH c.892-2A>G位点突变测序图Fig. 1 Picture of MUTYH gene mutation veri fied by Sanger sequencing

图 2 样本2和5是家系3的两个受试者的MUTYH c.892-2A>G位点突变PCR电泳图,在567 bp处可见清晰的目标条带Fig. 2 Electrophoresogram of MUTYH c.892-2A>G was tested by PCR, and patients 2 and 5 from the third family in the red frames were MUTYH c.892-2A>G with target bands at 567 bp
2.2MUTYHc.892-2A>G突变频率与BRCAs突变频率比较
我们同时检测了这95个家系的BRCA1和B R C A 2基因突变情况,检测结果见表2。在这9 5个家系中,有1个家系的先证者存在BRCA1突变,有5个家系共9个受试者存在B R C A 2突变,这6个家系发生BRCA突变的位点不一致,它们核酸改变位点分别是BRCA2基因位点c.793+1G>C、c.7617+1G>A、c.8946_8947delAG、c.9100C>T、c.5344_5345insA及BRCA1基因位点c.3770_3771delAG。
我们将MUTYH c.892-2A>G突变人数分别与BRCA1、BRCA2基因突变人数进行比较,虽然结果差异无统计学意义,但MUTYH c.892-2A>G在这95个家族中有7个受试者存在突变(7/224),而且主要发生在目前未患病的受试者中(6/7),而BRCA2、BRCA1在6个家族中的突变位点各不相同,突变率分别为2/224和1/224,并且这6个家族的先证者都存在BRCA1或BRCA2突变(表2、3)。另外,我们没有观察到这95个家系人群中存在MUTYH与BRCA基因共突变现象。
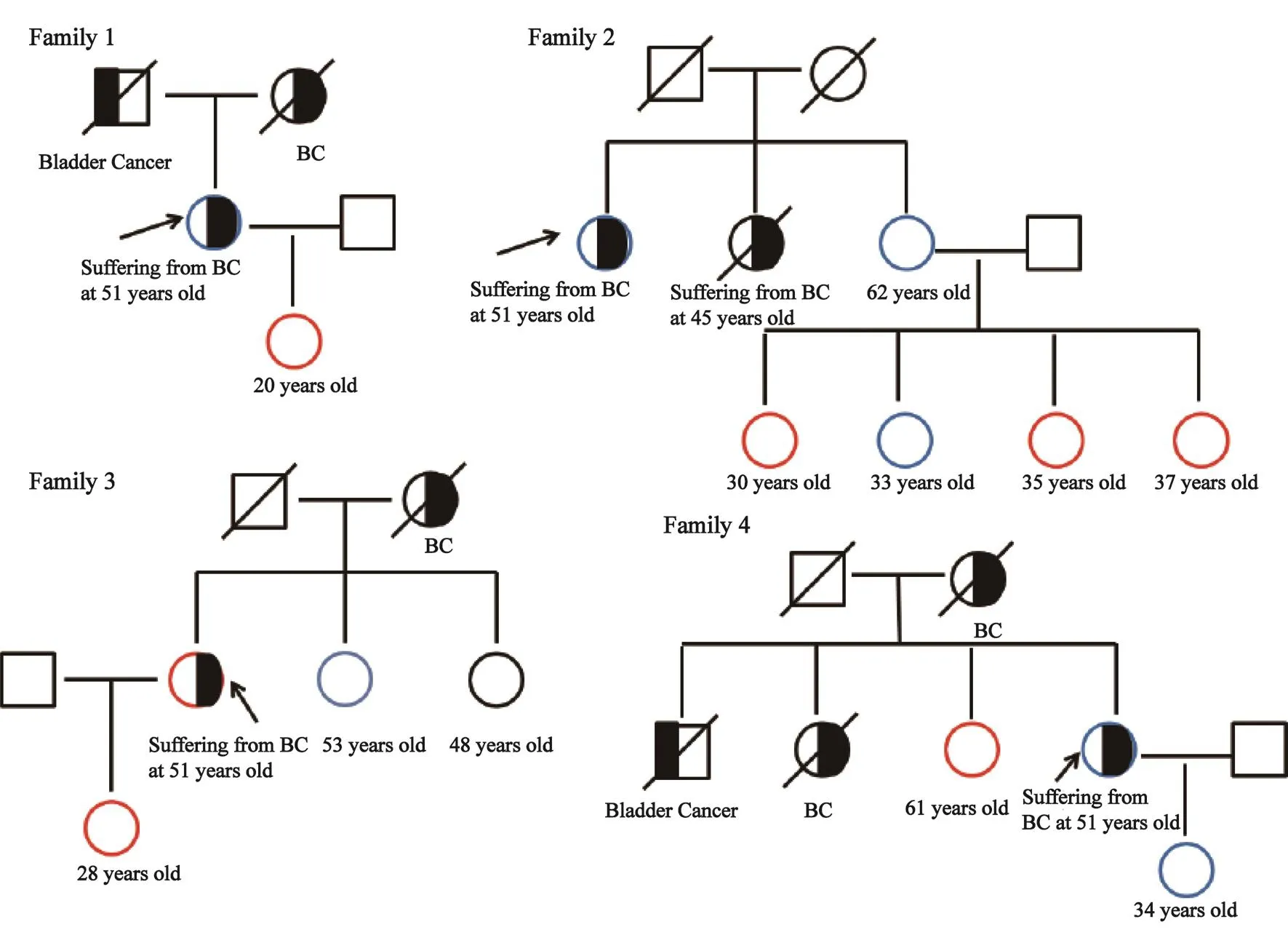
图 3 四个家系图谱Fig. 3 Pedigree maps of four families
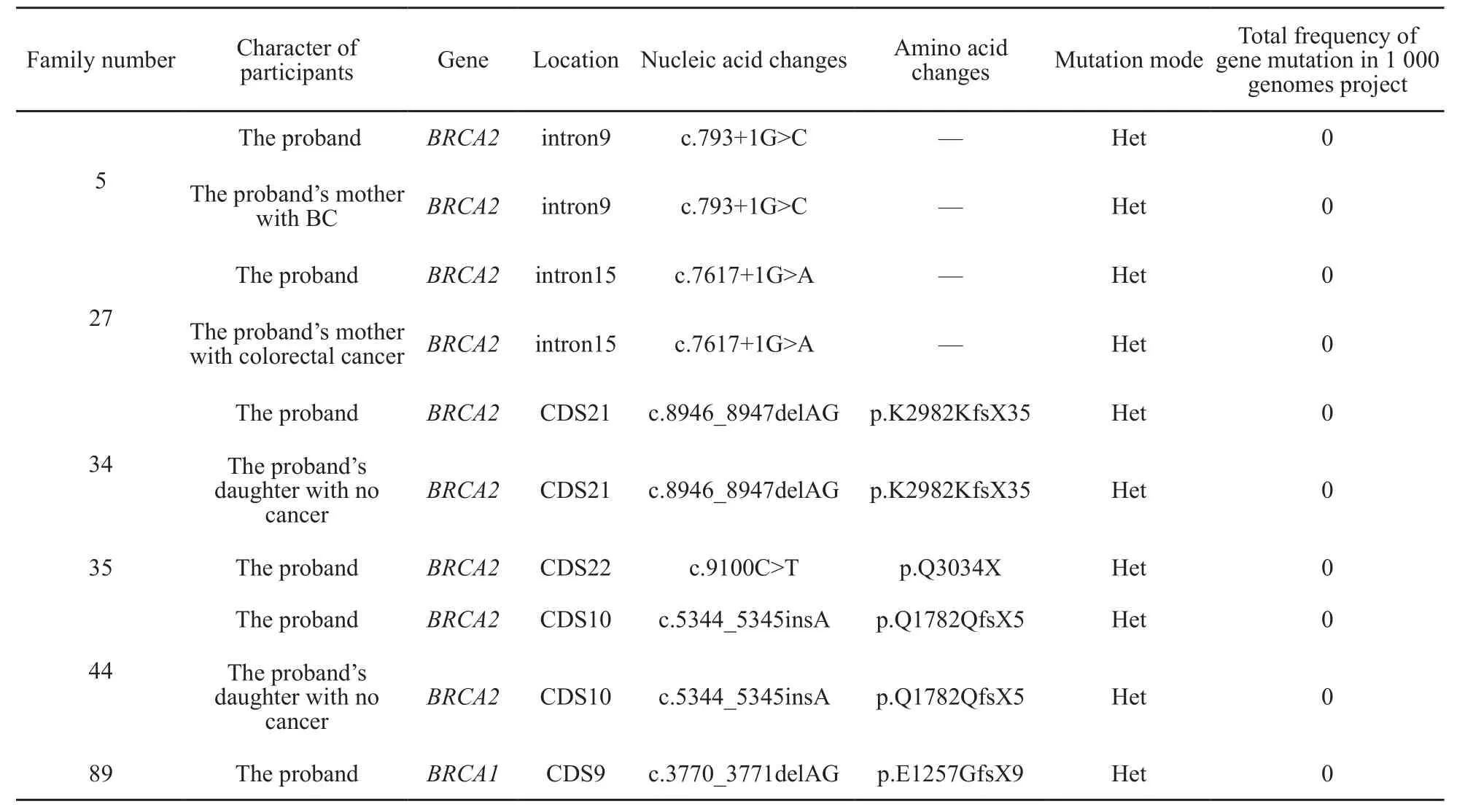
表 2 6个家系中BRCA1/2基因的突变信息及在千人数据库中的突变频率Tab. 2 BRCA1/2 gene mutation in six families with breast cancer and their mutation frequency in 1 000 genomes project

表 3 MUTYH c.892-2A>G突变与BRCA1/2基因突变频率的比较Tab. 3 Comparison of mutation frequency between MUTYH c.892-2A>G and BRCA1/2 genes
3 讨 论
5%~10%的乳腺癌是由于基因突变异常而从家族遗传而来的。与乳腺癌遗传相关的重要基因BRCA1、BRCA2突变,使BRCA1、BRCA2表达缺失而导致乳腺癌和(或)卵巢癌的产生。有研究表明,携带BRCA1突变的人群患乳腺癌的概率为50%~90%,而携带BRCA2突变的人群患乳腺癌或卵巢癌的概率为41%~87%[12]。但除了BRCA1/2基因突变外,还存在其他稀有的基因,如CDH1、CHEK2、BARD1、MUTYH及PALB2等基因的突变可能与遗传性家族性乳腺癌相关。但这些基因突变在中国家族性乳腺癌中的研究较少。
人MUTYH基因位于1号染色体短臂,包含15个内含子与16个外显子,编码含535个氨基酸的蛋白[13],参与氧化碱基8-oxodG错误复制所导致的错配修正[4]。若MUTYH基因发生突变,DNA修复缺陷很可能导致癌症的易感性[13-14]。多项研究证实,MUTYH突变与多种癌症的发生有关,如MUTYH突变在结直肠癌、MUTYH相关性息肉病发生中的分子机制被广泛研究[4,15-17]。而在乳腺癌研究中,MUTYH突变与乳腺癌发生风险相关性尚存在争议[9-11,16]。如有研究报道显示,在有乳腺癌及结直肠癌家族史的人群中,MUTYH突变的频率有所增加,并认为杂合的MUTYH突变与乳腺癌的表型有关[11]。但另一项病例对照研究结果显示,不能确定MUTYH突变与乳腺癌是否有相关性[9]。在中国人群中,AluYb8MUTYH等位基因频率可能与早发型乳腺癌有关[16]。
本研究发现,95个乳腺癌家系中MUTYH c.892-2A>G突变主要在有乳腺癌家族史而目前未患乳腺癌的亲属(3.1%)中被检出。在1000 Genomes Project中该基因位点突变的总频率为0.3%,在东亚人种中的突变频率为2.7%,说明MUTYH c.892-2A>G突变是东亚人群特有的高频突变,其与乳腺癌的家族血统有关。但在本研究中,只有1例乳腺癌患者检测出MUTYH c.892-2A>G位点突变,同时没有检测出携带其它基因突变(本研究课题检测了27个与家族性乳腺癌发生相关的基因),该基因位点突变在该家系中是否符合家系共分离现象还有待进一步考究。但有研究表明,MUTYH c.892-2A>G位点突变后,会产生异常的转录本,截短MUTYH蛋白的表达;并且突变的蛋白出现核定位失败[18],可能导致DNA损伤修复缺陷,引起肿瘤的发生。其次,因为BRCA1/2是目前公认的乳腺癌遗传相关的基因,携带BRCA基因突变的人群患乳腺癌的概率为40%~90%。因此本研究亦比较了MUTYH c.892-2A>G突变与BRCAs突变的关系,结果发现两者无明显关联,也没有检测出有MUTYH与BRCAs基因共突变现象。但是从检出分布来看,在这些研究家系中,MUTYH c.892-2A>G突变主要分别在有乳腺癌家族史的高危健康人群中,仅有一个家系的先证者携带,而BRCAs阳性突变位点在每个家系中不一致,且每个阳性家系的先证者都有BRCAs突变。这些结果也进一步表明,MUTYHc.892-2A>G突变与中国家族乳腺癌的发生有一定的关系,但很可能是一个低外显遗传易感基因,需要进一步扩大样本量,也需要延长随访时间观察这些携带者将来是否发生乳腺癌。从家系1和家系2的分布来看,两个家系的先证者都未携带MUTYHc.892-2A>G突变,而在她们的一级亲属及二级亲属,都发生了MUTYH突变,该突变是从父系遗传过来还是新生突变?很遗憾我们未能检测父系的样本。
本研究初步探讨了MUTYHc.892-2A>G剪切位点突变在中国家族性乳腺癌中的分布特征,尽管其可能是与乳腺癌发生相关的低外显基因,但仍需重视,尤其是乳腺癌和肠道肿瘤家族史都存在的家系人群更应密切关注该基因的突变情况,为肿瘤防治提供一定依据。
[1] LI T, MELLO-THOMS C, BRENNAN P C. Descriptive epidemiology of breast cancer in China: incidence, mortality, survival and prevalence[J]. Breast Cancer Res Treat, 2016, 159(3): 395-406.
[2] SHIOVITZ S, KORDE L A. Genetics of breast cancer: a topic in evolution[J]. Ann Oncol, 2015, 26(7): 1291-1299.
[3] CHANDLER M R, BILGILI E P, MERNER N D. A review of whole-exome sequencing efforts toward hereditary breast cancer susceptibility gene discovery[J]. Hum Mutat, 2016, 37(9): 835-846.
[4] MAZZEI F, VIEL A, BIGNAMI M. Role of MUTYH in human cancer[J]. Mutat Res, 2013, 743-744: 33-43.
[5] BRINKMEYER M K, DAVID S S. Distinct functional consequences of MUTYH variants associated with colorectal cancer: Damaged DNA affinity, glycosylase activity and interaction with PCNA and Hus1[J]. DNA Repair (Amst), 2015, 34: 39-51.
[6] THEODORATOU E, CAMPBELL H, TENESA A, et al. A large-scale meta-analysis to refine colorectal cancer risk estimates associated with MUTYH variants[J]. Br J Cancer, 2010, 103(12): 1875-1884.
[7] SHINMURA K, GOTO M, TAO H, et al. Impaired 8-hydroxyguanine repair activity of MUTYH variant p.Arg109Trp found in a Japanese patient with early-onset colorectal cancer[J]. Oxid Med Cellular Longev, 2014, 2014: 617351.
[8] CONDE J, SILVA S N, AZEVEDO A P, et al. Association of common variants in mismatch repair genes and breast cancer susceptibility: a multigene study[J]. BMC cancer, 2009, 9: 344.
[9] OUT A A, WASIELEWSKI M, HUIJT P E, et al. MUTYH gene variants and breast cancer in a Dutch case-control study[J]. Breast Cancer Res Treat, 2012, 134(1): 219-227.
[10] RENNERT G, LEJBKOWICZ F, COHEN I, et al. MUTYH mutation carriers have increased breast cancer risk[J]. Cancer, 2012, 118(8): 1989-1993.
[11] WASIELEWSKI M, OUT A A, VERMEULEN J, et al. Increased MUTYH mutation frequency among Dutch families with breast cancer and colorectal cancer[J]. Breast Cancer Res Treat, 2010, 124(3): 635-641.
[12] FORD D, EASTON D F, STRATTON M, et al. Genetic heterogeneity and penetrance analysis of the BRCA1 and BRCA2 genes in breast cancer families. The Breast Cancer Linkage Consortium[J]. American J Hum Genet, 1998, 62(3): 676-689.
[13] SLUPSKA M M, BAIKALOV C, LUTHER W M, et al. Cloning and sequencing a human homolog (hMYH) of the Escherichia coli mutY gene whose function is required for the repair of oxidative DNA damage[J]. J Bacteriol, 1996, 178(13): 3885-3892.
[14] ZEHIR A, BENAYED R, SHAH R H, et al. Mutational landscape of metastatic cancer revealed from prospective clinical sequencing of 10,000 patients[J].Nat Med, 2017, 23(6): 703-713.
[15] AGUSTINA L, HAHM S H, HAN S H, et al. Visualization of the physical and functional interaction between hMYH and hRad9 by Dronpa bimolecular fluorescence complementation[J]. BMC Mol Biol, 2014, 15: 17.
[16] ZHU M, CHEN X, ZHANG H, et al. AluYb8 insertion in the MUTYH gene and risk of early-onset breast and gastric cancers in the Chinese population[J]. Asian Pac J Cancer Prev, 2011, 12(6): 1451-1455.
[17] D’AGOSTINO V G, MINOPRIO A, TORRERI P, et al. Functional analysis of MUTYH mutated proteins associated with familial adenomatous polyposis[J]. DNA Repair (Amst), 2010, 9(6): 700-707.
[18] TAO H, SHINMURA K, HANAOKA T, et al. A novel splicesite variant of the base excision repair gene MYH is associated with production of an aberrant mRNA transcript encoding a truncated MYH protein not localized in the nucleus [J]. Carcinogenesis, 2004, 25(10): 1859-1866.
The signi ficance of MUTYH c.892-2A>G splicing mutation in familial breast cancer
JIAN Wenjing1,2, SHAO Kang3, XIAO Yu2, CAO Boyang3, XIE Xintong2, SHENG Haiyan2, SONG Shufen2, LIU Renbin1, WANG Xianming2
(1. Department of Thyroid and Breast Surgery, the Third Affiliated Hospital of Sun Yat-sen University, Sun Yat-sen University, Guangzhou 510630, Guangdong Province, China; 2. Department of Thyroid and Breast Surgery, the Second People’s Hospital of Shenzhen, Shenzhen 518035, Guangdong Province, China; 3. BGI-Research, BGI, Shenzhen 518083, Guangdong Province, China)
LIU Renbin E-mail: liur@vip.163.com
Background and purpose: It is suggested that MUTYH mutation is closed to high colorectal cancer risk, but it is not clear that the relationship between MUTYH mutation and susceptibility to familiar breast carcinoma. The study was to investigate the significance of MUTYH c.892-2A>G splicing mutation in familial breast cancer. Methods: The mutations of MUTYH,BRCA1 and BRCA2 genes were tested by the next generation sequencing (NGS) method in total of 224 participants, from 95 families with breast cancer patients (containing breast cancer patients and their relatives), and then comparisons were carried out between them. The mutations detected by NGS were veri fied by Sanger sequencing. Results: Seven participants from 4 families had a MUTYH c.892-2A>G splicing mutation, with a mutation rate of 3.1% (7/224), of which only one proband carried with this mutation. In 224 participants, only one proband carried with BRCA1 mutation. While 9 participants from 5 families had BRCA2 mutations, and their mutation rate was 4% (9/224). Further the BRCA2 mutation site detected in the proband of every family was not the same. There were no signi ficant di ff erences between the number of MUTYH c.892-2A>G mutation and BRCA2 mutation or betweenthe number of MUTYH c.892-2A>G mutation and BRCA 1 mutation. And there was no case which existed MUTYH and BRCAs gene co-mutations. Conclusion: Although its high mutation rate happens in the high-risk healthy population with a history of breast cancer, MUTYH c.892-2A>G is likely to be a low penetrance gene mutation of susceptibility to breast cancer.
MUTYH; Familial breast cancer; BRCA1; BRCA2
10.19401/j.cnki.1007-3639.2017.07.005
R737.9
A
1007-3639(2017)07-0545-07
2017-03-16
2017-05-16)
深圳市科技研发资金课题(JCYJ20120614155459154);深圳市战略新兴产业发展专项资金课题(CXZZ20140414170821163);深圳市科技计划基础研究课题(JCYJ20160425103015129)。
刘仁斌 E-mail: liur@vip.163.com

