长链非编码RNA PANDAR在非小细胞肺癌中的表达和临床意义
聂 军,周 波,张郁林
三峡大学人民医院心胸外科,湖北 宜昌 443000
长链非编码RNA PANDAR在非小细胞肺癌中的表达和临床意义
聂 军,周 波,张郁林
三峡大学人民医院心胸外科,湖北 宜昌 443000
背景与目的:长链非编码RNA(long non-coding RNA,lncRNA)在肿瘤的发生、发展过程中有重要作用。LncRNA CDKN1A反义链启动子DNA损伤激动RNA(promoter of CDKN1A antisense DNA damage activated RNA,PANDAR)与多种肿瘤的进展及预后相关。探讨非小细胞肺癌(non-small cell lung cancer,NSCLC)组织中lncRNA PANDAR的表达及临床意义。方法:采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)方法检测94例新鲜NSCLC组织标本及相对应的癌旁组织标本中PANDAR的表达,分析其与NSCLC的临床病理特征、诊断价值和预后的关系。结果:PANDAR在NSCLC组织中的表达显著低于癌旁组织(P<0.001);PANDAR低表达和高表达组在肿瘤体积、淋巴结转移、疾病分期和分化程度方面差异均有统计学意义(χ2=9.197,P=0.002;χ2=7.126,P=0.008;χ2=6.271,P=0.012;χ2=8.147,P=0.004);受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under the curve,AUC)为0.797(95%CI:0.614~0.849;P<0.001),灵敏度和特异度分别是49.8%和84.3%,Youden指数为0.402;PANDAR低表达和高表达组在总生存期(overall survival,OS)及无进展生存期(progression free survival,PFS)上的差异有统计学意义(χ2=7.282,P=0.007;χ2=6.777,P=0.009)。结论:PANDAR在NSCLC中低表达,可以作为NSCLC的新型生物标志物和诊断靶标。
CDKN1A反义链启动子DNA损伤激动RNA;非小细胞肺癌;受试者工作特征曲线;临床病理特征;生物标志物
肺癌是目前致死率较高的恶性肿瘤之一[1],超过85%的肺癌属于非小细胞肺癌(nonsmall cell lung cancer,NSCLC)[2]。尽管近年来NSCLC的临床治疗手段不断改进,但多数患者在癌症晚期才被诊断,患者的总生存期(overall survival,OS)没有显著提高[3]。因此,探究NSCLC分子机制对于疾病早期的诊断和治疗是非常有必要的。
过去对肿瘤发生机制的研究主要集中在蛋白编码基因,近年来非编码基因家族的新成员—长链非编码RNA(long non-coding RNA,lncRNA)被广泛关注。lncRNA不能被翻译成蛋白质,以往研究发现其在细胞发育、细胞分化、免疫应答和多种生物学过程中起重要作用[4-6],说明lncRNA在真核细胞基因组调控中发挥着重要作用。此外,包括NSCLC在内的多种肿瘤中都表现出lncRNA的失调[7-9]。lncRNA的分子机制多种多样,可能在包括染色质修饰、转录和转录后加工等不同水平的基因表达调控中具有重要作用。例如,HOTAIR可以通过重复染色质编程来促进乳腺癌转移[10],Linc-MD1能够作为一个海绵滴定测量来控制肌肉分化[11]。
最近,许多lncRNA被发现能够与RNA结合蛋白(如hnRNP、SUZ12和NF-YA等)反应,从而调控基因表达[12-14]。CDKN1A反义链启动子DNA损伤激动RNA(promoter of CDKN1A antisense DNA damage activated RNA,PANDAR)是首个被报道的lncRNA[15]。PANDAR可与转录因子NF-YA相互作用,抑制促凋亡基因的表达[16-17]。而且Jing等[18]研究发现,PANDAR在肺癌中低表达,并且可通过调控Bcl-2基因促进凋亡从而影响NSCLC的生长,本研究旨在探究PANDAR在NSCLC中的临床病理特征、诊断价值和预后等临床意义,以期为NSCLC的治疗提供新的分子基础。
1 资料和方法
1.1 标本采集
收集2010年1月—2011年1月三峡大学人民医院收治并确诊为NSCLC的肺癌标本94例,所有肿瘤标本均经病理诊断确诊为NSCLC,并取距离肿瘤病灶组织边缘5 cm以上、无癌浸润的癌旁组织标本作为对照,所有标本均于液氮中保存备用。患者年龄28~64岁,平均年龄(55.7±5.8)岁;高中分化59例,低分化35例;淋巴结转移70例,无转移24例。所有患者术前均未接受化疗或放疗,均签订知情同意书,经三峡大学人民医院伦理委员会批准。并通过电话或E-mail的形式定期随访48个月,记录患者的生存状况和疾病进展情况。
1.2 材料
TRIzol购自美国Invitrogen公司,PrimeScriptTMRT reagent Kit、Premix EX Taq DNA聚合酶和SYBR Green购自宝生物工程(大连)有限公司,实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)所用的ABl7300 RTFQ-PCR仪购自美国ABI公司,组织破碎仪购自美国Qiagen公司。
1.3 方法
组织先用组织破碎仪进行破碎后提取癌组织和癌旁组织的总mRNA。总mRNA提取按照TRIzol®RNA 提取试剂操作说明进行,所得RNA溶解于RNase Free H2O。Nano Drop检测RNA浓度及纯度,保证RNA的完整性(D260nm/ D280nm大于2.0)。按照试剂盒说明书特异度反转录后,进行RTFQ-PCR检测各组PANDAR 的表达。反应条件:95 ℃,2 min预变性;95 ℃,5 s;60 ℃,30 s;70 ℃,30 s,45个循环。反应结束后确认扩增曲线及溶解曲线。每个样本设3个副孔,实验重复3次。PANDAR相对表达量以GAPDH作为内参照。
PANDAR引物[18]设计如下顺义链:5’-TGCACACATTTAACCCGAAG-3’;反义链:5’-CCCCAAAGCTACATCTATGACA-3’;GAPDH引物顺义链:5’-AGCCACATCGCTCAGACAC-3’;反义链:5’-GCCCAATACGACCAAATCC-3’。
1.4 统计学处理
PANDAR相对表达量采用ΔΔCt法分析,ΔCt=CtPANDAR-CtGAPDH,ΔΔCt=ΔCtRCC-ΔCtNormal,用2-ΔΔCt法计算相对表达水平。对所得数据采用SPSS 18.0软件进行统计学分析,计量采用表示,资料采用t检验。将患者按PANDAR表达水平及临床特征分组列出四格表,采用χ2检验分析;采用Kaplan-Meier法和log-rank检验比较两组患者生存差异,P<0.05为差异有统计学意义。
2 结 果
2.1 PANDAR在NSCLC组织中低表达
经RTFQ-PCR检测后,在94对NSCLC组织中,81.9%(67/94)的PANDAR表达水平显著低于其对应的癌旁组织,其中平均相对表达量为1.97,高于平均值为高表达,低于平均值为低表达。NSCLC癌组织中PANDAR表达量明显低于癌旁组织(t=-4.016,P<0.001,图1)。
2.2 PANDAR表达与NSCLC患者临床病理特征关系
PANDAR表达在患者的年龄、性别、病理类型及吸烟史间直接进行比较,差异无统计学意义(P均>0.05),表明PANDAR表达与患者的年龄、性别、病理类型及吸烟史无关;而与肿瘤体积、淋巴结转移、疾病分期及分化程度比较,差异均有统计学意义(P均<0.05,表1)。
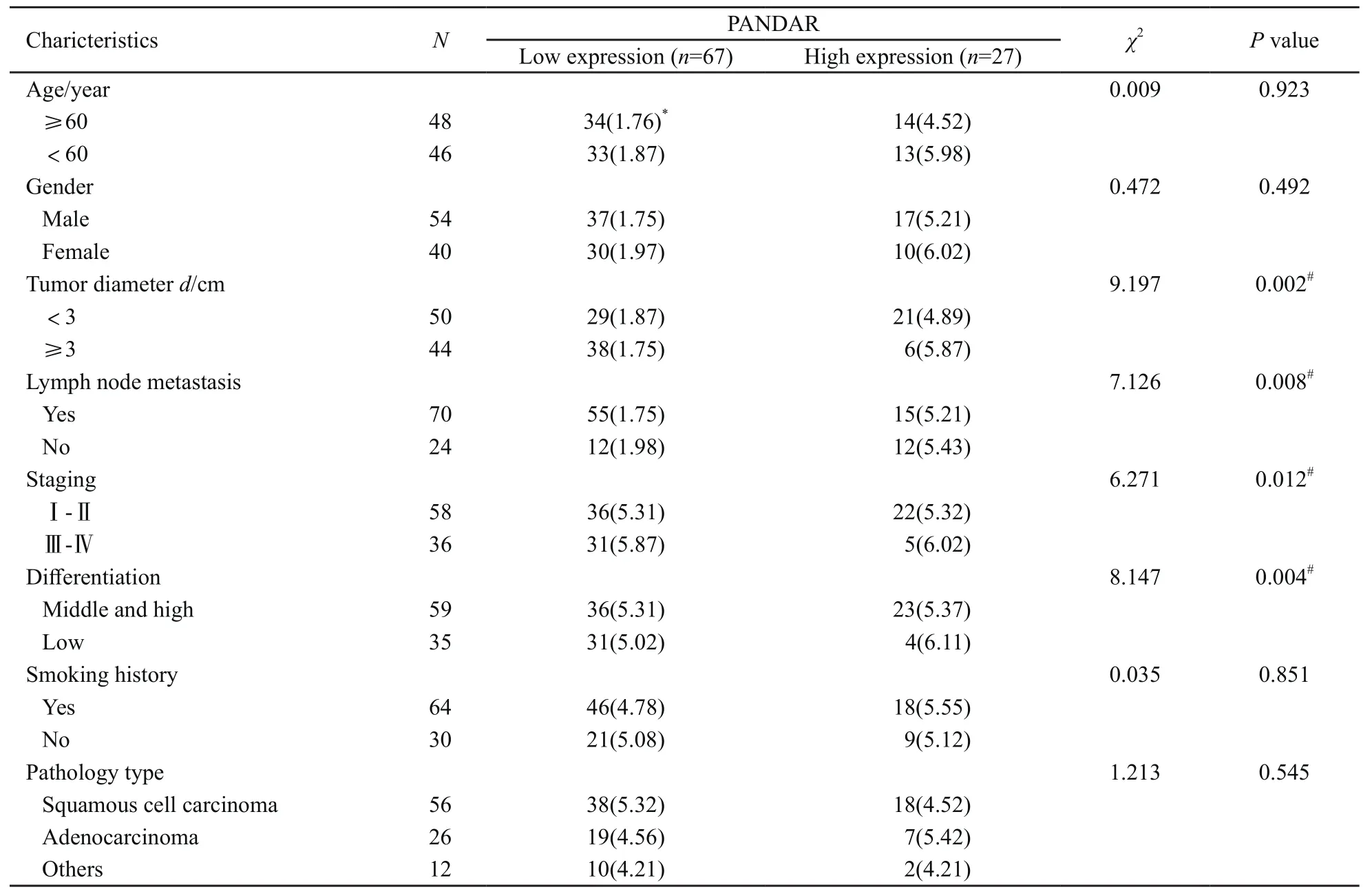
表 1 PANDAR表达与NSCLC患者临床病理特征的关系Tab. 1 The correlation between the expression of PANDAR and clinical pathological characteristics in NSCLC patients[n(%)]
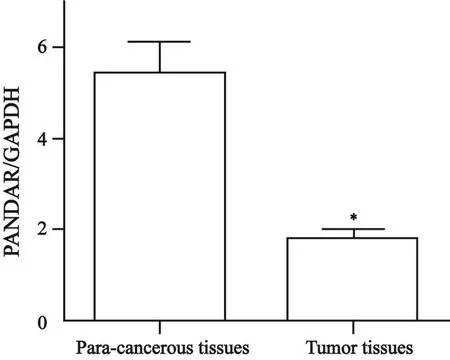
图 1 PANDAR在癌组织和癌旁组织中的差异表达Fig. 1 The expression level of PANDAR in non-small-cell lung cancer
2.3 PANDAR作为NSCLC潜在生物标志物的诊断价值
用受试者工作特征(receiver operating characteristic,ROC)曲线评价PANDAR作为NSCLC潜在的生物标志物的诊断价值。其中,ROC曲线的曲线下面积(area under the curve,AUC)为0.797(95%CI:0.614~0.849;P<0.001);灵敏度和特异度分别是49.8%和84.3%;Youden指数为0.402(图2)。此ROC曲线表明PANDAR在NSCLC中具有诊断价值。
2.4 PANDAR表达对患者生存关系的影响
对PANDAR在NSCLC患者生存关系中的影响进行分析,PANDAR高表达组的患者平均OS为39个月(95%CI:34.9~45.3),平均无进展生存期(progression free survival,PFS)为43个月(95%CI:37.6~48.2);PANDAR低表达组平均OS为28个月(95%CI:20.9~31.5),平均PFS为23个月(95%CI:18.9~24.5)。对两组患者采用Kaplan-Meier法进行生存数据假设检验比较的log-rank检验表明,PANDAR的表达与NSCLC患者OS(χ2=7.282,P=0.007)及PFS(χ2=6.777,P=0.009)上的差异有统计学意义,故可认为两组生存曲线不同(图3)。从而表明PANDAR低表达与NSCLC不良预后显著相关。
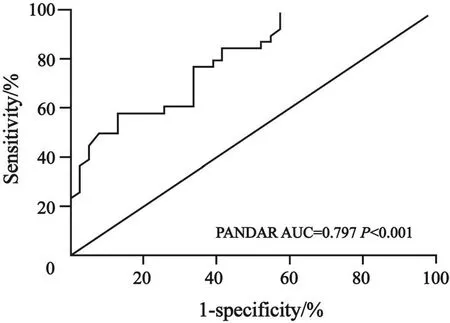
图 2 NSCLC患者癌组织和癌旁组织的PANDAR ROC曲线Fig. 2 ROC curve of patients with NSCLC based on PANDAR expression in tumor tissues and adjacent tissues
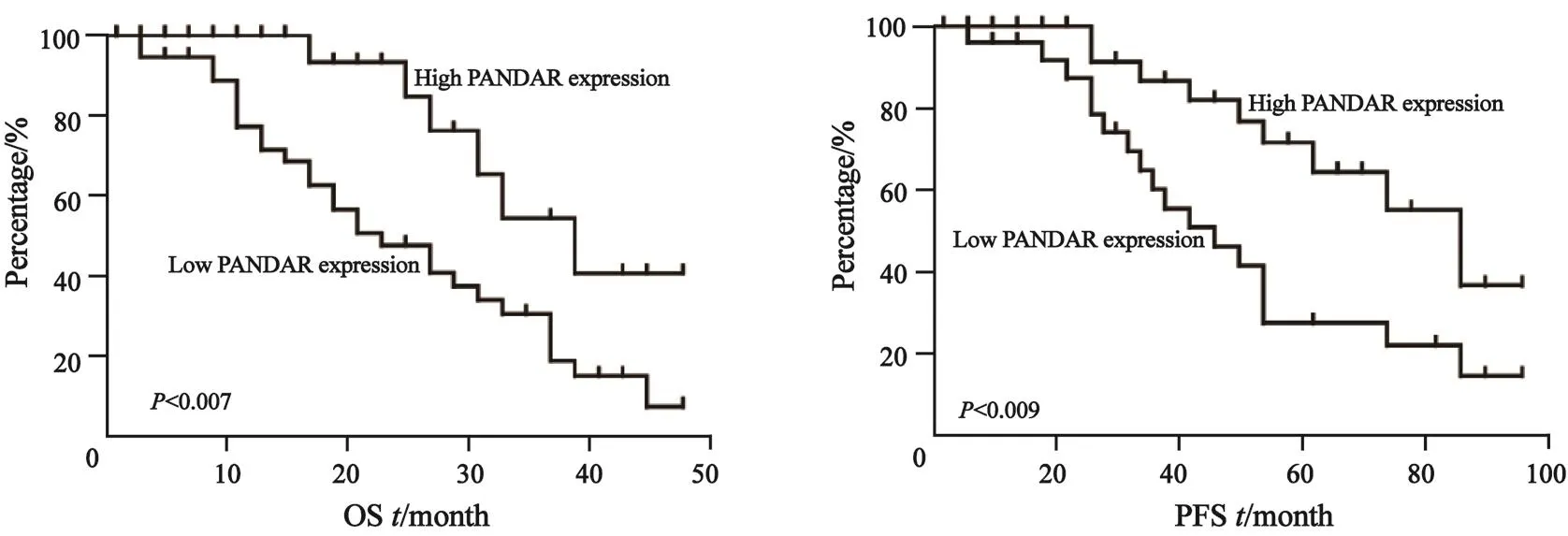
图 3 PANDAR表达与患者OS和PFS的关系Fig. 3 The relationship of PANDAR with OS and PFS
3 讨 论
传统的手术疗法、化疗和放射疗法对于晚期NSCLC患者而言效果不理想。尽管NSCLC的诊断和治疗已经取得了显著的进展,其预后仍然很差,因此迫切需要对NSCLC发展机制进行深入研究以研发新型且具有治疗前景的诊断试剂,从而满足每位NSCLC患者的治疗需求。寻找能提升NSCLC临床预后和确定最优治疗策略的新治疗靶点具有重要意义。
多种lncRNA被发现与NSCLC相关。例如,HOTAIR在NSCLC中高度表达,与癌症的预后显著相关[18];TUG1表达下调,通过调控p53影响NSCLC增殖[19];HMLincRNA717表达下调,常预示预后不良[20];PVT1在NSCLC中过表达,能促进NSCLC进展,影响患者预后[21];PANDAR在Han等[22]的研究中被首次报道与NSCLC的疾病进展和细胞凋亡相关。PANDAR属于lncRNA,是NSCLC的预后标志物,作为lncRNA,其癌基因的功能相当复杂,且在不同的肿瘤中参与不同的信号通路,例如PANDAR在肾癌组织中表达明显下调,且和肾癌TNM、AJCC分级和预后相关,提示其作为肾癌标志物应用于临床的可能[23]。本研究选取检测了lncRNA PANDAR的表达量,发现NSCLC患者组织中PANDAR水平显著低于相对应的癌旁组织。
LncRNA在基因表达、细胞发育调控、分化和凋亡等多种生物过程中发挥重要作用。我们推断低表达的PANDAR可能与NSCLC的发生、发展相关。我们使用χ2检验来检测PANDAR与各临床病理特征间的关系,发现PANDAR的表达受肿瘤体积大小、淋巴结转移、疾病分期和分化程度等因素的影响,低水平的PANDAR与各因素均呈负相关,提示PANDAR可作为NSCLC预后的预测因素。本研究结果与Han等[22]报道的结果基本一致。
考虑到肺癌的不良预后及lncRNA在癌症中的重要作用,我们分析了NSCLC中PANDAR可能的预后作用。Kaplan-Meier分析发现,低表达PANDAR的NSCLC患者平均OS及平均PFS较短,从而预示PANDAR低表达可作为NSCLC患者不良预后指标。为进一步检测PANDAR在NSCLC中的诊断价值,我们通过ROC曲线分析发现,PANDAR具有NSCLC潜在的生物标志物的诊断价值。以上结果表明,PANDAR在NSCLC诊断和预后中发挥重要作用。
总之,lncRNA PANDAR的表达失常可以进行NSCLC的疾病预后,并作为独立的预后标志。这一研究结果为NSCLC的治疗提供了一个新的潜在标记和治疗手段。但受样本数量限制,大样本的深入研究有待进一步开展,同时PANDAR在NSCLC中的生物功能及作用机制仍有待探究。
[1] 宋 勇, 杨 雯. 2014年晚期非小细胞肺癌内科治疗进展[J]. 解放军医学杂志, 2015, 40(1): 10-15.
[2] ETTINGER D S, WOOD D E, AKERLEY W, et al. Non-small cell lung cancer, version 6. 2015[J]. J Natl Compr Canc Netw, 2015, 13: 515-524.
[3] 徐 燕, 王孟昭. 非小细胞肺癌免疫治疗进展[J]. 中国肺癌杂志, 2014, 46(3): 277-281.
[4] CARPENTER S, AIELLO D, ATIANAND M K, et al. A long non-coding RNA mediates both activation and repression of immune response genes.[J]. Science, 2013, 341(6147): 789-792.
[5] IMAMURA K, IMAMACHI N, AKIZUKI G, et al. Long non-coding RNA NEAT1-dependent SFPQ relocation from promoter region to paraspeckle mediates IL8 expression upon immune stimuli[J]. Mol Cell, 2014, 53(3): 393-406.
[6] 胡 倩, 姚和瑞. 长链非编码RNA与肿瘤研究现状[J].中华肿瘤防治杂志, 2014, 21(21): 1746-1750.
[7] ZHANG E B, YIN D D, SUN M, et al. P53-regulated long non-coding RNA TUG1 affects cell proliferation in human non-small cell lung cancer, partly through epigenetically regulating HOXB7 expression[J]. Cell Death Dis, 2014, 5(5): 1243-1243.
[8] ZHANG E, KONG R, YIN D, et al. Long non-coding RNA ANRIL indicates a poor prognosis of gastric cancer and promotes tumor growth by epigenetically silencing of miR-99a/miR-449a[J]. Oncotarget, 2014, 5(8): 2276-2292.
[9] YUAN S, YANG F, YANG Y, et al. Long non-coding RNA associated with microvascular invasion in hepatocellular carcinoma promotes angiogenesis and serves as a predictor for hepatocellular carcinoma patients’ poor recurrence-free survival after hepatectomy[J]. Hepatology, 2012, 56(6): 2231-2241.
[10] 潘林江, 王毅雯, 张丽洁, 等. 非小细胞肺癌组织中HOX转录反义RNA的表达变化及意义[J]. 山东医药, 2016, 56(9): 1-3.
[11] CESANA M, CACCHIARELLI D, LEGNINI I, et al. A long non-coding RNA controls muscle differentiation by functioning as a competing endogenous RNA[J]. Cell, 2011, 147(2): 358-369.
[12] HUARTE M, GUTTMAN M, FELDSER D, et al. A large intergenic non-coding RNA induced by p53 mediates global gene repression in the p53 response[J]. Cell, 2010, 142(3):409-419.
[13] VANCE K W, PONTING C P. Transcriptional regulatory functions of nuclear long non-coding RNAs[J]. Trends Genet, 2014, 30(8): 348-355.
[14] LI Z, CHAO T C, CHANG K Y, et al. The long noncoding RNA THRIL regulates TNFα expression through its interaction with hnRNPL [J]. Proc Natl Acad Sci USA, 2014, 111(3): 1002-1007.
[15] HUNG T, WANG Y, LIN M F, et al. Extensive and coordinated transcription of non-coding RNAs within cell-cycle promoters[J]. Nat Genet, 2011, 43(7): 621-629.
[16] PENGPENG, WANG X Z. NF-YA underlies EZH2 upregulation and is essential for proliferation of human epithelial ovarian cancer cells[J]. Mol Cancer Res, 2013, 11(4): 9-11.
[17] DALVAI M, MONDESERT O, BUGLER B, et al. Doxorubicin promotes transcriptional upregulation of Cdc25B in cancer cells by releasing Sp1 from the promoter.[J]. Oncogene, 2012, 32(42): 5123-5128.
[18] JING C, WANG R, ZHANG K, et al. Long non-coding RNAs in non-small cell lung cancer as biomarkers and therapeutic targets[J]. J Cell Mol Med, 2014, 18(12): 2425-2436.
[19] 李雨薇, 王裕民, 张雪莹, 等. 长链非编码RNA HOTAIR在恶性肿瘤中的研究进展[J]. 生物化学与生物物理进展, 2015, 42(3): 228-235.
[20] ZHANG E B, YIN D D, SUN M, et al. P53-regulated long non-coding RNA TUG1 affects cell proliferation in human non-small cell lung cancer, partly through epigenetically regulating HOXB7 expression.[J]. Cell Death Dis, 2014, 5(5): e1243-e1243.
[21] XIE X, LIU H T, MEI J, et al. LncRNA HMlincRNA717 is down-regulated in non-small cell lung cancer and associated with poor prognosis[J]. Int J Clin Exp Pathol, 2014, 7(12): 8881-8886.
[22] HAN L, ZHANG E B, YIN D D, et al. Low expression of long noncoding RNA PANDAR predicts a poor prognosis of nonsmall cell lung cancer and affects cell apoptosis by regulating Bcl-2[J]. Cell Death Dis, 2015, 6(2): e1665.
[23] YANG Y R, ZANG S Z, ZHONG C L, et al. Increased expression of the lncRNA PVT1 promotes tumorigenesis in non-small cell lung cancer.[J]. Int J Clin Exp Pathol, 2014, 7(10): 6929-6935.
[24] 金 露, 李一帆, 何 韬, 等. 长链非编码RNA PANDAR在肾癌中的表达分析及临床意义[J]. 安徽医科大学学报, 2016(9): 1342-1345.
The expression and clinical signi ficance of PANDAR in non-small cell lung cancer
NIE Jun, ZHOU Bo, ZHANG Yulin
(Department of Thoracic Surgery, People’s Hospital of Sanxia University, Yichang 443000, Hubei Province, China)
NIE Jun E-mail: niejun197908@163.com
Background and purpose: Long non-coding RNA (lncRNA) is associated with carcinogenesis and cancer development. LncRNA promoter of CDKN1A antisense DNA damage activated RNA (PANDAR) was correlated with the progression and prognosis of various cancers. This study aimed to investigate the expression and clinical signi ficance of PANDAR in non-small cell lung cancer (NSCLC). Methods: Real-time fluorescence quantitative polymerase chain reaction (RTFQ-PCR) was used to detect PANDAR expression in 94 cases of NSCLC tissues and adjacent tissues. The association with patient clinic-pathological characteristics, diagnostic value and prognosis of PANDAR were further analyzed. Results: PANDAR expression was signi ficantly downregulated in the NSCLC compared with adjacent tissues (P<0.001). There was signi ficant di ff erences between tumor size, lymphatic metastasis, TNM stage and histologic di ff erentiation in terms of PANDAR expression (χ2=9.197, P=0.002 4; χ2=7.126, P=0.008; χ2=6.271, P=0.012; χ2=8.147, P=0.004). The area under the curve (AUC) of receiver operating characteristic (ROC) curve was 0.797 (95%CI: 0.614-0.849; P<0.001). The sensitivity and speci ficity were 49.8% and 84.3%, respectively. The index of Youden was 0.402. The di ff erences between PANDAR low expression and high expression groups were statistically signi ficant in overall survival time and progression free survival (χ2=7.282,P=0.007; χ2=6.777, P=0.009). Conclusion: The expression of PANDAR is down-regulated in patients with NSCLC and might prove useful as a biomarker for diagnosis and prognostic signi ficance.
Promoter of CDKN1A antisense DNA damage activated RNA; Non-small cell lung cancer; Receiver operating characteristic curve; Clinical pathological; Biomarker
10.19401/j.cnki.1007-3639.2017.07.008
R734.2
A
1007-3639(2017)07-0569-06
2017-02-09
2017-05-10)
聂 军 E-mail:niejun197908@163.com

