跨膜接头蛋白CBP对皮肤鳞癌细胞A431生长增殖的负调控作用研究
李美佳,张维娜,渠开攀,王 冰
1.青岛大学附属医院烧伤整形外科,山东 青岛 266000;2.青岛大学医学院免疫教研室,山东 青岛 266000
跨膜接头蛋白CBP对皮肤鳞癌细胞A431生长增殖的负调控作用研究
李美佳1,张维娜1,渠开攀1,王 冰2
1.青岛大学附属医院烧伤整形外科,山东 青岛 266000;2.青岛大学医学院免疫教研室,山东 青岛 266000
背景与目的:跨膜接头蛋白(Csk-binding protein,CBP)是新发现的Src家族成员,与多种肿瘤的发生有关。该研究旨在观察CBP基因过表达对皮肤鳞癌细胞系A431增殖及细胞凋亡的影响,探讨其相关的分子机制。方法:构建CBP-增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)融合蛋白的慢病毒过表达载体,采用反转录病毒转染的方法建立CBP过表达的A431细胞株。实验分为亲本细胞组(未进行基因转染的A431细胞)、对照组(A431细胞转染仅含EGFP阴性对照病毒)和实验组(A431细胞转染CBP-EGFP病毒)。在激光共聚焦显微镜下观察细胞转染率,验证转染成功与否;CCK-8法检测CBP过表达对A431细胞增殖能力的影响,并采用流式细胞术( flow cytometry,FCM)检测对细胞凋亡的影响;实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)和蛋白[质]印迹法(Western blot)检测Lck、Csk和Fyn三种上游信号转导分子分别在mRNA和蛋白中的表达水平变化。结果:建立了稳定过表达CBP的A431细胞株;CCK-8法结果提示,CBP过表达明显抑制细胞生长,第2~6天的组间差异有统计学意义(P<0.05);FCM检测显示,实验组细胞凋亡率显著增加,与亲本细胞组及对照组相比差异有统计学意义(P<0.001);RTFQ-PCR结果显示,实验组A431细胞Lck mRNA的相对表达水平显著下调(P<0.001),实验组细胞Csk和Fyn mRNA的表达分别约为亲本细胞组的1.6倍和3.8倍,表达显著上调(P<0.001);Western blot结果表明,实验组Lck蛋白的相对表达水平明显下降(P<0.001),实验组细胞Csk和Fyn蛋白与亲本细胞组和对照组相比表达明显增加(P<0.001)。结论:CBP过表达可抑制皮肤鳞癌细胞增殖,诱导细胞凋亡及坏死。CBP通过调节上游信号转导通路中的蛋白酪氨酸激酶Lck、Csk和Fyn来调控细胞的增殖活性。
皮肤鳞癌;跨膜接头蛋白;细胞增殖;细胞凋亡
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,cSCC)起源于表皮角质形成细胞,是世界第2常见的非黑色素瘤皮肤癌[1]。皮肤鳞癌的发病涉及多个基因的改变[2],其具体的机制当前尚未完全阐明,因此,进一步寻找与该病发生相关的基因是一项非常有意义的工作。跨膜接头蛋白(Csk-binding protein,CBP)是近年来新发现的Src家族中的一个成员,其主要参与细胞的生长、增殖和分化等过程,并与多种肿瘤的发生相关[3]。但CBP对皮肤鳞癌生物学特性的影响及与皮肤鳞癌发生的关系,相关研究较少。本实验初步探讨CBP过表达对皮肤鳞癌的细胞增殖及凋亡的影响。
1 材料与方法
1.1 主要材料
人皮肤鳞癌细胞株A431购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库,CBP-增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)融合蛋白及慢病毒载体由上海吉凯基因化学技术有限公司构建。CCK-8购自北京泛博生物化学有限公司。Annexin V apoptosis detection kit APC购自美国eBioscience公司。Csk、Fyn和Lck引物由南京金斯瑞生物科技有限公司合成,反转录及实时荧光定量试剂盒均购自美国Roch公司。兔抗人Csk、Fyn和Lck多克隆抗体购自美国Abgent公司,辣根过氧化物酶标记山羊抗兔IgG购自生工生物工程(上海)股份有限公司。ECL发光试剂购自美国Thermo公司。激光共聚焦显微镜为Leica SP8。流式细胞仪为美国BD公司C6。PCR仪为美国Bio-Rad公司CFX96。
1.2 方法
1.2.1 CBP过表达细胞株制备
根据慢病毒载体操作说明,收集处于对数生长期的正常A431细胞,以5 000个/孔接种于96孔板内,按MOI值为100加入反转录病毒。转染96 h后在激光共聚焦显微镜下观察融合蛋白荧光表达,检测转染率,扩大培养建立稳定的CBP过表达细胞株。实验分为亲本细胞组(未进行基因转染的A431细胞)、对照组(A431细胞转染仅含EGFP阴性对照病毒)和实验组(A431细胞转染CBP-EGFP病毒)。
1.2.2 CCK-8检测各组细胞增殖率
收集处于对数生长期的上述3组细胞,调整细胞密度为1×105个/mL,分别接种于96孔板,100 μL/孔。以上各组均设立1个调零孔和4个平行复孔。在37 ℃、CO2体积分数为5%的条件下预培养24 h后开始检测0、24、48、72、96和120 h(即第1、2、3、4、5和6天)6个时间点细胞增殖情况,每孔加入10 μL CCK-8溶液,继续温育2 h,多功能酶标仪检测450 nm处吸光度(D)值。以D值为纵坐标,时间为横坐标绘制生长曲线。
1.2.3 流式细胞术(flow cytometry,FCM)检测细胞凋亡
收集处于对数生长期的上述3组细胞,以5×104个/孔接种于12孔板内,在37 ℃、CO2体积分数为5%的条件下预培养24 h完全贴壁后,撤血清饥饿12 h,再换成10%的G-DMEM继续培养48 h。分别用0.25%胰蛋白酶消化各组细胞制备单细胞悬液,冷PBS、1×Binding Buffer各洗涤细胞1次,再用100 μL 1×Binding Buffer重悬,调整细胞浓度为1×106个/mL。取1 mL加入2.5 μL Annexin V-APC避光室温下反应15 min,2 300×g离心30 s后用500 μL 1×Binding Buffer重悬细胞,再加2.5 μL PI,用4 0 0目的筛网过滤后,上流式细胞仪检测。
1.2.4 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)
收集以上各组A431细胞,用TRIzol法提取细胞总RNA,SYBR Green标记产物,按照RTFQ-PCR检测试剂盒操作说明建立反应体系。反应条件: 95 ℃ 10 min;95 ℃ 10 s、 60 ℃ 20 s、72 ℃ 10 s,40个循环。各样品目的基因和管家基因进行RTFQ-PCR反应,分别获得Ct值,通过2-△△Ct方法分析各样品相对CBP表达差异,每组实验重复3次。各组实验以亲本细胞组的表达量设定为1,计算出其他组的相对表达量,以相对倍数进行作图。所检测的基因及相关PCR引物序列见表1。
1.2.5 蛋白[质]印迹法(Western blot)检测
收集对数生长期的3组细胞,每组约107个细胞,加入200 μL预冷的蛋白裂解液4 ℃裂解2 h,4 ℃下20 800×g离心20 min,收集上清。BCA法测定蛋白浓度,加入5×SDS上样缓冲液,煮沸5 min。10%SDS-PAGE后转膜,5%脱脂奶粉室温低速摇床封闭2 h,加入一抗4 ℃摇床过夜温育。TBST漂洗3次,每次10 min,加入辣根过氧化物酶标记二抗,室温摇床温育2 h。加入ECL显色液,室温避光温育3~5 min,曝光、显影。

表 1 RTFQ-PCR引物Fig. 1 RTFQ-PCR Primer
1.3 统计学处理
2 结 果
2.1 CBP在A431细胞中的表达
反转录病毒转染A431细胞(MOI值为100),转染72 h后出现绿色荧光,荧光表达于细胞膜,转染后96 h荧光表达达到高峰,转染细胞在激光共聚焦显微镜下观察,实验组和对照组均可见绿色荧光几乎遍布整个视野(图1A、C),同时采集同视野两组细胞在普通光镜下分布情况(图1B、D),两种病毒的转染率均接近100%,说明建立了稳定表达的细胞株。
2.2 CBP过表达对A431细胞增殖的影响
CCK-8法对3组细胞的生长情况进行检测,第1~5天,亲本细胞组和对照组细胞增殖率均在逐渐增加,第6天开始趋于稳定,两组之间各时间点增殖效率差异无统计学意义(P>0.05)。实验组细胞在检测的第2~6天内的增殖效应明显低于亲本细胞组和对照组,统计分析显示,第2~6天组间差异有统计学意义(P<0.05),提示CBP过表达明显抑制细胞的生长效率(图2)。

图 1 激光共聚焦显微镜观察反转录病毒转染效率Fig. 1 The transfection e fficiency was examined by laser confocal scanning microscope
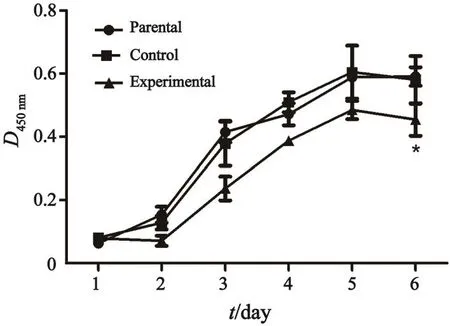
图 2 CCK-8检测CBP过表达对细胞增殖能力的影响Fig. 2 The e ff ect of overexpression CBP on prolieration ability of human cSCC cell line A431 were detected by CCK-8 assay
2.3 CBP过表达对A431细胞凋亡的影响
采用Annexin V Apoptosis Detection Kit APC染色,FCM检测的散点图分析结果显示,实验组细胞发生中晚期凋亡坏死的细胞为(27.2±0.70)%,亲本细胞组和对照组分别为(9.9±1.50)%和(15.33±2.00)%。由此可见,实验组细胞出现凋亡及坏死的数量显著增多,与亲本细胞组及对照组相比,差异有统计学意义(P<0.001,图3),说明CBP过表达可以诱导A431细胞发生明显的凋亡现象。
2.4 CBP过表达对Lck、Csk和Fyn在mRNA中表达水平的影响
RTFQ-PCR检测结果表明,实验组A431细胞Lck mRNA的表达约为亲本细胞组的0.4倍,相对表达水平显著下调(P<0.001),亲本细胞组与对照组之间表达差异无统计学意义(P>0.05);实验组细胞Csk和Fyn mRNA的表达分别约为亲本细胞组的1.6倍和3.8倍,表达显著上调(P<0.001),亲本细胞组与对照组之间表达差异无统计学意义(P>0.05,图4)。
2.5 Western blot检测Lck、Csk和Fyn蛋白表达水平
We s t e r n b l o t结果显示,与对照组(0.857±0.007)和亲本细胞组(0.910±0.006)相比,实验组Lck蛋白的相对表达水平(0.809±0.016)明显下降(P<0.001),亲本细胞组与对照组的表达差异无统计学意义(P>0.05);实验组细胞Csk和Fyn蛋白相对表达(0.786±0.006,1.313±0.039)与亲本细胞组(0.542±0.007,0.000±0.000)和对照组(0.527±0.007,0.416±0.008)相比明显增加(P<0.001,图5)。这与3种基因在mRNA水平的表达结果相一致。
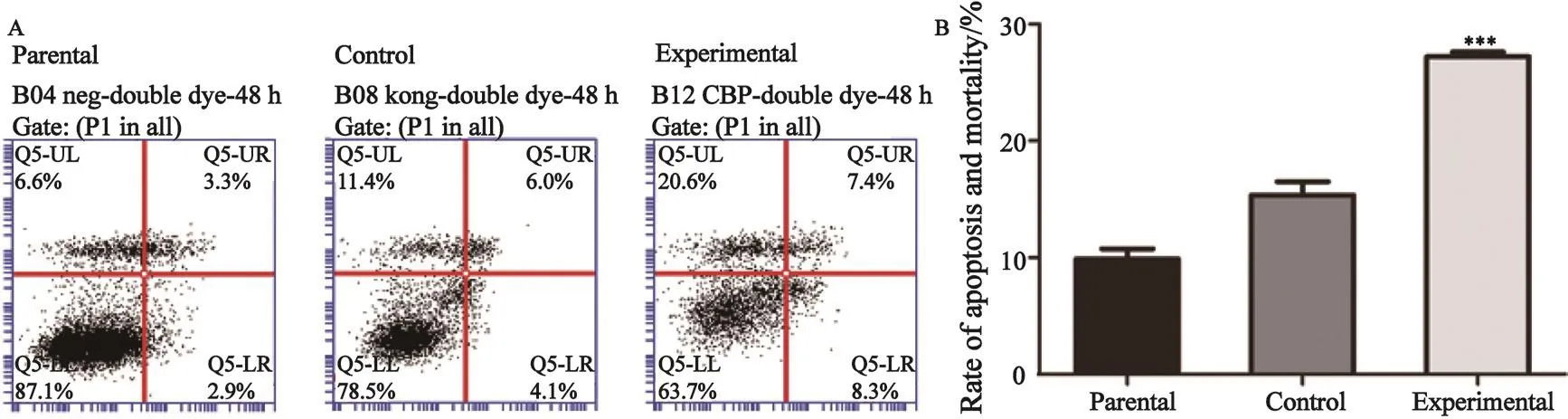
图 3 FCM法检测CBP过表达对A431细胞凋亡的影响Fig. 3 The e ff ect of overexpression CBP on apoptosis and mortality rate of human cSCC cell line A431 were detected by FCM
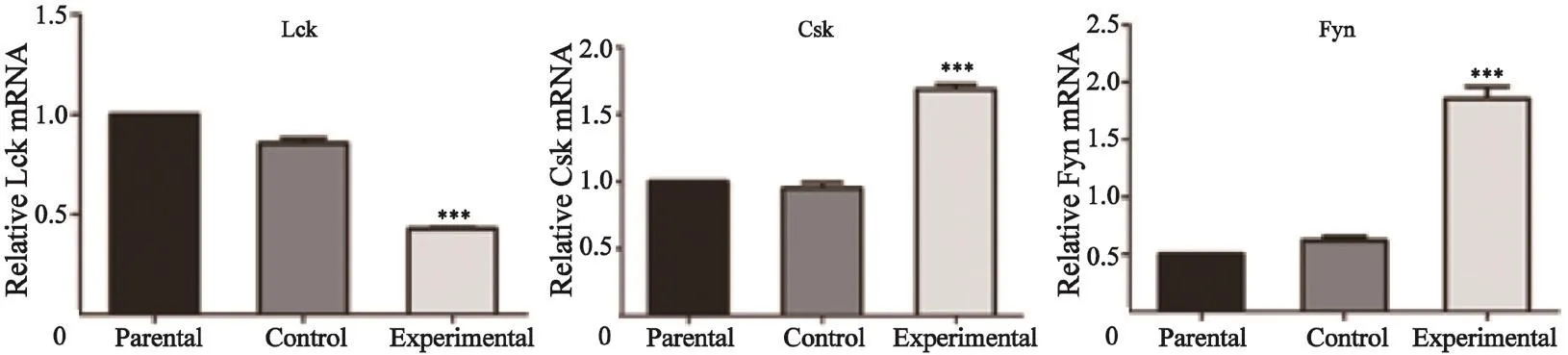
图 4 RTFQ-PCR分析CBP过表达对Lck,Csk和Fyn在mRNA表达水平的影响Fig. 4 The in fluence of overexpression CBP on the relative mRNA expression of Lck, Csk and Fyn assayed by RTFQ-PCR

图 5 Western blot检测CBP在A431细胞中过表达对Lck,Csk和Fyn活性的影响Fig. 5 The in fluence of overexpression CBP on the activation of Lck, Csk and Fyn measured by Western blot
3 讨 论
皮肤鳞癌的发生大多位于暴露辐射紫外线较多的皮肤部位,如面部和上肢,致使外形受损,严重影响患者的身心健康。有研究显示,其发病率一直呈持续上升趋势,给卫生保健系统造成巨大的负担,因此其防治越来越受到重视[4]。近年来,随着分子生物学技术及遗传学的发展,靶分子治疗在皮肤鳞癌中的应用越来越受关注。CBP是2000年发现报道的新基因,是跨膜接头蛋白家族成员之一,肿瘤相关性是其研究的热点[3]。关于CBP在肿瘤中的表达和其在肿瘤中的生物学影响的报道不少,但在不同类型的肿瘤中,其表达结果各异。在神经母细胞细胞系中,敲除CBP基因可促进其增殖,使CBP过表达则出现明显的抑制作用,提示CBP可能在某些类型的肿瘤中起抑制作用[5]。然而,在肾癌组织中,CBP过表达有致癌作用,并与肿瘤转移相关[6]。在非小细胞肺癌中,CBP明显抑制伴有c-Src上调类型的肿瘤细胞生长,而对不伴有c-Src上调类型的肿瘤细胞没有抑制作用[7]。因此,CBP的作用机制根据肿瘤类型不同而不同[3]。
为了探讨CBP对皮肤鳞癌的作用,本实验将构建有CBP基因的载体转染进入A431细胞中,观察CBP过表达对A431细胞增殖及凋亡的影响。细胞增殖实验结果显示,CBP表达上调可使细胞增殖活性明显下降。细胞凋亡检测发现,上调表达CBP有助于诱导细胞凋亡,甚至导致细胞发生坏死。CBP主要由SFK家族的Fyn磷酸化激活后招募胞质蛋白Csk到脂筏上,进而通过调节SFKs参与细胞转化和恶性疾病发病[8]。也有研究证明,CBP-Fyn-Sam68-RasGAP复合体参与SFK负性调控Ras蛋白[9]。本研究通过RTFQ-PCR和Western blot检测Csk和Fyn蛋白的表达,结果显示,实验组伴随外源性CBP表达的提高,Csk及Fyn的表达都显著提高。Lck是细胞活化信号转导通路中重要的上游激活蛋白。提示CBP表达增强后,会相应的抑制Lck表达,阻断Lck的激酶活性。因此,我们认为CBP招募CSK进入脂筏发挥抑制作用,可能主要是通过阻断LCK等活化类蛋白酪氨酸激酶的磷酸化,进而阻断了下游信号的传导。
本研究表明,CBP的表达可以抑制皮肤癌细胞增殖,并促进细胞凋亡,具有明显的抑癌效应。它是一种新的肿瘤抑制基因,可通过调节信号转导通路中相关蛋白酪氨酸激酶的表达来实现其功能。后续需要围绕CBP对皮肤癌细胞的侵袭、迁移及体内效应展开进一步的研究。
[1] SIMOES M C, SOUSA J J , PAIS A A. Skin cancer and new treatment perspectives: a review [J]. Cancer Lett, 2015, 357(1): 8-42.
[2] NISSINEN L, FARSHCHIAN M, RIIHILÄ P, et al. New perspectives on role of tumor microenvironment in progression of cutaneous squamous cell carcinoma [J]. Cell Tissue Res, 2016, 365(3): 691-702.
[3] HRDINKA M , HOREJSI V. PAG-a multipurpose transmembrane adaptor protein [J]. Oncogene, 2014, 33(41): 4881-4892.
[4] PARIKH S A, PATEL V A , RATNER D. Advances in the management of cutaneous squamous cell carcinoma [J]. F1000Prime Rep, 2014, 6(70): 1-8.
[5] AGARWAL S, GHOSH R, CHEN Z, et al. Transmembrane adaptor protein PAG1 is a novel tumor suppressor in neuroblastoma [J]. Oncotarget, 2016, 7(17): 24018-24026.
[6] FENG X, LU X, MAN X, et al. Overexpression of Cskbinding protein contributes to renal cell carcinogenesis [J]. Oncogene, 2009, 28(37): 3320-3331.
[7] KANOU T, ONEYAMA C, KAWAHARA K, et al. The transmembrane adaptor Cbp/PAG1 controls the malignant potential of human non-small cell lung cancers that have c-src upregulation [J]. Mol Cancer Res, 2011, 9(1): 103-114.
[8] SOLHEIM S A, TORGERSEN K M, TASKEN K, et al. Regulation of FynT function by dual domain docking on PAG/ Cbp [J]. J Biol Chem, 2008, 283(5): 2773-2783.
[9] SMIDA M, POSEVITZ-FEJFAR A, HOREJSI V, et al. A novel negative regulatory function of the phosphoprotein associated with glycosphingolipid-enriched microdomains: blocking Ras activation [J]. Blood, 2007, 110(2): 596-615.
CBP mediates negative regulation of growth and proliferation of cutaneous squamous cell carcinoma A431 in vitro
LI Meijia1, ZHANG Weina1, QU Kaipan1, WANG Bing2
(1. Department of Burn and Plastic Surgery, the Affiliated Hospital of Qingdao University, Qingdao 266000, Shandong Province, China; 2. Department of Immunology, Medical College of Qingdao University, Qingdao 266000, Shandong Province, China)
WANG Bing E-mail: wangbing@qdu.edu.cn
Background and purpose: The transmembrane adaptor Csk-binding protein (CBP), a recently identi fied tyrosine kinase of the Src family, is implicated in various aspects of cancer cell biology. This study aimed to investigate the e ff ect of the transmembrane protein CBP on the proliferation and apoptosis ability of A431 cells of human cutaneous squamous cell carcinoma and the implicated molecular mechanism. Methods: The CBP-EGFP lentiviral vector was constructed. A431 cells were transfected with CBP-EGFP lentiviral vector or negative-EGFP lentiviral vector, or remained untransfected. The transfection efficiency was detected by laser confocal microscope. After additional culture, the proliferation potential of A431 cells was assayed with CCK-8, and the apoptotic rate was assessed by flow cytometry (FCM). Lck, Csk and Fyn mRNA levels were detected by real-time fluorescence quantitative polymerase chain reaction (RTFQ-PCR) and their protein levels by Western blot. Results: The A431 cell line with overexpression ofPAG was constructed successfully. CCK-8 results suggested that overexpression of CBP markedly inhibited cell growth, with statistically signi ficant di ff erences at 2-6 days between the groups (P<0.05). FCM showed that both the apoptotic rate and the death rate of the cells transfected with CBP-EGFP lentiviral vector were increased signi ficantly compared to those of the cells transfected with negative-EGFP lentiviral vector or untransfected cells (P<0.001). RTFQ-PCR results showed that the Lck mRNA relative expression level of the cells transfected with CBP-EGFP lentiviral vector was signi ficantly reduced (P<0.001), but Csk and Fyn mRNA expression levels were 1.6 times and 3.8 times as high as the untransfected cells, respectively (P<0.001). Western blot results showed that the Lck protein level was signi ficantly decreased after transfection with CBP-EGFP lentiviral vector (P<0.001), whereas the Csk and Fyn protein levels were signi ficantly increased (P<0.001). Conclusion: The ectopic expression of CBP might inhibit the proliferation or growth of A431 cells, induce cell apoptosis and accelerate cell death, which may be related to down-regulation of Lck and up-regulation of Csk and Fyn expression.
cutaneous squamous cell carcinoma; Csk-binding protein; proliferation; apoptosis
10.19401/j.cnki.1007-3639.2017.07.002
R739.5
A
1007-3639(2017)07-0527-06
2017-02-01
2017-03-30)
王 冰 E-mail: wangbing@qdu.edu.cn

