人胎盘部位滋养细胞肿瘤细胞系的建立及其鉴定
刘齐雨,李 可,胥 婧,黄云柯,赵晨燕,罗建民,李桂玲,康 玉,徐丛剑
1.复旦大学附属妇产科医院中西医结合科,上海 200011;
2.上海市女性生殖内分泌相关疾病重点实验室,上海 200011;
3.复旦大学附属妇产科医院病理科,上海 200011;
4.复旦大学生物医学影像研究中心,上海 200032
人胎盘部位滋养细胞肿瘤细胞系的建立及其鉴定
刘齐雨1,2,李 可1,2,胥 婧1,2,黄云柯1,2,赵晨燕3,罗建民4,李桂玲1,2,康 玉1,2,徐丛剑1,2
1.复旦大学附属妇产科医院中西医结合科,上海 200011;
2.上海市女性生殖内分泌相关疾病重点实验室,上海 200011;
3.复旦大学附属妇产科医院病理科,上海 200011;
4.复旦大学生物医学影像研究中心,上海 200032
背景与目的:胎盘部位滋养细胞肿瘤(placental site trophoblastic tumor,PSTT)是一种特殊类型的妊娠滋养细胞肿瘤。该研究旨在建立人PSTT细胞系,鉴定其基本特性。方法:通过手术切除的PSTT组织标本原代培养,纯化并传代,建立人PSTT细胞系。鉴定方法包括:观察细胞形态,CCK-8法绘制细胞生长曲线,进行染色体核型分析,细胞与肿瘤组织短串重复序列(short tandem repeat,STR)分析,以及免疫组织化学染色。结果:建立稳定传代的人PSTT细胞系PSTT-1。PSTT-1细胞单层贴壁生长,失去接触抑制性,呈多突起的纺锤形结构。体外培养生长良好,每5 d传代1次,目前已传至30余代。染色体核型分析结果为正常女性核型:46,XX。PSTT-1与肿瘤组织STR分析结果高度匹配。PSTT-1细胞表达β-catenin、CD146、人绒毛膜促性腺激素(human chorionic gonadotrophin,hCG)、人胎盘生乳素(human placental lactogen,hPL)和Muc4。结论:该研究成功建立人PSTT细胞系PSTT-1,为PSTT的研究提供了体外实验模型。
PSTT;细胞系;原代培养
胎盘部位滋养细胞肿瘤(placental site trophoblastic tumor,PSTT)起源于胎盘种植部位的中间型滋养细胞(intermediate trophoblast,IT),是一种特殊类型的妊娠滋养细胞肿瘤,占妊娠滋养细胞肿瘤的1%~2%[1-3]。
多数PSTT病灶局限于子宫,预后较好;但是有10%~20%的患者会发生转移,一旦转移,即使患者接受手术和联合化疗,预后仍会不良。PSTT患者10年生存率为49%,复发患者的5年生存率不足30%[4-5]。
PSTT对化疗的敏感性低于绒毛膜癌,子宫切除术是主要的治疗方式[6]。PSTT多见于育龄期,子宫切除术将导致育龄期患者失去自然怀孕的能力。化疗则作为术后的辅助治疗,临床上多采用联合化疗方案,但是PSTT的最佳化疗方案尚不明确[5,7]。
因PSTT临床相对少见,目前的文献报道多为小样本或个例报道,基础研究进展缓慢。肿瘤细胞系的建立在肿瘤基础研究中具有重要作用,但是目前世界范围内几个权威细胞库,如美国典型菌种保藏中心、德国微生物菌种保藏中心及日本理化学研究所等,均没有PSTT细胞系。本研究通过PSTT组织原代培养建立可稳定传代的人PSTT细胞系PSTT-1,并鉴定其生物学特性,为PSTT的研究提供体外实验模型。
1 材料和方法
1.1 组织来源
组织来源于2014年9月复旦大学附属妇产科医院收治的1例PSTT患者经全子宫切除术后的组织标本。患者女性,29岁,术后病理诊断:子宫PSTT,浸润子宫深肌层;免疫组织化学检测:AE1/AE3(+),hCG(散在+),hPL(++),Inhibin-α(+)。肿瘤组织H-E染色可见特征性的中间型滋养细胞,肿瘤细胞形态相对一致,浸润肌层和血管(图1)。
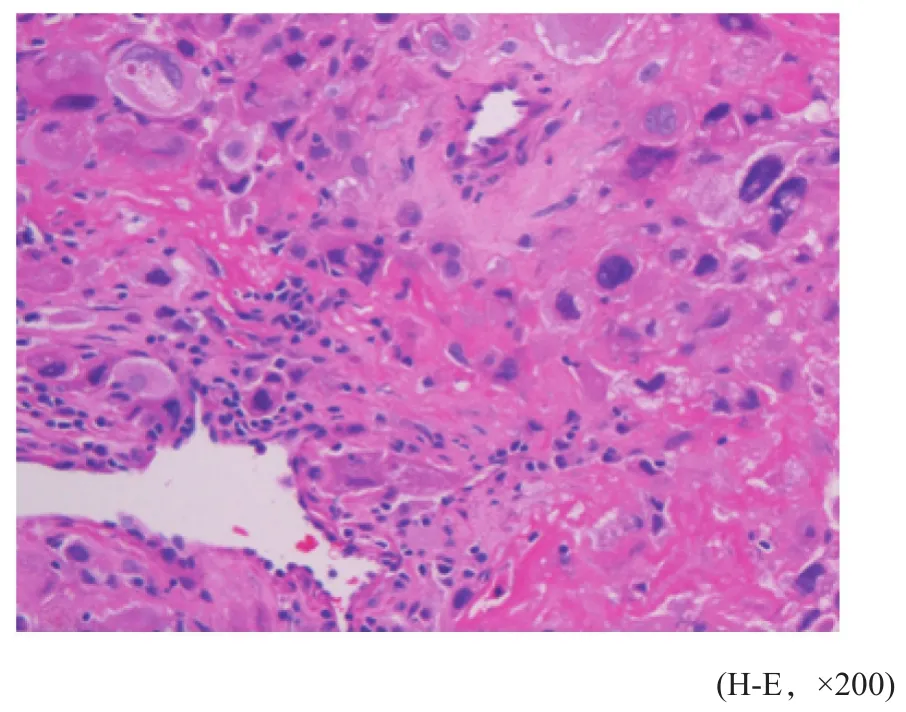
图 1 PSTT组织病理照片Fig. 1 Pathology photomicrograph of PSTT tissue
1.2 主要试剂
RPMI-1640培养基购自美国Gibco公司,胎牛血清购自美国Sigma公司,HEPES缓冲液、丙酮酸钠溶液、青霉素-链霉素和胰酶细胞消化液购自美国Gibco公司,CCK-8试剂盒购自日本同仁化学研究所,DNA提取试剂盒购自美国Axygen公司,β-catenin抗体(ab32572)购自美国Abcam公司,CD146抗体(GTX108777)购自美国GeneTex公司,hCG抗体(ab9376)、hPL抗体(ab15554)和Muc4抗体(ab150381)购自美国Abcam。
1.3 原代细胞培养及建系
取新鲜手术切除的肿瘤组织1 cm3浸入无菌Hanks溶液清洗,去除结缔组织和坏死组织,剪成约1 mm3大小的小块。将组织块均匀接种于T25培养瓶瓶壁,静置培养,每3 d半量换液1次,接种约3周后观察直至细胞从组织块长出。接种约7周后传第1代,用0.25%胰酶消化,将细胞悬液接种于1个培养瓶中(培液不含血清)静置15~20 min,在倒置相差显微镜下观察,见部分细胞贴壁,将细胞悬液倒入另1个培养瓶中继续培养。下次传代时再按上述方法处理,重复3~5次,可使肿瘤细胞与成纤维细胞完全分离。
当细胞布满瓶底时,吸除原瓶中的旧培养液,用PBS缓冲液漂洗1遍,用0.25%胰酶消化,按1∶3的比例传代,目前已传至30余代。体外常规培养条件为含10%FBS、1%丙酮酸钠、1%L-谷氨酰胺、1%HEPES及1%双抗的RPMI-1640细胞培养基,置于37 ℃、CO2体积分数为5%的温箱中培养。
1.4 细胞生长曲线
取对数生长期的细胞,胰酶消化后调整细胞悬液密度为2×104个/mL,混匀后按0.1 mL/孔接种于96孔板,每3孔为1组,共7组。接种后连续6 d在同一时间加入CCK-8试剂反应4 h,用酶标仪测定在450 nm波长处的吸光度(D)值。以时间为横轴,D相对值(以最后1天为100%)为纵轴,绘制细胞生长曲线。
1.5 染色体核型分析
取对数生长期细胞,用0.25 μg/mL秋水仙素处理6 h,37 ℃过夜。采集分裂中期细胞,甲醇-冰醋酸(3∶1)固定处理。标本经胰酶消化处理后,用Giemsa染液染色,于显微镜下观察计数。选取分散良好,染色适中的分裂相进行核型分析。
1.6 短串重复序列(short tandem repeat,STR)分析
用Axygen-DNA抽提试剂盒提取PSTT-1细胞与PSTT肿瘤组织DNA,PCR扩增。共选取20个位点(包括性别基因):D5S818、D13S317、D7S820、D16S539、VWA、TH01、AMEL、TPOX、CSF1PO、D12S391、FGA、D2S1338、D21S11、D18S51、D8S1179、D3S1358、D6S1043、PENTAE、D19S433和PENTA,用ABI 3730XL型遗传分析仪对STR位点进行检测。用一致位点数目除以总检测位点数目,取百分数即为相似度。
1.7 免疫组织化学染色
将单克隆PSTT-1细胞用4%甲醛溶液固定,石蜡包埋切片。切片常规二甲苯脱蜡、乙醇水化。加入柠檬酸钠缓冲液(pH为6.0)95 ℃加热12 min,缓慢冷却至室温。采用0.3%H2O2-甲醇溶液37 ℃温育15 min,加入10%牛血清蛋白溶液封闭60 min。加入稀释后的一抗(β-catenin 1∶200、CD146 1∶400、hCG 1∶200、hPL 1∶200、Muc4 1∶100),4 ℃过夜。加入HRP标记的二抗,于37 ℃温育90 min。DAB显色1~5 min后,用自来水冲洗15 min终止反应,然后依次进行苏木精复染、脱水、透化、封片。以TBS取代一抗作为阴性对照。
检测结果根据染色强度和阳性细胞百分比综合评定。染色强度:阴性为0分,弱阳性为1分,中等阳性为2分,强阳性为3分;阳性细胞百分比:无阳性细胞为0分,阳性细胞数1%~25%为1分,26%~50%为2分,51%~75%为3分,大于75%为4分。二者相乘,0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。随机选取5个高倍视野(×400)观察评分,取其均值。
2 结 果
2.1 在倒置显微镜下观察细胞形态
通过肿瘤组织块法原代培养,反复贴壁法去除成纤维细胞,建立可稳定传代的人PSTT细胞系,命名为PSTT-1。在倒置显微镜下观察,细胞单层贴壁生长,失去接触抑制,细胞体较大,呈多突起的星形或纺锤形结构,形态不均一(图2)。
2.2 CCK-8法观察细胞生长曲线
PSTT-1体外培养生长良好,每5 d传代1次,能够连续稳定传代,目前已传至30余代。细胞生长曲线见图3。冻存后复苏,细胞生长良好。
2.3 G显带观察染色体核型
随机计数21个细胞,染色体数目均为46条。G显带分析2个细胞核型,为正常女性核型:46,XX(图4),在此显带水平上未见明显染色体异常。
2.4 STR分析PSTT-1细胞来源
PSTT-1细胞与PSTT肿瘤组织STR分析匹配度高度一致(表1)。细胞系相比于肿瘤组织位点相似度达100%(相似度大于等于80%认为同源[8]),提示PSTT-1来源于肿瘤组织。
2.5 免疫组织化学染色

图 2 PSTT-1细胞形态特征Fig.2 Morphological characteristics of PSTT-1
PSTT-1免疫组织化学染色结果显示,β-catenin主要在细胞膜表达,呈强阳性(+++);CD146主要在细胞膜表达,呈中度阳性(++);hCG在细胞质和细胞膜表达,呈中度阳性(++);hPL在细胞质和细胞膜表达,呈强阳性(+++);Muc4主要在细胞膜表达,呈中度阳性(++)。符合中间型滋养细胞特征(图5)。
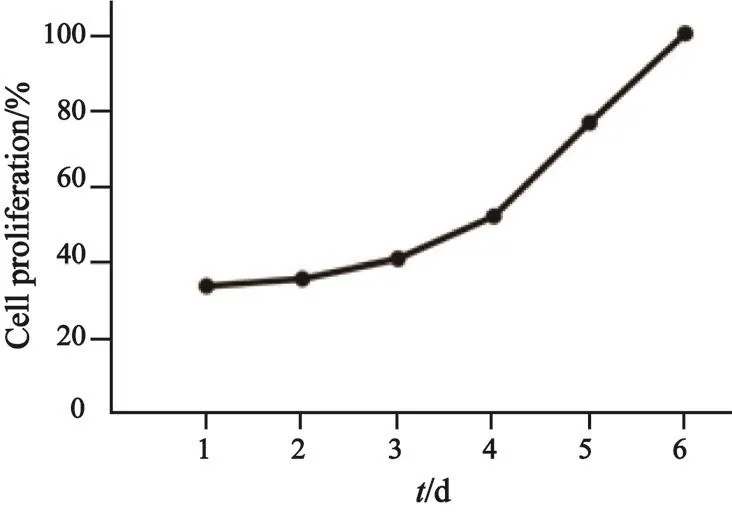
图 3 PSTT-1细胞生长曲线Fig. 3 Growth curve of PSTT-1
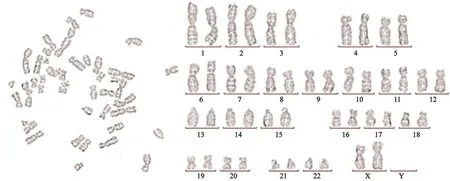
图 4 PSTT-1染色体核型分析Fig. 4 Chromosomal karyotype analysis of PSTT-1

图 5 PSTT-1细胞系表达β-catenin、CD146、hCG、hPL和Muc4Fig. 5 Expression of β-catenin, CD146, hCG, hPL and Muc4 in PSTT-1 cell line

表 1 PSTT-1与肿瘤组织STR分析Tab. 1 STR pro filing of PSTT-1 cell line and PSTT tissue
3 讨 论
本研究通过手术切除的PSTT组织标本原代培养,纯化并传代,建立人PSTT细胞系PSTT-1。PSTT-1具有以下生物学特征:
① 单层贴壁生长,失去接触抑制,形态不均一,呈多突起的星形或纺锤形结构;② 体外培养生长良好,每5 d传代1次,能够连续稳定传代,目前已传至30余代;③ 染色体核型分析结果为正常女性核型:46,XX;④ PSTT-1与肿瘤组织STR分析结果高度匹配,提示PSTT-1来源于肿瘤组织;⑤ PSTT-1细胞表达β-catenin、CD146、hCG、hPL和Muc4。
hCG和hPL是教科书上经典的滋养细胞标志物[9]。而滋养细胞又分为3种不同功能的亚型:细胞滋养细胞、合体滋养细胞和中间型滋养细胞,3种细胞亚型的鉴别对临床诊断有重要意义。近年来已有一些较公认的鉴别诊断标志物:中间型滋养细胞特异性表达CD146[2,10];β-catenin在中间型滋养细胞为细胞膜表达,而在细胞滋养细胞为细胞核表达[11];中间型滋养细胞表达Muc4[11]。PSTT-1的鉴定结果与文献报道一致,符合中间型滋养细胞的特征。
因PSTT临床相对少见,相关基础研究进展缓慢。目前仅有1例关于PSTT细胞系建立的报道,Shih等[12]于2002年成功建立1例PSTT细胞系IST-2,该团队利用IST-2探索了MAPK通路在PSTT侵袭和迁移中的作用。
化疗是肿瘤的主要治疗手段之一,特别是对于进展期肿瘤,但是其疗效受限于肿瘤的耐药性[13]。化疗耐药一直是肿瘤基础研究的热点,肿瘤的耐药机制复杂,包括药物外排增加、药物靶点突变、DNA损伤修复及细胞凋亡逃避等[14]。但是PSTT的化疗耐药问题尚未得到足够的重视,目前尚不清楚PSTT具体对何种化疗药物耐药,也不了解其耐药机制。本研究建立的PSTT细胞系,能够为PSTT的化疗敏感性研究提供体外实验模型。
PSTT多见于育龄期女性,近年来,随着生活质量的提高和二胎政策的开放,生育功能的保留成为治疗中需要特别考虑的问题。目前临床上对PSTT保留生育功能的治疗还处在探索阶段,对于有强烈保留生育功能意愿、病灶局限且无不良预后因素的患者,可以考虑行保守性手术;病灶弥漫者不适用[15-17]。但是考虑到转移和复发患者的预后不佳,PSTT保留生育功能的治疗仍有争议。通过PSTT基础研究如果能够找到逆转化疗耐药的靶点,将有助于临床上开展保留生育功能的治疗。
PSTT是妊娠滋养细胞肿瘤中一种特殊的类型,目前对PSTT的认识还非常有限,以致临床对转移性患者处理棘手,对保留生育功能的治疗仍需探索。本研究建立的细胞系为PSTT的病因学、转移机制及耐药机制等基础研究提供了体外实验模型。
[1] SECKL M J, SEBIRE N J, BERKOWITZ R S. Gestational trophoblastic disease[J]. Lancet, 2010, 376(9742): 717-729.
[2] KURMAN R J, SHIH I M. Discovery of a cell: reflections on the checkered history of intermediate trophoblast and update on its nature and pathologic manifestations[J]. Int J Gynecol Pathol, 2014, 33(4): 339-347.
[3] AJITHKUMAR T V, ABRAHAM E K, REJNISHKUMAR R, et al. Placental site trophoblastic tumor[J]. Obstet Gynecol Surv, 2003, 58(7): 484-488.
[4] BEHTASH N, KARIMI ZARCHI M. Placental site trophoblastic tumor[J]. J Cancer Res Clin Oncol, 2008, 134(1): 1-6.
[5] SCHMID P, NAGAI Y, AGARWAL R, et al. Prognostic markers and long-term outcome of placental-site trophoblastic tumours: a retrospective observational study[J]. Lancet, 2009, 374(9683): 48-55.
[6] NGAN H Y, SECKL M J, BERKOWITZ R S, et al. Update on the diagnosis and management of gestational trophoblastic disease[J]. Int J Gynaecol Obstet, 2015, 131(Suppl 2): 123-126.
[7] HOROWITZ N S, GOLDSTEIN D P, BERKOWITZ R S. Placental site trophoblastic tumors and epithelioid trophoblastic tumors: biology, natural history, and treatment modalities[J]. Gynecol Oncol, 2017, 144(1): 208-214.
[8] MASTERS J R, THOMSON J A, DALY-BURNS B, et al. Short tandem repeat profiling provides an international reference standard for human cell lines[J]. Proc Natl Acad Sci U S A, 2001, 98(14): 8012-8017.
[9] KURMAN R J, ELLENSON L H, RONNETT B M. Blaustein’s pathology of the female genital tract[M]. New York: Springer, 2011: 1080-1083.
[10] SHIH I M, KURMAN R J. Expression of melanoma cell adhesion molecule in intermediate trophoblast[J]. Lab Invest, 1996, 75(3): 377-388.
[11] MAO T L, KURMAN R J, HUANG C C, et al. Immunohistochemistry of choriocarcinoma: an aid in differential diagnosis and in elucidating pathogenesis[J]. Am J Surg Pathol, 2007, 31(11): 1726-1732.
[12] SHIH I M, SINGER G, KURMAN R J. Establishment of intermediate trophoblastic cell lines from PSTT and complete hydatidiform mole[J]. Mod Pathol, 2002, 15(1): 210A-210A.
[13] KOBEL M, POHL G, SCHMITT W D, et al. Activation of mitogen-activated protein kinase is required for migration and invasion of placental site trophoblastic tumor[J]. Am J Pathol, 2005, 167(3): 879-885.
[14] HOLOHAN C, VAN SCHAEYBROECK S, LONGLEY D B, et al. Cancer drug resistance: an evolving paradigm[J]. Nat Rev Cancer, 2013, 13(10): 714-726.
[15] PFEFFER P E, SEBIRE N, LINDSAY I, et al. Fertilitysparing partial hysterectomy for placental-site trophoblastic tumour[J]. Lancet Oncol, 2007, 8(8): 744-746.
[16] 赵 峻, 向 阳, 郭丽娜, 等. 胎盘部位滋养细胞肿瘤保留生育功能治疗17例临床分析[J]. 中华妇产科杂志, 2014, 49(4): 265-269.
[17] ZHAO J, LV W G, FENG F Z, et al. Placental site trophoblastic tumor: a review of 108 cases and their implications for prognosis and treatment[J]. Gynecol Oncol, 2016, 142(1): 102-108.
Establishment and identi fication of human placental site trophoblastic tumor cell line
LIU Qiyu1,2, LI Ke1,2, XU Jing1,2, HUANG Yunke1,2, ZHAO Chenyan3, LUO Jianmin4, LI Guiling1,2, KANG Yu1,2, XU Congjian1,2
(1. Department of Integrated Traditional Chinese and Western Medicine, Obstetrics and Gynecology Hospital of Fudan University, Shanghai 200011, China; 2. Shanghai Key Laboratory of Female Reproductive Endocrine Related Diseases, Shanghai 200011, China; 3. Department of Pathology, Obstetrics and Gynecology Hospital of Fudan University, Shanghai 200011, China; 4. Center for Biomedical Imaging, Fudan University, Shanghai 200032, China)
Correspondence to: KANG Yu E-mail: yukang@fudan.edu.cn
Background and purpose: Placental site trophoblastic tumor (PSTT) is a special type of gestational trophoblastic tumor. It remains no general cell line for PSTT. The aim of this study was to establish and identify a human PSTT cell line. Methods: In this study, a PSTT cell line (PSTT-1) was derived from primary culture of a surgically resected PSTT tissue. We further identi fied the basic characteristics of PSTT-1, including cell morphology, cell growth curve, karyotype analysis, short tandem repeat (STR) profiling of PSTT-1 and its parental tumor, and immunohistochemistry analysis. Results: A human PSTT cell line named PSTT-1 was successfully established. PSTT-1 formed a monolayer growth and lost contact inhibition, and exhibited a pleomorphic morphology. PSTT-1 cells grew actively in vitro. PSTT-1 was passaged every 5 days, and maintained in culture for more than 30 passages. Karyotyping of PSTT-1 revealed normal female karyotype: 46, XX. STR pro filing of PSTT-1 was nearly identical to itsparental tumor. Immunohistochemistry analysis of PSTT-1 revealed expression of β-catenin, CD146, human chorionic gonadotropin (hCG), human placental lactogen (hPL) and Muc4. Conclusion: This study established a PSTT cell line, which could be useful for further research on PSTT.
Placental site trophoblastic tumor; Cell line; Primary culture
10.19401/j.cnki.1007-3639.2017.07.001
R737.33
A
1007-3639(2017)07-0521-06
2017-01-04
2017-03-12)
国家自然科学基金(81472423);上海市科委国际合作项目(14430723000)。
康 玉 E-mail:yukang@fudan.edu.cn

