61例原发性肾淋巴瘤临床诊治分析
李 曾,廖 洪,谭 政,毛 顿,吴 毅,肖英明,杨盛柯,钟 磊
四川省肿瘤医院泌尿外科,四川 成都 610041
61例原发性肾淋巴瘤临床诊治分析
李 曾,廖 洪,谭 政,毛 顿,吴 毅,肖英明,杨盛柯,钟 磊
四川省肿瘤医院泌尿外科,四川 成都 610041
背景与目的:原发性肾淋巴瘤(primary renal lymphoma,PRL)在临床上较罕见,术前诊断较困难,易误诊为肾癌。该研究旨在总结并探讨PRL的临床分期、病理类型、诊治及预后的特点。方法:回顾性分析国内1981—2014年个案报道的61例PRL患者的临床资料。结果:61例患者中,男性34例(55.7%),女性27例(44.3%),男女比例为1.3∶1.0,发病年龄为3~84岁,50~70岁为高发,平均年龄为52.3岁;单侧病变53例(86.9%),其中左肾34例(64.2%),右肾19例(35.8%),双侧病变8例(13.1%);45例(73.8%)出现腰痛,17例(27.9%)出现发热,8例(13.1%)出现血尿,2例(3.3%)出现急性肾功能衰竭;非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)58例(95.1%),占绝大多数,其中B细胞淋巴瘤(B cell lymphoma,BCL)48例(82.8%),T细胞淋巴瘤(T cell lymphoma,TCL)5例(8.6%),未具体分类5例(8.6%),以弥漫大B细胞淋巴瘤(di ff use large B cell lymphoma,DLBCL)最常见,为28例(58.3%),霍奇金淋巴瘤(Hodgkin’s lymphoma,HL)只有1例(1.6%);47例(77.0%)接受过根治性肾切除手术,48例(78.7%)接受过化疗(其中14例为单纯化疗,34例为术后辅助化疗),9例(14.8%)接受过放疗;失访1例(1.6%),未提及预后情况3例(4.9%),34例(55.7%)病情稳定、存活,但有23例(37.7%)复发、进展,再治疗后,缓解稳定4例(6.6%),最终死亡19例(31.1%)。结论:PRL临床较罕见、易误诊、恶性程度较高、预后较差,早期行根治性肾切除术、术后联合化疗等综合治疗,有助于减少复发和改善预后。
肾肿瘤;淋巴瘤;临床特征;回顾性分析
原发性肾淋巴瘤(primary renal lymphoma,PRL)是原发于肾脏的结外淋巴瘤,在临床上较少见,国内外报道不多,且大多为个案报道,恶性程度较高,术前诊断较困难,易误诊为肾癌,其治疗及预后不同于常规肾脏肿瘤,因此有必要对PRL的临床、病理特征等进行总结分析,有助于在临床中对该疾病进行正确诊疗,而目前国内尚缺乏这方面的大宗研究。该研究结合四川省肿瘤医院曾收治的1例PRL患者,随访至今已21个月,未见肿瘤复发及转移,取得较满意效果,并回顾性分析国内1981—2014年个案报道的60例PRL患者的资料,以探讨PRL患者的临床分期、病理类型、诊治及预后的特点。
1 资料和方法
1.1 病例收集
本研究病例收集使用关键词“原发性肾淋巴瘤”在中国知网、万方和维普等数据库中对篇名及摘要进行系统文献检索,时限截至2014年。最终共搜索到相关文献43篇,文章发表时间分布在1981—2014年。经过筛选,排除非原发性肾淋巴瘤,即系统性淋巴瘤累及肾脏的病例,最终符合PRL诊断标准的相关文献36篇,共纳入61例患者。
1.2 研究方法
收集61例入组PRL患者的临床资料,包括性别、发病年龄、发病部位、临床症状、病理结果、治疗方案和随访生存情况等,回顾性分析其临床分期、病理类型、诊治及预后的特点。
2 结 果
2.1 PRL患者的临床特点
61例PRL患者中,男性34例(55.7%),女性27例(44.3%),男女比例为1.3∶1.0;发病年龄:30岁以下段6例(9.8%),其中4例为儿童,30~40岁段7例(11.5%),40~50岁段8例(13.1%),50~60岁段15例(24.6%),60~70岁段18例(29.5%),70岁以上段7例(11.5%),平均发病年龄为52.3岁,成人发病年龄为25~84岁,50~70岁高发;发病部位:单侧肾脏53例(86.9%),其中左肾34例(64.2%),右肾19例(35.8%),双侧肾脏8例(13.1%);临床症状方面:除10例(16.4%)无任何临床症状,为体检发现,其余51例(83.6%)患者均有临床症状,其中单纯腰痛26例(43.6%),单纯发热1例(1.6%),单纯血尿3例(4.9%),腰痛伴发热14例(23.0%),腰痛伴血尿3例(4.9%),腰痛、发热伴血尿2例(3.3%),急性肾功能衰竭2例(3.3%),总体来看,45例(73.8%)患者出现腰痛,17例(27.9%)出现发热,8例(13.1%)出现血尿(表1)。
2.2 PRL患者的病理特点
61例PRL患者中,除2例(3.3%)病理类型未具体明确外,余下59例中,非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)占绝大多数,为58例(95.1%),霍奇金淋巴瘤(Hodgkin’s lymphoma,HL)只有1例(1.6%),为结节硬化型(nodular sclerosis type,NS)。NHL中B细胞淋巴瘤(B cell lymphoma,BCL)48例(82.8%),T细胞淋巴瘤(T cell lymphoma,TCL)5例(8.6%),未具体分类5例(8.6%)。BCL中,以弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)最为常见,为28例(58.3%)。我们的病例即属于该型,具体病理结果:DLBCL,侵袭性见1A~C,肾静脉查见肿瘤细胞团,符合瘤栓,肾周脂肪及输尿管断端未查见肿瘤累及。免疫表型见图1D~F:CD3(-),CD20(+),CD79a(+),CD99(-),TdT(-),ki-67(90%),bcl-6(+),CD10(-),GCET(-),FOXP1(+),Mum-1(+),CK(-),EMA(-),MPO(-),LCA(+),CD34(-),CD43(+),CD117(-),提示为非生发中心来源。其他类型还有小淋巴细胞性淋巴瘤(small lymphocytic lymphoma,SLL)8例(16.7%),黏膜相关淋巴组织的结外边缘区B细胞淋巴瘤(mucosa associated lymphoid tissue outside the junction of marginal zone B cell lymphoma,MALT)4例(8.3%),滤泡性淋巴瘤(follicular lymphoma,FL)4例(8.3%),Burkitt淋巴瘤1例(2.1%),MALT/DLBCL 1例(2.1%),淋巴母细胞性淋巴瘤(lymphoblastic lymphoma,LBL)1例(2.1%),淋巴浆细胞性淋巴瘤(lymphatic plasma cell lymphoma,LPL)1例(2.1%)。TCL中,非特殊性外周T细胞淋巴瘤 (unspecified peripheral T-cell lymphoma,PTUN)4例,T细胞淋巴母细胞性淋巴瘤(T cell lymphoblastic lymphoma,T-LBL)1例(表2)。
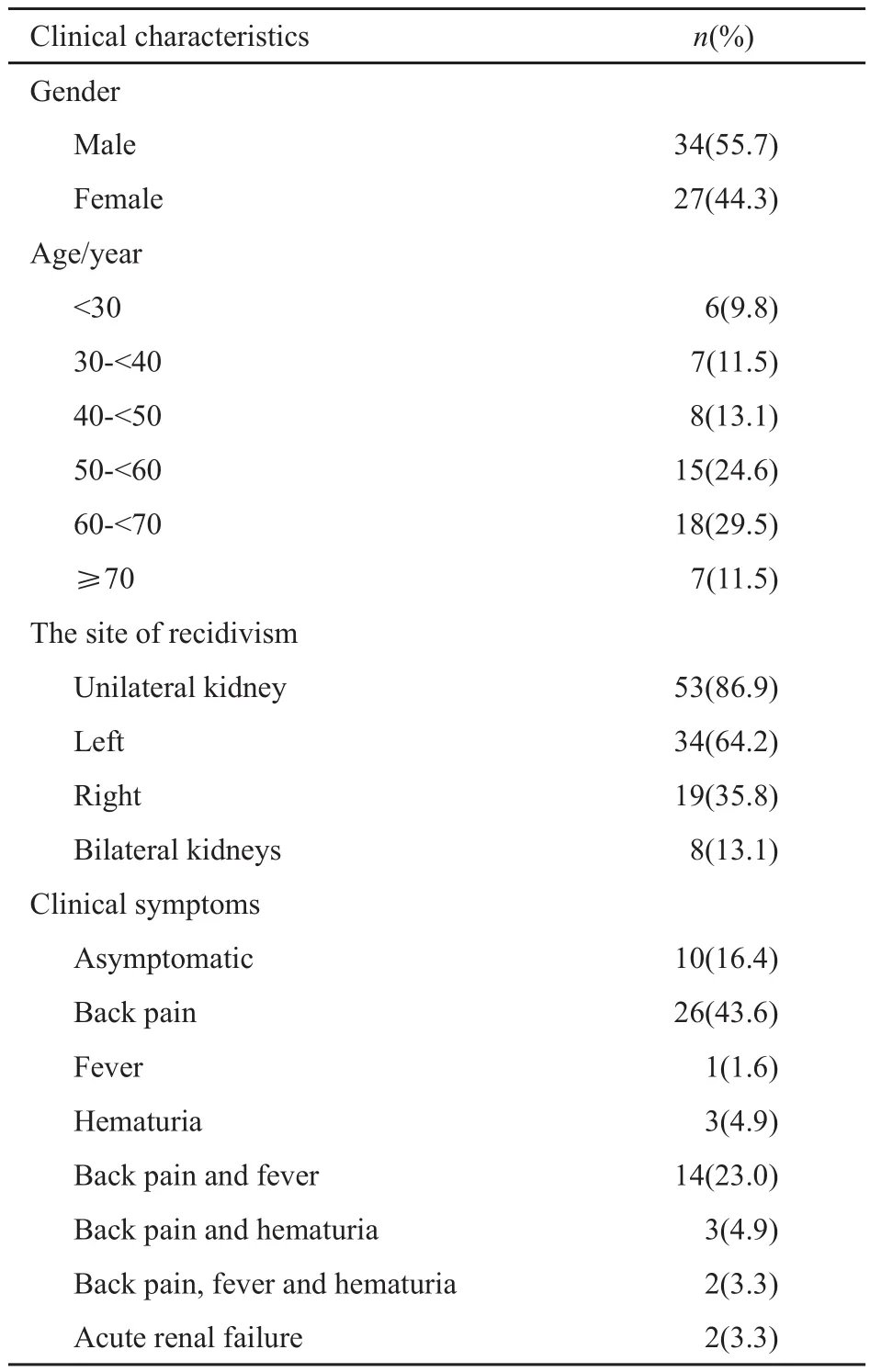
表 1 61例PRL患者的临床特点Tab. 1 Clinical characteristics of 61 PRL patients
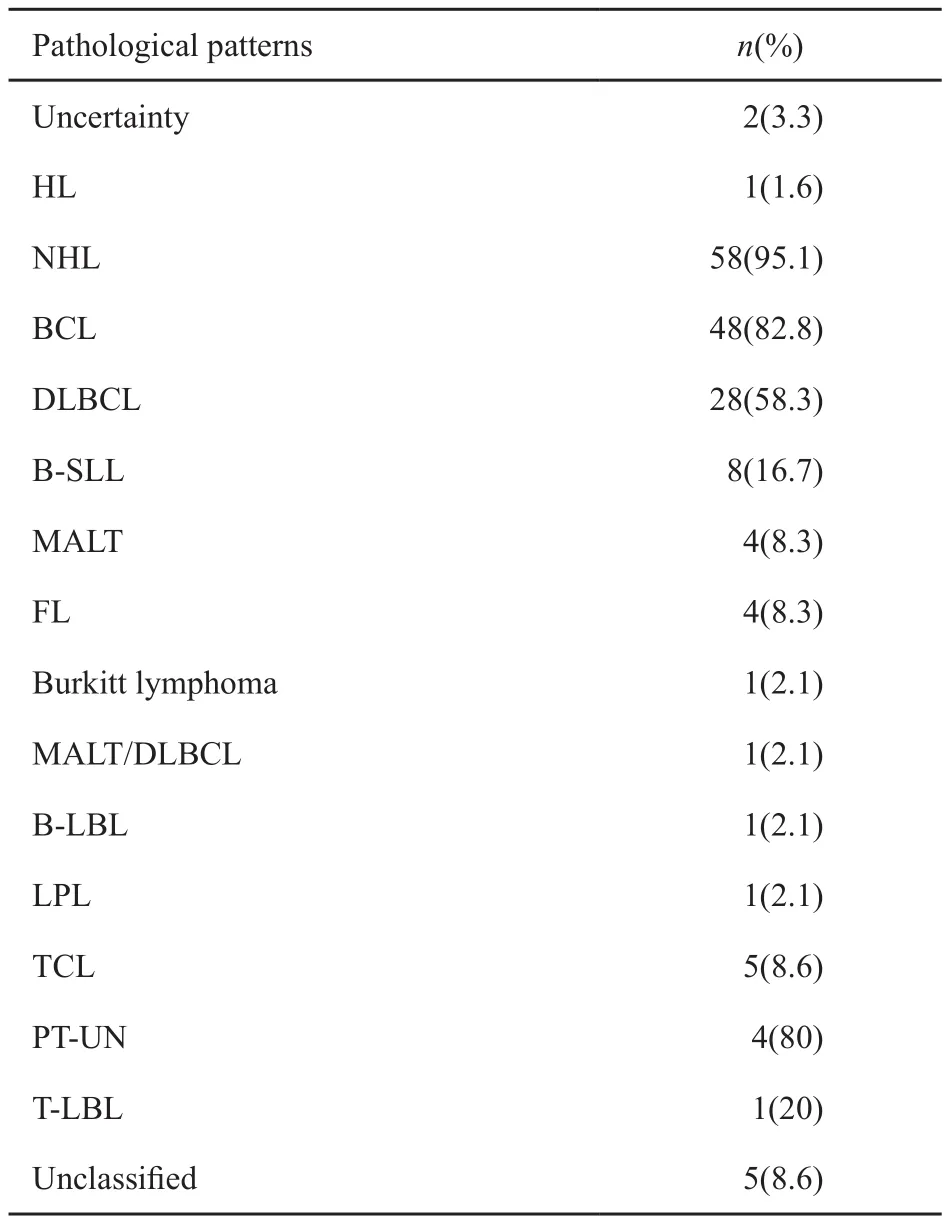
表 2 61例PRL患者的病理类型Tab. 2 Pathological patterns of 61 PRL patients
2.3 PRL患者的治疗和预后情况
治疗方面:61例PRL患者中,47例(77.0%)行根治性肾切除术(其中1例为双侧病变,行单侧根治性肾切除术),14例(23.0%)为穿刺活检病理明确,未行手术,均行单纯化疗;47例手术患者中,12例(19.7%)术后未给予任何辅助治疗,辅助化疗26例(42.6%),辅助放疗1例(1.6%),辅助放化疗7例(11.5%),辅助放化疗联合造血干细胞移植(hematopoietic stem cell transplantation,HSCT)1例(1.6%);总体来看,共有47例(77.0%)接受过手术,48例(78.7%)接受过化疗(其中14例为单纯化疗,34例为术后辅助化疗),9例(14.8%)接受过放疗。化疗方案方面:1例HL采用MOPP(氮芥+长春新碱+甲基苄肼+泼尼松)+阿霉素+博来霉素方案,47例NHL中,单用环磷酰胺1例(2.1%),采用CHOP(环磷酰胺+阿霉素+长春新碱+泼尼松)方案8例(17.0%),CHOP方案+利妥昔单抗17例(36.2%),CHOP方案+干扰素7例(14.9%),CHOP方案+利妥昔单抗+干扰素1例(2.1%),CHOP+博来霉素方案2例(4.3%),CHOEP(CHOP+依托泊苷)方案1例(2.1%),COP(环磷酰胺+长春新碱+泼尼松)方案+干扰素1例(2.1%),BACOP(博来霉素+阿霉素+COP)方案4例(8.6%),COPP(COP+盐酸甲基苄肼)方案2例(4.3%),COPP+博来霉素方案1例(2.1%),CTOP(COP+吡柔比星)方案+利妥昔单抗1例(2.1%),CEOP(环磷酰胺+吡柔比星+长春新碱+泼尼松)方案1例(2.1%,表3)。随访生存情况:失访1例(1.6%),未提及预后情况3例(4.9%),治疗后34例(55.7%)患者病情稳定、存活,但23例(37.7%)患者复发、进展,采用解救方案DICE、MINE及ESHAP等治疗,缓解稳定4例(6.6%),最终死亡19例(31.1%),分期较晚的患者均在半年左右死亡(表4)。
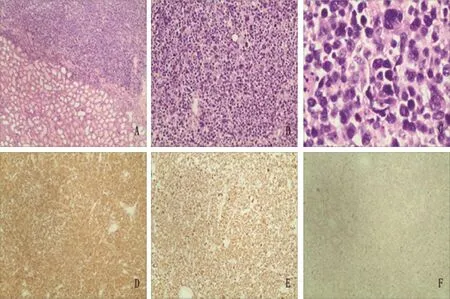
图 1 DLBCL的病理Fig. 1 Pathology of DLBCL
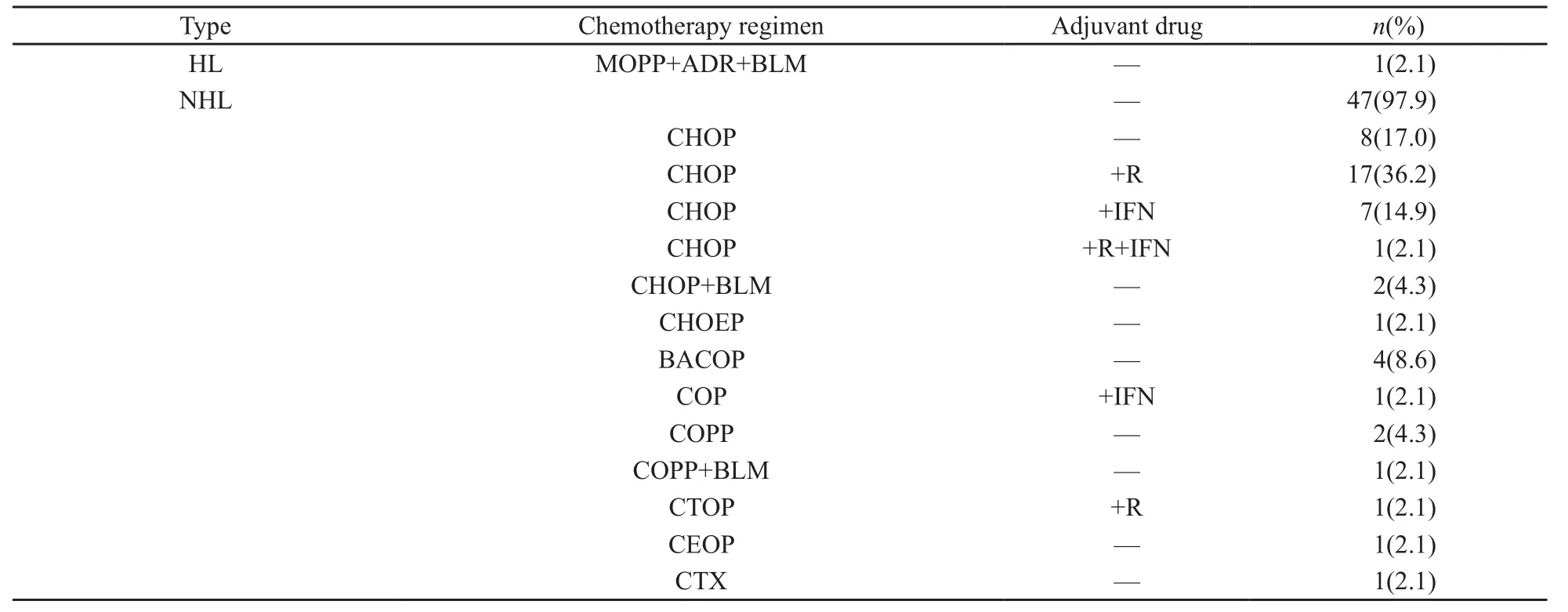
表 3 48例PRL化疗患者的化疗方案Tab. 3 Chemotherapy regimens of 48 PRL chemotherapy patients

表 4 61例PRL患者的治疗和预后Tab. 4 Treatment and prognosis of 61 PRL patients
3 讨 论
淋巴瘤是起源于淋巴造血系统的恶性肿瘤,分为结内型和结外型,结内型最常见。结外淋巴瘤是指发生于淋巴结以外的淋巴瘤,约占30%,其在临床分期、病理类型、诊治和预后等方面均具有自身特点,其中以胃肠道最常见,约占50%,其次为头颈部,少数发生于中枢神经系统、骨、皮肤软组织、肝、脾、肺、纵膈、心脏、卵巢、甲状腺、骨和睾丸等。PRL是原发于肾脏的结外淋巴瘤,1956年被首次报道后陆续有文献报道,但临床较罕见,其约占结外淋巴瘤的0.62%,全部淋巴瘤的0.1%[1]。目前,关于PRL的病因仍不清楚,可能与遗传、细胞凋亡机制的失控、DNA修复缺陷、免疫抑制和病毒(如EB病毒、HIV病毒和人类T细胞白血病病毒)感染等因素有关[1-2]。发病机制可能包括:① 由原始中胚层的干细胞向淋巴网状细胞分化而来;② 肾包膜或肾周脂肪内的淋巴组织侵入肾实质形成PRL[3];③ 自身免疫机制也可能导致淋巴细胞聚集并出现恶性潜能[4];④ 慢性炎性刺激引起淋巴细胞向肾实质内产生淋巴组织,在某些致癌因素的影响下形成PRL[2]。
PRL可发生于任何年龄,多见于中老年人,中位发病年龄为60~64岁,国内40~50岁多发,男性稍多于女性,约为2∶1,单侧多于双侧,左侧较右侧常见。临床表现多无特异性,主要为淋巴瘤B症状(指发热、盗汗及体重减轻)或肿块局部导致的相应症状,如腰痛、腰部肿块、血尿、蛋白尿[2,4]及急性肾功能衰竭[5]等,少数还可合并丙肝病毒感染[6]及中枢神经系统受累等[7],其中以腰痛最常见。本研究中,男性34例(55.7%),女性27例(44.3%),男女比例为1.3∶1.0;成人发病年龄为25~84岁,50~70岁高发,平均发病年龄为52.3岁;单侧病变53例(86.9%),其中左肾34例(64.2%),右肾19例(35.8%),双侧病变8例(13.1%);45例(73.8%)患者出现腰痛,17例(27.9%)出现发热,8例(13.1%)出现血尿,2例(3.3%)出现急性肾功能衰竭,与文献报道较一致,但发病年龄较年轻化。
PRL在影像学表现上缺乏特异性,多为乏血供表现。彩超表现为肾内局灶性低或弱回声病变,边界欠清,多数后方回声不增强;弥漫浸润者肾外形增大,肾内可见密集的弱回声区;肾周间隙内浸润生长者,可见肾周带状低回声环绕,液化、坏死及钙化少见,常易误诊为囊肿等。CT平扫时一般表现为软组织肿块密度,略高于肾实质,呈轻度持续强化,可表现为单或多发肿物型、邻近病灶侵犯型、肾周肿物型和弥漫增大型。而MRI表现为在T1WI上一般为等低信号,在T2WI上为低信号,轻度持续强化。与肾癌极易混淆,甚至同时存在[8],肾脏包膜或包膜下的弥漫浸润,呈不均匀的弱强化,一般无中心性坏死,极少侵犯肾血管及出现瘤栓是其特征性影像学表现。PET/ CT对于两者的术前鉴别、评估分期及预后等具有独特意义[9]。病理类型方面,NHL占绝大多数,HL极少见,前者在病理组织类型、免疫学表型及分子遗传学特征等方面具有很大的异质性。NHL中以BCL多见,TCL次之,其中国内外均以DLBCL最常见,占30%~40%,我们报道过的病例即属于该型[10],此外还有少数FL、SLL、MALT和血管内大B细胞性等报道[11]。免疫组织化学检查DLBCL可表达全B细胞相关标记,典型如CD19、CD20、CD22及CD79a等,可将DLBCL分为生发中心B细胞样(germinal center B cell-like,GCB)型和非生发中心B细胞样(non-GCB)型,后者包括基因表达谱分类的ABC型和其他无明确特征的异源性类型(第3型),GCB的标记为CD3、CD10和bcl-6,non-GCB的标记为MUM1,GCB型5年总生存率为76%,non-GCB型5年总生存率为34%。分子遗传学可检测到多种改变,如bcl-1、bcl-2、bcl-6、c-myc基因重排、非整倍体核型(+5、+6、+7和+18)及6q缺失等。我们统计的病例也与文献报道相近,其中NHL占绝大多数,为58例(95.1%),BCL 48例(82.8%),TCL 5例(8.6%),又以DLBCL最常见,为28例(58.3%)。其他还有少数SLL 8例(16.7%),MALT 4例(8.3%),fl4例(8.3%),Burkitt淋巴瘤1例(2.1%)等。
诊断PRL需符合以下几点:① 肾脏肿块病理证实为淋巴瘤浸润,肿块内部可见残存的肾小管;② 全身PET/CT影像学检查证实无肾外其他脏器或淋巴结受侵的证据;③ 血液化验和骨髓活检明确无白血病血象或骨髓象异常表现[3];④ 还有学者认为应具备发现肾脏淋巴瘤至少3个月后未发现其他部位淋巴瘤[12]。病理诊断上需注意与粒细胞肉瘤鉴别,后者是发生于髓外由未成熟髓系细胞构成的局限性淋巴造血系统肿瘤,其肿瘤细胞中存在髓过氧化物酶(myeloperoxidase,MPO),常使肿瘤呈淡绿色,也称为“绿色瘤”,由于MPO对髓系细胞有高度灵敏度和特异度,因此是粒细胞肉瘤与淋巴瘤鉴别诊断最有意义的免疫组织化学指标。
对于PRL的治疗,需根据分类、肿瘤分期、预后因素以及患者的年龄和身体状况等进行个体化治疗,如NHL可根据国际预后指数(international prognostic index score,IPI)评分将患者分为低危、中低危、中高危和高危来分层治疗。PRL主要表现为肾脏肿块,故单侧病变有手术条件应首选根治性肾切除术。双侧PRL则首选化疗,单独手术的疗效很差,约75%的患者于1年内死亡,术后应辅以全身化疗联合或不联合放疗[13],但年轻、局限期伴不良预后因素的侵袭性NHL患者联合或不联合放疗对预后无明显影响。对于惰性淋巴瘤(如FL),可采用COP或COPP方案,必要时用CHOP方案,有效率为60%~90%。对于中度恶性、侵袭性的淋巴瘤(如DLBCL、PT-Un),标准方案是CHOP方案化疗6~8个疗程,总有效率为80%~90%,联合放疗,5年生存率为64%,而单纯放疗的5年生存率只有37%。还有在CHOP方案基础上强化化疗强度(如CHOP 14天方案)、增加无交叉耐药药物(如BACOP、CHOEP方案等)和CHOP样方案(如CTOP、CEOP方案等),可使部分侵袭性NHL患者的无病生存期和总生存期改善。在CHOP方案基础上加用干扰素亦对近期和远期疗效有益,可明显提高NHL患者的5年治愈率。因为超过90%的BCL表达CD20抗原,利妥昔单抗为人鼠嵌合型的CD20单克隆抗体,能引起CD20阳性细胞的死亡,还能克服bcl-2介导的化疗药物耐药,增加化疗的敏感性,因此,近年来在标准CHOP化疗方案中联合应用利妥昔单抗即R-CHOP方案,有研究证实,无论哪种年龄或危险度的患者,利妥昔单抗与CHOP方案或CHOP样方案联合应用比单一CHOP方案能明显改善侵袭性BCL患者的生存期,已成为新的标准治疗方案[14]。Vázquez-Alonso等[15]报道早期行手术及联合R+CHOP方案化疗的综合治疗对于改善预后有重要意义,其治疗的2例患者均无瘤存活5年以上。不过仍有60%~70%的患者常规治疗失败和复发、进展,二线解救治疗方案包括ICE/DICE、MINE、EPOCH、DHAP/ ESHAP、GEMOX及GDP方案等,但总体长期生存率较差。高剂量化疗联合自体造血干细胞移植(autologous stem cell transplantation,ASCT)是复发或难治性高危型侵袭性NHL标准的治疗方法,完全缓解率要高于一线化疗方案,能够延长患者的无进展生存期和总生存期,但总有效率亦不超过50%,不过免疫化疗后早期复发(1年内)的患者即使行ASCT,预后也较差,应考虑异基因ASCT。此外,在二线化疗中和ASCT前后联合应用利妥昔单抗可增强疗效[16]。本研究统计的61例PRL患者中,共有47例(77.0%)接受过手术,48例(78.7%)接受过化疗(其中14例为单纯化疗,34例为术后辅助化疗),9例(14.8%)接受过放疗;化疗方面,除HL外,基本以COP、COPP、CHOP或CHOP样方案(如CTOP、CEOP和BACOP)为主,早期联合IFN,近年联合利妥昔单抗。
PRL的预后与病理组织类型、肿瘤分期、浸润程度、患者全身状况和治疗手段等有关,IPI对于NHL的治疗和预后评估有很好的指导意义。化疗、免疫治疗等治疗手段的进步虽然使PRL患者的生存改善,但总体预后仍较差,尤其是合并双侧病变、急性肾功能衰竭及人体免疫缺陷病毒感染者等,有研究报道,存活期最短不足1个月,最长超过108个月[17],中位生存时间为8个月~3年,5年生存率为40%~50%。NHL优于HL,虽然T、B来源并不是决定预后的主要因素,但T细胞来源的NHL缓解率和远期生存率都较B细胞来源低,此外,MALT预后良好。预后方面,我们的统计中有34例(55.7%)患者病情稳定、存活,但有23例(37.7%)复发、进展,再治疗后,缓解稳定4例(6.6%),最终死亡19例(31.1%),与文献报道较一致。
综上,PRL发病率较低,临床表现缺乏特异性,误诊率较高,早期诊断存在一定困难,希望通过对本组PRL患者相关临床和诊治特点的总结分析,提高研究者对该疾病的认识,积极采用个体化、综合性的治疗措施,合理评估和调控影响预后的相关因素,延长患者的生存期。
[1] OKUNO S H, HOYER J D, RISTOW K, et al. Primary renal non-Hodgkin’s lymphoma. An unusual extranodal site[J]. Cancer, 1995, 75(9): 2258-2261.
[2] YASUNAGA Y, HOSHIDA Y, HASHIMOTO M, et al. Malignant lymphoma of the kidney[J]. J Surg Oncol, 1997, 64(3): 207-211.
[3] STALLONE G, INFANTE B, MANNO C, et al. Primary renal lymphoma does exist: case report and review of the literature[J]. J Nephrol, 2000, 13(5): 367-372.
[4] RAJAPPA S, DIGUMARTI R, IMMANENI S R, et al. Primary renal lymphoma presenting with paraneoplastic limbic encephalitis[J]. J Clin Oncol, 2007, 25(24): 3783-3785.
[5] OZALTIN F, YALCIN B, ORHAN D, et al. An unusual cause of acute renal failure: renal lymphoma[J]. Pediatr Nephrol, 2004, 19(6): 912.
[6] KAYA A,KANBAY M,BAYRAK O, et al. Primary renal lymphoma associated with hepatitis C virus infection[J]. Leuk Lymphoma, 2006, 47(9): 1976-1978.
[7] WANG Y, GUO S. Primary renal diffuse large B-cell lymphoma with central nervous system involvement: a rare case report and literature review[J]. Int J Clin Exp Pathol, 2015, 8(6): 7045-7049.
[8] 李文婷, 房新志. 肾透明细胞癌合并肾原发性淋巴瘤一例[J]. 中华病理学杂志, 2012, 41(10): 701-702.
[9] DHULL V S, MUKHERJEE A, KARUNANITHI S, et al. Bilateral primary renal lymphoma in a pediatric patient: staging and response evaluation with 18F-FDG PET/CT[J]. Rev Esp Med Nucl Imagen Mol, 2015, 34(1): 49-52.
[10] 李 曾, 廖 洪, 谭 政. 原发性肾淋巴瘤伴肾静脉瘤栓形成一例报告[J]. 中华泌尿外科杂志, 2014, 34(9): 724.[11] VALARMATHI K, JAMILA A, RAVI S, et al. A rare case of renal tumour[J]. J Clin and Diag Res, 2013, 7(9): 2006-2007.
[12] 张 科, 黄 杰, 王 田, 等. 肾脏原发性非霍奇金淋巴瘤——附1例报告并文献复习[J]. 中国医师进修杂志, 2006, 29(1): 73-74.
[13] NAVAS MARTINEZ M C, MOLINA E R, SOTO D M, et al. Bilateral primary renal lymphoma: case report and bibliographic review[J]. Arch Esp Urol, 2011, 64(9): 904-907.
[14] ABRAMSON J S, SHIPP M A. Advances in the biology and therapy of difuse large B-cell lymphoma: moving toward a molecularly targeted approach[J]. Blood, 2005, 106(4): 1164-1174.
[15] VÁZQUEZ-ALONSO F, PUCHE-SANZ I, SANCHEZRAMOS C, et al. Primary renal lymphoma: long-term results of two patients treated with a chemotherapy + rituximab protocol[J]. Case Rep Oncol Med, 2012, 2012: 726424.
[16] DELARUE R, HAIOUN C, RIGRAG V, et al. CHOP and DHAP plus rituximab followed by autologous stem cell transplantation in mantle cell lymphoma: a phase 2 study from the Groupe d’Etude des Lymphomesde l’Adulte[J]. Blood, 2013, 121(1): 48-53.
[17] ARRANZ ARIJA J A, CARRION J R, GARCIA F R, et al. Primary renal lymphoma: report of 3 cases and review of the literature[J]. Am J Nephrol, 1994, 14(2): 148-153.
Diagnosis and treatment of primary renal lymphoma: an analysis of 61 cases
LI Zeng, LIAO Hong, TAN Zheng, MAO Dun, WU Yi, XIAO Yingming, YANG Shengke, ZHONG Lei
(Department of Urology, Sichuan Cancer Hospital, Chengdu 610041, Sichuan Province, China)
LIAO Hong E-mail: liaohong131@163.com
Background and purpose: Primary renal lymphoma (PRL) is rare in clinic, difficult to diagnose preoperatively and easily misdiagnosed as renal cancer. We investigated the clinical pathological characteristics and treatment as well as prognosis of PRL.. Methods: Clinical data from 61 cases of PRL domestic case reports (1981—2014) were obtained and analysed retrospectively. Results: Of the 61 patients, 34 cases (55.7%) were men, 27 cases (44.3%) were women, the ratio was 1.3∶1.0. The age of onset was between 3 and 84 years with high incidence among patients aged 50 to 70 years, and the average age was 52.3 years. Unilateral lesions were found in 53 cases (86.9%), of which the left kidney in 34 cases (64.2%), 19 cases (35.8%) of the right kidney. Bilateral lesions were found in 8 cases (13.1%). The signs and symptoms of PRL included back pain in 45 cases (73.8%), fever in 17 cases (27.9%), hematuria in 8 cases (13.1%), acute renal failure in 2 cases (3.3%). There were 58 cases (95.1%) of non-Hodgkin’s lymphoma (NHL), accounting for the vast majority, of which B cell lymphoma (BCL) in 48 cases (82.6%), T cell lymphoma (TCL) in 5 cases (8.7%), not clear in 5 cases (8.7%). Di ff use large B-cell lymphoma (DLBCL) was the most common type (28 cases, 58.3%). A total of 47 cases (77.0%) underwent surgery, 48 cases (78.7%)
chemotherapy (14 cases of simple chemotherapy, 34 cases of postoperative adjuvant chemotherapy), 9 cases (14.8%) underwent radiotherapy. One case (1.6%) was lost to follow-up, and prognosis was not mentioned in 3 cases (4.9%). There were 34 cases (55.7%) in stable condition and survival, 23 cases (37.7%) had recurrence and progression, 4 cases (6.6%) achieved remission after retreatment, and 19 cases (31.1%) died at last. Conclusion: PRL is a rare tumor with higher malignancy, poorer prognosis as well as easy to misdiagnosis. Radical nephrectomy among patients with early-stage PLR combined withpostoperative chemotherapy and other comprehensive treatment, could help to reduce recurrence and improve the prognosis of the disease.
Kidney neoplasms; Lymphoma; Clinical characteristics; Retrospective studies
10.19401/j.cnki.1007-3639.2017.07.010
R737.11
A
1007-3639(2017)07-0581-07
2017-02-26
2017-04-18)
廖 洪 E-mail: liaohong131@163.com

