探讨Tim-3在非小细胞肺癌浸润巨噬细胞上的表达及其对预后的影响
申学杰,潘 娜,魏 枫,王 扬,郑 禹,金 昊,曹 水,任秀宝
1.天津医科大学肿瘤医院国家肿瘤临床医学研究中心,天津 300060;
2.天津市“肿瘤防治”重点实验室,天津 300060;
3.天津市恶性肿瘤临床医学研究中心,天津 300060;
4.天津市肿瘤免疫与生物治疗重点实验室,天津 300060
探讨Tim-3在非小细胞肺癌浸润巨噬细胞上的表达及其对预后的影响
申学杰1,2,3,4,潘 娜1,2,3,4,魏 枫1,2,3,4,王 扬1,2,3,4,郑 禹1,2,3,4,金 昊1,2,3,4,曹 水1,2,3,4,任秀宝1,2,3,4
1.天津医科大学肿瘤医院国家肿瘤临床医学研究中心,天津 300060;
2.天津市“肿瘤防治”重点实验室,天津 300060;
3.天津市恶性肿瘤临床医学研究中心,天津 300060;
4.天津市肿瘤免疫与生物治疗重点实验室,天津 300060
背景与目的:T细胞免疫球蛋白和黏蛋白域分子3(T cell immunoglobulin and mucin-domaincontaining molecules 3,Tim-3)在免疫调节中起重要作用,参与多种疾病的发生、发展,且与疾病免疫逃逸和疾病临床预后明显相关。该研究旨在探讨负性共刺激分子Tim-3在非小细胞肺癌(non-small cell lung cancer,NSCLC)浸润巨噬细胞中的表达及临床意义。方法:采用免疫组织化学法检测126例NSCLC患者中Tim-3的表达水平,分析肿瘤组织浸润巨噬细胞Tim-3的表达水平与临床病理特征间的关系,并进一步分析Tim-3的表达水平对NSCLC患者预后的影响。结果:Tim-3主要分布于巨噬细胞的细胞质和细胞膜中;Tim-3在肿瘤浸润巨噬细胞中的表达水平与肿瘤大小、淋巴结转移及TNM分期均显著相关(P=0.002、0.045和0.022);Tim-3在肿瘤浸润巨噬细胞中的表达水平可显著影响NSCLC患者的生存及预后,在Ⅲ期NSCLC患者中,Tim-3的表达越高,患者总生存期(overall survival,OS)越短(Ⅲ期:χ2=12.910,P=0.000,中位OS分别为80和32个月)。而且,Tim-3的表达水平与Ⅲ期NSCLC患者的无疾病生存期(disease free survival,DFS)也显著相关(χ2=6.135,P=0.013,中位DFS分别为41和24个月),高表达Tim-3的NSCLC患者DFS短。另外,在Ⅲ期NSCLC患者中,Tim-3在淋巴细胞中的表达水平与OS和PFS呈负相关(χ2=4.737,P=0.030,中位OS分别为80和47个月;χ2=5.882,P=0.015,中位DFS分别为41和24个月)。结论:Tim-3在肿瘤免疫中起负性调节作用从而促进免疫逃逸,对患者的生存及预后有不良影响。
T细胞免疫球蛋白和黏蛋白域分子3;非小细胞肺癌;巨噬细胞;预后
T细胞免疫球蛋白和黏蛋白域分子3(T cell immunoglobulin and mucin-domain-containing molecules 3,Tim-3)最初被认为是Thl型细胞的表面标记性分子[1]。随后研究发现,Tim-3不仅在分化成熟的Thl细胞中表达,而且在多种固有免疫细胞(包括巨噬细胞、NK细胞和树突状细胞)中均高表达,并且Tim-3能够通过调节这些细胞的功能从而参与多种疾病的发生、发展过程[2-3]。另有研究发现,Tim-3也在一些肿瘤细胞中表达,促进肿瘤的发生、发展[4-6]。Tim-3现已成为备受关注的负性共刺激分子之一。然而,国内外至今尚无Tim-3在非小细胞肺癌(non-small cell lung cancer,NSCLC)浸润巨噬细胞中的表达情况及其预后意义的报道。本研究通过对石蜡包埋的NSCLC组织进行Tim-3的免疫组织化学分析,发现肿瘤组织浸润巨噬细胞表面Tim-3过表达的现象,分析其表达水平与患者生存预后的相关性,并进一步揭示了Tim-3在肿瘤发生、发展中的独特作用方式,可能会在未来肿瘤免疫治疗领域中发挥至关重要的作用。
1 材料和方法
1.1 患者与组织标本
收集2008年3月20日—2014年8月31日在天津医科大学肿瘤医院接受手术治疗,手术范围包括肺部病灶切除及淋巴结清扫,并经病理明确诊断的NSCLC新发病例。标本采集标准为手术前未经任何抗肿瘤治疗的原发性NSCLC且组织保存完好,排除同时患有其他肿瘤和免疫性疾病的患者。共129例,随访截至2015年8月30日,平均随访时间为37个月,失访3例。其中,男性72例,女性54例,年龄33~82岁,平均年龄62岁。所有患者按照第8版国际肺癌TNM分期标准进行分期:Ⅰ期33例,Ⅱ期33例,Ⅲ期60例。
1.2 方法
1.2.1 免疫组织化学法
① 烤片:取NSCLC组织石蜡切片置于65 ℃烤箱中烘烤1 h,使切片上的石蜡融化。②脱蜡及水化:烘烤后的切片过3次二甲苯,各30 min,之后置于梯度乙醇中水化,蒸馏水洗涤2次。③ 高压修复:将切片置于已经预热的枸橼酸盐或pH为9.0的EDTA抗原修复液中高压修复3 min,自然冷却至室温。④ 洗片:PBS洗片后,置于3%H20237 ℃避光20 min,去除过氧化物酶的影响。⑤ 封闭:兔/鼠血清37 ℃封闭30 min,去除非特异性结合位点。⑥ 加入山羊多克隆抗体Tim-3(AF2365,1∶100,购自美国R&D Systems公司)或鼠单克隆抗体CD68(MA5-13324,1∶500,购自美国Thermo Fisher公司),4 ℃过夜。⑦ 室温放置1 h,PBS洗片后,加入辣根过氧化物酶标记的兔抗羊二抗(ZDR-5308,1∶70,购自北京中杉金桥生物技术有限公司)或即用型免疫组织化学Elivision plus试剂盒(鼠/兔),37 ℃ 30 min。⑧ DAB显色1 min。⑨ 苏木精染色3 min,盐酸乙醇返红,氨水返蓝,水洗。⑩ 脱水。⑪ 封片。以PBS代替一抗作为阴性对照。
1.2.2 结果评估
经天津医科大学肿瘤医院3位病理科医师审核结果后,利用全自动数字切片扫描仪进行结果评估:阳性的细胞数所占比例小于5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,大于75%为4分。然后将染色强度×阳性细胞百分比对应的值作为评分。0~1为-,2~4为+,5~8为++,9~12为+++。根据结果进行分组:Tim-3在巨噬细胞上表达水平是-/+定义为Tim-3 low组,++/+++为Tim-3 high组;Tim-3在淋巴细胞上表达水平是-/+定义为Tim-3 weak组,++/+++为Tim-3 strong组;Tim-3在肿瘤细胞上表达水平是-定义为Tim-3 negative组,+/++/+++为Tim-3 positive组。
1.3 统计学处理
运用统计学软件SPSS 20.0进行分析,采用χ2检验或非参数秩和检验比较Tim-3表达与各临床病理因素的关系。通过Kaplan-Meier法绘制生存曲线。用Log-rank法比较两组的生存率,采用Cox回归进行多因素生存分析。P<0.05为差异有统计学意义。
2 结 果
2.1 Tim-3在NSCLC组织中的免疫组织化学染色情况
根据细胞形态学特点并结合CD68免疫组织化学结果(图1),天津医科大学肿瘤医院3位病理科医师审核结果显示,Tim-3主要分布于巨噬细胞的细胞质和细胞膜上(图2)。阴性染色22例(17.5%),阳性染色104例(82.5%),其中,强阳性、中阳性和弱阳性染色分别为8例(6.3%)、44例(34.9%)和52例(41.3%);另外,Tim-3还分布于肿瘤细胞上(图3),阴性染色79例(62.7%),阳性染色47例(37.3%);Tim-3也分布于淋巴细胞上(图4),阴性染色32例(25.4%),阳性染色94例(74.6%)。
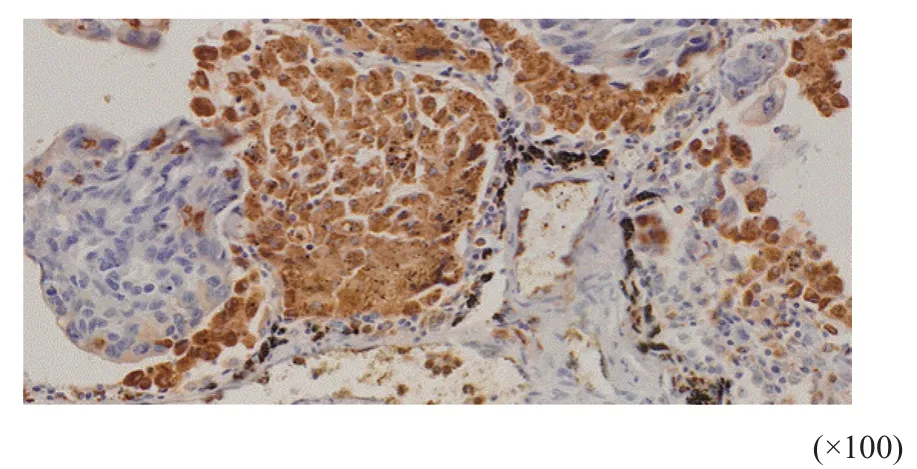
图 1 免疫组织化学法检测CD68在NSCLC浸润巨噬细胞上的表达Fig. 1 Expression of CD68 on macrophages in NSCLC detected by immunohistochemistry

图 2 免疫组织化学法检测Tim-3在NSCLC浸润巨噬细胞上的表达Fig. 2 Expression of Tim-3 on macrophages in NSCLC detected by immunohistochemistry
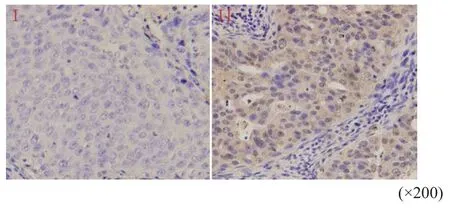
图 3 免疫组织化学法检测Tim-3在NSCLC肿瘤细胞上的表达Fig. 3 Expression of Tim-3 on tumor cells in NSCLC detected by immunohistochemistry
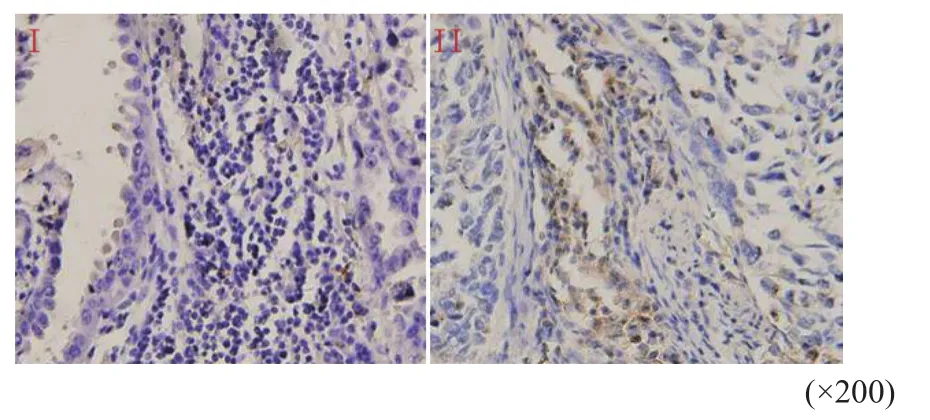
图 4 免疫组织化学法检测Tim-3在NSCLC淋巴细胞上表达Fig. 4 Expression of Tim-3 on lymphocytes in NSCLC detected by immunohistochemistry
2.2 Tim-3表达与临床病理特征的关系
χ2检验或非参数秩和检验单因素分析显示,Tim-3在NSCLC浸润巨噬细胞上的表达与患者的年龄、性别、体质量指数(body mass index,BMI)、是否吸烟及病理类型均无显著相关性,但与肿瘤大小、淋巴结转移及TNM分期均显著相关(P=0.002、0.045和0.022,表1)。
2.3 NSCLC患者单因素及多因素生存分析
Kaplan-Meier生存分析表明,Tim-3 high组患者中位总生存期(overall survival,OS)短于Tim-3 low组(41个月 vs 80个月),差异有统计学意义(χ2=22.701,P=0.000);Tim-3 negative组患者中位OS短于Tim-3 positive组(35个月vs 36个月),差异有统计学意义(χ2=8.182,P=0.004);Tim-3 strong组患者中位OS短于Tim-3 weak组(34个月 vs 37个月),差异有统计学意义(χ2=8.497,P=0.004)。另外原发灶大小、TNM分期也可影响患者的OS(P<0.05,表2)。Cox回归多因素生存分析显示,Tim-3在巨噬细胞中的表达(high/ low)、在肿瘤细胞中的表达(positive/negative)及pT(T≤3 cm/T>3 cm)为患者OS的独立预后影响因素(表3)。

表 1 Tim-3在巨噬细胞上的表达与临床病理因素的关系Tab. 1 Relationships between Tim-3 expression on macrophages and clinicopathologic characteristics
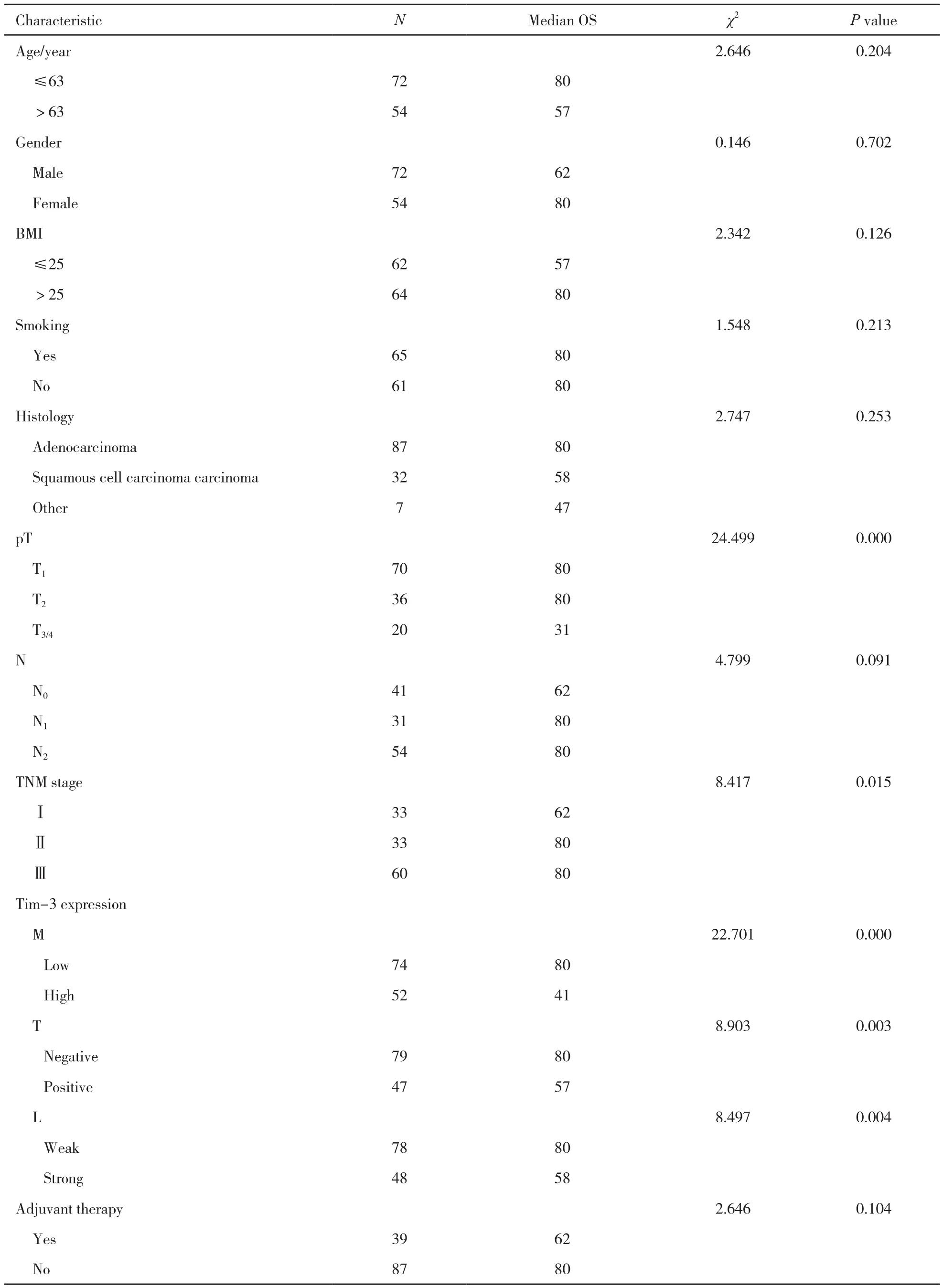
表 2 NSCLC中OS相关因素的单因素分析Tab. 2 Univariate analysis for OS in NSCLC

表 3 NSCLC中OS相关因素的Cox风险回归模型多因素分析Tab. 3 Multivariate Cox regression analysis for OS in NSCLC
2.3.1 Tim-3在Ⅰ期、Ⅱ期、Ⅲ期NSCLC患者巨噬细胞上的表达水平与预后的关系
进一步探讨Tim-3在肿瘤局部浸润巨噬细胞上的表达水平与患者预后的关系。结果显示,Tim-3在巨噬细胞上表达水平与Ⅰ期NSCLC患者的生存预后无明显的相关性(χ2=1.779,P=0.182,图5),在Ⅱ期和Ⅲ期NSCLC患者中,Tim-3的表达水平可显著影响预后,高表达Tim-3的患者OS短(Ⅱ期:χ2=8.574,P=0.003,中位OS均为40个月,图6;Ⅲ期:χ2=12.910,P=0.000,中位OS分别为80和32个月,图7)。另外,Tim-3在巨噬细胞上的表达水平与Ⅲ期NSCLC患者的无疾病生存期(disease free survival,DFS)也显著相关(χ2=6.135,P=0.013,中位DFS分别为41和24个月,图8),Tim-3的表达越高,患者越易复发或转移。
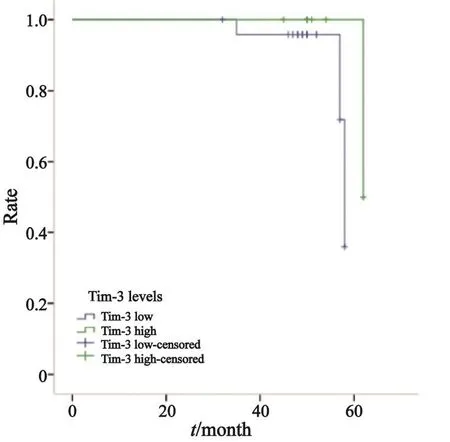
图 5 Ⅰ期NSCLC患者中Tim-3在巨噬细胞上表达与OS的关系Fig. 5 Relationship between Tim-3 expression on macrophages and OS in stage Ⅰ NSCLC patients.
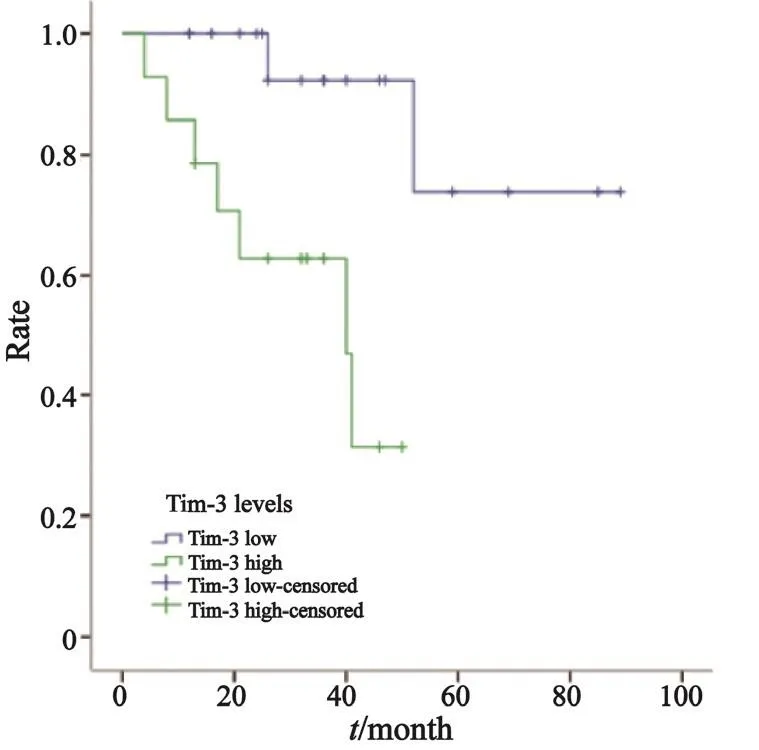
图 6 Ⅱ期NSCLC患者中Tim-3在巨噬细胞上表达与OS的关系Fig. 6 Relationship between Tim-3 expression on macrophages and OS in stage Ⅱ NSCLC patients

图 7 Ⅲ期NSCLC患者中Tim-3在巨噬细胞上表达与OS的关系Fig. 7 Relationship between Tim-3 expression on macrophages and OS in stage Ⅲ NSCLC patients
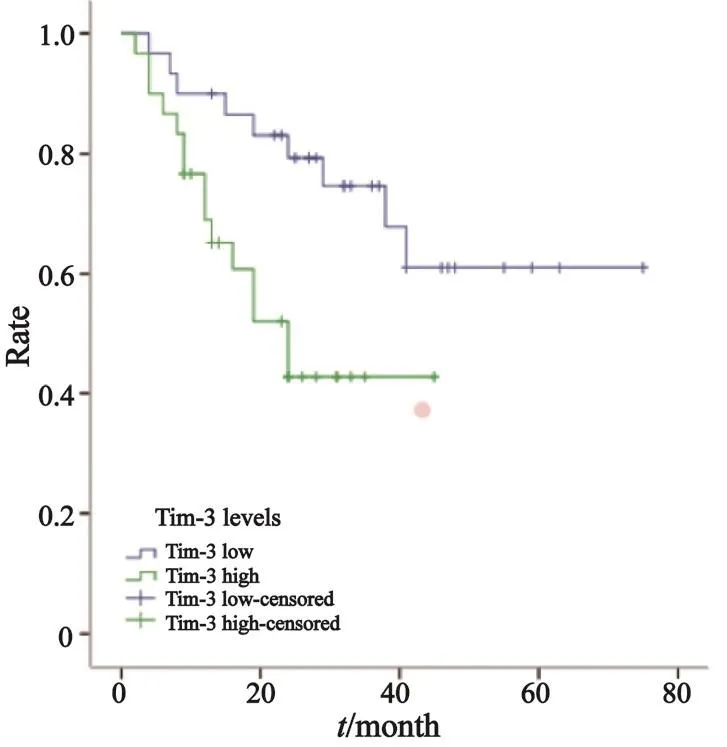
图 8 Ⅲ期NSCLC患者中Tim-3在巨噬细胞上表达与DFS的关系Fig. 8 Relationship between Tim-3 expression on macrophages and DFS in stage Ⅲ NSCLC patients
2.3.2 Tim-3在Ⅲ期NSCLC患者淋巴细胞上的表达水平与预后的关系
Kaplan-Meier生存分析显示,在Ⅲ期NSCLC患者中,Tim-3在淋巴细胞上的表达水平与OS和DFS均显著相关,Tim-3 weak组患者较Tim-3 strong组患者具有更长的OS和PFS,差异有统计学意义(χ2=4.737,P=0.030,中位OS分别为80和47个月,图9;χ2=5.882,P=0.015,中位DFS分别为41和24个月,图10)。
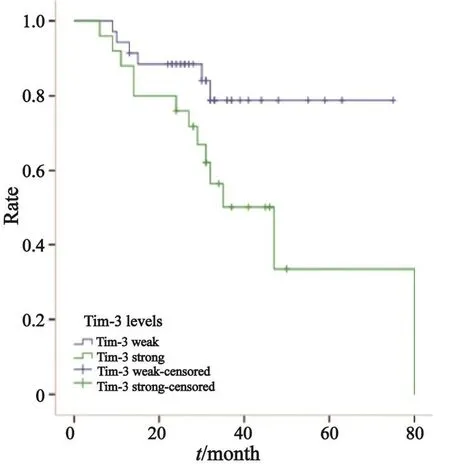
图 9 Ⅲ期NSCLC患者中Tim-3在淋巴细胞上表达与OS的关系Fig. 9 Relationship between Tim-3 expression on lymphocytes and OS in stage Ⅲ NSCLC patients

图 10 Ⅲ期NSCLC患者中Tim-3在淋巴细胞上表达与DFS的关系Fig. 10 Relationship between Tim-3 expression on lymphocytes and DFS in stage Ⅲ NSCLC patients
2.3.3 Tim-3在Ⅲ期NSCLC患者肿瘤细胞上的表达水平与预后的关系
Kaplan-Meier生存分析显示,在Ⅲ期NSCLC患者中,Tim-3在肿瘤细胞上的表达水平与OS和DFS无明显相关性,差异无统计学意义(χ2=3.205,P=0.073,图11;χ2=1.445,P=0.229,图12)。

图 11 Ⅲ期NSCLC患者中Tim-3在肿瘤细胞上表达与OS的关系Fig. 11 Relationship between Tim-3 expression on tumor cells and OS in stage Ⅲ NSCLC patients

图 12 Ⅲ期NSCLC患者中Tim-3在肿瘤细胞上表达与DFS的关系Fig. 12 Relationship between Tim-3 expression on tumor cells and DFS in stage Ⅲ NSCLC patients
3 讨 论
肺癌的发病率和死亡率均居我国恶性肿瘤第1位[7],其中NSCLC约占肺癌的85%,NSCLC根据组织学主要分为腺癌(约40%)、鳞状细胞癌(20%~30%)和大细胞癌(10%)等亚型[8]。尽管国内外对于NSCLC的研究层出不穷,但是对于NSCLC的认识仍有待进一步提高。近年来,免疫检查点分子的发现及其功能的阐明为肿瘤治疗提供了新的靶点和治疗手段[9-10]。这些免疫检查点分子包括CTLA-4、PD-1、Lag-3和Tim-3等,尤其是Tim-3在Th1细胞免疫、自身免疫和肿瘤免疫耐受中的重要功能使其成为肿瘤免疫研究的焦点[11]。
目前已有大量研究证明,Tim-3不仅在黑色素瘤、宫颈癌、前列腺癌、肾透明细胞癌、胃癌及子宫内膜癌等多种实体肿瘤癌细胞上过表达,且与患者预后呈负相关[5,12-16]。而且,在急性白血病患者中,白血病干细胞过表达Tim-3、CCL-1和BMI-1与不良预后密切相关[17]。另有研究表明,Tim-3在多种肿瘤组织浸润的T淋巴细胞上也存在过表达,且对患者生存及预后有不良影响[18-20]。但关于Tim-3在髓系细胞,如巨噬细胞、NK细胞和树突状细胞上的表达及其作用的研究相对较少[21]。而且,有关Tim-3在NSCLC局部浸润巨噬细胞上的表达情况及其临床意义的研究国内外仍未见报道,本研究恰恰弥补了这一领域的缺失。
Wiener等[5]首次发现在黑色素瘤组织中,Tim-3不仅在肥大细胞上表达,而且还在肿瘤细胞上表达,同时发现Tim-3受TGF-β的刺激后上调,有利于黑色素瘤细胞的生存。随后,Shang等[22]的研究发现,在骨肉瘤患者组织切片中,Tim-3在浸润的淋巴细胞、巨噬细胞和肿瘤细胞上表达,Tim-3可触发肿瘤细胞发生侵袭性上皮间质转化过程,可能参与恶性肿瘤的发生、发展。但在这些研究中,Tim-3在髓系细胞上的表达及其作用未引起重视。Zhuang等[6]首次通过免疫组织化学法研究Tim-3在30例NSCLC肿瘤细胞及淋巴细胞上的表达情况,并证明Tim-3的表达水平与淋巴结转移、TNM分期有关,Tim-3可作为NSCLC患者的独立预后因素。而本研究发现,Tim-3在浸润巨噬细胞及淋巴细胞上的表达水平与患者的疾病进展及预后均显著相关;然而,Tim-3在肿瘤细胞上的阳性表达率为38.1%(48/126例),其表达水平与患者的疾病进展及预后无显著相关性(χ2=3.205,P=0.073;χ2=1.445,P=0.229),但从生存曲线的走向可以看出Tim-3在肿瘤细胞上的表达水平越高预后越差的趋势,可能由于Tim-3 positive组人数较Tim-3 negative组人数偏少,差异无统计学意义,因此还需要大样本研究的进一步验证。另外,Li等[19]的研究也发现,在乙型肝炎病毒相关的肝细胞癌中,Tim-3+细胞数量与肿瘤大小呈正相关。而本研究结果显示,Tim-3在NSCLC浸润巨噬细胞上的表达水平与肿瘤大小、淋巴结转移及TNM分期显著相关;在NSCLC患者中,Tim-3过表达提示预后不良。其机制可能是:① Tim-3介导肿瘤微环境中效应T细胞的失能,抑制肿瘤免疫应答,从而有利于肿瘤免疫逃逸,促进肿瘤细胞生长;② Tim-3直接促进肿瘤的发生、发展。
早在2007年Anderson等[23]的研究显示,Tim-3可在巨噬细胞上高表达,并通过NF-κB通路促进巨噬细胞的炎性反应。近年来,关于Tim-3过表达在巨噬细胞的相关报道不断增多,Zhou等[24]的研究证实,在结肠癌患者中,Tim-3的表达可以作为一个独立的预后因素,Tim-3可通过STAT3或STAT3-pSTAT3途径直接促进肿瘤生长。Yan等[25]通过免疫组织化学法在肝细胞癌组织中检测到Tim-3在肿瘤相关巨噬细胞中的表达,且在CD68+肿瘤相关巨噬细胞中,Tim-3表达高的肝癌患者OS较短,预后较差;其次,肿瘤微环境及TGF-β促进巨噬细胞Tim-3表达升高,并进而调节巨噬细胞分泌细胞因子能力;此外,还证明Tim-3通过NF-κB-IL-6通路促进肿瘤生长。另外,Komohara等[26]在肾透明细胞癌中也检测到Tim-3在肿瘤细胞和CD204+肿瘤相关巨噬细胞上表达,并发现Tim-3表达水平越高,患者的PFS越短。此外,Tim-3可诱导肾癌细胞对sunitinib和mTOR抑制剂等肾透明细胞癌的标准治疗药物耐药。本研究在NSCLC中得到类似的结果,即Tim-3在Ⅱ/Ⅲ期NSCLC浸润巨噬细胞上过表达提示预后不良。虽然Ⅰ期NSCLC患者生存分析结果差异无统计学意义(χ2=1.779,P=0.182),但是其结果可能是由于Ⅰ期样本量较少、OS较长及随访时间相对较短造成的。基于现有报道及本研究结果,我们假设Tim-3可能通过IL-6-STAT3通路或NF-κB-IL-6通路直接促进肿瘤生长,或通过负性调节抗肿瘤免疫,从而有利于肿瘤免疫逃逸,促进肿瘤细胞生长。但Tim-3在NSCLC中的作用机制仍有待进一步研究,为本研究结果提供理论依据。
综上所述,本研究首次发现Tim-3在NSCLC浸润巨噬细胞上过表达提示预后不良。Tim-3现已成为备受瞩目的负性共刺激分子之一,上述研究为揭示NSCLC抑制性免疫微环境形成机制提供了新思路,同时也为NSCLC免疫治疗提供了新视野。但是它在肿瘤逃逸与免疫耐受中发挥的生物学功能及作用机制尚未明确,仍有待进一步研究。
[1] SABATOS C A, CHAKRAVARTI S, CHA E, et al. Interaction of Tim-3 and Tim-3 ligand regulates T helper type 1 responses and induction of peripheral tolerance[J]. Nat Immunol, 2003, 4(11): 1102-1110.
[2] MONNEY L, SABATOS C A, GAGLIA J L, et al. Th1-specific cell surface protein Tim-3 regulates macrophage activation and severity of an autoimmune disease[J]. Nature, 2002, 415(6871): 536-541.
[3] JIANG X, YU J, SHI Q, et al. Tim-3 promotes intestinal homeostasis in DSS colitis by inhibiting M1 polarization of macrophages[J]. Clin Immunol, 2015, 160(2): 328-335.
[4] PIAO Y R, JIN Z H, YUAN K C, et al. Analysis of Tim-3 as a therapeutic target in prostate cancer[J]. Tumour Biol, 2014, 35(11): 11409-11414.
[5] WIENER Z, KOHALMI B, POCZA P, et al. TIM-3 is expressed in melanoma cells and is upregulated in TGF-beta stimulated mast cells[J]. J Invest Dermatol, 2007, 127(4): 906-914.
[6] ZHUANG X, ZHANG X, XIA X, et al. Ectopic expression of TIM-3 in lung cancers: a potential independent prognostic factor for patients with NSCLC[J]. Am J Clin Pathol, 2012, 137(6): 978-985.
[7] 陈万青, 郑荣寿, 曾红梅, 等. 2011年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2015, 24(1): 1-10.
[8] 任红亮, 徐文贵, 尤 健, 等. 探讨PET/CT原发灶SUVmax在肺鳞癌患者术后预后中的意义及与临床病理特征的关系[J]. 中国肺癌杂志, 2016, 19(4): 192-199.
[9] HAMID O, ROBERT C, DAUD A, et al. Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma[J]. N Engl J Med, 2013, 369(2): 134-144.
[10] HODI F S, O’DAY S J, MCDERMOTT D F, et al. Improved survival with ipilimumab in patients with metastatic melanoma[J]. N Engl J Med, 2010, 363(8): 711-723.
[11] SAKUISHI K, JAYARAMAN P, BEHAR S M, et al. Emerging Tim-3 functions in antimicrobial and tumor immunity[J]. Trends Immunol, 2011, 32(8): 345-349.
[12] CAO Y, ZHOU X, HUANG X, et al. Tim-3 expression in cervical cancer promotes tumor metastasis[J]. PLoS One, 2013, 8(1): e53834.
[13] 朴勇瑞, 丁海鑫, 董秀哲. TIM-3在前列腺癌中的表达及意义[J]. 实用医学杂志, 2015, 31(21):3512-3515.
[14] YUAN J, JIANG B, ZHAO H, et al. Prognostic implication of TIM-3 in clear cell renal cell carcinoma[J]. Neoplasma, 2014, 61(1): 35-40.
[15] JIANG J, JIN M S, KONG F, et al. Decreased galectin-9 and increased Tim-3 expression are related to poor prognosis in gastric cancer[J]. PLoS One, 2013, 8(12): e81799.
[16] 徐国荣, 冯秀兰, 布占红. Tim-3及其配体与子宫内膜癌病理分级和预后的相关性研究[J]. 中国妇幼保健, 2016, 31(4): 826-828.
[17] DARWISH N H, SUDHA T, GODUGU K, et al. Acutemyeloid leukemia stem cell markers in prognosis and targeted therapy: potential impact of BMI-1, TIM-3 and CLL-1[J]. Oncotarget, 2016, 7(36): 57811-57820.
[18] 吉 芃, 陈迪康, 卞建叶, 等. TIM-3在人非小细胞肺癌CD4~+肿瘤浸润淋巴细胞的表达增强提示预后不良[J]. 细胞与分子免疫学杂志, 2015, 31(6): 808-811.
[19] LI H, WU K, TAO K, et al. Tim-3/galectin-9 signaling pathway mediates T-cell dysfunction and predicts poor prognosis in patients with hepatitis B virus-associated hepatocellular carcinoma[J]. Hepatology, 2012, 56(4): 1342-1351.
[20] YAN J, ZHANG Y, ZHANG J P, et al. Tim-3 expression defines regulatory T cells in human tumors[J]. PLoS One, 2013, 8(3): e58006.
[21] OCAÑA-GUZMAN R, TORRE-BOUSCOULET L, SADAOVALLE I. TIM-3 regulates distinct functions in macrophages[J]. Front Immunol, 2016, 7: 229.
[22] SHANG Y, LI Z, LI H, et al. TIM-3 expression in human osteosarcoma: Correlation with the expression of epithelialmesenchymal transition-specific biomarkers[J]. Oncol Lett, 2013, 6(2): 490-494.
[23] ANDERSON A C, ANDERSON D E, BREGOLI L, et al. Promotion of tissue inflammation by the immune receptor Tim-3 expressed on innate immune cells[J]. Science, 2007, 318(5853): 1141-1143.
[24] ZHOU E, HUANG Q, WANG J, et al. Up-regulation of Tim-3 is associated with poor prognosis of patients with colon cancer[J]. Int J Clin Exp Pathol, 2015, 8(7): 8018-8027.
[25] YAN W, LIU X, MA H, et al. Tim-3 fosters HCC development by enhancing TGF-β-mediated alternative activation of macrophages[J]. Gut, 2015, 64(10): 1593-1604.
[26] KOMOHARA Y, MORITA T, ANNAN D A, et al. The coordinated actions of Tim-3 on cancer and myeloid cells in the regulation of tumorigenicity and clinical prognosis in clear cell renal cell carcinomas[J]. Cancer Immunol Res, 2015, 3(9): 999-1007.
A study on the expression of Tim-3 in macrophages and its role in prognosis of non-small cell lung cancer
SHEN Xuejie1,2,3,4, PAN Na1,2,3,4, WEI Feng1,2,3,4, WANG Yang1,2,3,4, ZHENG Yu1,2,3,4, JIN Hao1,2,3,4, CAO Shui1,2,3,4, REN Xiubao1,2,3,4
(1. National Clinical Research Center for Cancer, Tianjin Medical University Cancer Institute and Hospital, Tianjin 300060, China; 2. Key Laboratory of Cancer Prevention and Therapy, Tianjin 300060, China; 3. Tianjin Clinical Research Center for Cancer, Tianjin 300060, China; 4. Key Laboratory of Cancer Immunology and Biotherapy, Tianjin 300060, China)
CAO Shui E-mail: caoshui9999@163.com
Background and purpose: T cell immunoglobulin and mucin-domain-containing molecules 3 (Tim-3) plays a pivotal role in immune regulation. It participates in the occurrence and development of a variety of diseases, and Tim-3 is associated with immune escape and poor prognosis. The aim of this study was to investigate the expression of negative costimulatory molecule, Tim-3, in macrophages in non-small cell lung cancer (NSCLC) and explore the clinical significance of the expression. Methods: A total of 126 human lung cancer tissue specimens were obtained from pathologically confirmed and newly diagnosed NSCLC patients. The expression level of Tim-3 was analyzed by immunohistochemistry staining. Correlation analysis was performed to study the relationship between Tim-3 expression in macrophagesand clinicopathological features. Survival analysis was performed by Kaplan-Meier. Results: Tim-3 was mainly expressed in the cytoplasm and cell membrane of macrophages. Tumor size, lymph node metastasis, TNM stage were significantly correlated with Tim-3 expression level (P=0.002, 0.045 and 0.022, respectively). Tim-3 expression in macrophages was negatively correlated with the prognosis of patients. Higher Tim-3 expression had a shorter overall survival (OS) in patients with stage Ⅲ NSCLC (χ2=12.910, P=0.000; Median OS: 80 months vs 32 months). Moreover, the expression level of Tim-3 had negative correlation with disease-free survival (DFS) in patients with stage Ⅲ NSCLC (χ2=6.135, P=0.013; Median DFS: 41 months vs 24 months). In addition, Tim-3 expression in lymphocytes was negatively correlated with OS and DFS in patients with stage Ⅲ NSCLC (χ2=4.737, P=0.030, Median OS: 80 months vs 47 months; χ2=5.882, P=0.015, Median DFS: 41 months vs 24 months). Conclusion: Tim-3, as a key negative regulator in anti-tumor immunity, contributes to the tumor immune evasion. It has an adverse influence on the prognosis of NSCLC patients.
T cell immunoglobulin and mucin-domain-containing molecules 3; Non-small cell lung carcinoma; Macrophages; Prognosis
10.19401/j.cnki.1007-3639.2017.07.007
R734.2
A
1007-3639(2017)07-0559-10
2017-02-08
2017-04-02)
国家科技支撑计划(2015BAI12B00);国家自然科学基金(81272221)。
曹 水 E-mail: caoshui9999@163.com

