应用微环DNA技术体外诱导和制备重组的乙型肝炎病毒共价闭合环状DNA
朱园飞,李改云,常豪,鱼康康,高月求,邓强
1. 上海中医药大学附属曙光医院细胞免疫实验室,上海 201203; 2. 中国科学院上海巴斯德研究所分子病毒与免疫重点实验室,上海 200032
·论著·
应用微环DNA技术体外诱导和制备重组的乙型肝炎病毒共价闭合环状DNA
朱园飞1, 2,李改云2,常豪2,鱼康康2,高月求1,邓强1, 2
1. 上海中医药大学附属曙光医院细胞免疫实验室,上海 201203; 2. 中国科学院上海巴斯德研究所分子病毒与免疫重点实验室,上海 200032
乙型肝炎病毒(hepatitis B virus,HBV)共价闭合环状DNA(covalently closed circular DNA,cccDNA)是病毒慢性感染的分子基础。本课题组前期研究通过Cre/loxP介导的位点特异性DNA重组策略,在细胞核内由前体质粒诱导重组cccDNA(rcccDNAloxP)产生,首次建立了HBV cccDNA的体外培养细胞和小鼠实验模型。本研究基于大肠埃希菌ZYCY10P3S2T PhiC31重组酶诱导表达系统,建立了一种体外诱导HBV rcccDNA(rcccDNAattR)微环产生和纯化的策略。纯化的rcccDNAattR微环具有超螺旋结构,细胞培养实验证实其能支持功能性的HBV复制和抗原表达。与普通的线性HBV复制子编码质粒相比,rcccDNAattR尾静脉高压注射小鼠模型能诱导显著延长的病毒抗原血症。因此,本研究在原核表达系统和实验小鼠水平提供了一种更为简化的HBV cccDNA实验模型系统,并再次显示rcccDNA具有显著的稳定性,能作为一种基本策略在小鼠模型中诱导病毒持续感染。
微环DNA技术;PhiC31;位点特异性重组;乙型肝炎病毒;共价闭合环状DNA
乙型肝炎病毒(hepatitis B virus,HBV)成熟粒子中含有约3.2 kb的松弛环状DNA基因组(relaxed circular DNA,rcDNA)。在病毒感染的肝细胞核内,rcDNA修复为共价闭合环状DNA(covalently closed circular DNA, cccDNA),是HBV 转录复制的原始模板[1]。rcDNA修复生成的cccDNA具有超螺旋结构,能结合组蛋白等形成串珠样核小体的微小染色体结构[2],具有表观遗传学修饰特征[3]。细胞核cccDNA具有较长的代谢周期,且能通过细胞分裂传递至子代细胞。细胞凋亡或坏死是cccDNA体内代谢的主要途径[4]。cccDNA是HBV慢性感染的分子基础,现有抗病毒药物可有效抑制病毒复制和rcDNA形成,但难以清除cccDNA,这是慢性乙型肝炎难以彻底治愈的主要原因[5-6]。
HBV感染的肝细胞中cccDNA拷贝数较低,迄今仍缺乏简单、高效的技术方法用于研究。本课题组早先通过构建含有线性单拷贝HBV基因组的编码质粒prcccDNA,在HBV基因组两侧引入同向loxP位点;在细胞核内,Cre重组酶引发loxP位点之间DNA 重组和环化,生成含有单拷贝loxP位点的rcccDNA;loxP位点则位于一段约90 bp的外源内含子5′供体序列与3′受体序列之间,可在RNA转录过程中实现高效拼接[7]。应用尾静脉高压技术,共注射前体质粒prcccDNA及Cre编码质粒,能在免疫功能健全小鼠中诱导显著延长的HBV抗原血症,可作为一种基本策略用于发展HBV持续感染和慢性肝炎的实验小鼠模型[7]。
本研究报道了一种由PhiC31介导的位点特异性重组策略[8-9],在大肠埃希菌中诱导rcccDNA产生。由于系统中删除了具有原核特征的质粒骨架序列,应用纯化的rcccDNA尾静脉高压注射小鼠,可能仅激活有限的宿主免疫反应,所以能诱导显著延长的HBV持续感染。此外,这一显著简化的模型系统将为高通量筛选抗cccDNA化合物提供更多的便利。
1 材料与方法
1.1 材料
大肠埃希菌ZYCY10P3S2T 购自SBI公司(MN920A-1)。人肝癌细胞株HepG2为本实验室保存。prcccDNA质粒为本实验室构建[7],编码单拷贝的HBV基因组(ayw亚型,GenBank登录号V01460.1)。微环母质粒pMC为SBI公司产品(MN501A-1)。实验所用的高保真DNA聚合酶PrimeSTAR和限制性内切酶购自TaKaRa公司。C57BL/6雄性小鼠购自上海灵畅生物科技有限公司。
1.2 方法
1.2.1 质粒构建 以prcccDNA为模板,聚合酶链反应(polymerase chain reaction,PCR)扩增HBV单拷贝基因组。引物序列分别为:F: 5′-GGGCGCGGCACCTATTGGTCTTACTGAC-3′; R:5′-ACGGTACCTTACCCCCAACTGAGAGA-ACTCAAAGGTTACCCCAGTTGGGGTATTGG-TCTCCTTAAACCTGTC-3′(斜体为KpnⅠ酶切位点,下划线为反方向的位点特异性重组相关序列attP)。PCR产物经KpnⅠ消化后连接到KpnⅠ/SmaⅠ双酶切的微环母质粒pMC中,获得亚克隆质粒prcccDNA-IV。pwtHBV1.2-intron质粒编码1.2拷贝的线性HBV基因组,attR杂合内含子编码序列(图1)插入HBV表面抗原(HBV surface antigen,HBsAg)基因中相应位置。
1.2.2 rcccDNA的体外诱导和制备 prcccDNA-IV常规转化大肠埃希菌ZYCY10P3S2T。微环DNA的诱导和制备按厂商指导手册进行,简述如下:100 μL 新鲜培养的prcccDNA-IV转化菌转接入400 mL含有50 μg/mL卡那霉素的TB 培养基中,37 ℃振荡培养16 h;加入400 mL LB培养液,16 mL 1 mol/L氢氧化钠溶液及400 μL 20%L-阿拉伯糖,32 ℃继续振荡培养6 h;离心收集细菌沉淀,-80 ℃存储备用。
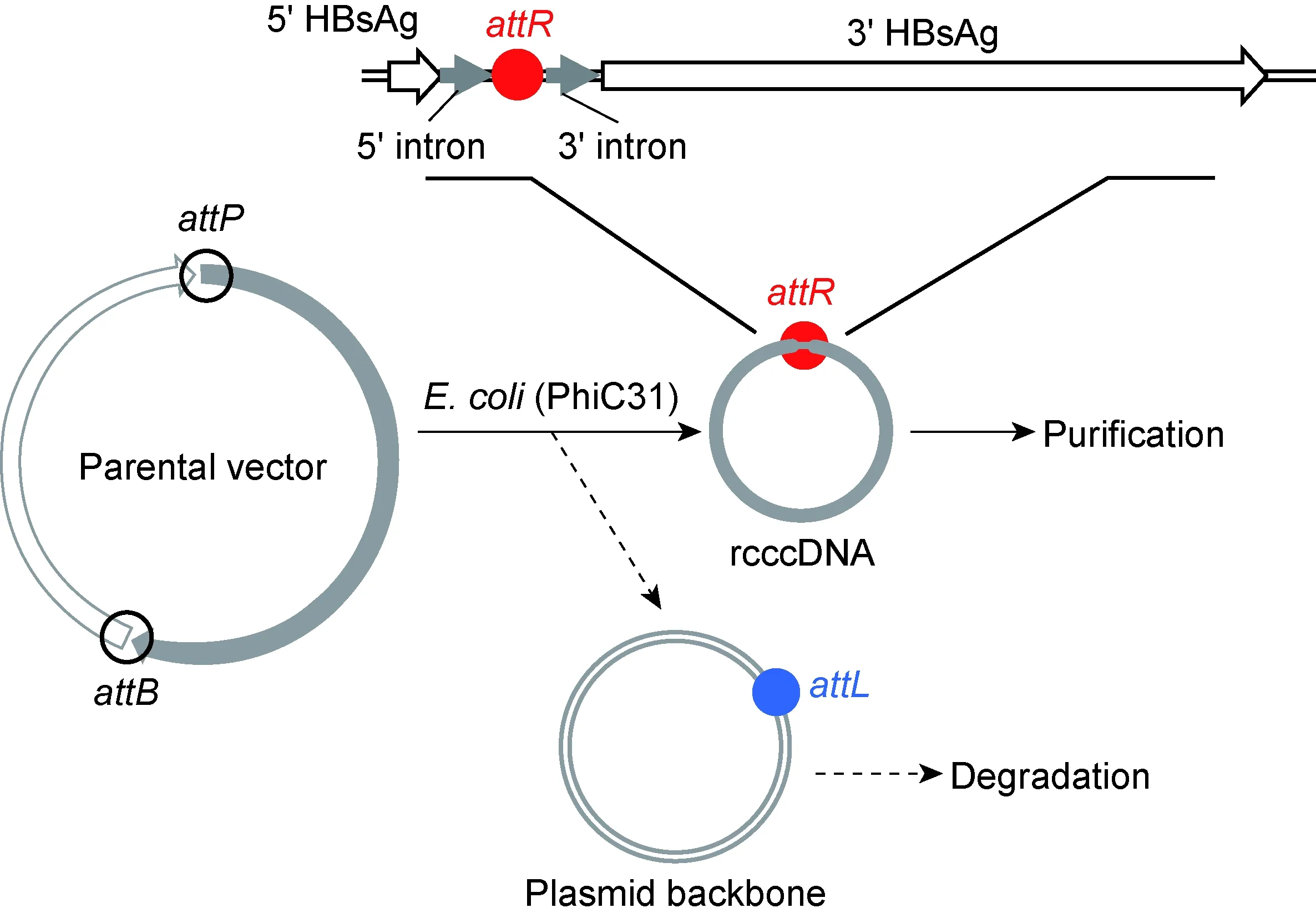
The parental vector of rcccDNAattR(prcccDNA-IV) replicates in anE.colistrain ZYCY10P3S2T which harbors an arabinose-inducible system to express the PhiC31 integrase and the I-SceI endonuclease. PhiC31 recognizes two heterotypic sites (attBandattP) within prcccDNA-IV and catalyzes intramolecular recombination, thereby generating a rcccDNA minicircle containing anattR-chimeric intron (rcccDNAattR) and a minicircle of the plasmid backbone. The latter contains several engineered I-SceI restriction sites that ultimately leads to degradation. TheattR-chimeric intron is inserted within HBsAg gene. The exogenous insert should be removed from viral transcripts through RNA splicing.
图1 体外诱导和制备rcccDNAattR的示意图
Fig.1 Schematic of the induction of rcccDNAattRinvitro
1.2.3 rcccDNA的纯化 采用去内毒素的DNA纯化试剂盒(Qiagen,12831)纯化rcccDNA,离心收集细菌裂解液上清,避免物理切割超螺旋DNA。柱纯化洗脱的DNA经1%琼脂糖凝胶电泳,切胶后分离具有超螺旋结构的rcccDNA(约2.0 kb),用胶纯化试剂盒(Qiagen,28704)回收纯化。
1.2.4 细胞培养和转染 HepG2细胞在含10%胎牛血清、100 U/mL青/链霉素的DMEM培养基(Gibco BRL)中常规培养。细胞转染试剂采用Lipofectamine 2000(Invitrogen),转染后4 d收取细胞上清液,检测HBsAg和HBV e抗原(HBV e antigen,HBeAg)的表达。
1.2.5 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测 采用上海科华生物工程股份有限公司的ELISA试剂盒,检测细胞培养上清液中HBeAg和HBsAg的表达。用Benchmark ELISA酶标仪(BioRad)读取450 nm波长处光密度(optical density,OD)。调整样品稀释度,使OD450值为0.1~3.0。小鼠血清中HBsAg浓度用Abbott荧光定量PCR仪(于上海交通大学附属瑞金医院)测定。
1.2.6 DNA印迹检测 参照文献[7]进行。细胞裂解液用含1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)的蛋白酶K(Merck)溶液(1 mg/mL)于55 ℃ 消化过夜,用酚/氯仿法抽提HBV DNA复制中间体。1%琼脂糖凝胶电泳分离DNA,并转移至Hybond-N+尼龙膜(Amersham)上。用地高辛标记检测试剂盒Ⅱ(Roche)标记HBV特异性探针,用于DNA杂交。
1.2.7 小鼠尾静脉高压注射 参照文献[7]进行。简述如下:将4~5周龄C57BL/6雄性小鼠经尾静脉分别高压注射 pwtHBV1.2-intron 质粒2~8 μg或 rcccDNAattR2.4 μg,注射后每周从小鼠眼眶后静脉丛采血,分离血清。
2 结果
2.1 基于phiC31介导的位点特异性重组策略构建rcccDNAattR
利用PhiC31 重组酶特异性识别attP和attB位点的特征,设计构建含有单拷贝HBV基因组的微环母质粒prcccDNA-IV(图1)。在插入的微环母质粒中,HBV基因组起始于HBsAg基因3′端(ayw亚型,nt203),结束于HBsAg基因5′端(nt202),上下游组成依次为34 bpattB、46 bp 3′内含子序列、3 182 bp HBV单拷贝基因、41 bp 5′内含子序列及39 bpattP序列。5′内含子(供体序列)和3′内含子(分支序列和受体序列)分别来自人类基因组的球蛋白基因和免疫球蛋白基因[7]。prcccDNA-IV在PhiC31作用下实现分子内剪切,形成含有123 bpattR杂合内含子的rcccDNA微环(rcccDNAattR)。与基于Cre/loxP重组系统构建的rcccDNAloxP相似,attR杂合内含子插于HBV基因组nt202与nt203之间,具有典型的外显子边界特征,能在病毒mRNA转录过程中被高效移除。母体质粒骨架形成的微环DNA中含有质粒复制元件及抗生素筛选基因,由于含有多个 I-SceⅠ酶切位点,在大肠埃希菌ZYCY10P3S2T中能被L-阿拉伯糖诱导表达的I-SceⅠ内切酶剪切而降解。
2.2 体外诱导和纯化具有超螺旋结构的rcccDNAattR
ZYCY10P3S2T菌株中含有阿拉伯糖转运蛋白基因LacY A177C,加入L-阿拉伯糖能诱导PhiC31重组酶和I-SceⅠ内切酶的表达。Qiagen柱纯化的rcccDNAattR微环在琼脂糖凝胶电泳中显示为约2.0 kb的条带,与野生HBV cccDNA电泳条带相似,提示具有相似的超螺旋结构特征(图2)。rcccDNAattR超螺旋能耐受95 ℃热变性(10 min)[10],用HBV基因组特异限制性内切酶EcoRⅠ处理后回复到3.2 kb,类似于HBV rcDNA的电泳特征。尽管如此,经柱纯化的rcccDNAattR产物并不理想,如图2A所示,琼脂糖凝胶电泳于2.0 kb超螺旋DNA之外仍可见很多污染物,可能包括宿主菌DNA片段、未重组的母体质粒、母体质粒骨架形成的微环DNA及含有多拷贝HBV基因组的DNA超螺旋,后者能耐受95 ℃热变性和限制性内切酶NdeⅠ的消化(NdeⅠ位点仅存在于微环母质粒骨架结构中,图2B)。进一步应用琼脂糖凝胶回收方法,获得单一条带的rcccDNAattR(图2C),这一纯化方法简便、高效,并不影响rcccDNAattR的超螺旋特征。琼脂糖凝胶纯化的rcccDNAattR通过DNA测序得到证实。
2.3 rcccDNAattR诱导功能性的病毒复制和抗原表达
HBsAg可指示rcccDNA的形成(图1)。应用纯化的rcccDNAattR转染肝肿瘤细胞系HepG2,在转染后4 d的培养细胞上清液中检测到HBeAg和HBsAg的表达(图3A)。与rcccDNAloxP前体质粒的转染相似[7],应用微环前体质粒prcccDNA-IV转染HepG2细胞仅能检测到少量HBeAg的表达。另一方面,通过DNA印迹杂交法,在rcccDNAattR转染的HepG2细胞中检测到HBV特异的病毒复制中间体(图3B)。这些结果表明,rcccDNAattR能诱导功能性的HBV复制和抗原表达。
2.4 尾静脉高压注射rcccDNAattR诱导小鼠模型中延长的抗原血症
小鼠是理想的实验模式动物, 但HBV并不感染小鼠[11];此外,由于未知原因,小鼠肝脏细胞中不能形成HBV cccDNA[12-13]。因此,本研究应用尾静脉高压注射法[14-15]对rcccDNAattR诱导的HBV抗原血症进行分析。如图4所示,应用1.2拷贝HBV基因组编码质粒(4 μg)注射免疫功能正常的C57BL/6小鼠,可检测到血清中短暂的病毒抗原表达(通常在2周以内)。有意思的是,注射等摩尔比的rcccDNAattR(2.4 μg)可在小鼠模型中诱导出显著延长的HBV抗原血症(5~7周)。注射2 μg或4 μg rcccDNAattR均有类似的发现。以上结果提示,与普通的编码线性HBV基因组的质粒DNA相比,rcccDNAattR微环在体内具有显著的稳定性。

A: DNA minicircles purified from theE.colistrain were heated to 95 ℃ for 10 min, with or without plasmid-safe (Pla) treatment as indicated at the bottom of each lane. B: After heat-denaturation, DNA minicircles were treated withEcoRI orNdeI. C: rcccDNAattRsupercoils (about 2.0 kb) were purified through gel extraction (QIAquick).
图2 鉴定体外制备的rcccDNAattR
Fig.2 Identification of rcccDNAattRpreparedinvitro

A: ELISA assay of HBeAg and HBsAg in the medium of HepG2 cells 4 d after transfection with rcccDNAattR. pcDNA3.1 and the parental vector prcccDNA-IV were used as controls. B: Intracellular viral replication detected in HepG2 cells transfected with rcccDNAattRor prcccDNA-IV, by Southern blotting using HBV-specific probe. RC, relaxed circular form; DSL, double-stranded linear form; SS, single-stranded form.
图3 rcccDNAattR诱导HepG2细胞中HBV抗原表达和病毒复制
Fig.3 rcccDNAattRinduces HBV antigen expression and viral replication in HepG2 cells

Kinetics of serum HBsAg at the indicated time points in C57BL/6 mice (4 weeks old, male;n=5) hydrodynamically injected with rcccDNAattR(2.4 μg). Mice injected with pwtHBV1.2-intron at indicated doses were set as controls. pwtHBV1.2-intron harbors 1.2-copy linear HBV genome with anattR-chimeric intron inserted into HBsAg gene. HBsAg was quantified using an architect platform (Abbott).
图4 rcccDNAattR在免疫功能正常小鼠模型中诱导出延长的HBV抗原血症
Fig.4 rcccDNAattRinduces prolonged HBV antigenemia in immunocompetent mice
3 讨论
HBV相关体内外研究多采用线性化的病毒复制子系统,即DNA质粒或重组病毒载体编码部分重复或多拷贝串联重复的HBV基因组[16],以替代cccDNA模板启始病毒复制周期。然而,由于具有较大的基因组长度及携带大量的外源性片段(如原核特征的质粒复制和抗性筛选元件等),DNA质粒或重组病毒载体可能具有与3.2 kb HBV cccDNA显著不同的病毒学特征和宿主反应性。本课题组早期通过Cre/loxP介导的位点特异性重组策略,由前体质粒诱导rcccDNAloxP产生[7],首次建立了HBV cccDNA的体外培养细胞和小鼠实验模型,因而获得广泛关注。
需指出的是,细胞核内重组产生的rcccDNAloxP可能具有一些与HBV野生cccDNA不一致的特征。例如,Cre/loxP介导的位点特异性重组可能在表观遗传学水平影响rcccDNA微小染色体的重建,影响rcccDNAloxP在细胞核中的稳定性。此外,rcccDNAloxP前体质粒中的骨架结构及共转染的重组酶Cre编码质粒引入了大量原核生物特征元件,重组酶Cre的表达和DNA重组效率也明显增加了系统复杂性。本研究通过设计基于PhiC31 重组酶介导的位点特异性重组,在大肠埃希菌系统(体外)诱导rcccDNAattR产生。rcccDNAattR直接转染培养的细胞或通过尾静脉高压注射转染小鼠肝细胞,有效避免了上述rcccDNAloxP系统的缺陷。
本研究没有特别针对rcccDNAloxP与rcccDNAattR两种系统的病毒学特征、体内稳定性等进行比较。上述两种系统的杂合内含子序列并不相同,rcccDNAattR在体外诱导和纯化,而rcccDNAloxP在培养细胞系或实验小鼠肝细胞核中由Cre重组酶介导的DNA重组形成。应用rcccDNAloxP进行实验对照时,须在系统中平行引入Cre表达质粒,同时须考虑rcccDNAloxP重组效率及细胞核内DNA重组对rcccDNA表观遗传学的影响等。
cccDNA是HBV慢性感染的分子基础。与普通的线性HBV复制子编码质粒相比,直接应用rcccDNAloxP尾静脉高压注射小鼠诱导了显著延长的病毒抗原血症,这一结果与本课题组早先基于rcccDNAloxP系统的研究类似。因此,(r)cccDNA的稳定性是其内在特征,与细胞核内位点特异性重组及系统引入的非HBV DNA元件没有显著关联。
总之,本研究是基于早期工作的改进,报道了一种体外诱导rcccDNA产生和纯化的策略,在原核表达系统和实验小鼠水平提供了一种更为简化的实验模型系统,也将为高通量筛选抗cccDNA化合物提供更多的便利。
[1] Seeger C, Mason WS. Hepatitis B virus biology [J]. Microbiol Mol Biol Rev, 2000, 64(1): 51-68.
[2] Bock CT, Schwinn S, Locarnini S, Fyfe J, Manns MP, Trautwein C, Zentgraf H. Structural organization of the hepatitis B virus minichromosome [J]. J Mol Biol, 2001, 307(1): 183-196.
[3] Pollicino T, Belloni L, Raffa G, Pediconi N, Squadrito G, Raimondo G, Levrero M. Hepatitis B virus replication is regulated by the acetylation status of hepatitis B virus cccDNA-bound H3 and H4 histones [J]. Gastroenterology, 2006, 130 (3): 823-837.
[4] Zhu Y, Yamamoto T, Cullen J, Saputelli J, Aldrich CE, Miller DS, Litwin S, Furman PA, Jilbert AR, Mason WS. Kinetics of hepadnavirus loss from the liver during inhibition of viral DNA synthesis [J]. J Virol, 2001, 75(1): 311-322.
[5] Nassal M. HBV cccDNA: viral persistence reservoir and key obstacle for a cure of chronic hepatitis B [J]. Gut, 2015, 64 (12): 1972-1984.
[6] Zoulim F, Lebossé F, Levrero M. Current treatments for chronic hepatitis B virus infections [J]. Curr Opin Virol, 2016, 18: 109-116.
[7] Qi Z, Li G, Hu H, Yang C, Zhang X, Leng Q, Xie Y, Yu D, Zhang X, Gao Y, Lan K, Deng Q. Recombinant covalently closed circular hepatitis B virus DNA induces prolonged viral persistence in immunocompetent mice [J]. J Virol, 2014, 88(14): 8045-8056.
[8] Thomson JG, Ow DW. Site-specific recombination systems for the genetic manipulation of eukaryotic genomes [J]. Genesis, 2006, 44(10): 465-476.
[9] Guo X, Chen P, Hou X, Xu W, Wang D, Wang TY, Zhang L, Zheng G, Gao ZL, He CY, Zhou B, Chen ZY. The recombined cccDNA produced using minicircle technology mimicked HBV genome in structure and function closely [J]. Sci Rep, 2016, 6: 25552.
[10] Gao W, Hu J. Formation of hepatitis B virus covalently closed circular DNA: removal of genome-linked protein [J]. J Virol, 2007, 81(12): 6164-6174.
[11] He W, Cao Z, Mao F, Ren B, Li Y, Li D, Li H, Peng B, Yan H, Qi Y, Sun Y, Wang F, Sui J, Li W. Modification of three amino acids in sodium taurocholate cotransporting polypeptide renders mice susceptible to infection with hepatitis D virus in vivo [J]. J Virol, 2016, 90(19): 8866-8874.
[12] Raney AK, Eggers CM, Kline EF, Guidotti LG, Pontoglio M, Yaniv M, McLachlan A. Nuclear covalently closed circular viral genomic DNA in the liver of hepatocyte nuclear factor 1 alpha-null hepatitis B virus transgenic mice [J]. J Virol, 2001, 75(6): 2900-2911.
[13] Lempp FA, Mutz P, Lipps C, Wirth D, Bartenschlager R, Urban S. Evidence that hepatitis B virus replication in mouse cells is limited by the lack of a host cell dependency factor [J]. J Hepatol, 2016, 64 (3): 556-564.
[14] Yang PL, Althage A, Chung J, Chisari FV. Hydrodynamic injection of viral DNA: a mouse model of acute hepatitis B virus infection [J]. Proc Natl Acad Sci USA, 2002, 99(21): 13825-13830.
[15] Huang LR, Wu HL, Chen PJ, Chen DS. An immunocompetent mouse model for the tolerance of human chronic hepatitis B virus infection [J]. Proc Natl Acad Sci USA, 2006, 103(47): 17862-17867.
[16] Qin Y, Zhang J, Garcia T, Ito K, Gutelius D, Li J, Wands J, Tong S. Improved method for rapid and efficient determination of genome replication and protein expression of clinical hepatitis B virus isolates [J]. J Clin Microbiol, 2011, 49(4): 1226-1233.
s. GAO Yueqiu, E-mail: gaoyueqiu@hotmail.com;LI Gaiyun, E-mail: ligaiyun@ips.ac.cn
Preparing recombinant cccDNA of hepatitis B virusinvitrousing minicircle DNA vector technology
ZHU Yuanfei1, 2, LI Gaiyun2, CHANG Hao2, YU Kangkang2, GAO Yueqiu1, DENG Qiang1, 2
1.LaboratoryofCellularImmunity,ShuguangHospitalAffiliatedtoShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China; 2.KeyLaboratoryofMolecularVirologyandImmunology,InstitutPasteurofShanghai,ChineseAcademyofSciences,Shanghai200032,China
Covalently closed circular DNA (cccDNA) of hepatitis B virus (HBV) is essential to establish and sustain viral replication. We recently reported a technique involving HBV recombinant cccDNA (rcccDNA) usingCre/loxP-mediated DNA recombination (rcccDNAloxP). rcccDNAloxPcould be substantially induced in the nuclei of hepatocytes, which thus represents a useful surrogate for HBV cccDNA-related investigations. In the present study, we described an approach to prepare rcccDNA in anEscherichiacoli(E.coli) strain ZYCY10P3S2T based on PhiC31-mediated site-specific recombination (rcccDNAattR). Purified rcccDNAattRminicircles were supercoils which demonstrated to support functional HBV expression and replication in the cell culture. Using the technique of hydrodynamic injection, rcccDNAattRinduced significantly prolonged HBV antigenemia in immunocompetent mice, as compared to a regular plasmid encoding linear HBV replicon. Collectively, our study provided a simplified method to surrogate HBV cccDNA in the prokaryotic expression system and in the mouse model. Our results suggested again that rcccDNA is intrinsically stable and could act as a prototype for modeling HBV persistence in mouse livers.
Minicircle DNA vector technology; PhiC31; Site-specific recombination; Hepatitis B virus; Covalently closed circular DNA
上海市科学技术委员会科研计划项目(16401970600、17ZR1433400)
高月求,李改云
2017-02-28)

