153例经外科干预的非小细胞肺癌伴胸膜播散患者的预后研究
王亚龙王亚格胡箫王永岗
·临床研究与应用·
153例经外科干预的非小细胞肺癌伴胸膜播散患者的预后研究
王亚龙①王亚格②胡箫③王永岗①
目的:探讨经不同外科治疗方式干预的非小细胞肺癌(non-small cell lung cancer,NSCLC)伴胸膜播散患者的预后。方法:回顾性分析2002年5月至2011年5月153例在中国医学科学院肿瘤医院胸外科接受外科手术并于术中或术后确诊NSCLC伴胸膜播散患者的临床资料。结果:全组患者,3年和5年生存率分别为38.5%和24.2%,中位生存时间29.0个月。其中31例接受胸膜结节活检术,122例接受原发肿瘤切除术,两组患者5年生存率分别是16.1%和26.2%,中位总生存时间分别为24.0个和29.0个月,两组间生存差异均无统计学意义(P>0.05)。122例接受原发肿瘤切除术患者中,是否行淋巴结清扫和转移结节切除,以及行部分肺叶或肺叶切除对患者预后影响无显著性差异(P>0.05)。结论:NSCLC伴胸膜播散患者预后较差,行不同外科干预方式生存未显示出显著性差异,外科干预的主要作用是除外及证实胸膜播散以明确病理诊断,指导后续治疗,肿瘤切除应慎重,其意义有待进一步探讨。
非小细胞肺癌 胸膜播散 手术 预后
肺癌严重危害人类健康,2012年全球新增肺癌患者180万,肺癌死亡患者160万[1-2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的85%。NSCLC伴胸膜播散是Ⅳ(M1a)期肺癌[3],占NSCLC的4.5%~7.5%[4-5]。胸膜播散包含恶性胸膜结节和恶性胸腔或心包积液。根据美国国家综合癌症网络(na⁃tional comprehensive cancer network,NCCN)非小细胞肺癌临床指南,NSCLC伴胸膜播散患者的治疗方法包括化疗和靶向治疗,伴大量胸腔积液患者可接受胸膜粘连术或胸腔积液引流术,不推荐患者接受原发肿瘤切除术[6]。然而,近年有学者报道原发肿瘤切除术可改善部分高度筛选患者预后[5,7-11];同时随着微创电视胸腔镜手术技术的普及和进步,外科手术带给患者的创伤明显减小,患者恢复时间也大大缩短。外科干预对患者预后的影响仍值得探讨。本研究回顾性分析了中国医学科学院肿瘤医院胸外科接受了外科干预伴胸膜播散NSCLC的153例患者的临床病理资料,进一步探讨这部分患者的临床病理特点和预后。
1 材料与方法
1.1 临床资料
1.1.1 一般资料收集2002年5月至2011年5月期间在本院胸外科接受过肺部肿瘤手术治疗患者;1)纳入标准:肺部肿瘤经术中或术后病理证实为NSCLC且伴胸膜播散。2)排除标准:①术前已经病理诊断为NSCLC且伴胸膜播散;②术前评估存在或可疑存在其他部位远处转移(脑、骨、肾上腺等);③术前行新辅助治疗。共纳入符合上述标准患者153例。
1.1.2 术前和术中评估所有患者术前均被推荐行肿瘤可切除性和肿瘤是否远处转移的评估检查,包括胸部增强CT、气管镜、头颅CT或核磁、腹部CT或超声、骨扫描或PET-CT。所有患者术中均行胸膜结节冰冻病理和/或胸腔积液细胞学检查并证实为胸膜播散。
1.2 方法
1.2.1 手术方式及术后治疗术者依据个人认知、经验、患者家属意愿对患者采取不同外科治疗方式,这些方式包括胸膜结节活检术(31例)、原发肿瘤切除伴或不伴系统性淋巴结清扫术(88例)、原发肿瘤切除伴系统性淋巴结清扫及胸膜结节切除或电灼术(34例,此术式仅针对胸膜结节有限、可数患者),所有患者均未发生严重术中和术后并发症,术后均恢复顺利出院。所有患者均被推荐术后接受4~6个疗程以铂类为基础的化疗,基因检测阳性患者推荐相应靶向治疗。
1.2.2 临床资料和随访临床资料通过查阅病历数据库信息获得。临床资料包括:性别、年龄、吸烟史、发病部位、术前影像评估情况、病理诊断、原发肿瘤大小、胸腔积液、手术方式、术后并发症、术后治疗方法。生存情况通过查阅医院随访中心信息和电话随访获得,随访截止2016年6月,共15例患者失访,失访率9.8%。
1.3 统计学分析
应用SPSS19.0软件进行统计学分析。计数资料比较采用χ2检验,生存分析采用Kaplan-Meier法和Log rank检验,单因素和多因素分析采用Cox风险回归模型,检验水准α=0.05。以P<0.05为差异具有统计学意义。
2 结果
2.1 患者临床病理特征及预后
共153例患者,其中男性87例,女性66例;年龄≥60岁92例,年龄<60岁61例。病灶位于右侧98例,位于左侧55例。有吸烟史者59例,无吸烟史者94例。术前影像检查未发现转移92例,提示转移61例。腺癌135例,其他病理类型18例。无胸腔积液90例,有胸腔积液63例。原发病灶直径≤3 cm 60例,直径>3 cm 73例。96例患者有完整术后治疗资料,且全部接受了化疗,45例接受了靶向治疗,51例无靶向治疗。全组患者3、5年生存率分别是38.5%、24.2%,中位总生存时间(median survival time,MST)为29.0个月(图1)。
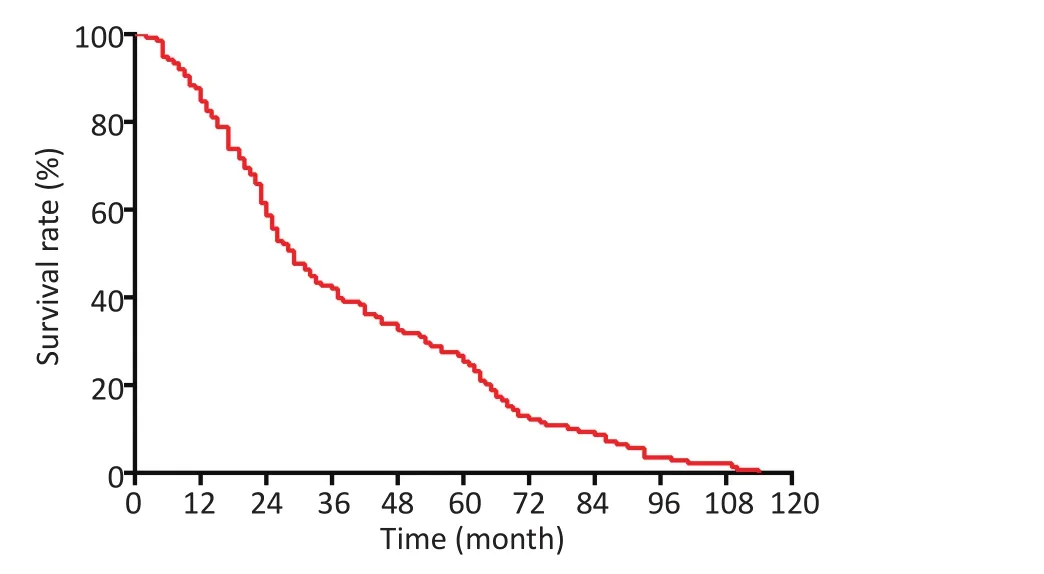
图1153 例伴恶性胸膜结节NSCLC患者总生存曲线Figure 1Overall survival curve of 153 NSCLC patients with pleural nodules
2.2 不同外科干预方式及预后
153例患者中,31例接受胸膜结节活检术,122例接受原发肿瘤切除术。在原发肿瘤切除组患者中,原发肿瘤切除伴或不伴系统性淋巴结清扫术88例,原发肿瘤切除伴系统性淋巴结清扫及胸膜结节切除或电灼术34例。肿瘤切除组患者中,接受亚肺叶切除(肺段切除或楔形切除)36例,肺叶或全肺切除86例(肺叶切除83例、全肺切除3例)。
2.2.1 胸膜结节活检组和原发肿瘤切除组患者临床病理特征及预后两组患者性别、年龄、部位、吸烟史、术前影像是否提示胸膜播散、病理类型差异无统计学意义(P>0.05),胸腔积液、肿物大小、术后化疗、术后靶向治疗差异具有统计学意义(P<0.05),胸膜结节活检组患者中,有胸腔积液者、原发肿瘤直径≥3 cm者、化疗情况未知者、未接受靶向治疗或靶向治疗情况未知者较原发肿瘤切除组多(表1)。肿瘤切除组和胸膜结节活检组患者3年生存率分别为42.6%和22.5%,5年生存率分别是26.2%和16.1%,MST分别为29.0个月和24.0个月,生存差异无统计学意义(P>0.05,图2)。

表1 胸膜结节活检组和原发肿瘤切除组患者临床病理特征Table 1Clinicopathologic features of pleural biopsy group and primary tumor resection group

表2 影响伴恶性胸膜结节NSCLC患者预后的单因素和多因素分析Table 2Univariate and multivariate analysis of prognostic factors of NSCLC patients with pleural nodules
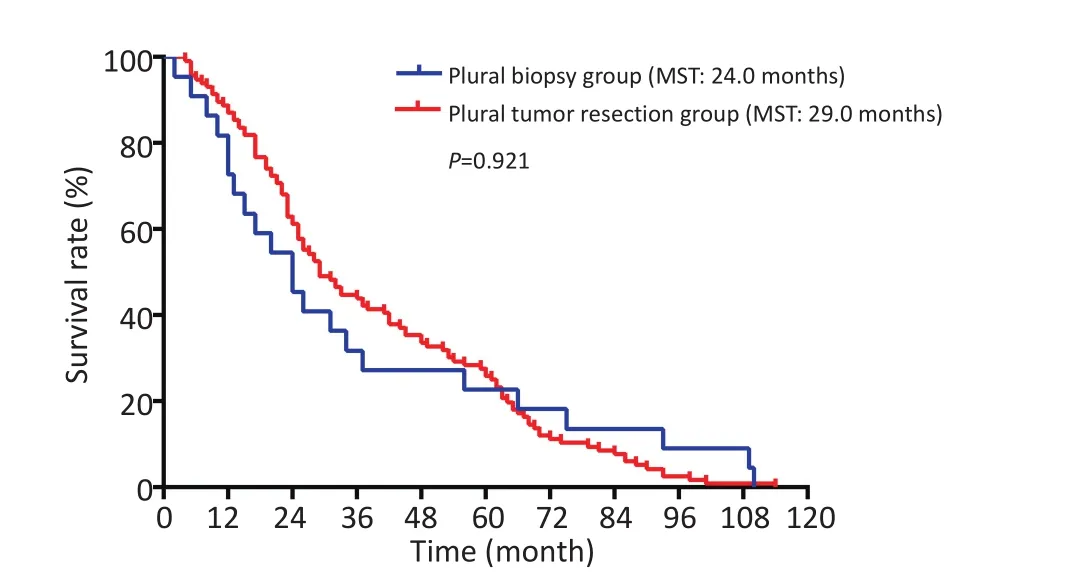
图2 原发肿瘤切除组和胸膜结节活检组患者总生存曲线Figure 2Overall survival curve of primary tumor resection group and pleural biopsy group
2.2.2 原发肿瘤切除组不同术式患者预后122例原发肿瘤切除组患者中,原发肿瘤切除伴或不伴系统性淋巴结清扫术88例,5年生存率为26.4%;原发肿瘤切除伴系统性淋巴结清扫及胸膜结节切除或电灼术34例,5年生存率为25.7%。两组患者总生存差异无统计学意义(P=0.430)。所有患者中,接受亚肺叶切除(肺段切除或楔形切除)36例,5年生存率为30.6%;肺叶或全肺切除86例(肺叶切除83例,全肺切除3例),5年生存率为24.4%。两组患者总生存差异无统计学意义(P=0.946)。
2.3 影响预后的单因素和多因素分析
单因素分析显示性别、年龄、部位、吸烟史、术前影像提示胸膜转移、病理类型、有无合并胸腔积液对患者预后无显著性影响,肿物直径≤3 cm、术后化疗、术后靶向治疗患者有更好的预后。将以上3个因素纳入多因素分析,术后靶向治疗是影响NSCLC伴胸膜播散患者预后的独立因素(表2)。进一步对有完整术后治疗资料的96例患者进行生存分析,96例患者中靶向治疗者45例,无靶向治疗者51例,两组患者MST分别为59.0个月和26.0个月(P=0.000),靶向治疗能够明显提高患者总生存期(图3)。
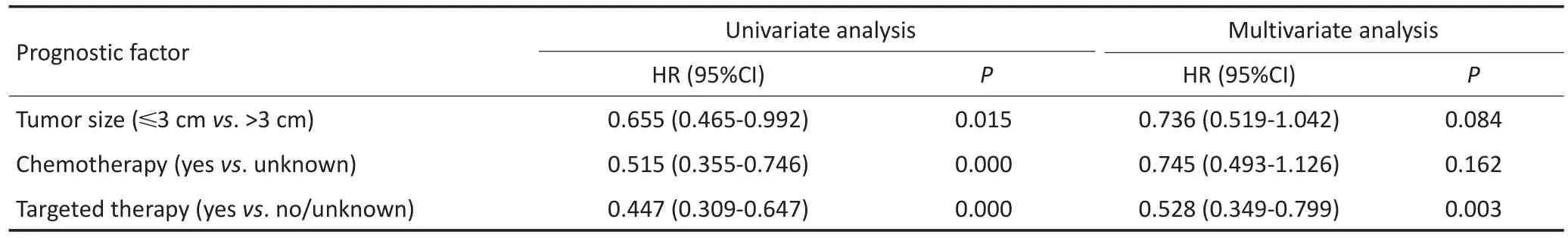
表2 影响伴恶性胸膜结节NSCLC患者预后的单因素和多因素分析(续表2)Table 2Univariate and multivariate analysis of prognostic factors of NSCLC patients with pleural nodules
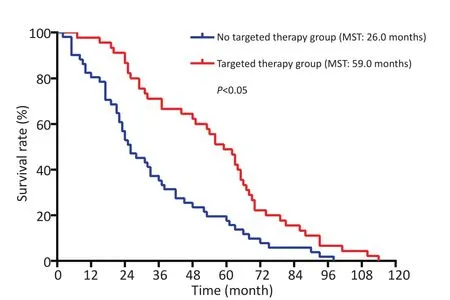
图3 靶向治疗组和无靶向治疗组患者总生存曲线(96例有术后辅助治疗资料患者)Figure 3Overall survival curve of targeted therapy group and no tar‐geted therapy group(96 patients with postoperative treatment data)
3 讨论
按照第7版国际抗癌联盟肺癌TNM分期标准,NSCLC伴胸膜播散为M1a期肺癌,目前国内外指南均不推荐该期患者接受手术治疗[6]。然而在临床实践中,外科医生经常面临术前检查未发现胸膜播散,或术前可疑胸膜播散但无法明确,而在术中行胸膜结节活检或胸水细胞学检查以除外或证实为播散的情况,本研究患者基本属于这一情况。如术中明确为胸膜播散,外科医生需要对是否继续手术和术式选择做出决定。近年有报道提示原发肿瘤切除术可改善部分NSCLC伴胸膜播散患者预后[5,7-11]。同时,随着近些年电视胸腔镜手术技术的普及和进步,外科手术带给患者的创伤明显减小,患者恢复时间也大大缩短。大部分一般情况较好患者可以耐受肺叶或亚肺叶切除。外科干预对患者预后的影响仍值得探讨。
Shen等[10]在一项包含7 321例M1a期NSCLC患者的大型回顾性研究中发现,接受原发肿瘤切除术患者总生存期明显优于单纯探查术或仅转移病灶切除术者(P<0.001)。Iida等[11]一项包含329例NSCLC伴胸膜播散患者的研究提示,行完整肿瘤切除术后患者5年生存率达37.1%,完整肿瘤切除是良好预后因素(P=0.013)。然而本研究中,尽管原发肿瘤切除组患者3、5年生存率及MST均高于胸膜结节活检组,但是两组患者生存情况差异无统计学意义(P>0.05);同时,接受术后靶向治疗者预后明显优于未接受靶向治疗者,靶向治疗是患者良好预后的重要因素。这一结果提示对于NSCLC伴胸膜播散患者,近些年患者生存情况的改善更多得益于靶向药物的出现和广泛应用。刘佳等[12]报道胸部CT对胸膜播散的阳性检出率为85%,因此,对于术前可疑胸膜播散或术前胸膜播散未知的患者,外科手术的价值在于除外及证实胸膜播散以明确诊断。对于术前已基本诊断为胸膜播散但无法取得病理组织的患者,外科手术在于通过微创的方式取得足够的病理组织,为下一步基因检测及靶向治疗提供基础。
有学者指出尽管NSCLC伴胸膜播散患者预后差,但经过严格筛选的患者仍可能从手术中获益。Ren等[7]认为术中首次发现的胸膜转移结节相较术前已知转移者病期可能相对较早,因此接受手术治疗能够明显改善患者预后。Ichinose等[13]研究术中发现的恶性胸膜结节平均个数为5.6(1~20)个,根据术中胸膜结节个数的多少可将恶性胸膜结节分为局限性结节(有限的、局部的结节)及弥漫性结节(大量的、播散的结节)[14]。局限性胸膜结节患者接受根治性手术治疗(原发肿瘤切除+淋巴结清扫+转移结节切除)后较单纯胸膜结节活检组能够明显提高5年生存率[9,15]。但本研究中,不论是术中首次发现胸膜转移的患者,还是胸膜转移结节较局限的患者,在接受根治性手术治疗后总体生存期并无明显提高,这一结果不支持更积极的手术治疗。这可能提示,伴恶性胸膜结节患者已发生肿瘤远处转移,即使对高度筛选的患者行原发病灶切除治疗已不能完全切除肿瘤组织,更激进的根治性肿瘤切除其减瘤效果也极其有限,第7版国际抗癌联盟肺癌分期系统将其分期为M期,符合这一类型肿瘤的生物学特点。
综上所述,对于术前可疑胸膜播散但难以确诊的NSCLC患者,多种外科干预方式并不显著改善患者预后,外科干预的主要目的是为了除外或证实胸膜播散以明确诊断,指导后续治疗。对术中证实有胸膜播散的患者,原发肿瘤切除及淋巴结清扫应慎重,其临床意义有待进一步探讨。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87‐108.
[2]Islami F,Tore LA,Jemal A.Global trends of lung cancer mortality and smoking prevalence[J].Transl Lung Cancer Res,2015,4(4):327‐338.
[3]GoldstrawP,Crowley J,Chansky K,et al.The IASLC Lung Cancer Staging Project:proposals for the revision of the TNM stage groupings in the forthcoming(seventh)edition ofthe TNM Classification of malignant tumours[J].J Thorac Oncol,2007,2(8):706‐714.
[4]Ou SH,Zell JA.Validation study of the proposed IASLC staging revisions of the T4 and Mnon‐small cell lung cancer descriptors using data from 23,583 patients in the california cancer registry[J].J Thorac Oncol,2008,3(3):216‐227.
[5]Okamoto T,Iwata T,Mizobuchi T,et al.Pulmonary resection for lung cancer with malignant pleural disease first detected at thoracotomy[J].Eur J Cardiothorac Surg,2012,41(1):25‐30.
[6]Ettinger DS,Wood DE,Akerley W,et al.NCCN guidelines insights:non‐small Cell lung cancer,version 4.2016[J].J Natl Compr Canc Netw,2016,14(3):255‐264.
[7]Ren YJ,She YL,Dai CY,et al.Primary tumour resection showed survival benefits for non‐small‐cell lung cancers with unexpected malignant pleural dissemination[J].Interact CardioVasc Thorac Surg,2016,22(3):321‐326.
[8]Liu T,Liu H,Wang G,et al.Survival of m1a non‐small cell lung cancer treated surgically:a retrospective single‐center study[J].Thorac Cardiovas Surg,2015,63(7):577‐582.
[9]Yun JK,Kim MA,Choi CM,et al.Surgical outcomes after pulmonary resection for non‐small cell lung cancer with localized Pleural seeding first detected during surgery[J].Thoracic Cardiovasc Surg,2015.[Epub ahead of print].
[10]Shen H,Cao Y,Li X,et al.Surgical Intervention Improves survival for metastatic non‐small cell lung cancer patients[J].Medicine,2016,95(21):e3800.
[11]Iida T,Shiba M,Yoshino I,et al.Surgical intervention for non‐small‐cell lung cancer patients with pleural carcinomatosis:results from the Japanese Lung Cancer Registry in 2004[J].J Thorac Oncol,2015,10(7):1076‐1082.
[12]Liu J,Li WW,Huang Y,et al.MSCT imaging diagnosis of peripheral lung cancer with dry pleural dissemination[J].Chinese Journal of Lung Cancer,2014,(5):406‐410.[刘佳,李文武,黄勇,等,周围型肺癌干性胸膜转移的多层螺旋CT影像学诊断[J].中国肺癌杂志,2014,(5):406‐410.]
[13]Ichinose Y,Tsuchiya R,Koike T,et al.Prognosis of resected non‐small cell lung cancer patients with carcinomatous pleuritis of minimal disease[J].Lung Cancer,2001,32(1):55‐60.
[14]Bolukbas S.Lung cancer with unexpected localized pleural dissemi‐nation detected during surgery:should we stop surgery or should we Go On[J]?Thorac Cardiovasc Surg,2015.[Epub ahead of print].
[15]Mordant P,Arame A,Foucault C,et al.Surgery for metastatic pleural extension of non‐small‐cell lung cancer[J].Eur J Cardiothorac Surg,2011,40(6):1444‐1449.
(2017‐02‐22收稿)
(2017‐04‐24修回)
(编辑:杨红欣校对:郑莉)

王亚龙专业方向为胸部肿瘤外科的临床和基础研究。
E-mail:china_wangyalong@163.com
·读者·作者·编者·
血清重轻链检测在浆细胞病中的应用
单克隆免疫球蛋白(M蛋白)是单克隆浆细胞增殖性疾病诊断、预后分析及疗效评价的核心指标。血清重轻链(HLC)检测,作为一种新兴的M蛋白定量技术,可以特异性测定重链及轻链相关的免疫球蛋白水平。近年来,HLC检测已被应用于多种单克隆浆细胞增殖性疾病的研究,给此类疾病的诊疗带来新的检测手段。《中国肿瘤临床》2016年第43卷第15期“特约综述”栏目中,特邀中国医学科学院北京协和医院血液内科科室副主任李剑教授就HLC检测在该类疾病中的应用进行综述。
阅读本文请登录网站www.cjco.cn或关注本刊微信公告号(扫描文章下方二维码)查看。

——本刊编辑部
Prognosis of 153 non-small cell lung cancer patients with pleural dissemination after surgery
Yalong WANG1,Yage WANG2,Xiao HU3,Yonggang WANG1
Yonggang WANG;E‐mail:wyg200963@163.com
1Department of Thoracic Surgical Oncology,National Cancer Center/Cancer Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100021,China.2Department of Surgical Oncology,First Affiliated Hospital of Henan University of Sci‐ence and Technology,Luoyang 471000,China;3Department of Pathology,National Cancer Center/Cancer Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100021,China
Objective:To evaluate the prognosis of non‐small cell lung cancer(NSCLC)patients with pleural dissemination after differ‐ent surgical interventions.Methods:We retrospectively reviewed clinical and survival data of 153 NSCLC patients with pleural dissemi‐nation who were diagnosed and treated in our hospital from May 2002 to May 2011.Results:The overall 3‐and 5‐year survival rates of all the patients are 38.5%and 24.2%,respectively,with a median survival time(MST)of 29.0 months.A total of 122 patients accept‐ed primary tumor resection whereas the remaining 31
pleural biopsy.The 5‐year survival rate of the primary tumor resection group was 26.2%with a MST of 29.0 months and 16.1%for the pleural biopsy group with a MST of 24.0 months.The survival analysis showed no significant differences in the prognosis between the primary tumor resection and pleural biopsy groups(P>0.05).In the pri‐mary tumor resection group,different surgical interventions(with or without lymph nodes dissection,with or without metastatic nod‐ules resection,lobe,or partial lobe resection)had no effect on prognosis(P>0.05).Conclusion:Patients with pleural dissemination had poor prognosis.Different surgical interventions showed no survival benefits for patients with NSCLC regarding pleural dissemination.The role of surgery was to rule out or confirm pleural dissemination.The definite value of surgery still needs further exploration.
,non‐small cell lung cancer,pleural dissemination,surgery,prognosis
10.3969/j.issn.1000-8179.2017.14.204
①北京协和医学院中国医学科学院肿瘤医院胸外科(北京市100021);②河南科技大学附属第一医院肿瘤外科;③北京协和医学院中国医学科学院肿瘤医院病理科
王永岗wyg200963@163.com

