致病细菌诱发细胞焦亡研究进展
卫朝辉,刘超英,高飞龙,王世玉,严玉霖,高 洪
(云南农业大学动物科学科技学院,云南昆明 650201)
致病细菌诱发细胞焦亡研究进展
卫朝辉,刘超英,高飞龙,王世玉,严玉霖,高 洪*
(云南农业大学动物科学科技学院,云南昆明 650201)
细胞焦亡(pyroptosis)是一种新发现的促炎性细胞程序性死亡方式。炎性小体和半胱天冬酶在细胞焦亡发生的过程中起着重要作用。细胞焦亡主要依赖半胱天冬酶1(caspase-1)、半胱天冬酶4(caspase-4)、半胱天冬酶5(caspase-5)及半胱天冬酶11(caspase-11)也可以介导。致病细菌刺激细胞内模式识别受体激活炎性小体形成,依赖于caspase-1的经典焦亡途径和依赖于caspase-4、caspase-5、caspase-11的非经典焦亡途径启动诱发细胞焦亡。细胞焦亡的形态特征以发生机理与凋亡、坏死存在着差异。论文主要对细胞焦亡的形态学特征、发生机制及致病细菌诱发的焦亡进行综述,以期为进一步研究细胞焦亡提供理论基础。
细胞焦亡;致病细菌;炎性小体;半胱天冬酶
细胞是机体结构和生命活动的基本单位,细胞死亡是生物活动中一种重要的现象,在机体维持自身稳态、新陈代谢及病理过程中起着重要的作用。细胞焦亡是在沙门菌感染巨噬细胞过程中发现的一种新的细胞程序性死亡方式,Cookson B T等[1]首次将这种依赖于半胱天冬酶1(caspase-1)的细胞死亡方式命名为“pyroptosis”,是来源于希腊语的合成词,“pyro”意思为火;“ptosis”意思是下落,反映了促炎性物质从宿主释放的细胞焦亡本质。细胞焦亡与凋亡、胀亡及自噬等细胞死亡方式有着明显的差异(图1),其典型特征是依赖于caspase-1/11介导的激活,同时细胞大量的释放促炎细胞因子IL-1β和IL-18。在焦亡发生的过程中,细胞膜会出现穿孔,胞内物质释放到胞外发生促炎性反应,并伴随着胞内核苷酸片段化的产生。
细胞焦亡已成为细胞死亡领域新的研究热点。随着对细胞焦亡的形态特征和发生机理逐步的了解,将促进细胞焦亡在天然免疫等生理过程的深入研究。本文综述了细胞焦亡的形态特征、发生机制及致病细菌诱发细胞焦亡,为相关研究提供参考。
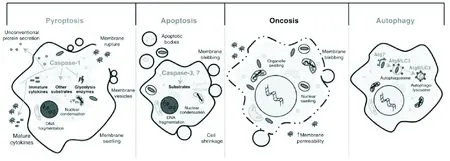
图1 细胞焦亡与凋亡、胀亡及自噬的区别[2]
1 细胞焦亡的形态学特征
细胞焦亡是一种新近发现并证实的促炎性细胞死亡方式,其最主要的生物学特征是依赖于caspase-1激活并伴随着炎症级联反应的发生。从其形态学特征来看,焦亡的细胞在形态上同时具有凋亡和坏死的特征,与凋亡的特征极为相似,但不是它们形态学特征的组合。caspase-3、caspase-6及caspase-8这些与凋亡相关的半胱天冬酶并没有参与细胞焦亡的发生[3]。ADP核糖聚合酶(ADPribose polymerase,PARP)和caspase激活DNA酶抑制剂(inhibitor caspase activated DNase,ICAD)此类凋亡相关半胱天冬酶的底物在细胞焦亡中也未发生蛋白分解[4]。在细胞焦亡中,细胞膜迅速破裂并失去完整性,这一特征与细胞坏死相似,但与细胞凋亡不同。在caspase-1被激活之后,发生焦亡的细胞膜上会形成直径约为1.1 nm~2.4 nm的小孔。这些小孔会使细胞变得对7-氨基放线菌素(7-aminoactinomycin,7-AAD)、溴化乙锭(ethiduim bromide,EtBr)及碘化丙啶(propidium iodide,PI)一类小分子量、膜不可渗透的染料变得可渗透。与之相反的是,凋亡细胞保持完整片段化的凋亡小体,不会被7-ADD和PI所染色。焦亡所形成的小孔会使细胞迅速失去离子梯度,细胞内的渗透压激增,细胞吸水肿胀,随之细胞膜破裂,细胞内容物被释放到细胞外[5]。膜破裂后,质膜的内部叶状组织会暴露于细胞外液,因此可以用与内部叶状组织所分离的脂质磷脂酰丝氨酸(phosphatidyl serine,PS)结合的Annexin V对内部叶状组织染色[6]。不同的是,在凋亡细胞中,PS是通过翻转酶移位到质膜的细胞外表面,被Annexin V所染色。细胞焦亡会出现DNA损伤并且在TUNEL测定中呈阳性,但是比细胞凋亡的程度低的多。另外,发生焦亡的细胞中存在很少梯带状的DNA。与凋亡相比,尽管也发生类似的染色质凝聚但核仍保持完整性。在凋亡中,DNA的损伤由caspase激活的DNA酶(caspase activated DNase,CAD)所决定。细胞凋亡过程中,凋亡相关caspase会介导ICAD发生水解,进而CAD被激活,在核小体间对染色体DNA加以剪切,细胞因此会出现梯带状DNA片段。细胞焦亡中,尽管caspase-1也可以在体外切割ICAD,但CAD仍然与其抑制剂ICAD结合。所以,细胞虽然会出现染色体DNA降解,但并不呈现大量DNA梯形条带。除此以外,在光镜下观察焦亡细胞时,还发现细胞核周围会形成气球样的囊泡[7]。
2 细胞焦亡的机制
2.1 经典焦亡途径
在激活caspase-1的过程中,炎性小体发挥重要作用。模式识别受体(pattern recognition receptors,PRRs)、凋亡相关微粒蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和caspase-1前体(Pro-caspase-1)构成细胞内高分子蛋白复合物即炎性小体。在危险信号刺激下,无活性的Pro-caspase-1被炎性小体处理,裂解成为有活性的caspase-1,进而诱使细胞引起炎症反应,并且其还可以促进pro-IL-1β和pro-IL-18的成熟,使其成为有活性的IL-1β和IL-18,释放到细胞外,招募更多的炎症细胞聚合,使炎症反应放大。依赖于caspase-1的细胞焦亡途径称为经典焦亡途径(图2)。尽管对细胞焦亡做了许多研究,但是该途径诱发细胞焦亡的机制还是不太清楚。2015年,研究人员利用CRISPR/CAS9全基因组敲除技术得到GSDMD-/-小鼠,对之进一步研究发现NLRC4、NLRP3及AIM2炎症小体所介导的经典焦亡途径在GSDMD-/-小鼠身上均无法诱发[9]。此外又证实Pyrin炎症小体介导的经典焦亡途径在GSDMD-/-小鼠身上同样无法发生[10]。这些都显示在NLRP3、NLRC4、AIM2及Pyrin等炎症小体介导的经典焦亡途径中GSDMD蛋白中起到重要作用。在使用ATP及鞭毛蛋白分别刺激GSDMD-/-小鼠中骨髓巨噬细胞(BMDM)与野生型BMDM的试验中,发现8 h内GSDMD-/-细胞发生焦亡的数量明显减少,试验也发现依赖caspase-1的焦亡途径中GSDMD涉及参与,诱发细胞焦亡[11]。但是,Xu H等[10]研究却表明在用ATP或鞭毛蛋白激活经典焦亡途径后的8 h~16 h内,野生型和GSDMD-/-巨噬细胞的焦亡发生没有显著差别。一些研究还表明在所有脊椎动物中存在caspase-1的同系物,但是在哺乳动物体内只存在caspase-4、caspase-5、caspase-11及GSDMD[12-14]。这些结果显示GSDMD可能作为caspase-1的下游靶目标参与经典焦亡途径,但可能不是依赖caspase-1经典焦亡途径所必需的,或者可能GSDMD只参与依赖caspase-1经典焦亡途径存中多条焦亡通路的一条。经典焦亡途径中的相关机制和必需分子仍需进一步深入研究。
2.2 非经典焦亡途径
细胞焦亡的诱发除了依赖caspase-1的经典途径外,新近的研究也报道了在受到脂多糖(lipopolysaccharide,LPS)刺激后,caspase-4、caspase-5及caspase-11可以与其直接结合并引起焦亡的发生[15-17],此焦亡途径与caspase-1诱发的焦亡过程存在着差异。依赖于caspase-4、caspase-5、caspase-11的这种细胞焦亡途径称为非经典焦亡途径。LPS与caspase-11特异性结合后,促进活化缝隙连接蛋白1,使胞内的ATP流出,释放的ATP激活P2X7,使离子通道打开,胞内的K+外流,胞外的Na+和Ca+内流,质膜完整性受损,胞内内容物外流,炎症反应引发。依赖caspase-11的非经典焦亡途径是经由ATP介导的P2X7信号通路发生的,缝隙结合蛋白1是该通路所必需的。在此焦亡途经中,缝隙结合大蛋白1的分裂可能经由释放ATP激活P2X7途径诱发细胞死亡,也可能通过K+外流激活NLRP3炎症小体影响caspase-1的活化和IL-1β的释放。值得的注意的是,caspase-1与caspase-11紧密关联,caspase-1也参与LPS诱发的依赖于caspase-11的非经典焦亡途径,无活性的Pro-IL-1β可以被活化的caspase-1切割处理形成成熟的IL-1β,随之释放到细胞外使炎症反应进一步扩大。在此途经中ASC和NLRP3参与,caspase-11的活化及细胞焦亡却不依赖ASC和NLRP3,这表明Pro-caspase-1、NLRP3及ASC组成的炎症小体虽然参与到依赖caspase-11的焦亡非经典途径,但不是介导此焦亡途径所必需的。试验发现LPS刺激GSDMD-/-巨噬细胞后,IL-1β不会被分泌并且细胞不会出现焦亡的现象[9,11]。在受到LPS刺激后,GSDMD-/-巨噬细胞中caspase-1的活性及IL-1β的分泌受到了抑制,IL-1β的成熟却没有受影响[9],表明在依赖caspase-11的焦亡非途径中,caspase-1的活化和IL-1β的分泌与GSDMD蛋白相关,IL-1β的成熟与该蛋白无关。对小鼠在体进行试验发现,LPS刺激GSDMD-/-、caspase-11-/-小鼠后,其致死率显著降低[11]。caspase-4和caspase-5的相关研究表明GSDMD是caspase-4、caspase-5及Caspse-11诱发细胞焦亡所必需的。细胞发生焦亡的过程中GSDMD蛋白会分割成C端和N端,分裂后的N端诱发细胞焦亡,C端则是与N端结合抑制诱发焦亡。

图2 细胞焦亡的分子机制[8]
3 细菌感染诱发细胞焦亡
3.1 志贺菌
志贺菌感染巨噬细胞后,会迅速引发巨噬细胞焦亡。细胞会出现DNA断裂,质膜完整性受损,胞质空泡化,线粒体膜电势消失等的焦亡现象。志贺菌的Ⅲ型分泌系统是诱发巨噬细胞焦亡所必需的。细胞焦亡研究认为,志贺菌感染诱发巨噬细胞的焦亡是由T3SS效应分子 IpaB 蛋白引起的,纯化的 IpaB 蛋白能够和 caspase-1 在体外直接结合[18]。其通过自发形成低聚化插入到宿主质膜中形成离子通道,干扰溶酶体区室中单价无机阳离子的稳态。值得注意的是,caspase家族的一些蛋白,如在细胞凋亡终端起执行作用的 caspase-3 及LPS诱导的caspase-1上游激活蛋白 caspase-11 都不参与志贺菌感染诱发巨噬细胞的焦亡[18]。炎症小体复合物上的 caspase-1 被激活后,将会对炎症因子前体pro-IL-1β 和 pro-IL-18进行切割,使其成熟,从死亡的巨噬细胞中释放出来,引发宿主的炎症反应[18]。最近对此过程的研究表明,胞质模式识别受体IPAF(ICE-protease-activating factor,IPAF)和ASC蛋白均会参与志贺菌IpaB 蛋白引发的caspase-1激活,其中 IPAF 蛋白是触发巨噬细胞焦亡必需的,但ASC蛋白不是此通路中所必需的[19]。膜裂解,溶酶体渗漏,IPAD/ASC炎症小体形成及caspase-1活化这一系列的反应最终导致巨噬细胞的细胞焦亡[20]。
3.2 沙门菌
沙门菌是通过使自身形成的囊泡破裂,从而释放到巨噬细胞的细胞质中,触发细胞焦亡。caspase-1的活化(IL-1β释放的驱动剂)和IL-1β的分泌由称为细胞质信号转导复合物的炎症小体所介导[21]。所有经典的炎症小体包含Nod样受体(nod-like receptors,NLRs)蛋白,但它们识别的病原体相关分子模式(pattern-associated molecular patterns,PAMPs)不同。沙门菌由NLRC4和NLRP3两个典型炎症小体所识别 。值得注意的是,NLRC4和NLRP3彼此相互作用并且可以协作激活caspase-1来对沙门菌感染做出反应[22]。NLRC4炎症小体能感应PAMP鞭毛蛋白,以及沙门菌T3SS的组分,特别是SPI-1编码的指针性蛋白PrgJ和PrgI,以活化caspase-1和触发细胞焦亡。沙门菌感染期间是如何引发NLRP3炎症小体激活的还不太清楚,只知道该过程需要细胞外的ATP和柠檬酸盐[23-24]。细胞焦亡也可以通过依赖于caspase-11识别沙门菌LPS的非经典途径而产生。 在这条途径中,caspase-11直接感应细胞溶质LPS作为释放IL-1α的信号,介导细胞死亡而不需要NLRC4和NLRP3[25]。需要指出的是,caspase-11所介导的这种非经典途径也是需要caspase-1通过经典途径诱导对IL-1β的裂解[26]。一旦被激活,caspase-1/11随之就会切割称为gasdermin D的蛋白质。在切割时,gasdermin D的N末端将易位至细胞膜,触发细胞的破裂和IL-1b的释放[9,11,27]。
3.3 耶尔森菌
耶尔森菌感染巨噬细胞,通过炎症小体引起其发生焦亡。T3SS是耶尔森菌引发此反应所必需的,其主要激活NLPR3和NLRC4炎症小体,诱发细胞焦亡。来自细菌的已知易位效应分子YopJ以及来自宿主细胞的受体相互作用苏氨酸激酶 1(receptor-interacting/threonine kinase 1,RIPK1),相关死亡结构域蛋白(Fas-associated death domain,FADD),caspase-8都不涉及此过程[28]。caspase-1被鼠疫耶尔森菌T3SS转位的未知配体所激活,进而引发被激活巨噬细胞中依赖于caspase-1焦亡的发生[28]。诱发细胞焦亡的caspase-1,与引起凋亡的caspase结构相关功能不同。细胞焦亡中caspase-1引发的DNA损伤的机制与凋亡中DNA切割的机制也不同。 caspasee-1能刺激炎性细胞因子IL-1β和IL-18的成熟和分泌。最终,炎症细胞裂解,内容物释放,扩增炎性细胞因子的生理效应[5]。耶尔森菌感染的巨噬细胞,LPS会与TLR2和TLR3结合抑制caspase-3的激活,使巨噬细胞更易发生焦亡。需要注意的是,目前发现有两个Yops能够抑制caspase-1的激活,YopK可以抑制炎症小体激活的初始,即LPS激活巨噬细胞[29];YopM则在体外通过抑制caspase-1活性来阻断LPS激活的巨噬细胞中焦亡,其主要是通过直接与caspase-1结合来隔离caspase-1,中止炎症小体形成并且其在体内的耶尔森菌引发病的作用也得到了证实[29]。
4 小结与展望
细胞焦亡是近期发现的一种新的细胞死亡方式,同时具有促炎性和凋亡的双重特征,是机体内重要的天然免疫反应,在拮抗和清除病原感染以及内源危险信号中发挥重要作用,正逐步成为研究焦点。作为一种伴随炎症反应的细胞死亡方式,细胞焦亡的意义并不亚于凋亡,在某些病理过程中,细胞焦亡甚至比凋亡更具实际意义。目前,相对凋亡这种迄今为止研究最为深入的细胞死亡方式,我们对细胞焦亡的认识和研究才刚起步。因此,在其发生机制、调控机制及检测技术方面都需更深入地进行研究,为临床防治及新药开发提供新的思路。
[1] Cookson B T,Brennan M A.Pro-inflammatory programmed cell death[J].Trends Microbiol,2001,9(3):113-114.
[2] Labbe K,Saleh M.Cell death in the host response to infection[J].Nature,2008,15:1339-1349.
[3] Jesenberger V, Proeyk K J,Yuan J,et al.Salmonella-induced caspase-2 activation in macrophages:a novel mechanism in pathogen-mediated apoptosis[J].J Exp Med,2000,192(7):1035-1046.
[4] Bergsbaken T,Cookson B T.Macrophage activation redirectsYersinia-infected host cell death from apoptosis to caspase-1-dependent pyroptosis[J].PLoS Pathog,2007,3(11):e161.
[5] Fink S L,Cookson B T.Caspase-1-dependent pore formation during pyroptosis leads to osmotic lysis of infected host macrophages [J].Cell Microbiol,2006,8:1812-1825.
[6] Siegel R M,Caspases at the crossroads of immune-cell life and death[J].Nature Rev Immunol,2006,6:308-317.
[7] Fernandes-Alnemri T,Wu J,Yu J W,et al.The pyroptosome:a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation[J].Cell Death Differ,2007,14(9):1590-1604.
[8] Man S M,Kanneganti T D. Gasdermin D:the long-awaited executioner of pyroptosis[J].Cell Res,2015,25:1183-1184.
[9] Shi J,Zhao Y,Wang K,et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J].Nature,2015,526(7575):660-665.
[10] Xu H,Yang J,Gao W,et al.Innate immune sensing of bacterial modifications of Rho GTPases by the Pyrin inflammasome[J].Nature,2014,513(7517):237-241.
[11] Kayagaki N,Stowe I B, Lee B L,et al.Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling[J].Nature,2015,526(7575):666-671.
[12] Tamura M,Tanaka S,Fujii T,et al.Members of a novel gene family,Gsdm,are expressed exclusively in the epithelium of the skin and gastrointestinal tract in a highly tissue-specific manner[J].Genomics,2007,89(5):618-629.
[13] Sakamaki K, Satou Y.Caspases:evolutionary aspects of their functions in vertebrates[J].J Fish Biol,2009,74(4):727-753.
[14] Angosto D,López-Castejón G,López-Muoz A,et al.Evolution of inflammasome functions in vertebrates:Inflammasome and caspase-1 trigger fish macrophage cell death but are dispensable for the processing of IL-1β[J].Innate Immun,2012,18(6):815-824.
[15] Schmid-Burgk J L,Gaidt M M,Schmidt T,et al.Caspase-4 mediates non-canonical activaton of the NLRP3 inflammasome in human myeloid cells[J].Eur J Immunol,2015,45(10):2911-2917.
[16] Baker P J,Boucher D,Bierschenk D,et al.NLRP3 inflammasome activation downstream of cytoplasmic LPS recognition by both caspase-4 and caspase-5[J].Eur J Immunol,2015,45(10):2918-2926.
[17] Yang D,He Y,Munoz-Planillo R,et al.Caspase-11 requires the pannexin-1 channel and the purinergic P2X7 pore to mediate pyroptosis and endotoxic shock[J].Immunity,2015,43(5):923-932.
[18] Schroeder G N,Hilbi H. Molecular pathogenesis ofShigellaspp.:controlling host cell signaling,invasion,and death by type Ⅲ secretion[J].Clin Microbiol Rev,2008,21(1):134-156.
[19] Suzuki T,Franchi L,Toma C,et al.Differential regulation of caspase-1 activation,pyroptosis,and autophagy via Ipaf and ASC inShigella-infected macrophages[J].PLoS Pathog,2007,3 (8):e111.
[20] Senerovic L,Tsunoda S P,Goosmann C,et al.Spontaneous formation of IpaB ion channels in host cell membranes reveals howShigellainduces pyroptosis in macrophages[J].Cell Death Dis,2012,3:e384.
[21] Sharma D,Kanneganti T D.The cell biology of inflammasomes:mechanisms of inflammasome activation and regulation[J].Cell Biol,2016,213:617-629.
[22] Qu Y,Misaghi S,Newton K,et al.A NLRP3 recruitment by NLRC4 duringSalmonellainfection[J].Exp Med,2016,213:877-885.
[23] Franceschini A,Capece M,ChiozziP,et al.The P2X7 receptor directly interacts with the NLRP3 inflammasome scaffold protein[J].FASEB J,2015,29:2450-2461.
[24] Wynosky-Dolfi M A,Snyder A G,Philip N H, et al.Oxidative metabolism enablesSalmonellaevasion of the NLRP3 inflammasome[J].Exp Med,2014,211:653-668.
[25] Shi J,Zhao Y,Wang Y,et al.Inflammatory caspases are innate immune receptors for intracellular LPS[J].Nature,2014,514:187-192.
[26] Broz P,Ruby T,Belhocine K,et al.Caspase-11 increases susceptibility to Salmonella infection in the absence of caspase-1[J].Nature,2012,490:288-291.
[27] Ding J,Wang K,Liu W,et al.Pore-forming activity and structural autoinhibition of the gasdermin family[J].Nature,2016,535:111-116.
[28] Philip N H,Dillon C P,Snyder A G,et al.Caspase-8 mediates caspase-1 processing and innate immune defense in response to bacterial blockade of NF-κB and MAPK signaling[J].Proc Natl Acad Sci USA,2014,111:7385-7390.
[29] LaRock C N,Cookson B T.TheYersiniavirulence effector YopM binds caspase-1 to arrest inflammasome assembly and processing[J].Cell Host Microbe,2012,12:799-805.
Progress on Pyroptosis Induced by Pathogenic Bacteria
WEI Zhao-hui,LIU Chao-ying,GAO Fei-long,WANG Shi-yu,YAN Yu-lin,GAO Hong
(CollegeofAnimalScienceandTechnology,YunnanAgriculturalUniversity,Kunming,Yunnan,650201,China)
Pyroptosis is a new form of programmed cell death activated by inflammatory caspases.Inflammasome and caspase protein family play important roles in process of pyroptosis.Pyroptosis mainly depends on caspase-1 activation,and caspase-4,caspase-5,caspase-11 can also mediate it.Pathogenic bacteria stimulate intracellular pattern recognition receptor,and can promote the formation of inflammasome,canonical pyroptosis depending on caspase-1 and non-canonical pyroptosis depending on caspase-4,caspase-5,caspase-11 start to mediate pyroptosis.The morphologic characteristics and molecular mechanisms of pyroptosis are distinct from those of apoptosis or necrosis.This paper summarized the morphologic characteristics,molecular mechanisms of pyroptosis and pathogenic bacteria inducing pyroptosis in order to provide a theoretical basis for further understanding of pyroptosis.
pyroptosis; pathogenic bacteria; inflammasome; caspase
2017-01-18
国家自然科学基金项目(31260594,31660704);云南省高校科技创新团队支持计划资助项目(云教科[2011]14号);云南省现代农业生猪产业技术体系建设项目(云财农[2009]171号)
卫朝辉(1992-),男,安徽合肥人,硕士研究生,主要从事兽医病理学与食品安全评价研究。*通讯作者
S852.33
A
1007-5038(2017)07-0078-05

