rt-PA静脉溶栓脑梗死患者治疗前血清胆红素、尿酸水平与早期神经功能改善情况及预后的关系
李鹤婷,徐艳红,杨嘉君
(上海交通大学附属第六人民医院,上海200233)
·临床研究·
rt-PA静脉溶栓脑梗死患者治疗前血清胆红素、尿酸水平与早期神经功能改善情况及预后的关系
李鹤婷,徐艳红,杨嘉君
(上海交通大学附属第六人民医院,上海200233)
目的 分析行重组组织型纤溶酶原激活剂(rt-PA)静脉溶栓治疗的急性脑梗死患者治疗前血清胆红素、尿酸水平与早期神经功能改善情况及预后的关系。方法 rt-PA溶栓治疗的脑梗死患者115例,根据溶栓治疗5天后NIHSS评分较溶栓前的差值(ΔNIHSS)分为神经功能改善良好组(ΔNIHSS≥4分)32例和神经功能改善不良组(ΔNIHSS<4分)83例。收集两组患者基础资料及血糖、血脂、胆红素、尿酸检查资料。记录溶栓后发生不良事件的患者例数(不良事件包括溶栓后有渗血或患者最终死亡)。对所有可能影响入组患者早期神经功能改善的因素进行Logistic逐步回归分析,待校正血压、血脂、肌酐等脑梗死相关因素后,进一步分析血清胆红素、尿酸水平与早期神经功能改善情况的相关性。分析血清胆红素、尿酸水平与不良事件发生情况的相关性。结果 神经功能改善良好组血清胆红素、尿酸水平及溶栓前NIHSS评分均高于神经功能改善不良组,合并高血压比例、TG、LDL低于神经功能改善不良组(P均<0.05)。Logistic回归分析结果显示,血清胆红素(OR为1.108,95%CI为1.015~1.210)、血清尿酸(OR为1.010,95%CI为1.003~1.016)及溶栓前NIHSS评分(OR为1.183,95%CI为1.085~1.289)与脑梗死溶栓患者早期神经功能改善情况有关。115例患者中,发生不良事件者13例、未发生不良事件者102例,发生不良事件者血清尿酸水平高于未发生不良事件者(P=0.042),两组血清胆红素水平差异无统计学意义;Logistic回归分析结果显示,尿酸与溶栓患者不良事件的发生呈不显著负相关(OR=0.992,95%CI为0.984~1.000,P=0.047)。结论 rt-PA静脉溶栓治疗的脑梗死患者治疗前血清胆红素、尿酸水平与早期神经功能改善情况有关,高胆红素及高尿酸可能有利患者的神经功能恢复,且高胆红素及高尿酸并不明显增加不良预后的发生率。
脑梗死;重组组织型纤溶酶原激活剂;胆红素;尿酸;美国国立卫生研究院卒中量表;神经功能
脑梗死是脑血管病中最常见的类型。早发现、早诊断、早治疗对改善脑梗死患者的预后具有重要意义。溶栓治疗是急性脑梗死最重要的恢复血流的措施。超早期采用重组组织型纤溶酶原激活剂(rt-PA)静脉溶栓是目前改善急性缺血性脑卒中患者临床结局最有效的治疗手段。急性脑梗死患者溶栓治疗过程中脑组织易受缺血再灌注损伤,导致自由基生成过多或抗氧化能力不足,造成脑组织细胞损伤[1]。研究[2,3]表明胆红素及尿酸均具有较强的抗氧化作用,因此研究脑梗死溶栓患者血清胆红素、尿酸水平对溶栓效果及神经功能改善的影响具有重要意义。本研究分析了rt-PA静脉溶栓治疗的急性脑梗死患者治疗前血清胆红素、尿酸水平与早期神经功能改善情况及预后的关系,现报告如下。
1 资料与方法
1.1 研究对象及分组 选择2015年10月~2016年10月在上海市第六人民医院神经内科进行rt-PA静脉溶栓治疗的115例急性脑梗死患者纳入研究。排除既往有痛风病史者,有严重肝肾功能损害者,入院前服用利尿剂者,资料不完整者。所有患者均给予0.9 mg/kg的rt-PA进行静脉溶栓治疗,其中总量的10%于1 min内静推,剩余的90%于1 h内静滴。采用美国国立卫生研究院卒中量表(NIHSS评分)评定早期神经功能改善情况,根据溶栓治疗5天后NIHSS评分较溶栓前的差值(ΔNIHSS)分为神经功能改善良好组(ΔNIHSS≥4分)32例和神经功能改善不良组(ΔNIHSS<4分)83例。
1.2 资料收集方法 收集患者基础资料及生化指标检查资料,包括性别、年龄、高血压病史、糖尿病病史、房颤病史及溶栓前糖化血红蛋白(HbA1c)、胆红素、肌酐、尿酸、总胆固醇(TC)、总甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、同型半胱氨酸(Hcy)水平。记录溶栓后发生不良事件的患者例数,不良事件包括溶栓后有渗血或患者最终死亡。
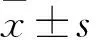
2 结果
神经功能改善良好组血清胆红素、尿酸水平分别为(14.98±6.58)、(399.72±84.73)mol/L,神经功能改善不良组分别为(12.10±4.59)、(343.02±76.46)mol/L,神经功能改善良好组血清胆红素、尿酸水平均高于改善不良组(P均<0.05)。神经功能改善良好组合并高血压比例(分别为81.25%、59.04%)、TG、LDL低于改善不良组,溶栓前NIHSS评分均高于改善不良组(P均<0.05)。见表1。以神经功能改善良好拟合回归模型,运用向前逐步回归分析方法对所有变量筛选后,将没有影响或影响较小的变量排除在模型之外,最终进入回归模型中的变量为胆红素、尿酸及溶栓前NIHSS评分,表明血清胆红素、尿酸水平与脑梗死溶栓患者早期神经功能改善情况有关。应用二分类Logistic回归分析校正混杂因素后,这种相关性仍然显著存在,并且呈明显的正相关。详见表2。

表1 不同神经功能改善情况患者溶栓前血脂指标、HbA1c、肌酐、Hcy、NIHSS比较
注:与神经功能改善不良组相比,*P<0.05。
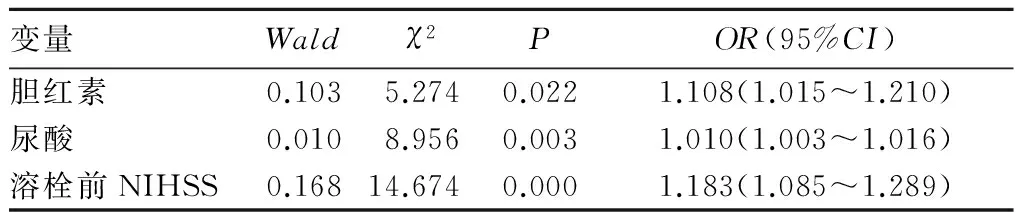
表2 溶栓后神经功能改善情况影响因素的Logistic回归分析结果
115例患者中,发生不良事件者13例、未发生不良事件者102例,两组血清胆红素水平分别为(12.97±5.29)、(12.39±5.98)mol/L,尿酸水平分别为(364.37±82.61)、(315.08±70.03)mol/L;发生不良事件者血清尿酸水平高于未发生不良事件者(P=0.042),两组血清胆红素水平差异无统计学意义。应用二分类Logistic回归分析,在校正混杂因素的影响后,尿酸与溶栓患者不良事件的发生呈不显著负相关(OR为0.992,95%CI为0.984~1.000,P=0.047)。
3 讨论
本研究分析血清胆红素、尿酸水平与脑梗死溶栓患者早期神经功能改善的关系,发现神经功能改善良好组血清胆红素、尿酸水平均高于改善不良组,胆红素、尿酸及溶栓前NIHSS评分是神经功能改善情况的影响因素,表明血清胆红素、尿酸水平与rt-PA溶栓患者早期神经功能改善情况有关,血清胆红素、尿酸水平增高可能有利于患者早期神经功能的改善。脑梗死溶栓患者的脑组织经历了缺血-再灌注的病理生理过程[4]。兴奋性毒性、钙超载、氧化应激、氮化应激、线粒体功能障碍、炎症反应等因素均参与再灌注损伤过程[5],而氧化应激是再灌注损伤研究的一大重点。急性脑梗死溶栓患者脑组织中黄嘌呤氧化酶生成增多、浸润的中性粒细胞耗氧量增多及儿茶酚胺自身氧化,均导致自由基生成增多;而线粒体功能障碍则导致神经细胞抗氧化能力减弱,引起机体内自由基生成与降解失衡,最终引发强烈的氧化应激反应,导致细胞损伤或死亡[6,7]。尿酸主要来源于内源性嘌呤的氧化分解,胆红素主要来自于衰老红细胞的降解,两者均具有较强的抗氧化应激作用,从而能在一定程度上缓解急性脑梗死患者溶栓后的再灌注损伤[8,9]。上述作用具体表现为:抗脂质过氧化作用,减少氧化性LDL的生成;对氧自由基、脂性自由基均具有较强的清除作用,保护脑组织免受氧化应激损伤;抑制血管平滑肌细胞增殖,有抗动脉粥样硬化作用[10]。脑梗死患者发生氧化应激时,黄嘌呤氧化酶生成增多,此过程使缺血脑组织产生大量自由基的同时也产生了大量尿酸,这种现象可能是机体为保护自身组织而产生的代偿作用。尿酸有抗氧化及抗自由基作用,协同外源性自由基清除剂及脑保护药物,共同减轻氧化应激损伤。另外,胆红素可增强体内其他抗氧化剂的功能,并改善胰岛素抵抗、增加神经细胞对葡萄糖的摄取率,从而达到脑保护作用[11]。因此高胆红素及高尿酸可能有利于脑梗死溶栓患者的神经功能恢复。
Kimm等[12]研究发现血清胆红素水平可评估缺血脑卒中的发生风险,随着胆红素水平增高,缺血性脑卒中的发病风险随之降低。Perlstein等[13]进行的一项横断面大样本回顾性研究显示,缺血性卒中患者血清胆红素与卒中不良事件发生率呈负相关,具体表现为血清胆红素水平每升高1.71 mol/L,卒中不良事件的发生率就降低10%。另有学者认为脑梗死患者血清胆红素水平与卒中严重程度呈正相关,与急性缺血性脑卒中患者短期临床预后则无明显相关性[14],这与本研究结果有所差别,可能与研究方法及研究人群的选择不同有关。Amaro等[15]纳入317例溶栓患者,研究内源性尿酸与脑梗死溶栓患者预后的相关性,结果表明高水平尿酸与溶栓患者的良好预后有关,该研究者深入研究后发现外源性尿酸的摄入并不能改善卒中患者的功能恢复情况,但降低了早期神经功能恶化的发生率,并且随着基线尿酸水平增高,患者不良事件的发生率并未增高[16]。Liu等[17]认为尿酸水平与脑梗死严重程度呈负相关,高尿酸与脑梗死溶栓患者的良好预后有关,并提出外源性尿酸可作为急性脑梗死患者静脉溶栓的辅助治疗方法。有学者[18,19]分析发现,高尿酸能控制脑梗死进展,改善脑梗死患者的功能恢复情况。本研究也发现,高胆红素、高尿酸对溶栓患者不良事件的发生没有明显影响,与上述研究结果基本一致。但由于本研究病例数较少,在分析血清胆红素、尿酸水平与早期神经功能恢复的相关性时可能会产生一定偏倚,尚需扩大入组病例数进一步深入研究。
综上所述,胆红素和尿酸可反映人体代谢状态,是人体内重要的抗氧化剂、自由基清除剂,在预测急性脑梗死溶栓患者的神经功能恢复情况方面有一定价值,且高胆红素、尿酸水平并不明显增加不良预后的发生率。利用尿酸协同静脉溶栓治疗急性脑梗死仍是研究热点,尚需在临床前期模型中进一步探索外源性尿酸辅助治疗的可行性。
[1] De Vries DK, Kortekaas KA, Tsikas D, et al. Oxidative damage in clinical ischemia/reperfusion injury: a reappraisal[J]. Antioxid Redox Signal, 2013,19(6):535-545.
[2] Amaro S, Llull L, Renu A, et al. Uric acid improves glucose-driven oxidative stress in human ischemic stroke[J]. Ann Neurol, 2015,77(5):775-783.
[3] Weinberger B, Archer FE, Kathiravan S, et al. Effects of bilirubin on neutrophil responses in newborn infants[J]. Neonatology, 2013, 103(2):105-111.
[4] Al Dera H. Neuroprotective effect of resveratrol against late cerebral ischemia reperfusion induced oxidative stress damage involves upregulation of osteopontin and inhibition of interleukin-1beta[J]. J Physiol Pharmacol, 2017,68(1):47-56.
[5] Tuttolomondo A, Di Raimondo D, Pecoraro R, et al. Inflammation in ischemic stroke subtypes[J]. Curr Pharm Des, 2012,18(28):4289-4310.
[6] Chen CY, Chen CL, Yu CC, et al. Association of inflammation and oxidative stress with obstructive sleep apnea in ischemic stroke patients[J]. Sleep Med, 2015,16(1):113-118.
[7] Chamorro A, Dirnagl U, Urra X, et al. Neuroprotection in acute stroke: targeting excitotoxicity, oxidative and nitrosative stress, and inflammation[J]. Lancet Neurol, 2016,15(8):869-881.
[8] Ben-Amotz R, Bonagura J, Velayutham M, et al. Intraperitoneal bilirubin administration decreases infarct area in a rat coronary ischemia/reperfusion model[J]. Front Physiol, 2014,18(5):53.
[9] Ekaidem IS, Usoh IF, Akpanabiatu MI, et al. Urate synthesis and oxidative atress phenytoin hepatotoxicity: the role of antioxidant vitamins[J]. Pak J Biol Sci, 2014,17(11):1179-1184.
[10] 张仁伟,刘熠敏.胆红素与脑血管疾病的关系研究进展[J].中华实用诊断与治疗杂志,2016,30(3):209-211.
[11] Dong H, Huang H, Yun X, et al. Bilirubin increases insulin sensitivity in leptin-receptor deficient and diet-induced obese mice through suppression of ER stress and chronic inflammation[J]. Endocrinology, 2014,155(3):818-828.
[12] Kimm H, Yun JE, Jo J, et al. Low serum bilirubin level as an independent predictor of stroke incidence: a prospective study in Korean men and women[J]. Stroke, 2009,40(11):3422-3427.
[13] Perlstein TS, Pande RL, Creager MA, et al. Serum total bilirubin level, prevalent stroke, and stroke outcomes: NHANES1999-2004 [J]. Am J Med, 2008,121(9):781-788.
[14] Xu T, Zhang J, Xu T, et al. Association of serum bilirubin with stroke severity and clinical outcomes[J]. Can J NeurolSci, 2013,40(1):80-84.
[15] Amaro S, Urra X, Gomez-Choco M, et al. Uric Acid Levels Are Relevant in Patients With Stroke Treated With Thrombolysis[J]. Stroke, 2011,42(1 Suppl):S28-S32.
[16] Chamorro A, Amaro S, Castellanos M, et al. Safety and efficacy of uric acid in patients with acute stroke (URIO-ICTUS):a random-ised,double-blind phase 2b/3 trial[J]. Lancet Neurol, 2014,13(5):453-460.
[17] Liu X, Liu M, Chen M, et al. Serum uric acid is neuroprotective in chinese patients with acute ischemic stroke treated with intravenous recombinant tissue plasminogen activator[J]. J Stroke Cerebrovasc Dis, 2015,24(5):1080-1086.
[18] Llull L, Laredo C, Renu A, et al. Uric acid therapy improves clinical outcome in women with acute ischemic stroke[J]. Stroke, 2015,46(8): 2162-2167.
[19] Chen LH, Zhong CK, Xu T, et al. Sex-specific association between uric acid and outcomes after acute ischemic stroke: a prospective study from CATIS trial[J]. Sci Rep, 2016,6:38351.
上海市科委生物医药重大项目(14401970303)。
杨嘉君(E-mail: sd_yangjj@sumhs.edu.cn)
10.3969/j.issn.1002-266X.2017.27.012
R743.3
B
1002-266X(2017)27-0043-03
2017-04-02)

