人参皂苷Rg1灌胃对大鼠特发性肺间质纤维化的治疗作用及其机制探讨
黄锋,孙娟,杨智华,贾岩龙,邵焕霞,刘会茹,詹合琴
(1新乡医学院,河南新乡453003;2新乡医学院第一附属医院)
人参皂苷Rg1灌胃对大鼠特发性肺间质纤维化的治疗作用及其机制探讨
黄锋1,孙娟1,杨智华2,贾岩龙1,邵焕霞1,刘会茹1,詹合琴1
(1新乡医学院,河南新乡453003;2新乡医学院第一附属医院)
目的 观察人参皂苷Rg1灌胃对大鼠特发性肺间质纤维化(IPF)的治疗作用,并探讨其机制。方法 雄性SD大鼠138只,分为假手术组、模型组、阳性对照组、实验1组、实验2组和实验3组。假手术组不做IPF模型;模型组、阳性对照组、实验1组、实验2组和实验3组用博来霉素气管内注射诱导IPF模型,于造模当天,阳性对照对照组给予5 mg/kg的醋酸泼尼松灌胃,实验1、2、3组18、36、72 mg/kg的人参皂苷Rg1灌胃,模型组给予等体积生理盐水灌胃,给药1次/d。于给药第7、28天分别处死各组小鼠,采用肺湿重法测算肺系数,采用ELISA法检测肺组织中的α-肌动蛋白(α-SMA),采用qPCR法检测肺组织中的血小板源性生长因子-A(PDGF-A) mRNA。结果 给药第7、28天时,模型组肺系数均高于其余各组(P均<0.01),模型组、阳性对照组、实验1组的肺系数均高于假手术组(P均<0.05),实验2、3组肺系数低于阳性对照组(P均<0.05)。给药第28天时,阳性对照组肺系数低于模型组,但高于假手术组(P均<0.05)。模型组肺组织α-SMA水平高于假手术组(P<0.05),实验1、2、3组及阳性对照组α-SMA水平低于模型组(P均<0.05)。给药第7、28天时,模型组肺组织中PDGF-A mRNA相对表达量均高于其余各组(P均<0.05)。给药第28天时,阳性对照组肺组织中PDGF-A mRNA相对表达量低于模型组,实验1、2、3组肺组织中PDGF-A mRNA相对表达量低于阳性对照组(P均<0.05)。结论 人参皂苷Rg1灌胃可降低IPF大鼠的肺系数及肺组织中α-SMA水平;人参皂苷Rg1有一定的抗肺纤维化作用,其机制可能与调节PDGF-A表达有关。
肺纤维化;人参皂苷Rg1;肺系数;α-肌动蛋白;血小板源性生长因子-A
近年来,特发性肺间质纤维化(IPF)的发病率呈逐年上升趋势,IPF可导致呼吸衰竭和死亡[1,2],严重危害人类健康。IPF主要特点是异常的成纤维细胞数量增加和细胞外基质(ECM)的过度积累[3]。IPF单用抗生素或激素类药物进行抗炎治疗效果差,因此,目前对于IPF的处理措施已由单纯的抗炎治疗转向抗纤维化治疗[4]。IPF一方面可导致肺功能严重受损,另一方面可使肺系数、肺纤维化标志物α-肌动蛋白(α-SMA)和调节细胞外基质含量的血小板源性生长因子-A(PDGF-A)表达异常增加[5]。有动物实验表明,三七总皂苷具有显著的抗肺纤维化作用[6]。人参皂苷Rg1是三七总皂苷的主要活性成分[7],但人参皂苷Rg1对IPF的治疗作用及其机制尚不明确。2013年4月~2015年4月,我们采用博来霉素诱导肺纤维化大鼠模型,观察人参皂苷Rg1对肺纤维化大鼠肺系数及肺组织中α-SMA水平、PDGF-A mRNA表达的影响。
1 材料与方法
1.1 实验动物与主要材料 清洁级雄性SD大鼠138只,体质量210~240 g,购于郑州大学动物实验中心(动物合格证号0005496)。博莱霉素(日本化药株式会社),人参皂苷Rg1(四川成都瑞芬思生物科技有限公司),PDGF-A和内参GAPDH(郑州乐睿生物科技有限公司)。α-SMA试剂盒(南京建成生物工程研究所),TRIzol试剂(美国Invitrogen公司),mRNA反转录试剂盒和实时荧光定量PCR试剂盒(南京Vazyme科技公司)。Nanodrop-2000紫外/可见光分光光度计(美国赛默飞世尔公司),实时荧光定量PCR仪(美国ABI公司)。
1.2 IPF模型制作及人参皂苷Rg1用法 选取120只大鼠制作IPF模型,剩余18只为假手术组。IPF模型制备方法如下:向大鼠腹腔内注射10%的水合氯醛300 mg/kg麻醉,仰卧位固定;切开颈部,迅速分离气管,快速注入博来霉素5 mg/kg,将大鼠直立并旋转数次,使药物快速、均匀地分散到肺组织;缝合手术创口,回笼饲养观察;参考文献[8]方法以肺纤维化评分和肺组织中α-SMA水平判定模型制作是否成功。假手术组除在气管内注入生理盐水外,其余操作与制作模型的动物相同。将模型制作成功的动物120只随机分为模型组、阳性对照组、实验1组、实验2组和实验3组,每组各24只。于造模当天开始灌胃给药,1次/d。阳性对照组给予醋酸泼尼松5 mg/kg;实验1、2、3组分别给予18、36、72 mg/kg的人参皂苷Rg1;假手术组和模型组给予等量生理盐水5 mL/kg。给药第7、28天时处死假手术组中的9只大鼠,其余各组处死10只,用于肺系数、α-SMA和PDGF-A mRNA测定。
1.3 肺系数测算 动物称重后处死,取肺脏反复冲洗至组织发白,称取肺湿重,用公式计算肺系数:肺系数=肺湿重(mg)/体质量(g)×100。
1.4 肺组织中α-SMA检测 采用ELISA法。给药第28天时处死各组大鼠,取右下叶肺组织0.2 g,加入1.8 mL的冰盐水,离心取上清液,4 ℃保存。加入考马斯亮蓝对各样品进行蛋白定量。根据标准蛋白的浓度和吸光度值(OD值)算出α-SMA的回归方程。用MulTISKAN酶标仪在450 nm波长处测定每个样本α-SMA的有色试样OD值,然后将样品OD值代入方程计算样品浓度,再乘稀释倍数,即可得出每个样品α-SMA水平。
1.5 肺组织中PDGF-A mRNA检测 采用实时荧光定量PCR法检测。取大鼠左肺组织100 mg在液氮中磨碎,用TRIzol试剂提取总RNA,逆转录合成cDNA。取cDNA 1 μL用AceQTMqPCR SYBR®Green Master Mix试剂盒进行PCR反应。PCR条件为95 ℃ 10 min,95 ℃ 10 s,60 ℃ 20 s,72 ℃ 15 s,共40个循环。以2-ΔΔCt表示目的基因的相对表达量。
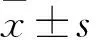
2 结果
2.1 各组大鼠肺系数比较 给药第7、28天模型组肺系数均高于其余各组(P均<0.01),模型组、阳性对照组、实验1组的肺系数均高于假手术组(P均<0.05),实验2、3组肺系数低于阳性对照组(P均<0.05)。给药第28天阳性对照组肺系数低于模型组,但高于假手术组(P均<0.05)。见表1。

表1 各组大鼠肺系数比较
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.01;与阳性对照组相比,△P<0.05。
2.2 各组大鼠肺组织α-SMA水平比较 给药第28天时,假手术组、模型组、阳性对照组、实验1组、实验2组、实验3组肺组织中α-SMA水平分别为(0.98±0.19)、(1.25±0.13)、(1.00±0.16)、(1.04±0.12)、(1.01±0.13)、(0.95±0.20)pg/mL。模型肺组织α-SMA水平高于假手术组(P<0.05),实验1、2、3组及阳性对照组α-SMA水平低于模型组(P均<0.05),实验1、2、3组肺组织中α-SMA水平与阳性对照组差异无统计学意义(P均>0.05)。
2.3 各组大鼠肺组织中PDGF-A mRNA表达比较 给药第7、28天时,模型组肺组织中PDGF-A mRNA相对表达量均高于其余各组(P均<0.05)。给药第28天时,阳性对照组肺组织中PDGF-A mRNA相对表达量低于模型组,实验1、2、3组肺组织中PDGF-A mRNA相对表达量低于阳性对照组(P均<0.05)。详见表2。

表2 各组大鼠肺组织中PDGF-A mRNA相对表达量比较
注:与假手术组相比,*P<0.05;与模型组相比,#P<0.05;与阳性对照组相比,△P<0.05。
3 讨论
博来霉素气管内给药诱导的肺纤维化动物模型被广泛用于IPF的发病机制研究和抗IPF药物的筛选,具有操作简单、方法可靠和实验周期短等优点,为目前公认的经典造模方法[9]。在本实验中我们制作该模型并分别于给药第7、28天进行观察,结果显示,给药第7、28天时,模型组肺系数均高于其余各组,造模7天肺系数增高往往反映肺泡炎的发生,而造模28天的肺系数增高与动物肺组织中的α-SMA水平增高往往预示着肺纤维化的发生,这与相关研究结果一致[10,11]。
肺系数和α-SMA水平是反映肺纤维化的重要指标,两者与肺纤维化的程度有着密切的联系。许多研究发现,肺纤维化时动物的肺系数与α-SMA水平均增高[12]。α-SMA为肺纤维化的标志物之一,其表达增高预示着肌成纤维母细胞形成,从而发生Ⅰ型胶原沉积,导致肺纤维化[13]。本研究结果显示,给药第7、28天时,模型组、阳性对照组、实验1组的肺系数均高于假手术组,实验2、3组肺系数低于阳性对照组;给药第28天时,模型组肺组织α-SMA水平高于假手术组,实验1、2、3组及阳性对照组α-SMA水平低于模型组。上述结果提示人参皂苷Rg1可减轻肺纤维化程度,高剂量组效果更为明显,该药可能通过降低α-SMA水平、阻抑细胞外基质合成,纠正大鼠的肺纤维化状态。目前已有研究表明在TGF-β1诱导的纤维母细胞分化为成肌纤维细胞的过程(IPF关键病理过程)中,可能以NOX4作为媒介促进α-SMA和骨胶原Ⅰ的表达,且能促进PDGF诱导的纤维母细胞的迁移[14]。
由上可见,PDGF在肺纤维化发生发展过程中也发挥了重要作用。在肺纤维化病变过程中,纤维病灶内肺泡巨噬细胞等产生的PDGF-A可穿越受损伤的上皮细胞进入肺泡间质;来自肺泡腔与肺泡间隔内的巨噬细胞产生的PDGF-A可共同趋化间质细胞,促进其增殖、分化[13]。国内外研究均发现肺间质纤维化的形成与氧化应激所致的炎症细胞浸润、细胞因子水平失衡有关,其中PDGF是重要的致纤维化生长因子,在纤维化早期分泌增多、表达增强[15],启动肺纤维化过程,形成不可逆性的肺损伤。
本研究结果显示,给药第7、28天时,模型组肺组织中PDGF-A mRNA相对表达量均高于其余各组;给药第28天时,阳性对照组肺组织中PDGF-A mRNA相对表达量低于模型组,实验1、2、3组肺组织中PDGF-A mRNA相对表达量低于阳性对照组。上述结果提示人参皂苷Rg1作用后,肺纤维化大鼠肺组织PDGF-A mRNA表达减少,可能会使纤维化细胞的侵袭能力降低或纤维化细胞凋亡,从而产生治疗肺纤维化的作用[16]。然而,人参皂苷Rg1调节α-SMA水平和PDGF-A mRNA表达的机制尚需进一步研究。
[1] Lee AS, Mira-Avendano I, Ryu JH, et al. The burden of idiopathic pulmonary fibrosis: an unmet public health need[J]. Respir Med, 2014,108(7):955-967.
[2] Raghu G, Collard HR, Egan JJ, et al. An official ATS/ERS/JRS/ALAT statement: Idiopathic pulmonary fibrosis: Evidence-based guidelines for diagnosis and management[J]. Am J Respir Crit Care Med, 2011, 183:788-824.
[3] Li L, Li D, Xu L, et al. Total extract of Yupingfeng attenuates bleomycin-induced pulmonary Fibrosis in rats[J]. Phytomedicine, 2015,22(1):111-119.
[4] Nair GB, Matela A, Kurbanov D, et al. Newer developments in idiopathic pulmonary fibrosis in the era of anti-fibrotic medications[J]. Expert Rev Respir Med, 2016,10(6):699-711.
[5] Asano S, Ito S, Takahashi K, et al. Matrix stiffness regulates migration of human lung fibroblasts[J]. Physiol Rep, 2017,5(9):1-11.
[6] 吴娟娟,凌春华,何焕荣,等.复方三七饮对博莱霉素致大鼠肺纤维化TGF-β1/Smads信号通路的影响[J].细胞与分子免疫学杂志,2013,29(9):927-930.
[7] Palaniyandi SA, Suh JW, Yang SH, et al. Preparation of ginseng extract with enhanced levels of Ginsenosides Rg1 and Rb1using high hydrostatic pressure and polysaccharide hydrolases[J]. Pharmacogn Mag, 2017,13(Suppl 1):142-147.
[8] Zhan H, Huang F, Ma W, et al. Protective effect of ginsenoside Rg1 on bleomycin-induced pulmonary fibrosis in rats: involvement of caveolin-1 and TGF-β1signal pathway[J]. Biol Pharm Bull, 2016,39(8):1284-1292.
[9] 吴树才,杨永辉,李辉,等.人胎盘间充质干细胞对小鼠肺纤维化的影响及机制[J].山东医药,2016,56(12):13-15.
[10] Zhai HQ, Hhang JR, Gao MC, et al. Comparative study between Ephedra sinica Stapf and Fructus Schisandrae Chinensis on ET-1 and 6-keto-prostaglandin F1α in rats with idiopathic pulmonary fibrosis[J]. Genet Mol Res, 2014,13(2):3761-3771.
[11] Sabry MM, Elkalawy SA, Abo-Elnour RK, et al. Histolgical and immuno- histochemical study on the effect of stem cell therapy on bleomycin induced pulmonary fibrosis in albino rat[J]. Int J Stem Cells, 2014,7(1):33-42.
[12] Lucattelli M, Fineschi S, Selvi E, et al. Ajulemic acid exerts potent anti-fibrotic effect during the fibrogenic phase of bleomycin lung[J]. Respir Res, 2016,17(1):49.
[13] 宁康,王超,董延春,等.补肾宣肺活血方对肺纤维化大鼠肺组织TGF-β、Smad3蛋白和PDGF表达的影响[J].山东医药,2011,51(29):30-31.
[14] Amara N, Goven D, Prost F, et al. NOX4/NADPH oxidase expression is increased in pulmonary fibroblasts from patients with idiopathic pulmonary fibrosis and mediates TGF beta1-induced fibroblast differentiation into myofibroblasts[J]. Thorax, 2010,65(8):733-738.
[15] Zhu X, Fang X, Chen W, et al. Lower expression of platelet derived growth factor is associated with better overall survival rate of patients with idiopathic nonspecific interstitial pneumonia[J]. J Thorac Dis, 2017,9(3):519-528.
[16] Kusko RL, Brothers JF, Tedrow J, et al. Integrated genomics reveals convergent transcriptomic networks underlying chronic obstructive pulmonary disease and idiopathic pulmonary fibrosis[J]. Am J Respir Crit Care Med, 2016,194(8):948-960.
新乡市重点科技攻关项目(S10008)。
詹合琴(E-mail: xiaofei1@126.com)
10.3969/j.issn.1002-266X.2017.27.011
R563
A
1002-266X(2017)27-0040-03
2016-10-24)

