516例缺血性小卒中患者SSS-TOAST分型结果及颅内梗死灶分析
游文霞,钟剑萍,欧阳基鹏,黎宏庄,杨少民,胡秋根
(南方医科大学顺德医院,佛山市顺德区第一人民医院,广东佛山528300)
516例缺血性小卒中患者SSS-TOAST分型结果及颅内梗死灶分析
游文霞,钟剑萍,欧阳基鹏,黎宏庄,杨少民,胡秋根
(南方医科大学顺德医院,佛山市顺德区第一人民医院,广东佛山528300)
目的 观察516例缺血性小卒中患者的SSS-TOAST分型情况,并分析颅内梗死灶的特点。方法 缺血性小卒中患者516例,进行SSS-TOAST分型,观察颅内梗死灶情况。收集患者年龄、Essen卒中风险分层量表(ESRS)评分、90 d改良Rankin量表(mRS)评分、头颅核磁共振成像(MRI)+磁共振血管成像(MRA)+弥散加权成像(DWI)、颈部血管检查等资料,并在不同SSS-TOAST分型间进行比较。结果 516例缺血性小卒中患者SSS- TOAST分型为大动脉粥样硬化型174例(33.72%)、心源性脑栓塞型39例(7.56%)、小动脉闭塞型229例(44.38%)、其他原因11例(2.13%)、原因不明63例(12.21%),主要类型为大动脉粥样硬化型和小动脉闭塞型,其中大动脉粥样硬化型患者大动脉狭窄、90 d mRS评分预后不良发生率高于小动脉闭塞型(P均<0.05)。357例(69.19%)颅内梗死灶为孤立性病灶,其中231例(64.71%)病灶在皮层下、深部白质、基底节等常见位置;159例(30.81%)为多发病灶。282例(54.65%)患者颅内梗死灶直径(或之和)<20 mm,234例(45.35%)直径(或之和)≥20 mm。本组缺血性小卒中患者颅内梗死灶多为孤立性病灶,多数病灶大小<20 mm,孤立性病灶多位于常见位置(P均<0.05)。结论 缺血性小卒中患者SSS-TOAST分型多为大动脉粥样硬化型和小动脉闭塞型,前者合并大动脉狭窄和预后不良比例更高;缺血性小卒中患者颅内梗死灶多为常见位置的孤立性病灶,但部分患者颅内梗死灶直径≥20 mm,多发梗死灶者也占一定比例。
脑梗死;缺血性小卒中;大动脉粥样硬化;小动脉闭塞
脑血管病发病率、致残率、病死率均较高,我国脑卒中患者近千万。但统计发现,小卒中患者的例数为临床脑卒中的数倍。小卒中患者在病情达到最高峰时仅表现为轻微、稳定的神经功能损害,持续时间略长,随访时大多可恢复。小卒中的定义亦经历了较长时间的变迁,2010年Fischer等[1]提出了目前较公认的小卒中诊断标准,即基线美国国立卫生院卒中量表(NIHSS)评分中,任何一项≤1分,其中意识评分为0分;基线NIHSS评分≤3分。小卒中因长期无临床症状或临床症状轻,易被忽略而延误治疗,复发率及致残率较高。本研究对516例急性缺血性小卒中患者进行SSS-TOAST分型,并分析颅内梗死灶的特点,以期进一步增强对缺血性小卒中的认识。
1 资料与方法
1.1 研究对象 选择2013年1月~2015年1月在南方医科大学顺德医院(佛山市顺德区第一人民医院)神经内科住院的急性缺血性小卒中患者进入研究。纳入标准:①符合缺血性小卒中的诊断标准[1];②发病7 d内就诊;③年龄≥18岁;④本次起病前改良Rankin量表(mRS)评分≤2分。排除标准:①患有其他已知的严重威胁生命的疾病,如晚期恶性肿瘤;②合并脑出血。共纳入患者516例,男320例、女196例,年龄(62.8±11.8)岁,合并高血压394例、糖尿病153例、高脂血症357例、外周动脉疾病26例、有心脏病史128例、吸烟187例、重度饮酒96例、既往短暂性脑缺血发作(TIA)或缺血性卒中史71例。所有患者均完成头部核磁共振成像(MRI)+磁共振血管成像(MRA)+弥散加权像(DWI)检查,52例(10.08%)行主动脉弓、颈部血管、颅内血管的数字减影血管造影(DSA)检查,18例(3.49%)进行颈部血管计算机断层扫描血管造影(CTA)检查,87例(16.86%)完成颈部对比增强MRA(CEMRA)检查,427例(82.75%)完成颈部血管彩超检查(血管检查的参考价值:DSA>CTA>MRA>血管彩超)。本研究经医院伦理委员会同意,患者或监护人均签署知情同意书。
1.2 SSS-TOAST分型方法
1.2.1 大动脉粥样硬化型 ①肯定:责任动脉有粥样硬化导致阻塞或狭窄程度≥50%管径,责任血管外的区域无急性梗死。②极可能:过去1个月内有发作1次或1次以上相同责任血管的短暂性单眼黑蒙、TIA或中风;或责任动脉(椎动脉除外)有粥样硬化导致几近完全阻塞或非慢性完全阻塞;或在受影响的血管支配区域内有分水岭梗死、多发性或不同时间的梗死。③可能:责任动脉有粥样硬化狭窄程度<50%但有发现突出的斑块,同时过去有发作2次或2次以上相同责任血管的短暂性单眼黑蒙、TIA或中风,其中至少1次发生在过去1个月内;或临床有大动脉粥样硬化的证据,但其他病因评估未完善。
1.2.2 心源性栓塞型 主动脉弓粥样硬化斑块增生列于该分型。①肯定:有高危险性心源性脑栓塞的证据存在。②极可能:有系统性栓塞的证据存在;或有急性多发性脑梗死同时发生在左右前循环或前后循环,而责任血管没有发现完全阻塞或近完全阻塞;排除其他可能造成多发性脑梗死的原因,如血管炎、血液病或血流动力学不稳。③可能:有低危险性或不确定危险性脑栓塞的证据存在;或临床有主动脉弓及心源性脑栓塞的证据,但其他病因的评估未完善。
1.2.3 小动脉闭塞型 ①肯定:影像学检查显示有一个与临床相符的病灶,直径小于20 mm,位于颅底或脑干的穿支动脉,穿支动脉源头的载体动脉未发现其他病理变化,如局部粥样硬化、动脉夹层、血管炎或血管痉挛等。②极可能:过去1周有发生相同症状的TIA,症状符合腔隙性综合征。③可能:临床符合典型腔隙综合征,但影像学检查未发现相符合的腔隙梗死;临床有小动脉阻塞的证据,但其他病因评估未完善。
1.2.4 其他病因型 ①肯定:确认存在一个病因影响脑部血管造成相应的临床症状。②极可能:确认存在一个疾病与脑梗死发生的关系明确且密切,如动脉夹层、心脏血管手术或心血管介入手术。③可能:临床有其他病因的证据,但前述所列病因的评估未完善。
1.2.5 原因不明 ①无确定病因,如隐源性脑栓塞和其他隐源性脑栓塞,或未完善评估者。②难分类病因,存在两个或两个以上病因证据符合“极可能”的诊断标准,或均不符合“极可能”的诊断标准。
1.3 颅内梗死灶检测及判定 头颅MRI-DWI序列上可见高信号、表观扩散系数(ADC)图上可见低信号、液体衰减反转恢复序列(FLAIR)上可见高信号考虑颅内急性梗死灶,纳入统计分析。病灶数目:主要分为孤立性病灶(单发的、连续的梗死灶)和多发性病灶(多发的、不相连的梗死灶)。病灶大小:因多数病灶形态不规则,故取用最大直径处作为病灶大小;多发性病灶时计算各病灶直径总和。病灶部位:孤立性病灶分为孤立性皮层、孤立性皮层下、深部白质、基底节区、脑干、小脑;多发病灶为颅内任意部位≥2个病灶。皮层下定义为各个脑叶皮层下部分,不包括半卵圆中心和放射冠;深部白质定义为半卵圆中心和放射冠[2]。
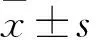
2 结果
2.1 SSS-TOAST分型情况 根据SSS-TOAST分型,516例缺血性小卒中患者中,大动脉粥样硬化型174例(33.72%);心源性脑栓塞型39例(7.56%);小动脉闭塞型229例(44.38%);其他原因11例(2.13%),其中神经梅毒2例、颈内动脉夹层3例、大脑中动脉瘤1例、重度贫血2例、烟雾病1例、鼻咽癌放疗致颈部血管损伤2例;原因不明63例(12.21%),其中无确定病因20例,病因难以分类的有43例,主要为大动脉粥样硬化型与心源性栓塞型难以区分。516例患者的主要分型为大动脉粥样硬化型和小动脉闭塞型。大动脉粥样硬化型患者年龄(63.2±10.8)岁、中位ESRS评分为2分、大动脉狭窄174例(100%)、90 d mRS评分预后不良43例(24.71%),小动脉闭塞型患者分别为(62.8±11.7)岁、2分、70例(30.57%)和30例(13.10%),大动脉粥样硬化型患者大动脉狭窄、90 d mRS评分预后不良发生率高于小动脉闭塞型(P均<0.05)。小动脉闭塞分型中70例大动脉狭窄者为非责任血管狭窄。典型的大动脉粥样硬化型和小动脉闭塞型MRI表现见图1、2。
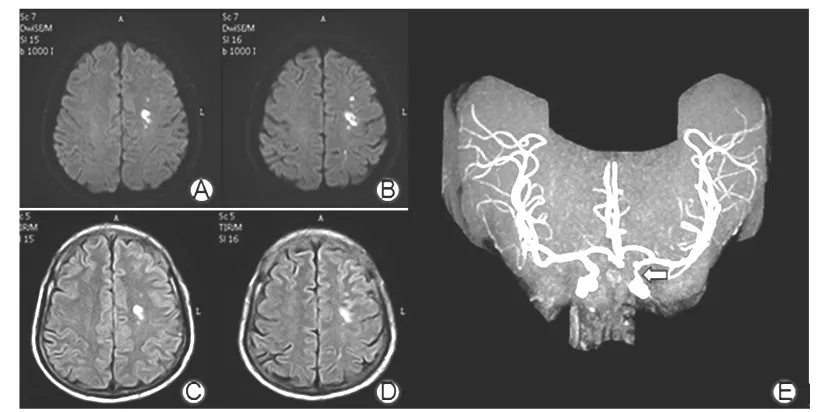
注:A、B为DWI序列,可见左侧顶叶散在多发斑片状高信号病灶;C、D为相应Flair序列,可见高信号改变;E显示左侧颈内动脉终末段明显狭窄。
图1 大动脉粥样硬化型患者典型MRI表现
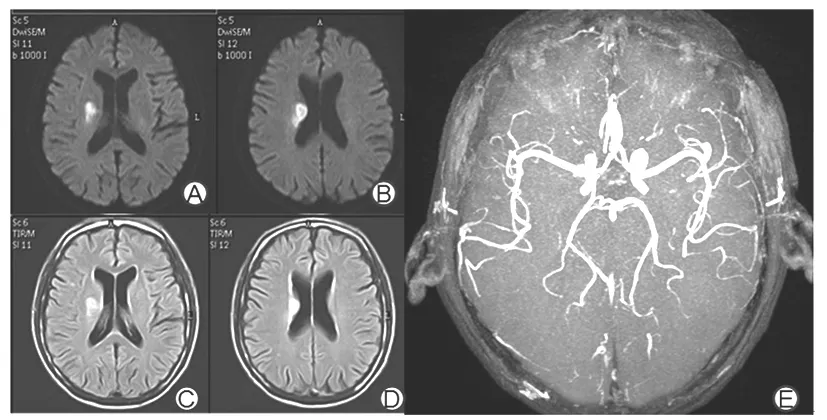
注:A、B为DWI序列,可见右侧放射冠孤立性条片状高信号病灶;C、D为相应Flair序列,可见高信号改变;E显示脑动脉硬化改变,但无大动脉明显狭窄。
图2 小动脉闭塞型患者典型MRI表现
2.2 颅内梗死灶特点 357例(69.19%)颅内梗死灶为孤立性病灶,其中231例(64.71%)病灶在皮层下、深部白质、基底节等常见位置;159例(30.81%)为多发病灶。282例(54.65%)患者颅内梗死灶直径(或之和)<20 mm,234例(45.35%)直径(或之和)≥20 mm。本组缺血性小卒中患者颅内梗死灶多为孤立性病灶,多数病灶大小<20 mm,孤立性病灶多位于常见位置(P均<0.05)。
3 讨论
小卒中及TIA曾因其临床症状轻,神经功能缺损不明显,被认为属于非致残性脑血管事件,容易被忽略。虽然2008年世界卒中日以“小卒中,大问题”作为主题,使小卒中得到了前所未有的重视,但研究显示小卒中或TIA仍然存在不同程度的院前延误[3,4]。同时,多项研究发现TIA、小卒中后7 d内复发风险为8%~12%,尤其是发病48 h以内[5~7]。目前小卒中患者约为临床脑卒中患者总数的5倍[8],需要得到及时、正确的评估和针对性治疗。目前用于评价TIA和卒中风险的评分量表主要包括ABCD(A指年龄、B指血压、C指临床特征、D指持续时间)、ABCD2、ESRS、卒中预测工具(SPI)-Ⅰ、SPI-Ⅱ、Hankey模型等,但Wijnhoud等[9]在TIA和小卒中患者的独立队列中对7种卒中预测模型进行有效性验证,结果显示目前常用的7种卒中风险预测模型对TIA或小卒中患者远期卒中预测的可靠性有限。Chandratheva等[10]的研究结果亦表明ESRS预测小卒中的卒中复发效果不理想。为了能够更准确地了解小卒中患者的病情、进行针对性治疗,我们对缺血性小卒中患者进行了SSS-TOAST病因分型。
在我们统计的516例缺血性小卒中患者中,大动脉粥样硬化型174例(33.72%),心源性脑栓塞型39例(7.56%),小动脉闭塞型229例(44.38%),其他原因11例(2.13%),原因不明63例(12.21%)。有学者[11]对中国国家卒中登记研究(CNSR)的4 584例小卒中患者进行TOAST分型,结果显示其中大动脉粥样硬化型1 951例(42.1%),小血管闭塞型1 071例(23.6%),心源性脑栓塞型115例(2.5%),其他原因163例(3.6%),原因不明1 284例(28.2%)。国外学者[12]对文献[13]的数据进行病因分类系统(CCS)-TOAST分型,结果显示大动脉粥样硬化型51例(10.87%),心源性脑栓塞型109例(23.24%),小动脉闭塞型31例(6.61%),其他原因6例(1.28%),原因不明272例(58%)。我们对比国内外数据[14],发现西方人群较中国人群的数据差异明显。国外心源性脑栓塞型比例较高,在我们及Pan等[11]的研究中,该分型所占比例均小,查阅Wang等[15]的数据,在危险因素统计中,心源性因素(冠心病、充血性心衰、房颤、心脏瓣膜病等)所占比例亦只在10%以内。同时,国外不明原因型比例亦较高。考虑上述结果差异的原因可能有以下几方面:①资料收集方面,本研究中患者针对心脏和主动脉弓的检查并不十分全面,完成主动脉弓扫描的比例较低,这可能是导致心源性脑栓塞型偏少的原因之一;且本研究颈动脉及颅内血管检查主要是采取MRA及血管超声检查,准确率不如CTA高,这可能是大动脉粥样硬化型比例相对高的原因之一。②我国是高血压、糖尿病大国,且心脑血管疾病一二级预防效果不如西方国家,考虑与小动脉闭塞型、大动脉粥样硬化型比例增高有关。③人种的差异导致缺血性小卒中发病机制不同。④数据、样本量方面,目前检索到关于小卒中病因分型的研究不多,需要更多的数据进行分析。
通过本研究数据可以看出,真正由于小动脉闭塞引发的卒中所占比例不到一半,大动脉粥样硬化型患者比例高达33.72%。通过统计分析发现,大动脉粥样硬化型和小动脉闭塞型患者发病年龄、ESRS评分差异无统计学意义,考虑小动脉闭塞组与大动脉粥样硬化组的脑卒中危险因素基本相同,主要是高龄、高血压、糖尿病、吸烟、既往心脑血管疾病史等,但是小动脉闭塞型患者大动脉狭窄、90 d mRS评分预后不良发生率较大动脉粥样硬化型患者明显降低。
通过对颅内外血管狭窄情况统计发现,大动脉粥样硬化型患者均存在责任大动脉粥样硬化性狭窄;在小动脉闭塞型患者中,70例(30.57%)有非责任血管狭窄;病因难以分类的患者中还存在21例患者有大血管狭窄。在516例患者中总计有265例(51.36%)有大血管狭窄,这个比例较国外文献[16]报道的结果明显增高。国内外多项研究均提示小卒中患者的颅内外血管狭窄程度与卒中的复发和预后不良密切相关[5,13,17],我们的统计也显示预后不良的患者多数为大动脉粥样硬化分型。也有研究显示小卒中后的认知障碍与颈动脉狭窄、动脉粥样硬化斑块性质有关[18~21]。
此外,我们还对颅内梗死灶进行了统计和分析,结果显示,69.19%的颅内梗死灶为孤立性病灶,多数位于皮层下、深部白质、基底节等常见位置,这与小动脉闭塞为主要分型是一致的;但仍有30.81%的患者为多发病灶,主要是由于大血管动脉粥样硬化及狭窄导致的动脉-动脉栓塞和分水岭梗死,以及心源性栓塞。因SSS-TOAST分型将小动脉闭塞的病灶判定为直径小于20 mm,故我们将所有患者的病灶直径按照20 mm作为界值,多发性病灶者计算各病灶直径总和,结果显示,仍有234例(45.35%)患者病灶大小≥20 mm。
综合上述研究结果可以发现,虽然在本研究中小卒中患者的SSS-TOAST分型最主要的类型为小动脉闭塞型,但有33.72%的患者为大动脉粥样硬化型;且51.36%的患者有大动脉狭窄,45.35%的患者病灶直径≥20 mm。所以很多小卒中病灶并不小,尽早完善MRI、CT等检查进行病因分型非常重要,大量研究[16,17,21~25]均表明早期完善影像学检查对小卒中患者病情的明确及治疗、预后评估有重要价值。
[1] Fischer U, Baumgartner A, Arnold M, et al. What is a minor stroke[J]. Stroke, 2010,41(4):661-666.
[2] 李菁晶,鞠奕,王春雪,等.缺血性小卒中患者1年卒中复发的相关因素分析——来自中国颅内动脉粥样硬化研究的数据[J].中国卒中杂志,2015,10(8):643-649.
[3] Chandratheva A, Lasserson DS, Geraghty OC, et al. Population-based study of behavior immediately after transient ischemic attack and minor stroke in 1000 consecutive patients: lessons for public education[J]. Stroke, 2010,41(6):1108-1114.
[4] Wang L, Chao Y, Zhao X, et al. Factors associated with delayed presentation in patients with TIA and minor stroke in China: analysis of data from the China National Stroke Registry (CNSR)[J]. Neurol Res, 2013,35(5):517-521.
[5] Ois A, Gomis M, Rodríguez-Campello A, et al. Factors associated with a high risk of recurrence in patients with transient ischemic attack or minor stroke[J]. Stroke, 2008,39(6):1717-1721.
[6] Giles MF, Rothwell PM. Risk of stroke early after transient ischaemic attack: a systematic review and meta-analysis[J]. Lancet Neurol, 2007,6(12):1063-1072.
[7] Coutts SB, Hill MD, Campos CR, et al. Recurrent events in transient ischemic attack and minor stroke: what events are happening and to which patients[J]. Stroke, 2008,39(9):2461-2466.
[8] Hachinski V. World Stroke Day 2008: "little strokes, big trouble"[J]. Stroke, 2008,39(9):2407-2420.
[9] Wijnhoud AD, Maasland L, Lingsma HF, et al. Prediction of major vascular events in patients with transient ischemic attack or ischemic stroke: a comparison of 7 models[J]. Stroke, 2010,41(10):2178-2185.
[10] Chandratheva A, Geraghty OC, Rothwell PM. Poor performance of current prognostic scores for early risk of recurrence after minor stroke[J]. Stroke, 2011,42(3):632-637.
[11] Pan Y, Wang Y, Li H, et al. Association of diabetes and prognosis of minor stroke and its subtypes: a prospective observational study[J]. PLoS One, 2016,11(4):e0153178.
[12] Desai JA, Abuzinadah AR, Imoukhuede O, et al. Etiologic classification of TIA and minor stroke by A-S-C-O and causative classification system as compared to TOAST reduces the proportion of patients categorized as cause undetermined[J]. Cerebrovasc Dis, 2014,38(2):121-126.
[13] Coutts SB, Modi J, Patel SK, et al. What causes disability after transient ischemic attack and minor stroke: results from the CT and MRI in the triage of TIA and minor cerebrovascular events to identify high risk patients (CATCH) study[J]. Stroke, 2012,43(11):3018-3022.
[14] Bogiatzi C, Wannarong T, McLeod AI, et al. SPARKLE (Subtypes of Ischaemic Stroke Classification System), incorporating measurement of carotid plaque burden: a new validated tool for the classification of ischemic stroke subtypes[J]. Neuroepidemiology, 2014,42(4):243-251.
[15] Wang Y, Wang Y, Zhao X, et al. Clopidogrel with aspirin in acute minor stroke or transient ischemic attack[J]. N Engl J Med, 2013,369(1):11-19.
[16] Poisson SN, Nguyen-Huynh MN, Johnston SC, et al. Intracranial large vessel occlusion as a predictor of decline in functional status after transient ischemic attack [J]. Stroke, 2011,42(1):44-47.
[17] Ois A, Cuadrado-Godia E, Rodríguez-Campello A, et al. High risk of early neurological recurrence in symptomatic carotid stenosis[J]. Stroke, 2009,40(8):2727-2731.
[18] Moustafa RR, Izquierdo-Garcia D, Jones PS, et al. Watershed infarcts in transient ischemic attack/minor stroke with > or = 50% carotid stenosis: hemodynamic or embolic[J]. Stroke, 2010,41(7):1410-1416.
[19] Lindsay AC, Biasiolli L, Lee JM, et al. Plaque features associated with increased cerebral infarction after minor stroke and TIA: a prospective, case-control, 3-T carotid artery MR imaging study[J]. JACC Cardiovasc Imaging, 2012,5(4):388-396.
[20] Moratto R, Veronesi J, Silingardi R, et al. Urgent carotid artery stenting with technical modifications for patients with transient ischemic attacks and minor stroke[J]. J Endovasc Ther, 2012,19(5):627-635.
[21] Demarin V, Zavoreo I, Kes VB. Carotid artery disease and cognitive impairment[J]. J Neurol Sci, 2012,322(1-2):107-111.
[22] Kang DW, Chalela JA, Ezzeddine MA, et al. Association of ischemic lesion patterns on early diffusion-weighted imaging with TOAST stroke subtypes[J]. Arch Neurol, 2003,60(12):1730-1734.
[23] Coutts SB, Simon JE, Eliasziw M, et al. Triaging transient ischemic attack and minor stroke patients using acute magnetic resonance imaging[J]. Ann Neurol, 2005,57(6):848-854.
[24] Bal S, Patel SK, Almekhlafi M, et al. High rate of magnetic resonance imaging stroke recurrence in cryptogenic transient ischemic attack and minor stroke patients[J]. Stroke, 2012,43(12):3387-3388.
[25] Asdaghi N, Hill MD, Coulter JI, et al. Perfusion MR predicts outcome in high-risk transient ischemic attack/minor stroke A derivation-validation study[J]. Stroke, 2013,44(9):2486-2492.
SSS-TOAST classification and cerebral infarction lesions in 516 ischemic minor stroke patients
YOUWenxia,ZHONGJianping,OUYANGJipeng,LIHongzhuang,YANGShaomin,HUQiugen
(ShundeHospital,SouthernMedicalUniversity,TheFirstPeople'sHospitalofShunde,Foshan528300,China)
Objective To observe the SSS-TOAST classification and to analyze the characteristics of cerebral infarction lesions in 516 patients with ischemic minor stroke. Methods The SSS-TOAST classification and lesions analysis were performed in 516 patients with ischemic minor stroke. The data including age, Essen stroke risk scale (ESRS) score, 90 d modified Rankin scale (mRS) score, head magnetic resonance imaging (MRI) + magnetic resonance angiography (MRA) + diffusion-weighted imaging (DWI), and cervical vascular examination, etc. were collected. Then we did comparisons between the different SSS-TOAST sub-types. Results The SSS-TOAST classification showed that: there were 174 (33.72%) patients with large-artery atherosclerosis subtype, 39 (7.56%) patients with cardioembolism subtype, 229 (44.38%) patients with small-artery occlusion subtype, 11 (2.13%) patients with other determined etiology subtype, and 63 (12.21%) patients with undetermined cause subtype. The main subtypes were small-artery occlusion and large-artery atherosclerosis. We compared these two subtypes and found that patients with large artery atherosclerosis subtype had more arteriostenosis and bad outcomes at 90 d mRS (allP<0.05). Totally 357 (69.19%) patients had isolated lesions, and the isolated lesions of 231 (64.71%) cases occurred mainly in subcortical location, deep white matter, and basal ganglia; 159 (30.81%) patients had multiple lesions. The diameter (or sum) of lesion in 282 (54.65%) patients was less than 20 mm, and 234 (45.35%) patients' lesion diameter (or sum) was ≥20 mm. These cerebral infarction lesions in patients with ischemic minor stroke were mostly isolated, diameter< 20 mm, and the isolated lesions were mostly found in common locations (allP<0.05). Conclusions The main SSS-TOAST subtypes are large-artery atherosclerosis and small-artery occlusion in patients with ischemic minor stroke, the ratios of arteriostenosis and bad outcomes mainly occur in patients with large-artery atherosclerosis subtype. These cerebral infarction lesions are mostly isolated and found in common locations. However, some patients have infarction diameter≥20 mm and multiple infarction.
cerebral infarction; ischemic minor stroke; large-artery atherosclerosis; small artery occlusion
佛山市医学类科技攻关项目(2014AB001533)。
游文霞(1982-),女,硕士,主治医师,主要研究方向为脑血管病、神经系统免疫病。E-mail:uouo5460@sina.com
钟剑萍(1968-),女,硕士,主任医师,主要研究方向为脑血管病、帕金森病及痴呆。E-mail:276459623@qq.com
10.3969/j.issn.1002-266X.2017.27.003
R743
A
1002-266X(2017)27-0009-05
2017-05-03)

