侧脑室注射微量GnIH大鼠的血浆GnRH、FSH水平及下丘脑组织POMC蛋白表达观察
司丽娜,吴迪,苏玮,魏萌,杨旭庆,陈磊,杨松鹤,程露阳,乔跃兵,4
(1承德医学院,河北承德067000;2承德医学院附属医院;3陆军总医院263临床部;4沧州医学高等专科学校)
侧脑室注射微量GnIH大鼠的血浆GnRH、FSH水平及下丘脑组织POMC蛋白表达观察
司丽娜1,吴迪2,苏玮3,魏萌1,杨旭庆1,陈磊1,杨松鹤1,程露阳1,乔跃兵1,4
(1承德医学院,河北承德067000;2承德医学院附属医院;3陆军总医院263临床部;4沧州医学高等专科学校)
目的 观察侧脑室微量注射促性腺激素抑制激素(GnIH)后雄性大鼠血浆促性腺激素释放激素(GnRH)、卵泡刺激素(FSH)水平变化,及下丘脑组织中阿片促黑素细胞皮质素原(POMC)蛋白的表达变化。方法 雄性SD大鼠60只,随机分为实验组和对照组各30只。10%水合氯醛腹腔注射麻醉,实验组于大鼠侧脑室一次性注射GnIH 5 μL,于5 min内注射完毕,留针10 min。对照组给予等量生理盐水。两组分别于注射后60、120、240 min各取10只大鼠心房取血,采用ELISA法检测血浆GnRH、FSH;心房取血后断头处死大鼠,取下丘脑组织,采用Western blotting法检测下丘脑组织中的POMC蛋白。结果 实验组注射后60、120、240 min血浆GnRH、FSH水平均低于对照组(P均<0.05),实验组内注射后不同时点差异无统计学意义。实验组注射后60、120、240 min下丘脑组织中POMC蛋白相对表达量低于对照组,且实验组注射后240 min下丘脑组织中POMC蛋白相对表达量低于注射后60、120 min(P均<0.05)。结论 侧脑室微量注射GnIH后雄性大鼠血浆GnRH、FSH水平降低,下丘脑组织中POMC蛋白表达下调。GnIH对下丘脑-垂体-性腺轴有一定调节作用,其机制可能与抑制POMC神经元功能有关。
促性腺激素抑制激素;促性腺激素释放激素;卵泡刺激素;阿片促黑素细胞皮质素原;下丘脑-垂体-性腺轴
哺乳动物的生殖功能主要依赖于下丘脑、垂体和性腺通过自分泌和旁分泌方式所分泌的各种激素进行调控,此神经内分泌调节体系即为下丘脑-垂体-性腺轴。下丘脑以脉冲方式合成并分泌促性腺激素释放激素(GnRH)。GnRH在生殖内分泌的调控中起到核心作用,其可以兴奋或抑制下丘脑及其他一些神经元产生效应。很多学者认为下丘脑分泌GnRH是生殖功能调控的惟一途径,而促性腺激素抑制激素(GnIH)的发现改变了人们对神经内分泌生殖轴的认识。GnIH是一种由日本鹌鹑脑中分离纯化的新型神经肽[1],GnIH可通过其受体G蛋白耦联受体147(GPR147)作用于垂体和下丘脑的GnRH神经元,抑制促性腺激素释放和合成[2],但具体作用机制还没有明确报道。虽然在GnRH神经元上有GnIH受体表达,但鉴于GnIH的多效性,不排除它可以通过投射到其他神经元而间接影响GnRH分泌。阿片促黑素细胞皮质素原(POMC)是一种很强的抑制食欲因子,在调节摄食能量平衡和生殖方面发挥重要作用。但是POMC神经元是如何调节生殖功能的,是直接还是间接作用于GnRH神经元,说法不一。有研究观察到POMC神经元与GnIH神经元之间存在突触联系,而有学者则否认这种联系的存在。因此,本研究观察了侧脑室微量注射GnIH后雄性大鼠血浆GnRH、FSH水平变化,及下丘脑组织中POMC蛋白表达变化,以此探讨GnIH对HPG轴的影响及其机制。
1 材料与方法
1.1 实验动物与主要材料 健康成年雄性SD大鼠60只购自北京华阜康生物科技股份有限公司(合格证号11401300016009),体质量220~250 g,饲养于实验动物中心,室温维持25 ℃左右,通风良好,自由摄食、饮水,饲养两周后用于实验,随机分为实验组和对照组各30只。酶标仪购自美国Thermo公司,大鼠的脑立体定位仪购自日本Narishige公司,大鼠ELISA试剂盒(GnRH、FSH)购自上海酶连生物有限公司,蛋白定量试剂盒购自上海碧云天生物技术有限公司,GnIH购自美国Peprotech公司,POMC与GAPDH均购自Bioworld公司,二抗(山羊抗兔IgG)购自武汉博士德生物工程有限公司。
1.2 GnIH给药方法 10%水合氯醛腹腔注射麻醉,实验组于大鼠侧脑室一次性注射GnIH 5 μL,于5 min内注射完毕,留针10 min。对照组给予等量生理盐水。
1.3 血浆GnRH、FSH检测 在麻醉状态下,两组大鼠分别于侧脑室注射后60、120、240 min各取10只大鼠开胸,快速自右心房采集静脉血,4 ℃ 3 000 r/min离心20 min后取其上清液,-80 ℃储存。采用ELISA法检测血浆GnRH、FSH。
1.4 下丘脑组织中POMC蛋白检测 在麻醉状态下,两组大鼠分别于侧脑室注射后60、120、240 min各取10只大鼠,心房采血后立即断头处死,取下丘脑组织,用PBS清洗,称重。将下丘脑组织放入匀浆器并加入组织裂解液和蛋白酶抑制剂(PMSF),匀浆,4 ℃ 12 000 r/min离心30 min,取上清液,-80 ℃储存备用。用蛋白定量试剂盒测定总蛋白含量,调整电泳上样量。经SDS-PAGE电泳分离的蛋白电转移至PVDF膜上,以含5%脱脂奶粉的TBST缓冲液室温封闭2 h,加入一抗[兔抗POMC(1∶500),兔抗CAPDH(1∶8 000)]4 ℃孵育过夜,洗膜3次后加入二抗[羊抗兔IgG(1∶4 000)]孵育2 h,洗膜3次,化学发光法显色。扫描图像后采用Image J软件分析蛋白条带的平均灰度值,以目的条带与内参条带灰度值之比代表POMC蛋白相对表达量。
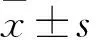
2 结果
实验组注射后60、120、240 min血浆GnRH、FSH水平均低于对照组(P均<0.05),实验组内注射后不同时点差异无统计学意义。实验组注射后60、120、240 min下丘脑组织中POMC蛋白相对表达量低于对照组,且实验组注射后240 min下丘脑组织中POMC蛋白相对表达量低于注射后60、120 min(P均<0.05)。详见表1。
3 讨论
GnIH及其同系肽(RFRP)分布于哺乳动物[3]、鸟类[4]、两栖动物[5]和鱼类[6]中。哺乳动物的GnIH神经元主要存在于下丘脑的室周核、背内侧核、背内侧核与下丘脑腹内侧核中间的区域[3]。同时,大多数哺乳动物的垂体、间脑、端脑、视顶盖等组织都能表达GnIH的内源受体GPR147。有研究[7]显示GPR147在垂体的促黄体激素(LH)、促卵泡素(FSH)细胞中都有表达。哺乳动物的GnRH1神经元上也有GnIH受体的表达[3],证明GnIH可能通过GnRH1神经元来抑制生殖功能。有学者认为GnIH通过抑制GnRH神经元进而抑制促黄体激素(LH)和促卵泡素(FSH)的合成与释放[8]。GnIH及其受体可以在垂体水平抑制促性腺激素的合成与释放[9]。此外,GnIH在性腺中也有表达[10,11],这表明GnIH不仅能抑制促性腺激素的释放,还可能通过某种方式调节性腺的发育。GnIH神经纤维可以投射到NPY神经元、POMC神经元、MCH神经元,这些神经元在控制摄食方面发挥着重要作用[12]。因此,GnIH可能通过与这些神经元相互作用,从而调控神经内分泌生殖系统。

表1 药物注射后不同时点两组大鼠血浆GnRH、FSH水平及下丘脑组织中POMC蛋白相对表达量比较
注: 与同时点对照组相比,*P<0.05。
POMC神经元广泛存在于无脊椎动物及所有脊椎动物的下丘脑中,是调节能量稳态的重要神经元[13]。POMC是在垂体、下丘脑弓状核表达的一种含有267个氨基酸序列的神经肽,是脑内多种激素的前体,具有调节能量平衡和抑制食欲的重要作用[14]。有学者[15]在大鼠胚胎第12天的下丘脑中就发现POMC的表达,证实POMC神经元在下丘脑能量平衡调节过程中发挥重要作用。研究[16]发现GnIH能降低小鼠脑中POMC细胞的电生理功能,而POMC及其受体表达可提高GnRH神经元的活性[17]。由此推测,GnIH通过其受体可作用于GnRH神经元,可通过其神经纤维投射至POMC神经元,还可能通过POMC神经元间接作用于GnRH,进而影响生殖功能。
GnIH是神经内分泌调节的重要参与者,前期研究已证实GnIH受体存在GnRH神经元上,GnIH可直接作用于GnRH神经元发挥对生殖系统的抑制作用。但GnIH的多效性暗示其不只限于这一种作用途径,它能进一步投射到脑部其他区域,与该区域的神经元相联系并发挥作用[18]。由此,POMC神经元可能作为GnIH调节GnRH的一个中间神经元,影响GnIH神经元对下丘脑-垂体-性腺轴的调节作用。我们在侧脑室微量注射GnIH后,观察雄性大鼠GnRH、FSH水平变化,结果显示侧脑室微量注射GnIH后60、120、240 min大鼠血浆GnRH、FSH水平均降低,提示GnIH在一定时间内可抑制GnRH和FSH的分泌,此抑制作用在一定时间范围内呈时间依赖性。GnIH可抑制下丘脑GnRH神经元的分泌作用,进而抑制垂体FSH的分泌,提示GnIH对下丘脑-垂体生殖轴有一定的抑制作用。本研究还发现侧脑室微量注射GnIH 60、120、240 min后,实验组下丘脑组织中POMC蛋白相对表达量呈下降趋势,且注射240 min后下丘脑组织中POMC蛋白相对表达量低于注射后60、120 min,表明GnIH在一定时间范围内对大鼠下丘脑POMC分泌具有负反馈调节作用,可抑制POMC的分泌。本实验提示GnIH可能通过抑制POMC神经元抑制下丘脑GnRH的释放,进而抑制垂体促性腺素FSH的释放,从而发挥对下丘脑-垂体生殖轴的调节作用。然而,GnIH神经元对POMC神经元的调节是直接作用还是间接作用,或是综合作用的结果,还需要进一步研究来证明。本实验受河北省高校人体解剖学与组织胚胎学重点发展学科建设项目资助、河北省高校病原生物学重点学科项目资助。
[1] Tsutsui K, Saigoh E, Ukena K, et al. A novel avian hypothalamic peptide inhibiting gonadotropin release[J]. Biochem Biophys Res Commun, 2000,275(2):661-667.
[2] Ukena K, Ubuka T, Tsutsui K. Distribution of a novel avian gonadotrophin-inhibitory hormone in the quail brain[J]. Cell Tissue Res, 2003,312(1):73-79.
[3] Ubuka T, Inoue K, Fukuda Y, et al. Identification, expression, and physiological functions of Siberian hamster gonadotropin-inhibitory hormone[J]. Endocrinology, 2012,153(1):373-385.
[4] Tobari Y, Iijima N, Tsunekawa K, et al. Identification of gonadotropin-inhibitory hormone in the zebra finch (Taeniopygia guttata): Peptide isolation, cDNA cloning and brain distribution[J]. Peptides, 2010,31(5):816-826.
[5] Chowdhury VS, Ubuka T, Shimura T, et al. Identification, localization and expression of LPXRFamide peptides, and melatonin-dependent induction of their precursor mRNA in the newt brain[J]. J Endocrinol, 2011,209(2):211-220.
[6] Shahjahan M, Ikegami T, Ukena K, et al. Synchronised expressions of LPXRFamide peptide and its receptor genes: seasonal, diurnal and circadian changes during spawning period in grass puffer[J]. J Neuroendocrinol, 2011,23(1):39-51.
[7] Maddineni S, Ocon-Grove OM, Krzysik-Walker SM, et al. Gonadotrophin-inhibitory hormone receptor expression in the chicken pituitary gland: potential influence of sexual maturation and ovarian steroids[J]. J Neuroendocrinol, 2008,20(9):1078-1088.
[8] Hinuma S, Shintani Y, Fukusumi S, et al. New neuropeptides containing carboxy-terminal RFamide and their receptor in mammals[J]. Nat Cell Biol, 2000,2(10):703-708.
[9] 李素环,汪永红.GnIH/GPR147和 Kisspeptin/GPR54与青春发育启动[J].国际儿科学杂志,2014,41(4):394-397.
[10] Zhao S, Zhu E, Yang C, et al. RFamide-related peptide and messenger ribonucleic acid expression in mammalian testis: association with the spermatogenic cycle[J]. Endocrinology, 2010,151(2):617-627.
[11] Singh P, Krishna A, Sridaran R, et al. Immunohistochemical localization of GnRH and RFamide-related peptide-3 in the ovaries of mice during the estrous cycle[J]. J Mol Hist, 2011,42(5):371-381.
[12] Clarke IJ, Smith JT, Henry BA, et al. Gonadotropin-inhibitory hormone is a hypothalamic peptide that provides a molecular switch between reproduction and feeding[J]. Neuroendocrinology, 2012,95(4):305-316.
[13] Yu Y, Deng C, Huang XF. Obese reversal by a chronic energy restricted diet leaves an increased Arc NPY/AgRP, but no alteration in POMC/CART,mRNA expression in diet-induced obese mice[J]. Behav Brain Res, 2009,205(1): 50-56.
[14] Yeo GS, Farooqi IS, Challis BG, et al. The role of melanocortin signalling in the control of body weight:evidence from human and murine genetic models[J]. QJM, 2000,93(1):7-14.
[15] Returners F. Delemarre-vandeWaalH Develop-mentalprogramm ing ofenergy balance and itshypo-halamicregulation [J]. EndocrRev, 2011,32(2):272-311.
[16] Fu LY, van den Pol AN. Kisspeptin directly excites anorexigenic proopiomelanocortin neurons but inhibits orexigenic neuropeptide Y cells by an indirect synaptic mechanism[J]. J Neurosci, 2010,30(30):10205-10219.
[17] Matsuyama S, Ohkura S, Sakurai K, et al. Activation of melanocortin receptors accelerates the gonadotropin-releasing hormone pulse generator activity in goats[J]. Neurosci Lett, 2005,383(3):289-294.
[18] Tsutsui K, Ubuka T, Son YL, et al. Contribution of GnIH Research to the Progress of Reproductive Neuroendocrinology[J]. Front Endocrinol (Lausanne),2015,23(6):179.
河北省自然科学基金资助项目(H2013406115);河北省科学技术研究与发展计划项目(08276101D-20);河北省高等学校科学研究项目(QN2015121);河北省卫生厅医学科学研究项目(20130021)。
乔跃兵(E-mail:qiaoyuebing@126.com)
10.3969/j.issn.1002-266X.2017.27.009
R-332
A
1002-266X(2017)27-0034-03
2017-03-23)

