紫色红曲霉液态发酵产糖化酶的工艺研究
陈景智,林 娟,叶秀云,徐美爱,李雯娟,邓香圳(福州大学,福建省海洋酶工程重点实验室,福建福州 350116)
紫色红曲霉液态发酵产糖化酶的工艺研究
陈景智,林 娟*,叶秀云,徐美爱,李雯娟,邓香圳
(福州大学,福建省海洋酶工程重点实验室,福建福州 350116)
通过培养基和发酵条件的优化提高紫色红曲霉G6液态发酵产糖化酶活力。研究接种菌龄、碳源、氮源、金属离子、培养基初始pH、接种量、装液量、摇床转速以及温度等对产酶的影响。结果表明,最佳培养基配方(w/v)为大米粉8%,蛋白胨1%,KCl 0.1%,ZnSO40.01%,FeSO40.005%,MnSO40.015%,培养基初始pH为4.0;最适发酵条件:装液量50 mL/250 mL,转速150 r/min,温度32 ℃,接种量12%(v/v);在此条件下发酵10 d,糖化酶活力为1652.36 U/mL比优化前(109.54 U/mL)提高了14.08倍。
紫色红曲霉,糖化酶,培养基,发酵条件
红曲是一种传统的中药材,具有消食活血,健脾燥胃,治脚气、哮喘、咳嗽等作用,早在宋代初期便有用红曲煮肉的记录[1]。红曲菌代谢产物众多,包括具有降胆固醇功效的Monacolin K[2-3],降血压活性的氨基丁酸,可促进人体对钙磷吸收的麦角甾醇和作为食用色素的红曲色素等多种活性物质[4],还包括淀粉酶、葡萄糖淀粉酶(糖化酶)、蛋白酶、果胶酶、酯化酶等多种酶类物质[5-6]。
糖化酶是世界上生产量最大应用范围最广的酶类之一,已被广泛应用于葡萄糖、果葡糖浆、酿酒、发酵食品等工业。红曲菌发酵生产的糖化酶和淀粉酶可以作为糖化发酵剂,酿制成红曲酒,红曲酒在我国台湾、福建、浙江等省享誉盛名[7],福建古田平湖镇,生产红曲有1000多年的悠久历史,在国内外久负盛名。但作为酿造黄酒的古田红曲,糖化酶活力低,很难适应现在的市场要求。
根据报道产糖化酶的曲霉以黑曲霉居多,红曲霉相对较少,高产糖化酶的红曲霉更为少见[8-11]。本文以古田平湖样品中筛选、诱变得到的菌株出发,研究红曲霉菌株产糖化酶的液态发酵工艺条件,通过优化发酵工艺提高糖化酶活力,优化后的发酵工艺参数可直接为工业化生产提供技术指导,从而降低生产成本,增加红曲产品的市场竞争力。
1 材料与方法
1.1 材料与仪器
紫色红曲霉G6(MonascuspurpureusG6) 由福建省海洋酶工程重点实验室选育获得;PDA培养基 配制方法参照文献[12];种子培养基 不添加琼脂的PDA培养基;液态发酵基础培养基(MM培养基) 葡萄糖5%(w/v),蛋白胨1%(w/v),蒸馏水定容至1 L,pH自然,121 ℃灭菌20 min;液态发酵培养基(w/v,CM培养基) 大米粉8%,蛋白胨1%,KCl 0.1%,ZnSO40.01%,FeSO40.005%,MnSO40.015%,pH4.0,蒸馏水定容至1 L,121 ℃灭菌20 min;蛋白胨 购于Oxiod公司;葡萄糖、可溶性淀粉、KCl、ZnSO4、FeSO4等试剂 均来自国产分析纯。
T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;SW-CJ-2F洁净工作台 苏州安泰空气技术有限公司;HWS24电热恒温水浴锅 上海一恒科技有限公司;SHP-250生化培养箱 上海精宏实验设备有限公司;YXQ-LS-50S11立式蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;ZWYR-2102C恒温振荡培养箱 上海智城分析仪器制造有限公司);CF16RXII高速冷冻离心机 日本HITACHI公司。
1.2 实验方法
1.2.1 紫色红曲霉糖化酶的液态发酵 将红曲菌接种于PDA平板上,在30 ℃条件下培养3~5 d。待红曲菌长好后,用打孔器在红曲菌平板上打出6 mm菌饼,将菌饼接种到液体种子培养基中,于恒温振荡培养箱中150 r/min、30 ℃培养2 d,之后以4%(v/v)的接种量接到发酵培养基中,装液量20%(50 mL/250 mL),于恒温振荡培养箱中180 r/min、30 ℃培养数天,测定发酵液的糖化酶活力。
1.2.2 糖化酶活力测定 粗酶液制备:将锥形瓶中发酵液于8000 r/min离心10 min,然后取上清液,作为粗酶液。采用DNS比色法测定糖化酶活力[13]。1 mL酶液在40 ℃、pH4.6的条件下,1 h水解可溶性淀粉产生1 mg葡萄糖,定义为1个酶活力单位(U/mL)。相对酶活力:定义某个条件下,其相对酶活力为100%,其他条件下酶活力占该条件下酶活力的百分率为相对酶活力。
1.2.3 接种菌龄的确定 将培养不同时间(1~6 d)的种子液接种于液态基础培养基(MM培养基),装液量20%(50 mL/250 mL),接种量4%(v/v),转速180 r/min,温度32 ℃,于恒温振荡培养箱中培养8 d,之后取一定的发酵液测定糖化酶活力,研究不同接种龄对液态发酵产糖化酶相对酶活力的影响。
1.2.4 培养基确定
1.2.4.1 优化前液态发酵培养条件 葡萄糖5%(w/v),蛋白胨1%(w/v),蒸馏水定容至1 L,pH自然,121 ℃灭菌20 min。种子液培养时间2 d,温度32 ℃,转速180 r/min,装液量50 mL/250 mL,接种量8%,发酵培养8 d。
1.2.4.2 碳源确定 分别用葡萄糖、蔗糖、可溶性淀粉、甘油、大米粉、玉米粉、糊精、麸皮作为MM培养基的碳源,添加量均为5%(w/v);培养基初始pH为5.0,装液量20%(50 mL/250 mL),接种量4%(v/v),转速180 r/min,温度32 ℃,考察不同碳源对发酵产糖化酶相对酶活力的影响;另外,在确定最佳碳源之后,考察不同添加量4%~16%(w/v)对产糖化酶相对酶活力的影响。
1.2.4.3 氮源确定 在确定最佳碳源的基础上,分别以谷氨酸钠、尿素、蛋白胨、黄豆饼粉、硫酸铵、酵母膏、大米粉、大豆粉、玉米粉和硝酸钠为MM培养基的氮源,其他培养条件同1.2.4.2,研究不同氮源对液体发酵产糖化酶相对酶活力的影响;另外,在确定最佳氮源后,考察不同添加量0.5%~5.0%(w/v)对产糖化酶相对酶活力的影响。
1.2.4.4 金属离子优化 以最佳的碳源和氮源配制培养基,其他培养条件同1.2.4.2,分别考察添加量0、0.005%、0.010%、0.015%、0.020%、0.025%的金属离子Mn2+、Fe2+、Zn2+,0、0.01%、0.15%、0.20%、0.30%的金属离子Mg2+和K+对紫色红曲霉G6产糖化酶能力的影响。进一步利用L9(34)正交表进行实验设计确定这些金属离子的最优配比,因素水平编码如表1所示。
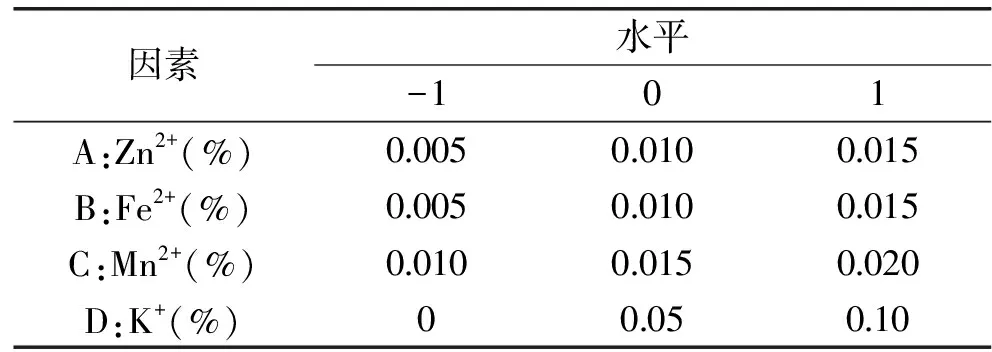
表1 正交实验设计因素水平编码Table 1 Factors and levels table of orthogonal experiment
1.2.4.5 培养基初始pH确定 在通过实验研究,明确最佳培养基配方之后,调节液态发酵培养基的初始pH为2.5~6.0,考察不同初始pH对紫色红曲霉G6产糖化酶相对酶活力的影响。
1.2.5 发酵条件研究 在优化后的液态发酵培养基(CM培养基)的基础上,采用单因素实验,固定装液量50 mL/250 mL、摇床转速180 r/min,温度32 ℃,考察接种量(2%~16%)对紫色红曲霉G6产糖化酶相对酶活力的影响。
固定接种量12%、摇床转速180 r/min、温度32 ℃,考察装液量(30、50、70、90、110 mL/250 mL)对紫色红曲霉G6产糖化酶相对酶活力的影响。
固定接种量12%、装液量50 mL/250 mL、温度32 ℃,考察摇床转速(100、120、140、160、180、200、220 r/min)对紫色红曲霉G6产糖化酶相对酶活力的影响。
固定接种量12%、装液量50 mL/250 mL、摇床转速150 r/min,考察温度(28、30、32、35、37 ℃)对紫色红曲霉G6产糖化酶相对酶活力的影响。
1.2.6 紫色红曲霉G6产酶曲线的测定 采用优化后的培养条件进行发酵培养,发酵2~11 d,每隔1 d取一定量的发酵液测一次糖化酶的酶活力。
1.3 数据处理
实验中每个处理重复3次,采用SPSS 1.70软件进行正交实验设计,应用Microsoft Excel 2010软件作图。
2 结果与分析
2.1 接种菌龄对产糖化酶的影响
图1表明培养2 d的种子液接种发酵的糖化酶活力最高(定义为100%),这时红曲菌处于快速生长期,菌种的生命力及适应能力都很强,因此选择种子培养时间为2 d。
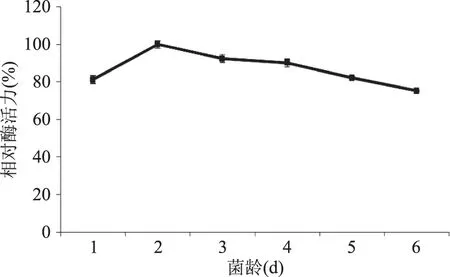
图1 接种龄对液态发酵产糖化酶的影响Fig.1 Effect of seed age on glucoamylase production
2.2 培养基优化
2.2.1 不同碳源对液态发酵产糖化酶的影响 就曲霉而言,糖化酶是诱导酶,所以在微生物发酵过程中,作为碳源的物质除了作为微生物所需碳元素的主要来源外,又是诱导物的主要来源,所以不同的碳源对糖化酶的合成具有显著的影响[14]。图2结果表明,不同碳源对产糖化酶的影响差异较大,碳源为大米粉时糖化酶活力最高(定义为100%),其次是玉米粉,相对酶活为91.6%。可能是因为这类碳源中含有丰富的维生素、有机酸、氨基酸、糖类等,几乎包含有微生物生长所需要的绝大部分营养要素,并且配比较为合适。所以,选择大米粉为产糖化酶培养基中的最适碳源。
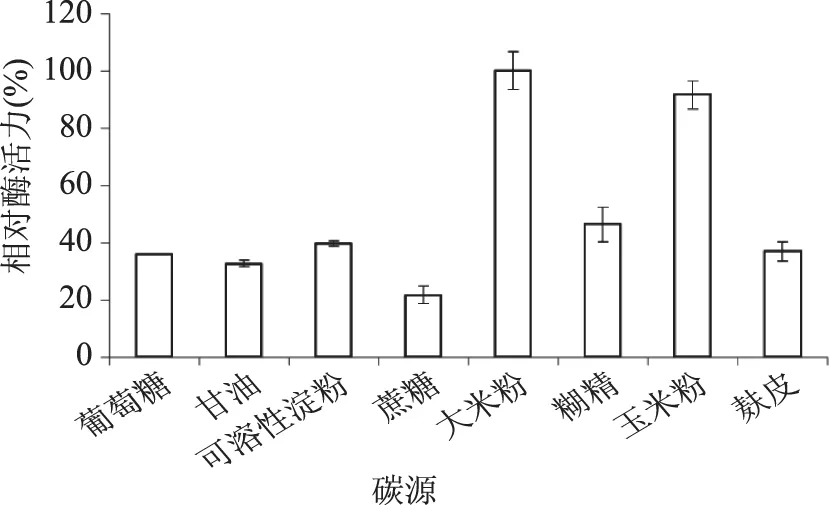
图2 不同碳源对液态发酵产糖化酶的影响Fig.2 Effect of carbon sources on glucoamylase production
确定大米粉为最优碳源后,进一步考察不同添加量对产糖化酶的影响。由图3可知,碳源添加量为12%时糖化酶活力最高(定义为100%),当添加量从2%增加到8%时,相对酶活从33.68%提高到97.94%;随着添加量的增加,添加量8%以后,酶活力基本不变,所以,从成本方面考虑,确定大米粉的最适添加量为8%。
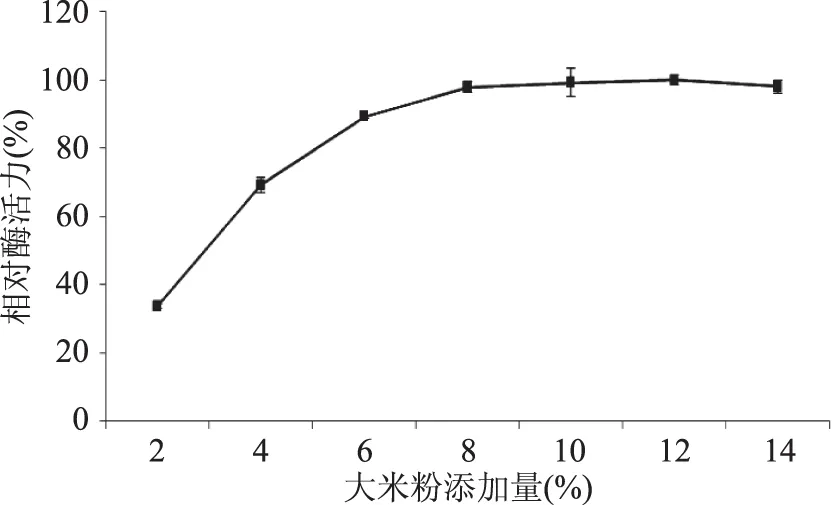
图3 大米粉添加量对液态发酵产糖化酶的影响Fig.3 Effect of rice flour content on glucoamylase production
2.2.2 氮源对液态发酵产糖化酶的影响 在最适碳源为大米粉(添加量为8%)的基础上,研究不同氮源对紫色红曲霉G6产糖化酶的影响,结果如图4所示。可以看出,选用的有机氮效果优于硫酸铵和硝酸钠等无机氮。蛋白胨、黄豆饼粉、玉米浆干粉和大米蛋白作为氮源时的产酶量相近,其中蛋白胨糖化酶活力最高(定义为100%);豆粕由于油脂含量较高,影响了菌体对氮源的利用,使其生长受到抑制,因此糖化酶活力较低。观察发酵液颜色,添加黄豆饼粉和玉米浆干粉的发酵液呈橙红色,添加大米蛋白的发酵液呈暗黄色,色泽不佳,可能会影响到后续糖化酶的提取和应用。在酿造福建黄酒的过程中,红曲霉发挥了提供色泽、风味和糖化等作用,所以对整体发酵液的色泽有一定的要求[15-16]。因此确定产酶培养基中的氮源为蛋白胨。
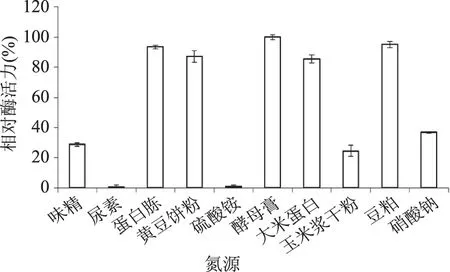
图4 不同氮源对液态发酵产糖化酶的影响Fig.4 Effect of nitrogen sources on glucoamylase production
图5实验结果表明,添加量在1.0%~4.0%范围内,产酶水平相近,添加量1.0%时糖化酶活力最高(定义为100%)。所以后续实验以蛋白胨为氮源,添加量为1.0%。
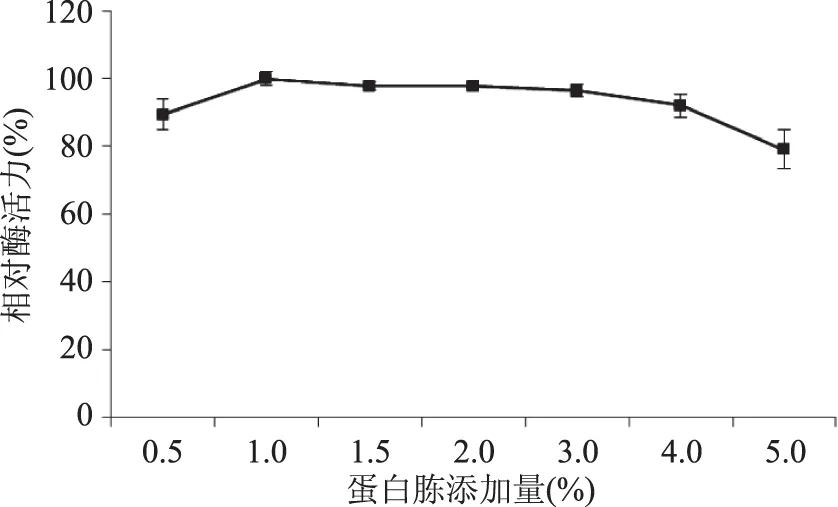
图5 蛋白胨添加量对液态发酵产糖化酶的影响Fig.5 Effect of peptone content on glucoamylase production
2.2.3 金属离子对液态发酵产糖化酶的影响

图6 不同金属离子对液态发酵产糖化酶的影响Fig.6 Effect of different metal ions on glucoamylase production
2.2.3.1 单因素实验 不同金属离子以及其不同添加浓度对产糖化酶的影响结果见图6,无添加的对照组酶活力定义为100%。Mn2+在实验浓度0%~0.025%范围内对产糖化酶没有多大影响,当添加量为0.025%时,酶活力略高,仅仅提高了2.4%;Fe2+添加量为0.005%时,相对于无添加时产酶提高了11.85%;Zn2+在添加量0%~0.025%范围内均对产酶起到了促进作用,但随着浓度的升高,促进作用提高不明显,相对酶活维持在130%左右;Mg2+在添加量0%~0.3%范围内对产酶有抑制作用,相对酶活为90%左右;当K+的添加量为0.05%时,对产酶的促进作用明显,较无添加情况下提高了35.0%。
2.2.3.2 正交实验 为了进一步研究金属离子对产糖化酶的影响,选择对酶活有一定促进作用的Zn2+、Fe2+、Mn2+和K+,通过正交实验L9(34)优化这4种金属离子的配比,正交实验结果见表2。由极差R可知,影响糖化酶合成的金属离子主次顺序为A>B>D>C,最优组合为A2B1C2D3(实验号4),即添加Zn2+0.010%、Mn2+0.015%、K+0.10%、Fe2+0.005%,紫色红曲霉G6在该条件下发酵,糖化酶活力达到1471.95 U/mL,较优化前(109.54 U/mL)提高了13.44倍。
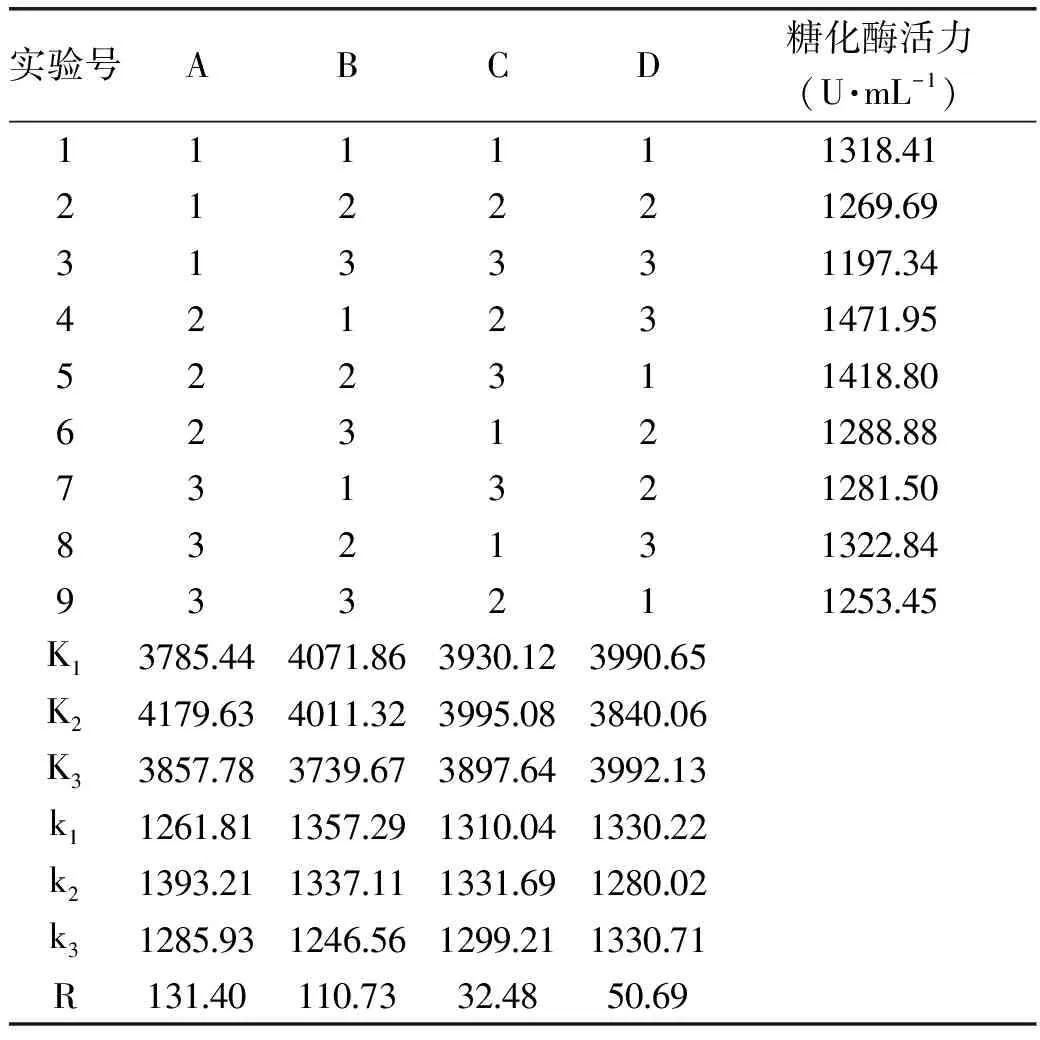
表2 金属离子L9(34)正交实验结果Table 2 Results of L9(34)orthogonal experiment(metal ions)
2.2.4 培养基不同初始pH对液态发酵产糖化酶的影响 由图7可知,在pH3.5~5.0范围内,发酵产酶活力均维持在较高水平,其pH的适应范围较宽,以pH为4.0时的酶活力最高(定义为100%)。因此,确定培养基初始pH为4.0。
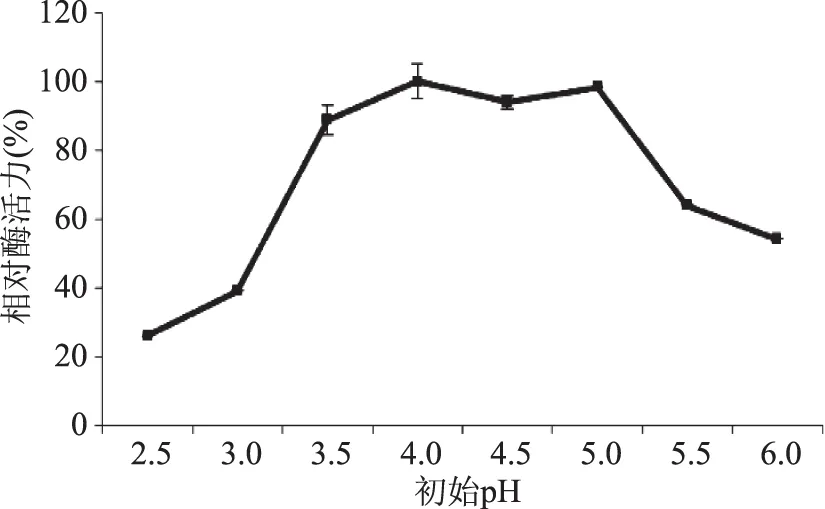
图7 初始pH对液态发酵产糖化酶的影响Fig.7 Effect of initial pH on glucoamylase production
2.3 液态发酵产糖化酶条件优化
2.3.1 不同接种量对液态发酵产糖化酶的影响 由图8可知,在2%~16%(v/v)接种量范围内,糖化酶活力呈现先上升后下降的趋势,当接种量为12%时,发酵产酶效果最好。过高的接种量使得菌体生长旺盛,快速消耗营养物质,对发酵产酶不利,所以确定接种量为12%。
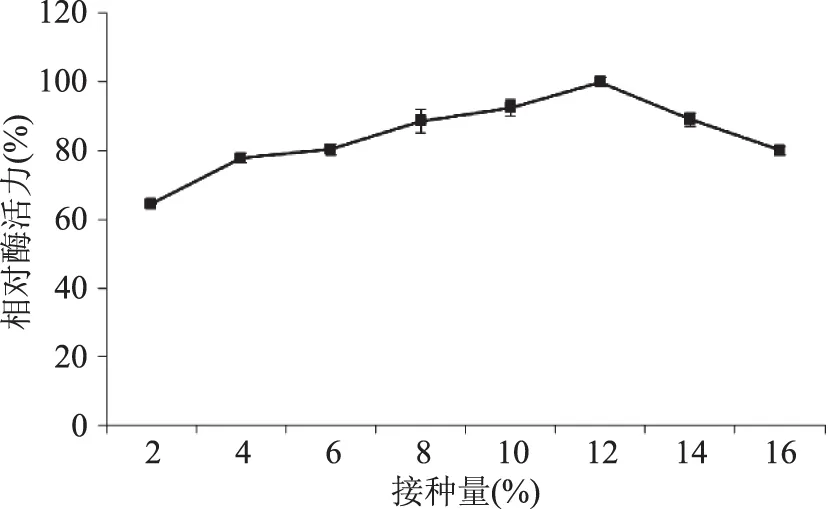
图8 接种量对液态发酵产糖化酶的影响Fig.8 Effect of inoculation amount on glucoamylase production
2.3.2 不同装液量对液态发酵产糖化酶的影响 摇瓶装液量与转速是影响通气量的两个主要因素。装液量对产糖化酶的影响结果见图9,装液量为30 mL时,糖化酶相对酶活力最高;当装液量为50 mL时,酶活力是装液量30 mL时的91.32%,其余的装液量,酶活力都较低,考虑到投入产出比,选择摇瓶装液量为50 mL。

图9 装液量对液态发酵产糖化酶的影响Fig.9 Effect of medium volume on glucoamylase production
2.3.3 不同转速对液态发酵产糖化酶的影响 在前面的基础上,摇床转速控制在100~220 r/min范围内,糖化酶活力先升后降,在150 r/min时,糖化酶相对酶活力达到最高(图10),因此选择摇床转速为150 r/min。
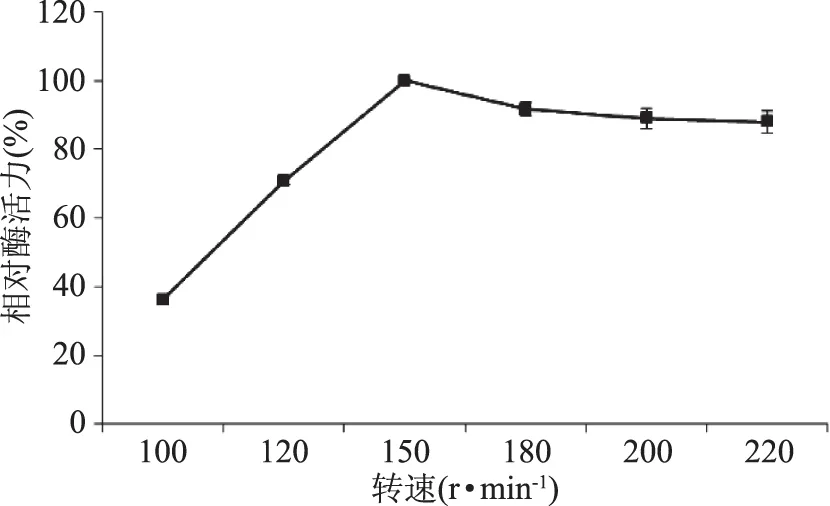
图10 转速对液态发酵产糖化酶的影响Fig.10 Effect of rotation speed on glucoamylase production
2.3.4 不同温度对液态发酵产糖化酶的影响 适宜的温度对于发酵产酶的影响较大,不同温度条件下发酵产糖化酶情况如图11所示,在温度为32 ℃时糖化酶活力最高(定义为100%),在发酵温度28 ℃下,相对酶活为71.30%;而在37 ℃下,酶活力迅速下降,相对酶活仅为41.09%,说明高温不利于红曲菌株产糖化酶。因此,确定液态发酵产糖化酶最适温度为32 ℃。

图11 发酵温度对液态发酵产糖化酶的影响Fig.11 Effect of fermentation temperature on glucoamylase production
2.4 紫色红曲霉G6产酶曲线的测定
将紫色红曲霉G6按照优化后的液态产酶工艺进行发酵,并绘制产酶曲线,如图12所示,随着发酵时间的延长,糖化酶活力不断升高,在第6 d之后,上升变得相对平缓,直到第10 d达到最高(糖化酶活力为1652.36 U/mL)。与优化前(糖化酶活力为109.54 U/mL)相比,产酶能力提高了14.08倍。

图12 发酵时间对液态发酵产糖化酶的影响Fig.12 Effect of fermentation time on glucoamylase production
3 结论
通过对紫色红曲霉G6液态发酵生产糖化酶的接种菌龄、培养基配方和发酵条件的研究,确定其最佳接种菌龄为2 d;最适发酵培养基成分为大米粉8%,蛋白胨1%,KCl 0.1%,ZnSO40.01%,FeSO40.005%,MnSO40.015%,pH4.0;最适发酵条件为装液量50 mL/250 mL,转速150 r/min,温度32 ℃,接种量12%(v/v)。在该条件下发酵至第10 d糖化酶活力可达1652.36 U/mL,比优化前提高了14.08倍。
[1]李浩然,冯雅丽,伍军. 降脂红曲研究进展[J]. 北京农学院学报,2001,16(3):80-85.
[2]Panda B P,Javed S,Ali M. Optimization of Fermentation Parameters for Higher Lovastatin Production in Red Mold Rice through Co-culture ofMonascuspurpureus,andMonascusruber[J]. Food and Bioprocess Technology,2010,3(3):373-378.
[3]肖连冬,王志强. 降胆固醇红曲霉菌株的分离及其降解性能研究[J]. 中国酿造,2015,34(5):74-77.
[4]Pattanagul P,Pinthong R,Phianmongkhol A,et al.Mevinolin citrinin and pigments of adlay angkak fer-mented byMonascussp.[J]. International Journal of Food Microbiology,2008,126(1):20-23.
[5]李丽,张文学,罗芳,等. 红曲药曲的制备工艺及药曲清酒的研究[J]. 食品工业科技,2014,35(18):194-198.
[6]赵吉兴,李耀,李凯. 红曲霉固体发酵生产酿造增香发酵剂的研究与应用[J]. 中国酿造,2013,32(3):114-117
[7]王雅芬,傅月华.红曲霉的有效生理活性物质及应用[J].杭州科技,2000(5):25-27.
[8]杨丽娟,余少文,YANGLi-juan,等. 黑曲霉高产糖化酶的分子水平研究方法概论[J]. 食品研究与开发,2016,37(8):204-208.
[9]龙茜萍,王晓丹,谭静,等. 一株高产糖化酶菌株的筛选与鉴定[J]. 酿酒科技,2013(8):7-9.
[10]武金霞,王沛,李晓明. 糖化酶的研究进展及趋势[J]. 自然杂志,2003,25(3):161-163.
[11]王秋辰,王昌禄,陈勉华,等. 红曲霉固态发酵产糖化酶及酸性蛋白酶条件的优化[J]. 天津科技大学学报,2014(4):21-25.
[12]徐美爱,林娟,李亮,等. 高产红色素及糖化酶红曲菌株的诱变选育[J]. 中国食品学报,2015,15(12):74-82.
[13]刘洋,唐芳荣,相宏宇,等.小体系高通量比色测定糖化酶活力新方法[J].中国酿造,2012(7):140-143.
[14]夏娟. 高产糖化酶菌株的诱变育种及其发酵工艺的优化[D]. 杭州:浙江工业大学,2013.
[15]倪莉,吴智广,张雯. 福建红曲中的红曲霉的生理生化特性研究[J]. 福州大学学报,2009(6):929-934.
[16]韩兴林,王建耀,王广峰,等. 清香型大曲糖化力的简单分析[J]. 酿酒科技,2009(9):68-70.
Study on the liquid fermentation conditions of glucoamylase byMonascuspurpureus
CHEN Jing-zhi,LIN Juan*,YE Xiu-yun,XU Mei-ai,LI Wen-juan,DENG Xiang-zhen
(Fujian Key Laboratory of Marine Enzyme Engineering,Fuzhou University,Fuzhou 350116,China)
The production conditions of glucoamylase through liquid-state fermentation byMonascuspurpureusG6 were optimized. Based on results of single factor tests,the optimal conditions for glucoamylase production were 8% rice powder,1% peptone,0.1% KCl,0.01% ZnSO4,0.005% FeSO4,0.015% MnSO4,50 mL/250 mL loading medium volume(v/v),12% inoculation amount(v/v)and rotation speed of shaking incubator was 150 r/min,initial pH value of culture medium was 4.0,fermentation temperature was 32 ℃. The fermentation was carried out under these conditions for 10 days to obtain the maximum glucoamylase activity of 1652.36 U/mL,which was 14.08 times higher than that without optimization of fermentation condition.
Monascuspurpureus;glucoamylase;culture medium;fermentation conditions
2016-12-20
陈景智(1991-),男,在读硕士研究生,研究方向:应用微生物学,E-mail:1548426184@qq.com。
*通讯作者:林娟(1970-),女,博士,教授,研究方向:应用微生物学、分子酶学,E-mail:ljuan@fzu.edu.cn。
国家863计划课题(2013AA102101);福建省高校产学合作项目(2017N5008)。
TS201.3
A
1002-0306(2017)14-0146-06
10.13386/j.issn1002-0306.2017.14.029

