4种烹饪方式对中华绒螯蟹感官及风味品质的影响
何 捷 蔡春芳 王永玲 杨彩根 丁 磊D
(苏州大学基础医学与生物科学学院,江苏 苏州 215123)
4种烹饪方式对中华绒螯蟹感官及风味品质的影响
何 捷 蔡春芳 王永玲 杨彩根 丁 磊D
(苏州大学基础医学与生物科学学院,江苏 苏州 215123)
为探讨烹饪方式对中华绒螯蟹感官品质的影响,分析冷水蒸制、冷水煮制、热水蒸制、热水煮制4种熟制方式对中华绒螯蟹不同部位游离氨基酸、核苷酸及虾青素含量的影响,同时进行感官评定。结果表明:热水处理组肌肉和性腺中游离氨基酸总量、鲜味氨基酸总量、头胸甲中的虾青素含量均显著高于冷水处理组(P<0.05);感官评定结果显示4种烹饪方式对中华绒螯蟹可食部分红度、甜味影响显著(P<0.05),其中热水熟制组性腺较甜,冷水蒸制组性腺和肝胰腺较红,总体上热水蒸制组得分最高。热水蒸制是烹饪中华绒螯蟹的优选方式。
中华绒螯蟹;烹饪方式;游离氨基酸;核苷酸;虾青素;感官鉴定
中华绒螯蟹俗称河蟹,是中国特有的水产品之一。因其口味鲜甜而深受广大消费者的喜爱。中华绒螯蟹的鲜、甜特质与其可食部分甜味氨基酸[如甘氨酸(Gly)、丙氨酸(Ala)、丝氨酸(Ser)、苏氨酸(Thr)]和鲜味氨基酸[如谷氨酸(Glu)、天冬氨酸(Asp)]含量较高有关[1]。此外,中华绒螯蟹可食部分5’-核苷酸的钠盐[主要包括5’-单磷酸肌苷二钠(IMP)、5’-单磷酸鸟苷二钠(GMP)和5’-单磷酸腺苷二钠(AMP)]含量也较高[2],这些物质本身呈鲜味,还可与游离氨基酸产生协同效应,从而增强中华绒螯蟹的甜味和鲜味。
中华绒螯蟹的口味还受烹饪方式的影响。付娜等[3]报道蒸制中华绒螯蟹腹肉、钳肉、足肉和蟹膏中游离氨基酸总量比煮制的高。杨玲芝[4]36指出呈鲜味的Glu含量随着加热时间延长而增加。中华绒螯蟹主要的烹饪方式是蒸和煮,2种烹饪方式又可分为冷水下锅和热水下锅。但至今未见下锅水温对中华绒螯蟹食用品质影响的研究报道。动物在应激过程中肝脏[5-6]、肌肉[6]中游离氨基酸含量会发生变化,例如,中华绒螯蟹肌肉中的亮氨酸、异亮氨酸含量会降低,谷氨酸的含量会升高[4]36。中华绒螯蟹烹饪时下锅水温不同,其应激反应强度也不同,因此可能对口味产生潜在的影响。
甲壳动物的体色取决于其中类胡萝卜色素群的浓度[7],主要是虾青素的浓度。由于虾青素结构中长共轭不饱和双键数量较多,性质极不稳定, 光、热、酸、碱等均有可能破坏其结构[8]。研究[9]表明,随着温度的升高,虾青素的稳定性会有所下降。此外,虾青素作为一种高效的抗氧化剂,在动物应激时能发挥清除自由基的作用[10],并被代谢分解[11]。因此,中华绒螯蟹烹饪过程中下锅水温不同可能会导致营养质量和体色的差异。
已有很多文献[3,5][4]14-16报道蟹类的风味,但主要集中在氨基酸等指标的分析,缺乏基于感官鉴定基础上的营养价值分析。本试验拟比较冷水蒸制、冷水煮制、热水蒸制、热水煮制4种烹饪方式对中华绒螯蟹不同部位游离氨基酸、核苷酸及虾青素含量的影响,同时进行感官评定,旨在探讨中华绒螯蟹对烹饪胁迫的响应,筛选合理的烹饪方式。
1 材料和方法
1.1 材料与仪器
1.1.1 材料
中华绒螯蟹180只,于2016年10月17日购于乐水农业科技(苏州)有限公司,体重均为(100±10) g,所有个体均为完成生殖脱壳的硬壳蟹,健康且附肢齐全。购回后,用清水浸泡0.5 h并冲洗数次,用毛巾擦拭干净待用。
向编号为A、B、C、D的4口锅中加入4 L蒸馏水,其中A、C锅中放置有蒸笼。A、B锅中放入螃蟹后置于电磁炉上大火(2 000 W)加热至沸腾,再继续加热15 min。C、D锅放在电磁炉上大火加热至沸后放入中华绒螯蟹,再继续加热20 min。每锅15只螃蟹,每个处理3次重复。
烹饪结束后,从每锅中随机抽取5只,采集肝胰腺、性腺和肌肉,置于样品袋中,编号。将头胸甲用清水冲洗,试管刷刷净,去除表面的油以及黏连的蟹肉,置于样品盒内。将组织样品称重后准确加入适量纯水,用组织捣碎机打匀后再冷冻干燥,并计算鲜样中水分含量。所有组织在进行冷冻干燥时采用避光处理。
1.1.2 试剂
磺基水杨酸、正己烷、丙酮、氢氧化钠、高氯酸、乙酸乙酯:分析纯,国药集团化学试剂有限公司;
甲醇:色谱纯,上海安谱实验科技股份有限公司;
游离氨基酸标准品:赛卡姆(北京)科学仪器有限公司;
虾青素标准品:西格玛奥德里奇(上海)贸易有限公司。
1.1.3 仪器
氨基酸分析仪:S-4330型,北京捷胜依科科技发展公司;
高效液相色谱仪:岛津LC-20AT型,苏州普今生物科技有限公司;
冷冻干燥机:LGJ-18型,北京四环科学仪器厂有限公司。
1.2 试验方法
1.2.1 蛋白和脂肪含量分析
(1) 粗蛋白含量:采用凯氏定氮法测定[12]。
(2) 粗脂肪含量:采用索氏抽提法测定[13]。
1.2.2 游离氨基酸含量分析 参照陈德慰[14]17的方法,并修改如下:称取0.50 g左右的组织样品,加入5%磺基水杨酸5 mL,匀浆2 min,4 ℃静置过夜。匀浆液12 000 r/min离心10 min,将上清液转移至15 mL离心管中;重复3次,但第2、3次提取时加入的磺基水杨酸分别为3,2 mL。合并上清液,用5%磺基水杨酸定容至15 mL;取1.5 mL左右的液体,用0.45 μm水系滤膜过滤至进样小瓶,4 ℃保存。使用S-4330型氨基酸分析仪进行测定,样品中的游离氨基酸通过Li+型强酸性阳离子交换树脂被逐一淋洗,经过茚三酮柱衍生反应后,混合物进入双通道光度计检测。仪器运行条件为:S2100压力5.2×106Pa,总流速0.45 mL/min;S4300压力6.0×105Pa,总流速0.25 mL/min,反应器温度130 ℃。
1.2.3 核苷酸分析 参照文献[15]和[16]12的方法,并修改如下:称取0.50 g左右的组织样品,加入5%的高氯酸4.5 mL,冰浴下高速匀浆(20 000 r/min,30 s × 2次),再经8 000 r/min离心10 min,取上清液,沉淀用5%的高氯酸2.5 mL重复提取2次,合并上清液,用15 mol/L 氢氧化钠调pH至6.5,样品提取液用5%的高氯酸定容至10 mL,0.45 μm滤膜过滤后采用高效液相色谱法分析。高效液相色谱运行条件:色谱柱为KromstarTMC18(4.6 mm×100 mm,5 μm),流动相0.05 mol/L的磷酸氢二钾,流速1 mL/min,检测波长260 nm,柱温为室温,进样体积20 μL。
1.2.4 虾青素含量分析 根据孔丽[16]11-12的方法:称取0.50 g左右磨碎的头胸甲粉末于50 mL棕色离心管中,加入30 mL丙酮,冰浴匀浆(10 000 r/min,1 min);匀浆液4 ℃离心(8 000 r/min,10 min),将上清液转移至250 mL分液漏斗,重复上述步骤3次至提取液无色,合并上清液;加40 mL正己烷和100 mL 0.5% 氯化钠溶液,摇匀静置25 min后,放掉下层水溶性成分,在上层提取液中加入5 g无水硫酸钠脱水,转入棕色容量瓶中并用正己烷定容至50 mL;用0.45 μm有机系滤膜过滤至棕色进样小瓶,4 ℃保存。高效液相色谱法测虾青素含量运行条件:色谱柱为KromstarTMC18(4.6 mm×100 mm,5 μm),流动相为甲醇与乙酸乙酯混合液,其中甲醇与乙酸乙酯体积比为1∶1,流速1 mL/min,检测波长470 nm,柱温为室温,进样体积20 μL。标准曲线为:y=2 021 000x+3 800,R2=0.999。
1.2.5 感官鉴评 邀请了38名感官鉴评员。所有参评人员均具备食品感官鉴定的知识与经验,且无不良嗜好、偏食及过敏反应。所有参评人员在感官调查前1 h内禁止进食、吸烟、饮酒以及进行其他影响调查的活动。由2名熟练的学生将中华绒螯蟹头胸甲与整体分离,分别置于有编号的碟子中,供参与者品尝和鉴定。参评人员在品尝完一个样品后需用纯净水漱口再进行下一个样品的品尝。感官鉴定的表格采用强制性排名法(1~4),数值越大,表示特征越强。感官评价标准见表1。
1.2.6 数据分析 所有数据以平均值±标准差表示。采用统计软件SPSS 21.0对数据进行单因素方差分析、二因素有重复交叉分组方差分析,其中二因素有重复交叉分组方差分析将得出单个因素及二因素对各指标影响的大小,显著水平为0.05。
2 结果与分析
2.1 中华绒螯蟹感官鉴定
烹饪方式对中华绒螯蟹色度、味道影响的感官评价结果见表2,感官评价总得分平均值以热蒸组最高,但各组织不同评价指标的得分与总评分并不完全一致。就颜色而言,热煮组头胸甲色泽得分最高,冷蒸组显著低于其他各组(P<0.05)。而肝胰腺黄色得分几乎与头胸甲色泽的相反,热煮组最低,冷蒸组最高,两者差异显著(P<0.05)。各处理间性腺的红色得分高低与肝胰腺黄色得分基本一致。不同烹饪方式对3个可食部分的鲜味均没有显著影响(P>0.05),对肝胰腺甜味也没有显著影响(P>0.05),但肌肉的甜味以热煮组最低,且显著低于其它3组(P<0.05),而其他3组间差异不显著(P>0.05)。性腺的甜味及整蟹的香味得分均表现为热水下锅组极显著高于冷水下锅组(P<0.01)。

表1 感官评价标准
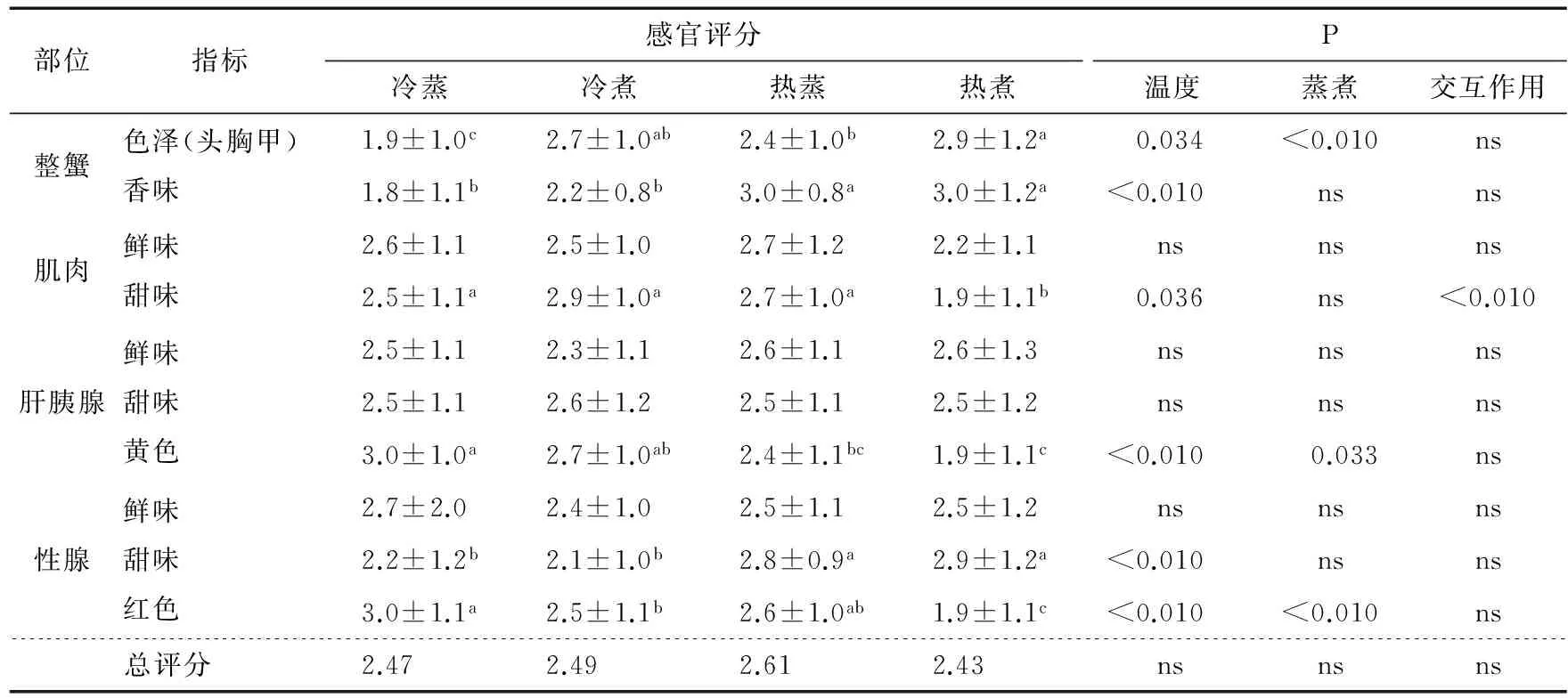
表2 烹饪方式对中华绒螯蟹色度、味道影响的感官评价†
† 同行不同字母表示差异显著(P<0.05),ns表示差异不显著(P>0.05)。
2.2 烹饪方式对中华绒螯蟹概略养分的影响
熟制中华绒螯蟹各部分的概略养分(鲜物质基础)见表3。肝胰腺水分含量为41.9%~43.6%,粗蛋白含量为11.5%~12.6%,粗脂肪含量为41.73%~44.51%;性腺水分为52.1%~54.1%,粗蛋白含量为28.5%~31.3%,粗脂肪含量为10.70%~12.55%;肌肉水分为75.4%~77.1%,粗蛋白为17.8%~21.5%,与杨玲芝[4]12-13的结果基本一致。由3个可食部分的概略养分结果可见,成熟中华绒螯蟹的肝胰腺是个高脂肪的组织。由于肝胰腺中的脂类在加热过程容易形成醛酮类香气物质,因此肝胰腺是中华绒螯蟹香气物质的主要来源[17]。热水下锅组中华绒螯蟹的肝胰腺脂肪含量略高于冷水下锅组,可能是其香味得分数显著高于冷水组(P<0.05,表1)的原因之一。
由表3可知,烹饪方式显著影响可食部分的水分(P<0.05),冷煮组性腺、肌肉水分显著高于蒸制组(P<0.05)。因为煮制时中华绒螯蟹浸泡在水中,熟制后携带的水分稍高。烹饪方式对脂肪的影响表现得相对复杂,冷煮组性腺中脂肪含量显著低于冷蒸组(P<0.05),热水下锅组却相反(P<0.05),可能与熟制过程中脂肪渗出量不同以及组织中水分含量不同等因素有关。
烹饪方式对3个可食部分蛋白含量的影响不显著,但均呈现出热水组高于冷水组的趋势,可能是热水下锅组蛋白质迅速变性[18],溶解度下降,流失的蛋白质相对较少。蛋白质的这种变化趋势对上述各处理组脂肪含量的差异应该也有影响。
2.3 烹饪方式对中华绒螯蟹虾青素含量的影响
已有的研究表明,超过70 ℃时虾青素稳定性就会降低[19],即使温度低于70 ℃,受热后动物强烈的应激反应也会导致虾青素的消耗[20-22]。不同烹饪方式下中华绒螯蟹应激强度不同,各组织中虾青素受热破坏的程度以及动用虾青素清除自由基的程度不同,因而烹饪后各组间的含量也不同。由表4可知,下锅温度对中华绒螯蟹头胸甲中虾青素含量的影响显著。冷水下锅组中华绒螯蟹头胸甲中虾青素含量显著低于热水下锅组(P<0.05),其中冷蒸组最低,与感官评价时该组的头胸甲色泽得分最低一致。但肝胰腺中虾青素含量却以冷蒸组最高,与预期完全相反。热水下锅组的蟹很快被熟化,就2个冷水下锅组相比较,水温升至70 ℃时煮制的中华绒螯蟹大多已熟化,甲壳由青变红,但此时热蒸汽还较少,因此,冷蒸组的蟹仍然存活。从抗应激的角度来看,冷蒸组应激时间最长,因此预测肝胰腺中虾青素含量应该最低;从受热直接氧化的角度来看,冷蒸组在70 ℃以上的时间最短,因此预测头胸甲中虾青素含量应该较高。本试验结果提示,冷蒸组中华绒螯蟹在受热致死前可能启动了自我保护机制,将蟹壳中的虾青素迅速释放到肝胰腺中,以消除氧化应激损伤。但具体机制还有待于进一步验证。
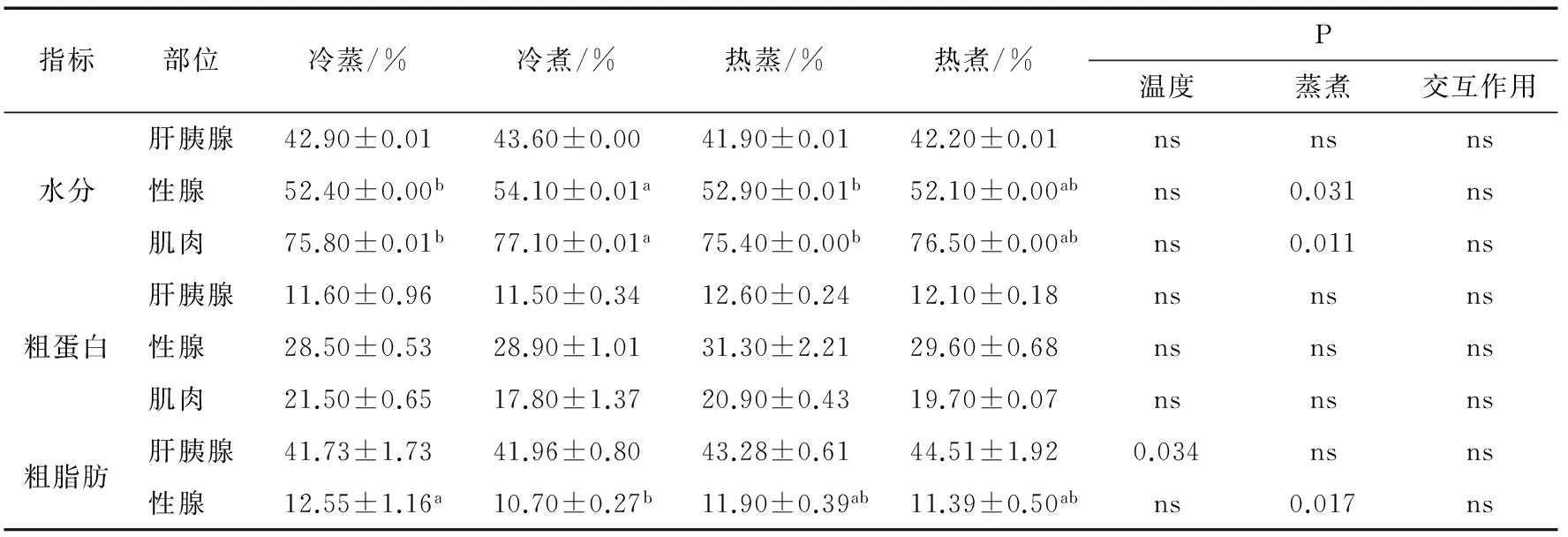
表3 4种烹饪方式下中华绒螯蟹可食部分的水分、粗蛋白、粗脂肪含量†
† 同行不同字母表示差异显著(P<0.05),ns表示差异不显著(P>0.05)。
虾青素的抗氧化能力是VE的550倍,能有效阻止不饱和脂肪酸过氧化[23]。另外,它还可以穿过细胞膜和血脑屏障,直接与肌肉组织结合。因此,它对眼和大脑的抗氧化保护、抑制肿瘤并增强免疫力优势非常明显[24]。中华绒螯蟹虽然能提供优质蛋白和脂肪,但蛋白及脂肪膳食来源广泛,相对而言,膳食中虾青素的来源相对不足。冷蒸组肝胰腺中虾青素含量是其他处理的2倍以上,提示应进一步研究烹饪过程中虾青素的变化规律及变化机制,从而提高可食部分虾青素的保留量。
2.4 烹饪方式对中华绒螯蟹游离氨基酸和核苷酸含量的影响
游离氨基酸是呈味的物质基础[14]1-4,往往游离氨基酸含量越高,食品的味道越鲜美[4]13-14。由表5~7可知,在3个可食组织中,肌肉总游离氨基酸含量(TFAA)较高(62.01~78.44 mg/g),性腺和肝胰腺中TFAA均约为肌肉中的一半。肌肉是中华绒螯蟹最大的蛋白质储存库[25],其蛋白在肌肉中含量达17.8%~21.5%(见表3),折算成干物质含量则高达80.1%~87.9%,是其TFAA含量高于其它2个组织的原因[4]13[25]。在TFAA种类上,Tau、Glu、Gly、Ala、Arg、Pro这几种氨基酸在3个组织中含量均较高。其中Glu含量高于已有的文献报道[2,25-26],差异可能与产地[4]25-30、成熟度和饲料[26]有关。
由表5、6可知,肌肉和性腺中TFAA含量受烹饪方式的影响显著(P<0.05),具体表现为热蒸组最高,冷蒸组最低。Laakkonen等研究发现高温或加热时间过长,使得蛋白中的酶完全失去活性,蛋白质过度聚合变性[27],同时蛋白疏水性会增强[28]。本试验中热水下锅处理组蛋白质可能迅速变性,快速固定了游离氨基酸,而氨基酸随水分流失较少,加上疏水性增强,表现为机体内TFAA含量较高。虽然肌肉和性腺中TFAA差异显著(P<0.05),但感官评定时未发现各处理间鲜味的显著差异,感官评价的灵敏度可能不足以分辨TFAA含量为62.01 mg/g和78.44 mg/g(见表5)以及28.82 mg/g和34.56 mg/g(见表6)的区别。
煮制相当于样品稀释过程[3],但本试验结果显示,冷煮组TFAA含量反而比冷蒸组高(P>0.05)。蒸汽主要在水沸腾后产生,因此冷蒸组中华绒螯蟹在下锅至蛋白质变性的时间较冷煮长,损失的游离氨基酸可能相对较多。

表4 4种烹饪方式下中华绒螯蟹头胸甲、性腺和肝胰腺中虾青素含量 †
† 同行不同字母表示差异显著(P<0.05),ns表示差异不显著(P>0.05)。

表5 4种烹饪方式下中华绒螯蟹肌肉中的游离氨基酸含量†
† 同行不同字母表示差异显著(P<0.05),ns表示差异不显著(P>0.05),nd表示未检测到。
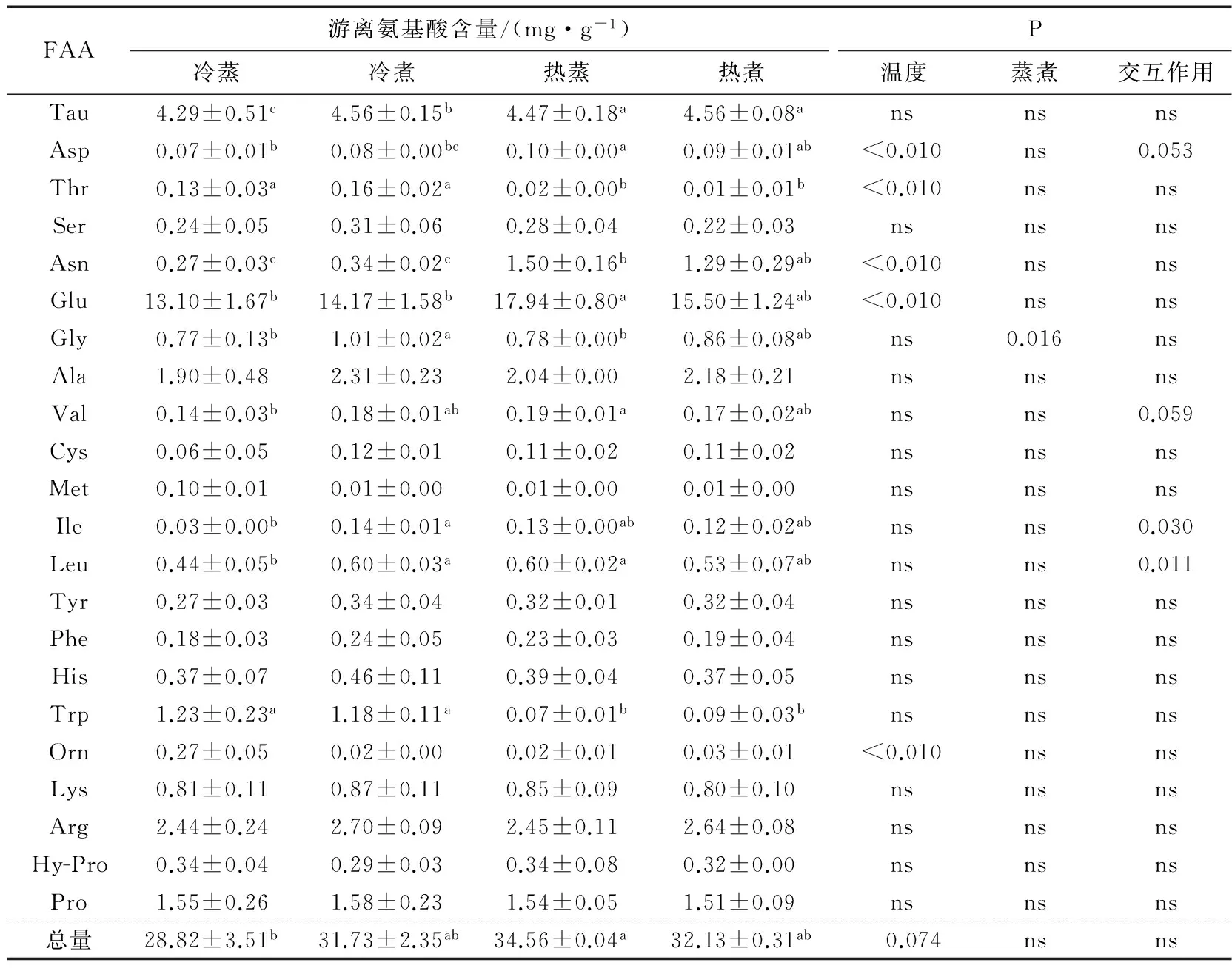
表6 4种烹饪方式下中华绒螯蟹性腺中的游离氨基酸含量†
† 同行不同字母表示差异显著(P<0.05),ns表示差异不显著(P>0.05)。

表7 4种烹饪方式下中华绒螯蟹肝胰腺中的游离氨基酸含量†
† 同行不同字母表示差异显著(P<0.05),ns表示差异不显著(P>0.05),nd表示未检测到。
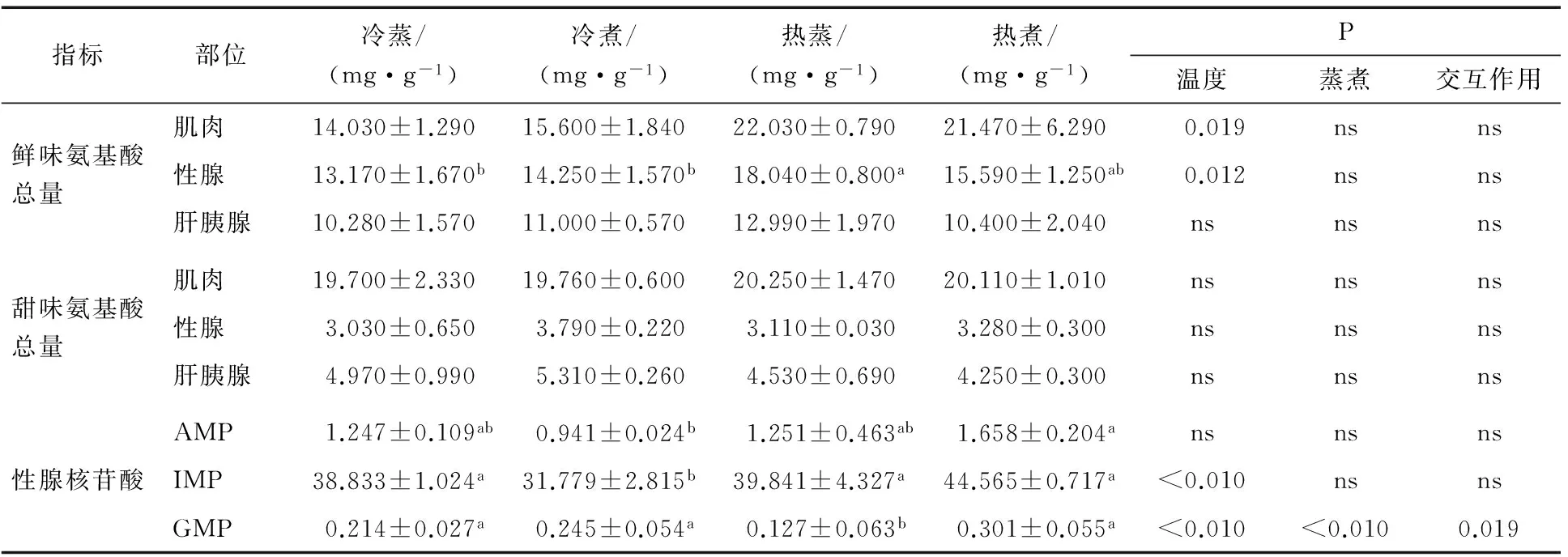
表8 4种烹饪方式下中华绒螯蟹可食部分呈鲜味和甜味的氨基酸总量以及性腺中的核苷酸含量†
† 同行不同字母表示差异显著(P<0.05),ns表示差异不显著(P>0.05)。
Asp和Glu为主要的呈鲜味氨基酸[14]1-4[29]。从鲜味氨基酸总量(Total Umami Free Amino acids,TUFA)看,热水下锅组肌肉中TUFA(22.03,21.47 mg/g)含量显著高于冷水下锅组(15.60,14.03 mg/g)(P<0.05),性腺也同样如此。各组间TUFA和TFAA的差异都与感官评价的总评分一致,都是热蒸组最高,烹饪方式对游离氨基酸的影响是造成口感风味差异的原因之一。
Gly、Ala、Ser、Thr为呈甜味的主要氨基酸[14]1-4[29]。本试验结果显示,3个可食部分的甜味氨基酸总量差异均不显著,推测感官评价中发现的甜味差异可能是由其它因素导致的。
核苷酸同样是产生鲜美可口味道的重要化合物[4]30-31,这些物质本身呈鲜味,还可与游离氨基酸产生协同效应,从而增强中华绒螯蟹的甜味和鲜味。中华绒螯蟹可食部分5’-核苷酸的钠盐含量较高[2]。杨玲芝[4]39-41报道中华绒螯蟹肝脏、肌肉的核苷酸总量仅是雌蟹性腺的1/12,因此本试验选取性腺作核苷酸检测对象。结果显示,熟制后中华绒螯蟹性腺中核苷酸总量为3 000 mg/100 g(见表8),高于文献[4]39-41中报道的值(1 300 mg/100 g),可能与中华绒螯蟹养殖地区、生长阶段有关[4]25-30[25]。
本试验热蒸组性腺中GMP含量显著低于其他3组(P<0.01),冷煮组IMP含量显著低于其他3组(P<0.01),而感官评定结果显示各组性腺的鲜味并没有显著差异(P>0.05),因此烹饪方式造成的GMP含量的差异不足以造成感官鉴定时鲜味的差异,与陈德慰[14]31-32的研究结果一致。
3 结论
不同烹饪方式下,中华绒螯蟹不同部位的感官评价得分不一致,以热蒸组总评分最高;各组织游离氨基酸总量显著不同,均以热水下锅组游离氨基酸含量较高;熟制方式会影响甜味氨基酸、鲜味氨基酸以及核苷酸含量,但这种影响不足以造成显著的感官差异。综合感官评定和风味物质的检测结果,热水下锅蒸制是烹饪中华绒螯蟹的优选方式。
在蟹类烹饪研究中,有学者[30]发现在保证最佳感官的前提下,电蒸箱蒸制可以较好地保留食材本身的营养。另有学者[3]发现与煮制相比,蒸制为较好的中华绒螯蟹的熟制方式。对于蟹类等水产品,消费者更注重基于感官评定下的营养价值比较。本试验在感官鉴定的基础上,进行了营养价值的比较,对日常烹饪中华绒螯蟹具有一定指导意义。而结果中发现冷水蒸制时头胸甲中虾青素含量低,但肝胰腺中含量是其他组的2倍以上,其机制值得更深层次的研究。
[1] MARTIN C, PASSILLY D P, SPARKS S M, et al. Impact of long chain fatty acids on sweet taste sensitivity in mice. Role of the GPR120/GLP-1 signaling[J]. Appetite, 2011, 57(Suppl 1): S29.
[2] 伍彬, 章超桦, 吉宏武, 等. 南美白对虾虾头自溶产物主要呈味成分分析[J].食品科学, 2010, 31(10): 184-187.
[3] 付娜, 王锡昌, 陶宁萍, 等. 蒸制和煮制中华绒螯蟹4个部位中游离氨基酸含量差异分析[J]. 食品科学, 2013, 34(24): 178-181.
[4] 杨玲芝. 中华绒螯蟹主要呈味物质及其加热过程中的变化[D]. 上海: 上海水产大学学报, 2006.
[5] BHASKAR M. Changes in the liver protein fractions of Tilapia mossambica, (Peters) during acclimation to low and high pH media[J]. Fisheries Research, 1994, 19(s 1/2): 179-186.
[6] SAHA N, DUTTA S, BHATTACHARJEE A. Role of amino acid metabolism in an air-breathing catfish, Clarias batrachus in response to exposure to a high concentration of exogenous ammonia[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2002, 133(2): 235-250.
[7] TERUHISA K, TADASHI K, CHICHERTER C O. The biosynthesis of astaxanthin. VI. the carotenoids in the prawn, Penaeus japonicus, bate (part II)[J]. International Journal of Biochemistry, 1972, 3(15): 363-368.
[8] 耿华田. 虾青素简介[J]. 化学教育,2007, 28(3): 5-7.
[9] 毛丽哈·艾合买提, 吐力吾汗·阿米汗, 阿布都拉·艾尼瓦尔. 虾壳虾青素的提取及其稳定性研究[J]. 食品安全质量检测学报, 2013, 4(3): 905-910.
[10] 陈晋明, 王世平, 马俪珍, 等. 虾青素抗氧化活性研究[J]. 营养学报, 2007, 2(2): 163-169.
[11] 刘合露, 郑怀平, 张涛, 等. 海产动物体内虾青素的代谢及转运沉积[J]. 海洋科学, 2010, 34(4): 104-108.
[12] 中国卫生部. GB 5009.5—2010 食品安全国家标准 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010: 1-3.
[13] 中国卫生部. GB/T 9695.7—2008 肉与肉制品 总脂肪含量测定[S]. 北京: 中国标准出版社, 2008: 1-4.
[14] 陈德慰. 熟制大闸蟹风味及冷冻加工技术的研究[D]. 无锡: 江南大学, 2007.
[15] LIU Jing-ke, ZHAO Si-ming, XIONG Shan-bai, et al. Influ-ence of recooking on volatile and non-volatile compounds found in silver carp Hypophthalmichthys molitrix[J]. Fisheries Science, 2009, 75(4): 1 067-1 075.
[16] 孔丽. 中华绒螯蟹感官品质的差异及改良方法[D]. 苏州: 苏州大学, 2012.
[17] GU Sai-qi, WANG Xi-chang, TAO Ning-ping, et al. Characterization of volatile compounds in different edible parts of steamed Chinese mitten crab ( Eriocheir sinensis )[J]. Food Research International, 2013, 54(1): 81-92.
[18] 李媛, 刘通讯, 王永江. 低值鱼蛋白的热变性与酶解特性关系研究[J]. 食品科学, 2005, 26(5): 50-53.
[19] 张影霞, 武利刚, 罗志辉, 等. 虾青素的提取及其稳定性的研究[J]. 现代食品科技, 2008, 24(12): 1 288-1 291.
[20] 谢剑华, 管越强, 王静波. 虾青素对日本沼虾血细胞密度及吞噬活力的影响[J]. 河北渔业, 2008(1): 8-10.
[21] PAN C H, CHIEN Y H, HUNTER B. The resistance to ammonia stress of Penaeus monodon Fabricius juvenile fed diets supplemented with astaxanthin[J]. Journal of Experimental Marine Biology & Ecology, 2003, 297(1): 107-118.
[22] CHIEN Y H, PAN C H, HUNTER B. The resistance to physical stresses by Penaeus monodon, juveniles fed diets supplemented with astaxanthin[J]. Aquaculture, 2003, 216(1/2/3/4): 177-191.
[23] GUERIN M, HUNTLEY M E, OLAIZOLA M. Haematococ-cus astaxanthin: applications for human health and nutrition.[J]. Trends in Biotechnology, 2003, 21(5): 210-216.
[24] 付佳, 杨月欣, 张立实. 天然虾青素的生物保健功能及安全性概述[J]. 环境卫生学杂志, 2007, 34(6): 382-386.
[25] 赵樑, 吴娜, 王锡昌, 等. 不同生长阶段下中华绒螯蟹滋味成分差异研究[J]. 现代食品科技, 2016(7): 261-269.
[26] 代伟伟, 麦康森, 徐玮, 等. 饲料中赖氨酸和精氨酸含量对大菱鲆幼鱼生长、体成分和肌肉氨基酸含量的影响[J]. 水产学报, 2015, 39(6): 876-887.
[27] LAAKKONEN E. Factors Affecting Tenderness During Heating of Meat[J]. Advances in Food Research, 1973, 20: 257-323.
[28] 李晓龙. 热诱导日本对虾(Marsupenaeus japonicus)虾肉蛋白质变性规律研究[D]. 广东: 广东海洋大学, 2015.
[29] 张娜, 袁信华, 过世东. 中华绒螯蟹不同部位游离氨基酸的测定与分析[J]. 天然产物研究与开发, 2009, 21(4): 634-637.
[30] 朱塽, 郑忻, 刘梦茵, 等. 不同蒸制方式下太湖蟹感官评定及营养价值比较[J]. 食品与机械, 2017, 33(1): 32-38.
Effect of cooking condition on the sensory and flavour quality of Chinese mitten crab (Eriocheirsinensis)
HE Jie CAI Chun-fang WANG Yong-lin YANG Cai-gen ING Lei
(School of Biology and Basic Medical Science, Soochow University, Suzhou, Jiangsu 215123, China)
Steaming and boiling, the two main methods to cook Chinese mitten crab(Eriocheirsinensis), were investigated, started from hot water and cold water respectively. In order to screen optimal cooking method, the content of free amino acid, nucleotide and astaxanthin in edible parts as well as head shell were compared among crabs cooked in four condition, i.e. steaming with cold and hot water respectively and boiling with cold and hot water respectively. The results showed that the total free amino acids content and the total umami amino acids in muscle and gonad, and astaxanthin content in head shell of crab cooked with hot water were significantly higher than that cooked with cold water (P < 0.05). Sensory evaluation showed that cooking condition influenced the redness and sweetness of edible parts significantly (P < 0.05), with most redness observed in gonad and hepatopancreas of crab cooked by steaming with cold water, and more sweetness noticed in gonad of crab cooked with hot water. However, in general, steaming with hot water obtained the highest score in sensory evaluation. These results suggested it was optimal to cook crabs by steaming with hot water.
Eriocheirsinensis; cooking method; free amino acid; nucleotide; astaxanthin; sensory evaluation
何捷,女,苏州大学在读硕士研究生。
蔡春芳(1967—),女,苏州大学教授,博士。 E-mail:caicf@suda,edu,cn
2017—03—31
10.13652/j.issn.1003-5788.2017.06.011

