脉冲电场对蛋白质与金属离子螯合作用的影响
汤 婷 刘燕燕 蒋爱民 蒋 卓
(华南农业大学食品学院,广东 广州 510642)
脉冲电场对蛋白质与金属离子螯合作用的影响
汤 婷 刘燕燕 蒋爱民 蒋 卓
(华南农业大学食品学院,广东 广州 510642)
采用拉曼光谱研究脉冲电场对卵清蛋白与金属离子(Cu2+、Ba2+、Mn2+或 Ca2+)螯合作用的影响。试验结果表明:① PEF处理时间和金属离子种类都能影响金属离子和蛋白质的螯合作用,随着脉冲时间的延长,金属离子与卵清蛋白的螯合作用增强,PEF处理时间为1 695 μs时,Mn2+和Cu2+与蛋白质的鳌合开始减弱;② 蛋白质分子和金属离子在1 200~1 700 cm-1位置出现不同程度的螯合:与Mn2+鳌合最强,Cu2+和Ca2+较弱,Ba2+最弱。
脉冲电场;卵清蛋白;拉曼光谱;金属离子;螯合作用
脉冲电场(Pulsed Electric Fields,PEF)处理技术是一种新型的食品绿色加工技术[1-2],能在保持食品风味和营养成分的前提下[3-4],不可逆破坏微生物的细胞膜结构,杀死病原微生物和腐败微生物,达到杀菌的目的[5-6],并在钝酶、消除农残、物质提取等方面都有增强效应[7-9]。通过圆二色谱、荧光光谱等方法研究PEF对蛋白质二级结构的影响,已有数据[10-11]表明PEF诱导酪氨酸和色氨酸的构象改变,二硫键和疏水基团的暴露,α-螺旋和β-折叠等结构的改变。张芳等[12]研究表明,金属离子与蛋白质结合后会引起氨基酸残基周围的化学环境发生变化,导致这些残基化学位移发生改变。金属离子与蛋白质的结合可能是高度专一的、紧密的,也可能是瞬态的、松散的。由于金属离子与蛋白质结合会导致蛋白质分子结构和功能特性的改变,金属离子在蛋白质分子结构和生物学功能方面都起着关键作用[13]。因此,本研究采用脉冲电场调控金属离子和蛋白质的结合,从而得到理想的蛋白质分子结构。
拉曼光谱是一项能够在不破坏生物组织、分子的前提下,对活体生物、细胞以及蛋白水溶液进行光谱采集,进而提供蛋白质二级和三级结构信息的直接分析技术[14-16]。相对于傅立叶红外转换光谱和圆二色谱,它能提供更广泛的结构信息,包括脂肪族氨基酸的C—H基团等氨基酸的侧链信息。研究表明,通过拉曼光谱研究不同条件对蛋白质变性的影响[17],还可通过观察O—H的伸缩变化研究蛋白质和水的相互作用[18]。
本试验以卵清蛋白(Ovalbumin)为原料,结合相关文献[19-21]对卵清蛋白的拉曼图普解析知识,利用拉曼光谱检测PEF对蛋白质与金属离子鳌合作用的影响,为脉冲电场在食品中更广泛的运用提供理论依据。
1 材料与方法
1.1 材料与仪器
卵清蛋白:白蛋白,美国Sigma公司;
脉冲电场处理装置:SY-Z-500型,华南理工大学食品与食品学院研制;
低温冷冻液循环泵:DLSK-3/10型,郑州科泰实验设备有限公司;
恒流泵:BT100-2J型,英国Longer公司;
数显电导率仪:DDS-11A型,上海雷磁·创益仪器仪表有限公司;
冷冻干燥机:SCIENTZ-18N型,宁波新芝生物科技有限公司;
拉曼光谱仪:LabRAM Aramis型,法国H.J.Y公司。
1.2 试验方法
1.2.1 卵清蛋白处理流程 配制10 g/L卵清蛋白溶液,透析12 h后,使电导率低于180 μs/cm,分别以摩尔比1∶3,1∶4,1∶6,1∶4加入Cu2+,Ba2+,Mn2+,Ca2+。在不同脉冲条件下获得PEF处理样品,冷冻干燥后,待用。
1.2.2 脉冲电场参数 脉冲宽度20 μs,电场强度20 kV/cm,流速25 mL/min,样品接受电脉冲处理时间分别为565,1 130,1 695,2 260 μs。
1.2.3 拉曼光谱分析 将处理样品放在拉曼显微镜下,激光波长785 nm,光栅600 grades/cm,激光功率>30 mW,夹缝宽度50~800 μm,扫描范围100~400 cm-1,扫描时间20 s,积分5次。所有图片均使用ORIGIN 9.0 绘制处理。
1.3 拉曼光谱中特征波段的指认
蛋白质构象或构型的变化引起拉曼激光的散射程度呈现不同的吸收峰位置、强度和退偏比,从而得到氨基酸侧链的构象信息及其微环境的变化情况等。拉曼谱图中不同波段的卵清蛋白分子基团和结构信息见1。

表1 拉曼光谱中特征波段的指认[19-21]
2 结果与分析
2.1 金属离子对卵清蛋白分子微观结构的影响
结合图1和表1,添加金属离子后,相对空白样,卵清蛋白的微观结构改变,金属离子和卵清蛋白分子在1 700~1 200 cm-1位置存在差异性螯合:添加Mn2+、Cu2+和Ba2+分别在1 700~1 200 cm-1,1 400~1 200 cm-1和1 660 cm-1,1 458 cm-1和1 660 cm-1处出现结构变化,添加Ca2+不存在明显的结构变化,说明Mn2+鳌合作用最强,Ba2+和Cu2+次之,Ca2+最弱。
金属离子(Mn2+、Ba2+、Cu2+、Ca2+)的加入,引起760 cm-1和840 cm-1吸收峰变化,表明金属离子引起色氨酸和酪氨酸残基基团状态改变,说明蛋白质分子微环境变化;而995,1 458,1 660 cm-1附近峰峰强增强,说明金属离子影响卵清蛋白分子中的无规则卷曲结构,脂肪酸侧链C—H弯曲和酰胺Ⅰ带无规则结构,蛋白质分子极性环境增强。3 000~2 800 cm-1波段的吸收峰发生变化,加入Ca2+,吸收峰强度峰强减小;加入Mn2+、Ba2+和Cu2+,吸收峰强度增加,说明金属离子影响卵清蛋白分子中脂肪族侧链C—H伸缩,Ca2+诱导其微环境极性减小,Mn2+、Ba2+和Cu2+诱导其微环境极性增强。

图1 金属离子影响卵清蛋白分子Raman图
2.2 脉冲电场对添加Ca2+的卵清蛋白分子微观结构的影响
由图2和表1可知,对比未经PEF处理的加Ca2+的卵清蛋白图谱,随着处理时间的延长,1 672 cm-1处吸收峰向低波段迁移至1 660 cm-1,且峰强明显增强,说明PEF能量的输入引起卵清蛋白分子中酰胺Ⅰ带β-折叠减少,无规则结构增多,蛋白质分子展开增强;1 454 cm-1吸收峰峰强增强,说明PFF诱导脂肪族侧链C—H弯曲,微环境极性增强;1 400~1 200 cm-1波段的吸收峰峰强增强,说明PEF引起C—H平面弯曲和C—N伸缩增强,蛋白质分子微环境极性改变,即PEF诱导Ca2+和蛋白质分子在1 700~1 200 cm-1位置螯合增强。
同时,PEF处理诱导在541,763,946 cm-1峰强度增强,说明PEF引起蛋白质分子脂肪族侧链构象和色氨酸周围环境改变,以及无规则卷曲结构增多;对于2 800~3 050 cm-1波段的峰,随着脉冲处理时间的延长,2 970 cm-1附近峰峰形更趋均一单峰,说明PEF引起脂肪族侧链C—H伸缩振动,微环境极性增强[1]。
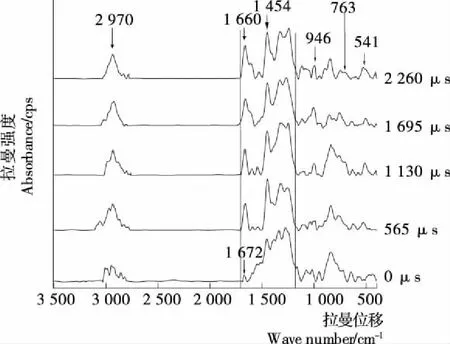
图2 PEF协同Ca2+影响卵清蛋白分子Raman图
2.3 脉冲电场对添加Cu2+的卵清蛋白分子微观结构的影响
经PEF处理后,添加Cu2+的卵清蛋白分子得到拉曼光谱图见图3,在1 700~1 200 cm-1位置螯合增强。随着PEF处理时间延长,1 400~1 200 cm-1波段吸收峰强度增强,其中1 260 cm-1吸收峰向低波段迁移,且峰强增加,说明PEF诱导卵清蛋白分子酰胺Ⅲ带结构变化,α-螺旋结构减少,无规则结构增多;1 596 cm-1开始出现吸收峰,其峰强随处理时间延长而增大,说明PEF增强了C—H伸缩和N—H变形振动;1 660 cm-1峰强增大,说明PEF诱导酰胺Ⅰ带无规则结构增多。
同时在500,775,960,1 450 cm-1峰强先增加后降低(在处理时间为1 695 μs时开始降低),说明PEF诱导卵清蛋白分子中脂肪族侧链的构象变化,色氨酸包埋残基、无规则卷曲结构先增加后减少,蛋白分子的微环境极性先增强后减弱,1 695 μs时蛋白质开始变性。850,830 cm-1代表酪氨酸酚羟基及酪氨酸的状态,I850/I830用来指示酚羟基基团的氢键以及酪氨酸包埋或暴露的状态。I850/I830增大,说明PEF诱导赖氨酸酚羟基基团氢键增多,酪氨酸被包埋程度增加;2 957 cm-1处的明显吸收峰逐渐变为多个小杂峰,说明PEF影响脂肪族侧链C—H伸缩振动,微环境极性减弱。

图3 PEF协同Cu2+离子影响卵清蛋白分子Raman图
2.4 脉冲电场对添加Ba2+的卵清蛋白分子微观结构的影响
结合图4和表1,随着脉冲电场处理时间延长,添加Ba2+的卵清蛋白结构发生变化:1 600 cm-1峰消失,说明PEF诱导C—H伸缩振动和N—H变形振动变化,酰胺Ⅰ带结构变化;1 660 cm-1峰强先增大后减小,可能是PEF先打乱卵清蛋白分子中酰胺Ⅰ带结构,然后诱导无规则结构增加;同时,1 400~1 200 cm-1波段吸收强度逐渐增大,其中1 260 cm-1处吸收峰增大,说明PEF引起卵清蛋白分子酰胺Ⅲ带结构变化,α-螺旋增加;结果表明PEF诱导添加Ba2+的卵清蛋白分子展开减少,即Ba2+和蛋白质分子在1 700~1 200 cm-1位置螯合增强。
753 cm-1峰强增大,说明卵清蛋白分子中色氨酸侧链残基暴露程度,以及对微环境的敏感性增强;经PEF处理后,945 cm-1吸收峰消失,当PEF处理时间达到2 260 μs时,吸收峰又重新出现,且峰强增大,说明短时间电脉冲处理会使卵清蛋白分子中无规则卷曲结构展开,当处理时间达到一定时,会影响其C—C骨架振动,重新形成无规则卷曲结构;同时,未进行PEF处理的卵清蛋白在3 000~2 800 cm-1波段为多个小杂峰,经PEF处理后的在3 000~2 800 cm-1波段的吸收峰逐渐趋于单峰,最终在2 931 cm-1处形成均一单峰,说明PEF引起脂肪族侧链C—H伸缩振动,微环境极性增强[1]。
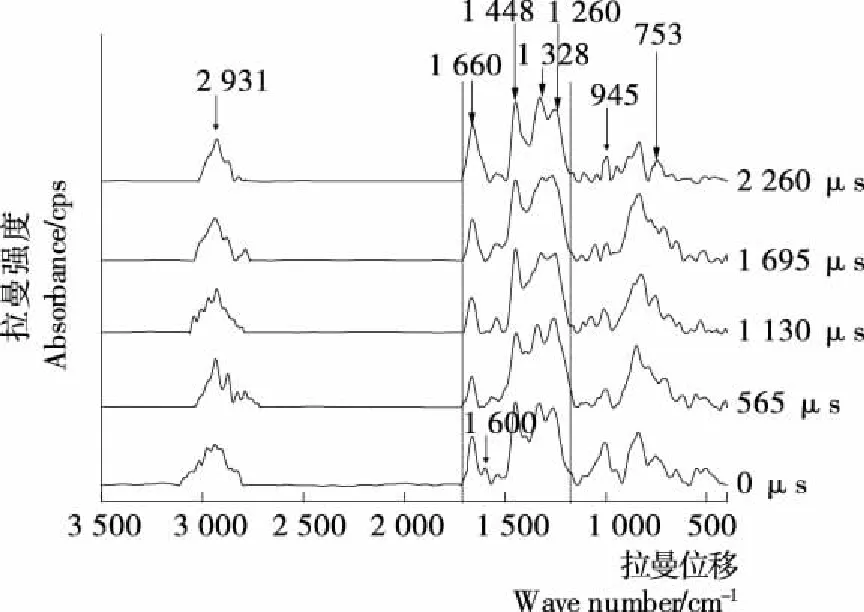
图4 PEF协同Ba2+离子影响卵清蛋白分子Raman图
2.5 脉冲电场对添加Mn2+的卵清蛋白分子微观结构的影响
结合表1,由图5可知,PEF在1 700~1 200 cm-1对Mn2+和蛋白质分子的螯合作用明显。对比未经PEF处理的Mn2+卵清蛋白,随着PEF处理时间延长,在1 400~1 200 cm-1波段的吸收强度逐渐减小,说明PEF影响卵清蛋白中C—H平面弯曲振动和C—N伸缩振动,结果表明PEF诱导添加Mn2+的卵清蛋白分子展开减少,即PEF诱导Mn2+和蛋白质分子在1 400~1 200 cm-1位置螯合减弱,可能是PEF扰乱蛋白质分子结构,影响了与金属离子的鳌合作用;1 600 cm-1处出现吸收峰,说明PEF引起卵清蛋白中酰胺键C═O伸缩,即PEF诱导Mn2+和蛋白质分子在1 600 cm-1螯合作用增强;1 660 cm-1处吸收峰随PEF处理时间延长而变化,说明565 μs时卵清蛋白分子中酰胺Ⅰ带结构被打乱,经PEF进一步处理,其无规则结构开始增多,处理1 695 μs后蛋白可能发生变性,无规则结构减少并保持稳定状态。
515,750 cm-1的吸收峰峰强逐渐增强,说明PEF诱导卵清蛋白分子中S—S伸缩变化,脂肪族侧链的构象变化,色氨酸的包埋残基减少,酰胺Ⅰ带无规则结构减少,对微环境的敏感程度减弱;946 cm-1处峰的位置和吸收强度均随处理时间发生变化,说明PEF诱导卵清蛋白分子中C—C骨架振动变化,无规则卷曲结构改变;2 910 cm-1处的强吸收峰逐渐变为多个小杂峰,说明PEF影响脂肪族侧链C—H伸缩振动,微环境极性改变。
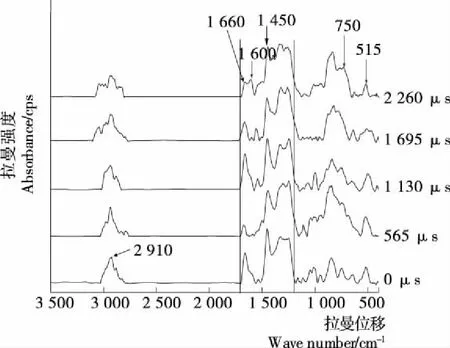
图5 PEF协同Mn2+影响卵清蛋白分子Raman图
3 结论
经过大量试验证明,金属离子过量会导致蛋白质变性。卵清蛋白和金属离子主要在1 700~1 200 cm-1波段具有鳌合作用,且不同金属对卵清蛋白微观结构的影响不同,其中,Mn2+影响最大,Ca2+影响最小,可能与电子层数和电子云密度有关。
PEF对金属离子和卵清蛋白鳌合作用的影响主要表现在加强1 700~1 200 cm-1波段吸收峰峰强。金属离子不同,影响程度也不同。其中,Mn2+影响最大,Ba2+最小,可能是由电子云密度造成的,Ba2+电子云密度最大,PEF穿透最难,导致蛋白质结构变化最小,因而对鳌合作用造成的影响最小。PEF处理时间对金属离子和卵清蛋白的鳌合作用也会造成影响,整体而言,处理时间与加强鳌合程度呈正相关,但不同金属离子影响不同。
[1] LIU Yan-yan, ZHANG Ying, ZENG Xin-an, et al. Effect of Pulsed Electric Field on Microstructure of Some Amino Acid Group of Soy Protein Isolates[J]. International Journal of Food Engineering, 2014, 10(1): 113-120.
[2] 曾新安, 资智洪, 杨连生. 高强脉冲电场对食品成分的影响[J]. 食品工业科技, 2008, 29(12): 256-259.
[3] ZHAO Wei, TANG Ya-li, LU Li-xin, et al. Review: Pulsed Electric Fields Processing of Protein-Based Foods[J]. Food and Bioprocess Technology, 2014, 7(1): 114-125.
[4] 颜文旭, 张姗姗, 公群. 高压脉冲电场杀菌多物理场特性研究[J]. 食品与机械, 2016, 32(2): 1-6.
[5] ZHANG Qing-hua, BARBOSACANOVAS G V, SWANSON B G. Engineering aspects of pulsed electric-field pasteurization[J]. Journal of Food Engineering, 1995, 25: 261-281.
[6] 夏涛, 吴云峰, 王胜利, 等. 高压脉冲电场杀菌系统中高压脉冲发生器研究进展[J]. 食品与机械, 2016, 32(5): 229-231.
[7] 曾新安, 刘燕燕, 李云, 等. 高强脉冲电场和热处理对橙汁维生素C影响比较[J]. 食品工业科技, 2009, 30(6): 123-124.
[8] 赵伟, 杨瑞金, 张文斌, 等. 高压脉冲电场对食品中微生物、酶及组分影响的研究进展[J]. 食品与机械,2010, 26(3): 153-157.
[9] 卢沿钢, 董全. 高压脉冲电场提取食品中天然产物的研究进展[J]. 食品与机械, 2012, 28(1): 243-246.
[10] 李乐军. 荧光光谱与激光拉曼光谱研究脉冲电场对蛋白质构象的影响[D]. 上海: 华东师范大学, 2005: 1-3.
[11] 贾晓, 曾新安. 拉曼光谱研究脉冲电场作用下磷脂脂质体构象的变化[J]. 食品工业科技, 2012, 33(5): 138-140.
[12] 张芳, 林东海. 用核磁共振方法研究金属离子与蛋白质的相互作用[J]. 波谱学杂志, 2009, 26(1): 136-149.
[13] 刘西海. 金属离子对蛋清蛋白质结构的影响研究[J]. 中国家禽, 2012, 34(1): 27-31.
[14] 赵南明. 生物物理学[M]. 北京: 高等教育出版社, 2000: 215-216.
[15] 王中江, 江连洲. 大豆分离蛋白在不同pH下的拉曼光谱分析[J]. 食品工业科技, 2012, 33(11): 65-70.
[16] 孙娟, 张晖, 王立, 等. 基于拉曼光谱的大米快速分类判别方法[J]. 食品与机械, 2016, 32(1): 41-45.
[17] 袁丽, 纪秀, 石彤, 等. 拉曼光谱法分析凡纳滨对虾冻藏过程蛋白质与水分结构变化[J]. 食品科学, 2016, 37(18): 202-207.
[18] HERRERO A M, CARMONA P, GARCIA M L, et al. Ultrastructural changes and structure and mobility of myowater in frozen-stored hake (Merluccius merluccius L.) muscle: relationship with functionality and texture[J]. Journal of Agricultural and Food Chemistry, 2005, 53(7): 2 558-2 566.
[19] 李乐军, 陈树德, 乔登江. 脉冲电场与牛血清白蛋白相互作用的同步荧光光谱和拉曼光谱比较研究[J]. 光谱学与光谱分析, 2006(1): 81-86.
[20] 黄群, 金永国, 马美湖, 等. 超高压处理对S-卵白蛋白构象与功能特性的影响[J]. 农业机械学报, 2013, 44(3): 161-166.
[21] CRAIG W S,GABER B P. Laser Raman scattering from an enzyme of well-documented structure,human carbonic anhydrase B[J]. J. Am. Chem. Soc., 1977, 99(12): 4 130-4 134.
Study on chelating of metal ion and protein in pulsed electric field
TANG Ting LIU Yan-yan JIANG Ai-min JIANG Zhuo
(College of Food Science, South China Agricultural University, Guangzhou, Guangdong 510642, China)
The effects of pulsed electric field on chelating of ovalbumin and metal ions (Cu2+, Ba2+, Mn2+or Ca2+) and the effect of pulsed electric field on the chelating effect of ovalbumin were studied by Raman spectroscopy. Results: ① PEF treatment time and metal ion species could affect the chelation of metal ions and protein, and the chelation of metal ions with ovalbumin was enhanced with the prolongation of pulse treatment time, when PEF treatment time was 1 695 μs, the chelation of Mn2+and Cu2+with protein began to weaken; ② The protein and metal ions chelated to different degrees at 1 200~1 700 cm-1, the strongest was Mn2+, followed by Cu2+and Ca2+, and the weakest was Ba2+.
pulsed electric fields; Ovalbumin; Raman spectra; metallic ion; chelation
国家自然科学基金(编号:21506069);广东省自然科学基金项目(编号:2016A030310455)
汤婷,女,华南农业大学在读硕士研究生。

2017—03—10
10.13652/j.issn.1003-5788.2017.06.003

