香乳菇多糖对Hela细胞凋亡及对RAW264.7细胞免疫活性的影响
赵大群 丁 祥 刘 露 钱 叶 许 婷 苟凡铖 宋 波 侯万儒 侯怡铃
(1. 西华师范大学生命科学学院,四川 南充 637009;2. 西南野生动植物资源保护教育部重点实验室,四川 南充 637009)
香乳菇多糖对Hela细胞凋亡及对RAW264.7细胞免疫活性的影响
赵大群 丁 祥 刘 露 钱 叶 许 婷 苟凡铖 宋 波 侯万儒 侯怡铃
(1. 西华师范大学生命科学学院,四川 南充 637009;2. 西南野生动植物资源保护教育部重点实验室,四川 南充 637009)
为研究香乳菇多糖(LC-1)的抗肿瘤和免疫调控活性,将人的宫颈癌Hela细胞和小鼠巨噬细胞RAW264.7体外培养,分别通过CCK-8法、流式细胞术和ELISA技术检测不同浓度LC-1对Hela细胞增殖和凋亡周期的影响,对RAW264.7细胞增殖、吞噬的影响,及对RAW264.7细胞分泌NO、IL-6和TNF-α的影响。结果表明:香乳菇多糖对体外培养的Hela细胞有明显的抑制作用,且影响Hela细胞的形态及凋亡周期,当LC-1浓度为10 μg/mL时,Sub峰含量可达19.4%;同时,LC-1能调控巨噬细胞的免疫活性,当LC-1浓度为10 μg/mL时,巨噬细胞增值率和吞噬活性分别为67.48%和87.09%,亦能促进巨噬细胞从G0/G1期向G2期和S期转化,同时刺激巨噬细胞产生IL-6和TNF-α,且呈现出明显的剂量依赖性,但对NO生成没有明显的促进作用。综上,在体外试验中,香乳菇多糖LC-1能抑制宫颈癌Hela细胞生长,促进RAW264.7细胞增殖和吞噬活性,刺激巨噬细胞产生免疫因子。
香乳菇多糖;Hela细胞;凋亡;巨噬细胞RAW264.7;增殖作用;吞噬作用
近年来,掀起了开发新型有效、低毒性的抗肿瘤药物的热潮。其中,真菌多糖引起越来越多科学家的关注[1-2]。由于多糖分离纯化困难及其本身结构的复杂性,能够纯化得到多糖纯品并阐明其结构的并不多,且大部分真菌多糖免疫调节活性的研究都集中在多糖粗提物的生物学活性方面[3-4],而其混合物或复合物中具体是哪些成分起作用或者是起主要作用,尚不明确,导致其活性及相关分子生物学机制不清晰。
香乳菇[Lactariuscamphoratum(Bull.) Fr.] 属伞菌目红菇科乳菇属的珍稀型食用真菌。因气香味美,常将干品研磨成粉作为调味品。抗癌试验[5-6]显示,其提取物对肉瘤S-180 和艾氏腹水癌抑制率可达70%以上。
在笔者[7]前期的研究中,从香乳菇子实体中纯化得到了水溶性的香乳菇多糖(LC-1)。该多糖是由两种单糖组成的杂多糖,是一种结构新颖的真菌多糖,具有显著的抗氧化作用。本试验拟探讨香乳菇多糖(LC-1)对宫颈癌Hela细胞凋亡及对巨噬细胞RAW264.7免疫活性的影响。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
香乳菇:采自四川省小金县的野生真菌,由四川省重点实验室西华师范大学丁祥教授鉴定;
小鼠巨噬细胞系RAW264.7、人类宫颈癌Hela细胞株:北纳创联生物技术有限公司;
RPMI 1640培养基、胎牛血清、5%胰酶和双抗:美国Gibco公司;
LPS(脂多糖):美国Sigma公司;
Griess检测试剂盒:南京建成生物工程研究所;
CCK-8试剂盒:日本同仁化学研究所;
细胞周期与凋亡试剂盒、细胞凋亡与坏死检测试剂盒:碧云天公司;
TNF-α ELISA试剂盒、IL-6 ELISA试剂盒:武汉博士德公司;
其它化学药品和试剂均为分析级。
1.1.2 主要仪器
细胞培养箱:311(气套式)型,美国Thermo公司;
酶标仪:Multiskan GO型,美国Thermo公司;
流式细胞:BD Accuri C6型,美国BD公司;
倒置荧光显微镜:DM3000型,德国莱卡公司。
1.2 试验方法
1.2.1 多糖提取 按王芳等[7]提供的方法,将香乳菇子实体烘干,粉碎,获得的子实体粉末于95 ℃水浴5 h,上清液浓缩,95%乙醇与浓缩液以体积比3∶1醇沉,收集沉淀烘干,获得粗多糖。粗多糖溶液经葡聚糖凝胶柱G-200纯化后,收集过柱液浓缩烘干,-4 ℃储存备用。
1.2.2 LC-1对HeLa细胞生长的影响 将Hela细胞加入96孔板中培养24 h,分别用100 μL不同浓度LC-1的细胞培养液(2,4,6,8,10 μg/mL,试验组)和LPS(2 μg/mL,阳性对照组)刺激细胞,培养24 h。加CCK-8试剂5 μL,酶标仪检查450 nm波长时的吸光度值。倒置荧光显微镜400×镜下拍照保存[6]。按式(1)计算细胞抑制率。

(1)
式中:
I——抑制率,%;
A1——测试样品孔细胞的吸光度值;
A0——空白对照孔细胞的吸光度值[8]。
1.2.3 LC-1对Hela细胞凋亡的影响 用1 mL含不同浓度LC-1(2,4,6,8,10 μg/mL)和RPMI1640完全培养液(空白对照组)处理细胞,用细胞凋亡与坏死检测试剂盒中1 mL细胞染色缓冲液重悬细胞,加入Hoechst染色液5 μL与PI染色液5 μL,混匀后,冰浴双染30 min,用流式细胞仪检测凋亡率[9]。
1.2.4 LC-1对巨噬细胞RAW264.7增殖的影响
(1) LC-1浓度对巨噬细胞RAW264.7增殖的影响:用100 μL 不同浓度(2,4,6,8,10 μg/mL)的LC-1、LPS(2 μg/mL,阳性对照组)和空白培养液(阴性对照组)刺激细胞,培养24 h。加入5 μL CCK-8试剂,用酶标仪测定在450 nm 波长下的吸光度值[10]。按式(2)计算细胞增殖活性。

(2)
式中:
P——细胞增殖率,%;
A0——细胞培养基的平均吸光度值;
A1——阴性对照组孔的平均吸光度值;
A2——测试样品孔细胞的平均吸光度值[11]。
(2) 刺激时间对巨噬细胞RAW264.7增殖的影响:将巨噬细胞RAW264.7培养在10 μg/mL的LC-1中,分别在0,6,12,24,48,72 h用CCK-8试剂盒检测巨噬细胞RAW264.7增殖活性。
1.2.5 LC-1对巨噬细胞RAW264.7周期的影响 用1 mL不同浓度的LC-1的完全培养液(1,5,10 μg/mL)处理细胞,以不含LC-1的完全培养液作为空白对照,培养24 h,收集细胞。按细胞周期与凋亡试剂盒操作说明进行固定与染色。用流式细胞仪检测细胞的DNA含量,并使用的modifit LT软件计算各时期细胞DNA含量。每个试验重复3次[12]。
1.2.6 LC-1对巨噬细胞RAW 264.7吞噬功能的影响 用不同浓度的LC-1溶液(2,4,6,8,10 μg/mL,试验组)、LPS (2 μg/mL,阳性对照组)和空白培养液(阴性对照组)刺激细胞,培养24 h后,取出上清液,加入0.075%中性红溶液100 μL,继续培养1 h,吸出上清液,PBS洗3次,加0.1 mol/L的细胞裂解缓冲液(乙醇与乙酸体积比为1∶1)100 μL,放置于4 ℃冰箱中,2 h后用酶标仪测定540 nm处的吸光度[13]。
1.2.7 LC-1对RAW 264.7细胞IL-6和TNF-α含量的影响 分别用100 μL含有不同浓度LC-1的细胞培养液(2,4,6,8,10,50,100,200 μg/mL,试验组)、LPS细胞培养液(2 μg/mL,阳性对照组)和空白培养液(阴性对照组)刺激细胞,培养24 h后,用ELISA试剂盒检测上清液中的IL-6和TNF-α含量[13]。所有试验重复3次。
1.2.8 LC-1对RAW 264.7细胞NO产生量的影响 分别用100 μL含有不同浓度LC-1的细胞培养液(2,4,6,8,10,50,100,200 μg/mL,试验组)、LPS细胞培养液(2 μg/mL,阳性对照组)和空白培养液(阴性对照组)刺激细胞,培养24 h后,在上清液中加入Griess试剂50 μL,于540 nm处测定吸光度值,用亚硝酸钠溶液绘制标准曲线计算NO生成量[14]。
1.2.9 统计学分析 以SPSS 17.0统计软件进行单因素方差分析和t检验。
2 结果与分析
2.1 LC-1对HeLa细胞生长抑制试验结果分析
LC-1对宫颈癌HeLa细胞抑制作用异常迅速,结果显示(图1),在试验组中,经不同浓度LC-1处理后HeLa细胞活细胞数量明显不同。当LC-1浓度为2 μg/mL 时较空白组抑制作用显著(P<0.05);而LC-1浓度达4~10 μg/mL时,均呈现极显著的抑制作用(P<0.01)。当LC-1浓度为10 μg/mL时,在试验浓度范围内对HeLa细胞的抑制率达最大,超过阳性对照组。经不同浓度LC-1刺激后的宫颈癌细胞生长形态见图2,随香乳菇多糖LC-1浓度的增加,细胞的数量明显减少,细胞开始变圆,细胞间隙增大,与邻近细胞脱离,细胞核体积增大,出现悬浮细胞。结果表明,香乳菇多糖LC-1能够抑制HeLa细胞的生长。
2.2 LC-1对Hela细胞周期的影响
不同浓度LC-1对Hela 细胞凋亡的影响见图3。Sub峰表示凋亡细胞数量占所测细胞总数的百分比。结果显示,在空白对照组中,Hela 细胞凋亡率为12.1%,经2~10 μg/mL LC-1处理后的Hela 细胞的凋亡率分别达14.0%,15.1%,15.9%,18.9%,19.4%,较空白照对组均有所升高,并且随着多糖浓度的升高,凋亡率升高越明显。

*表示与空白对照组相比具有显著性差异,P<0.05;**表示与空白对照组相比具有极显著性差异,P<0.01
图1 LC-1对Hela细胞体外抑制作用
Figure 1 Inhibitory effect of LC-1 on Hela cells in vitro

1. 未加多糖LC-1的空白组 2~6. 分别为2,4,6,8,10 μg/mL的LC-1的试验组 7. 2 μg/mL的LPS阳性对照组
图2 LC-1对Hela细胞形态的影响(400×)
Figure 2 Effect of LC-1 on the morphology of Hela cells (400×)

图3 LC-1对Hela细胞周期的影响
多糖制剂作为抗肿瘤药物,一般不会直接杀伤肿瘤细胞,而是通过刺激机体的特异性免疫功能达到抗肿瘤效果[15],但LC-1可以在体外直接抑制Hela细胞的生长。当LC-1浓度为10 μg/mL 时,LC-1对HeLa细胞的直接抑制率可达为40.87%,超过阳性对照组,且影响Hela细胞的凋亡周期与细胞形态。
2.3 LC-1对RAW264.7细胞体外增殖活性的影响
由图4可知,随着LC-1浓度的增加,细胞增殖活性呈剂量依赖性增加。当LC-1浓度为6 μg/mL时,RAW264.7细胞增殖率达25.99%(与空白对照组相比,P<0.05);当LC-1浓度为8,10 μg/mL时,增值率分别为47.55%,67.48%(与空白对照组相比,P<0.01);当LC-1浓度为10 μg/mL时,RAW264.7细胞增殖活性接近阳性对照组。
由图5可知,经10 μg/mL LC-1处理了6 h的细胞与0 h比较,其增殖活性达15.98%;当处理时间达12 h,增殖活性达34.79%(与空白对照组相比,P<0.05);当多糖刺激达到24 h,增殖活性为65.48%(与空白对照组相比,P<0.01);值得注意的是,当刺激时间达48,72 h时,增殖活性虽然依旧在增加,但是增加速率较前12 h有所减慢。

*表示与空白对照组相比具有显著性差异,P<0.05;**表示与空白对照组相比具有极显著性差异,P<0.01
图4 不同浓度LC-1对巨噬细胞RAW264.7增殖作用的影响
Figure 4 Effect of different concentrations of LC-1 on the proliferation of macrophage RAW264.7

*表示与空白对照组相比具有显著性差异,P<0.05;**表示与空白对照组相比具有极显著性差异,P<0.01
图5 10 μg/mL LC-1刺激不同时间对巨噬细胞RAW264.7增殖作用的影响
Figure 5 Stimulation effect of 10 μg/mL LC-1 on proliferation of RAW264.7 in different time
2.4 LC-1对RAW264.7细胞周期分布的影响
LC-1对RAW264.7细胞周期进程的影响见图6,LC-1对RAW264.7细胞周期各个阶段分布都有一定程度的影响。用LC-1刺激细胞24 h后,G0/G1期细胞数相比对照组有明显降低的现象,且呈浓度依赖性关系。当LC-1浓度达1,5,10 μg/mL时,其G0/G1期细胞比例分别减少到58.3%,57.6%,55.1%。同时,发现改变LC-1浓度,G2/M期的细胞数也发生变化。分别由空白组的14.1%,增加到14.7%,15.1%,19.7%。在细胞周期中,G1期主要合成RNA和核糖体,S期主要是DNA复制、组蛋白和酶的合成;G2期为有丝分裂的准备期。G0期细胞大量存在,则不利于细胞进行有丝分裂。结果提示,LC-1 可以促进巨噬细胞在G1期向G2期和S期转化,减少G0期细胞产生,导致巨噬细胞增殖。

图6 LC-1对巨噬细胞RAW264.7细胞周期的影响
2.5 LC-1对巨噬细胞吞噬功能的影响
巨噬细胞活力增加的重要指标之一是吞噬能力增强。用0.075%中性红检测LC-1刺激后巨噬细胞的吞噬能力,结果见图7,与空白对照组相比,不同浓度的LC-1培养液中孵育24 h后的RAW264.7细胞,其吞噬能力增强,在试验剂量范围内,活性与剂量呈依赖性关系。当LC-1浓度在8,10 μg/mL时,RAW264.7细胞的吞噬能力分别为85.60%,87.09%(与空白对照组相比,P<0.05),且LC-1浓度在10 μg/mL时LC-1刺激RAW264.7细胞的吞噬能力高于阳性对照。

*表示与空白对照组相比具有显著性差异,P<0.05;**表示与空白对照组相比具有极显著性差异,P<0.01
图7 LC-1对巨噬细胞RAW264.7吞噬功能的影响
Figure 7 Effect of LC-1 on phagocytosis of macrophage RAW264.7
多糖的主链结构、支链的组成和分子量决定多糖的高级结构,也是其抗肿瘤活性的重要因素。一般来说,具有中等分枝程度和分子量的多糖活性较高。分子量太大或太小,都难以达到理想的活性,各个多糖都有自己的最适分子量[16]。同时,多糖发挥抗生物活性的前提是能溶于水。多糖的水溶性增加,其药理活性也相应提高[17]。LC-1分子量为9 279 Da,在最适相对分子质量范围内,且具有良好的水溶性[7],可能是导致香乳菇多糖具有诱导宫颈癌Hela细胞凋亡及对巨噬细胞RAW264.7具有免疫调控活性的关键。
2.6 LC-1对细胞因子分泌的影响
细胞因子在免疫应答机制中起着举足轻重的作用。由图8、9可知,加入LC-1刺激后的RAW264.7细胞中IL-6和TNF-α的含量较阴性对照组有增高趋势,且在试验范围内呈现出明显的剂量依赖性。当LC-1的剂量为8 μg/mL 时,IL-6和TNF-α的含量分别为153.02,483.74 pg/mL,与阴性对照组相比,均显著上调,但LC-1的作用效果仍低于阳性对照组。

*表示与空白对照组相比具有显著性差异,P<0.05;**表示与空白对照组相比具有极显著性差异,P<0.01
图8 LC-1对巨噬细胞分泌白介素6(IL-6)与肿瘤坏死因子α(TNF-α)的影响
Figure 8 Effect of LC-1 on IL-6 and TNF-α production in macrophage RAW264.7

图9 低浓度LC-1对巨噬细胞RAW264.7产生NO的影响
巨噬细胞在机体的特异性免疫过程中最重要的是吞噬作用,在吞噬过程中同时会释放出大量的细胞因子,调节其他免疫细胞进行免疫应答[18-19]。10 μg/mL LC-1促使巨噬细胞增值率和吞噬活性分别可达67.48%,87.09%(与空白对照组相比,P<0.01),亦能促进巨噬细胞从G1期向G2、S期转化,减少G0期细胞产生,同时刺激巨噬细胞产生IL-6和TNF-α,且呈现出明显的剂量依赖性。
2.7 LC-1刺激巨噬细胞生成NO效应的影响
用上清液中亚硝酸盐量作为检测巨噬细胞RAW264.7生成NO量标准,其测定结果见图9、10。与随性对照组和空白培养液比较,低浓度LC-1对小鼠巨噬细胞RAW264.7产生NO没有明显的促进作用。高浓度LC-1对NO的生成量有一定的促进作用,但促进效果亦不显著。
巨噬细胞在干扰素IFN-γ或者肿瘤坏死因子(TNF)激活下,能产生一氧化氮合酶(iNOS),诱导NO的产生,调控巨噬细胞参与炎症反应和免疫反应。同时,IL-6作为一种抗炎细胞因子,在TNF-α,IL-1的协同作用下以及IL-10等的激活下发挥免疫作用[20]。本试验结果表明,LC-1可以促进IL-6和TNF-α的生成,不促进NO的生成,提示可能的分子机制不涉及一氧化氮合酶(iNOS)的参与。
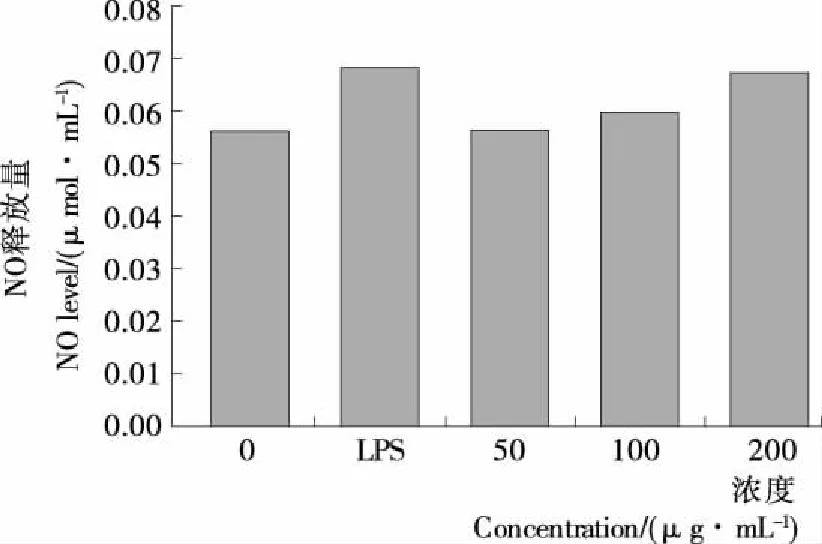
图10 高浓度LC-1对巨噬细胞RAW264.7NO产生的影响
3 结论
多糖制剂作为抗肿瘤药物,一般不会直接杀伤肿瘤细胞,而是通过刺激机体的特异性免疫功能达到抗肿瘤效果。LC-1的主链和侧链具有中等分枝程度,分子量在最适相对分子质量范围内,且具有良好的水溶性,是导致香乳菇多糖具有诱导宫颈癌Hela细胞凋亡及对巨噬细胞RAW264.7具有免疫调控活性的关键。在体外试验中,LC-1能抑制宫颈癌Hela细胞生长,促进巨噬细胞增殖和吞噬活性,影响宫颈癌Hela细胞和巨噬细胞的周期,刺激巨噬细胞产生免疫因子,但涉及的相关信号转导通路与分子机制还有待验证。
[1] 王斌, 连宾. 食药用真菌多糖的研究与应用[J]. 食品与机械, 2005, 21(6): 96-100.
[2] 贾林, 陆金健, 周文雅, 等. 桔梗多糖对环磷酰胺诱导的免疫抑制小鼠的免疫调节[J]. 食品与机械, 2012, 28(3): 112-114.
[3] 翁梁, 温鲁术. 药用真菌多糖研究进展[J]. 食品科学, 2008, 29(12): 748-751.
[4] 李六文, 赵刚. 药用真菌多糖抗肿瘤免疫生物活性研究进展[J]. 中华肿瘤防治杂志, 2015, 22(14): 1 156-1 160.
[5] 黄年来. 中国食用菌百科[M]. 北京: 中国农业出版社, 1993: 146-147.
[6] 应建浙, 卯晓岚, 马启明. 中国药用真菌图谱[M]. 北京: 科学出版社, 1987: 283.
[7] WANG Fang, HOU Yi-ling, DING Xiang, et al. Structure elucidation and antioxidant effect of a polysaccharide from Lactarius camphoratum (Bull.) Fr[J]. Int J Biol Macromol, 2013, 62: 131-136.
[8] 张华, 王振宇, 杨鑫, 等. 黑木耳多糖的羧甲基化及其对肝癌细胞HePG2的抑制作用[J]. 食品与机械, 2011, 27(3): 42-44, 67.
[9] 李雪, 李鹏飞, 李晓东, 等. 5种长白山野生食用菌的抗肿瘤活性研究[J]. 食品与机械, 2015, 31(1): 151-154.
[10] 杨艳, 刘东波, 康信聪, 等. H2O2诱导胰岛RIN-m5F细胞构建氧化应激模型[J]. 食品与机械, 2014, 30(2): 40-43.
[11] 王雯, 王东, 方明明, 等. 糖皮质激素对脂多糖诱导小鼠巨噬细胞增殖和细胞因子的影响[J]. 国际呼吸杂志, 2015(12): 911-913
[12] 孙震, 郑婕, 张莉, 等. 芹菜素对甲状腺癌BCPAP细胞生长及细胞周期的影响[J]. 食品与机械, 2015, 31(3): 3-7.
[13] 徐明生, 林日新, 汤群, 等. 卵转铁蛋白体外免疫活性研究[J]. 食品与机械, 2012, 28(2): 115-118, 169.
[14] 李艳红, 高志玲, 马金姝. 藜芦酸抑制LPS刺激的RAW264.7细胞中NO表达的研究[J]. 中国免疫学杂志, 2014, 30(3): 326-329.
[15] HORI S, NOMURA T, SAKAGUCHI S. Control of Regulatory T Cell Development by the Transcription Factor Foxp3[J]. Science, 2003, 299(5 609): 1 057-1 061.
[16] SURENJAV U, ZHANG Li-na, XU Xiao-juan, et al. Effects of molecular structure on antitumor activities of (1→3)-β-Dglucans from different Lentinus Edodes[J]. Carbohydrate Polymers, 2006, 63: 97-104.
[17] BOHN J A, BEMILLER J N. (1→3)-β-DGlucans as biological response modifiers: a review of structure-fuctional activity relationships[J]. Carbohydrate Polymers, 1995, 28: 3-14.
[18] KIM S S, OH O J, MIN H Y, et al. Eugenol suppresses cyclooxygenase-2 expression in lipopolysaccharide-stimulated mouse macrophage RAW264.7 cells[J]. Life Sciences, 2003, 73(3): 337-348.
[19] WANG Shi-yao, TAI Gui-xiang, ZHANG Peng-yu, et al. Inhibitory effect of activin A on activation of lipopolysaccharide-stimulated mouse macrophage RAW264.7 cells[J]. Cytokine, 2008, 42(1): 85-91.
[20] ANESTAKIS D, PETANIDIS S, KALYVAS S, et al. Mechanisms and applications of interleukins in cancer immunotherapy[J]. International Journal of Molecular Sciences, 2015, 16 (1): 1 691-1 710.
Inhibitory effect on Hela cells and immune effects on RAW264.7 cells of a polysaccharide fromLactariuscamphoratum(Bull.) Fr
ZHAO Da-qun DING Xiang LIU Lu QIAN Ye XU TingGOUFan-chengSONGBoHOUWan-ruHOUYi-ling
(1.CollegeofLifeScience,ChinaWestNormalUniversity,Nanchong,Sichuan637009,China; 2.KeyLaboratoryofSouthwestChinaWildlifeResourcesConservation〔MinistryofEducation〕,Nanchong,Sichuan637009,China)
The antitumor and immunoregulatory activities of polysaccharide LC-1 fromLactariuscamphoratum(Bull.) Fr. were studied by using the human cervical cancer Hela cells and the mouse macrophage RAW264.7 cells. The two kinds of cells were cultured in vitro, and the effects of different concentrations of LC-1 on the proliferation and cell cycle of Hela cells and the proliferation and phagocytosis of RAW264.7 cells were investigated. Moreover, the secretion of NO, IL-6 and TNF- alpha of RAW264.7 cells were tested using CCK-8 method, flow cytometry and ELISA technique, respectively. The results showed that polysaccharide LC-1 fromL.camphoratum(Bull.) Fr. has obvious inhibitory effect on Hela cells in vitro, and could influence the apoptosis cell cycle of Hela cells. When the concentration of LC-1 was 10 μg/mL, the content of Sub peaks was 19.4%. It was further found that polysaccharide LC-1 could regulate the immune activity of macrophage. When the concentration of LC-1 was 10 μg/mL, the phagocytic activity and proliferation rate of macrophage were 67.48% and 87.09%, respectively. LC-1 could also promote the transformation of macrophages from G0/G1 phase to G2 phase and S phase and stimulate macrophages to produce IL-6 and TNF-α, showing a dose-dependent. However, no obvious effect on the production of NO was observed. In conclusion, in vitro, polysaccharide LC-1 fromL.camphoratum(Bull.) Fr. could inhibit the growth of cervical carcinoma Hela cells and promote the proliferation and phagocytosis of macrophage, as well as stimulate macrophages to produce immune factors.
Lactariuscamphoratum(Bull.) Fr. polysaccharide; Hela cells; apoptosis; macrophage RAW264.7; proliferation; phagocytosis
国家自然科学基金项目(编号:31400016);四川省生态安全与保护重点实验室开放基金资助项目(编号:ESP1408);四川省教育厅重大培育项目(编号:16CZ0018);南充市科技局项目(编号:16YFZJ0043)
赵大群,女,西华师范大学在读硕士研究生。
侯怡铃(1983—),女,西华师范大学教授,博士。 E-mail: starthlh@126.com
2017—03—06
10.13652/j.issn.1003-5788.2017.06.001

